不同浸提剂及对照设置对土壤脲酶活性测定的影响
2017-03-21李秀芝黄斌范弟武
李秀芝+黄斌+范弟武

摘要:关于土壤脲酶活性的测定,不同学者选用的浸提剂以及对照的设置往往大相径庭,对于这些不同处理方式测得的脲酶活性的差异,目前还缺乏相应的比较研究。选用1.0 mol/L KCl+0.01 mol/L HCl、2.5 mol/L KCl+0.1 mmol/L Ag2SO4、2.5 mol/L KCl、2.0 mol/L KCl以及1.0 mol/L KCl等5种不同的浸提剂,设置对照培养2 h与对照不培养2种对照方法,以洪泽湖湿地土壤为例,比较不同浸提剂及对照设置方法间土壤脲酶活性的差异。结果表明,在对照培养条件下,测得的脲酶活性最大达到0.098 μg/(kg·h),浸提剂1.0 mol/L KCl+0.01 mol/L HCl;脲酶活性最小为0.035 μg/(kg·h),浸提剂2.5 mol/L KCl+0.1 mmol/L Ag2SO4。与对照不培养组相比,对照培养2 h组更容易获得较高的脲酶活性,当浸提剂分别为2.5 mol/L KCl+0.1 mmol/L Ag2SO4、2.0 mol/L KCl、1.0 mol/L KCl+0.01 mol/L HCl 时,对照培养组土壤脲酶活性分别是对照不培养的1.6、3.0、7.5倍。对于不同的抑制剂而言,1.0 mol/L KCl+0.01 mol/L HCl 是1.0 mol/L KCl的1.58 倍,而2.5 mol/L KCl+0.1 mmol/L Ag2SO4与2.5 mol/L KCl的差异较小,差值仅为0.001 μg/(kg·h)。
关键词:土壤;脲酶活性;浸提剂;对照培养
中图分类号: S154.2 文献标志码: A
文章编号:1002-1302(2016)11-0427-03
在土壤酶中,脲酶催化土壤中尿素酰胺态氮水解为铵态氮,在土壤氮元素的循环与转化过程中扮演重要角色[1-3]。脲酶活性是评价生态系统氮素转化机制及其功能演变时最常见的酶学指标。土壤脲酶活性的测定有比色法、扩散法、尿素剩余量测定法、电极法、CO2量度法等[4-6]多种方法,其中比色法由于测量结果精确性较高、重现性较好、仪器设备简单,应用最为广泛。非甲苯法[7]因为没有甲苯的加入因而更加注重脲酶对于尿素的水解功能,是比色法中最常应用的方法。对于非甲苯法,可以选择不同的浸提剂,如有的学者采用 2.5 mol/L KCl+0.1 mmol/L Ag2SO4混合液或者1.0 mol/L KCl+0.01 mol/L HCl,在浸提剂加入的同时加入抑制剂阻止脲酶的进一步水解;而有的学者直接采用2.0 mol/L KCl进行浸提。并且对于对照的处理方法也不尽相同,有的是在土样培养之后加入底物尿素[7];有的则是与处理同步加入底物,但对照处理不进行培养[8]。抑制剂是否可以有效地抑制酶的活性、这些不同的处理方式测出的脲酶活究竟会有什么差异,目前还缺乏相应的比较与研究。本研究以洪泽湖湿地为原型区域,采集湿地沉积物样品,采用非甲苯法并使用5种不同的浸提剂(1.0 mol/L KCl+0.01 mol/L HCl、2.5 mol/L KCl+0.1 mmol/L Ag2SO4、2.5 mol/L KCl、2.0 mol/L KCl、1.0 mol/L KCl),同时设立对照培养2 h与对照不培养2种不同的对照试验,对脲酶活性进行检测,以期明确不同浸提剂及不同对照设置对土壤脲酶活性测定的影响。
1 材料与方法
1.1 试验材料
试验土壤取自于洪泽湖湿地,取0~20 cm的表层沉积物自然风干后,碾碎,过2 cm筛,备用。供试土样的全氮、全碳含量分别为0.675、0.1 g/kg。
1.2 试验方法
1.2.1 脲酶活性的测定 选用水杨酸钠-二氯异氰尿酸钠比色法测定脲酶活性[6-11]。(1)称取5 g土壤样品,置于 100 mL 的有盖容器内,加入2.5 mL 0.08 mol/L尿素水溶液,密封后在37 ℃下恒温培养2 h。培养结束后,打开塞子,加入2.5 mL蒸馏水,然后加入50 mL 5种不同的浸提剂(1.0 mol/L KCl+0.01 mol/L HCl、2.5 mol/L KCl+0.1 mmol/L Ag2SO4、2.5 mol/L KCl、2.0 mol/L KCl、1.0 mol/L KCl)振荡30 min,转速180 r/min,将振荡后的土壤悬浊液迅速过滤,取1.0 mL滤液于10 mL容量瓶中,加蒸馏水定容至刻度线,摇匀,倒入25 mL小烧杯中,并依次加入 5 mL 的水杨酸钠和2 mL的二氯异氰尿酸钠溶液。室温下靜置30 min,以蒸馏水为参比,用紫外可见分光光度计在 690 nm 处测吸光度。每个样品3个重复,比较不同浸提剂对于土壤脲酶活性的差异。
1.2.2 第1种对照的设置 称取5 g土壤样品置于100 mL的有盖容器内,加入2.5 mL蒸馏水,密封,在37 ℃下恒温培养2 h。培养结束后,打开塞子,加入浸提剂,再加入 2.5 mL 0.08 mol/L尿素水溶液(先加浸提剂再加尿素)。之后的步骤与处理试验中相同。
1.2.3 第2种对照的设置 在处理试验与对照试验中,处理与对照同时按相同试验步骤进行的,但对处理进行2 h培养,对照不培养,分析不同对照的设置对脲酶活性测定结果的影响。该对照下浸提剂使用1.0 mol/L KCl+0.01 mol/L HCl、2.5 mol/L KCl+0.1 mmol/L Ag2SO4、2.0 mol/L KCl。比较不同对照对于脲酶活性的差异。
1.2.4 脲酶活性的计算 脲酶活性用1 g干土1 h水解尿素产生铵态氮的量表示。
U=(T-CK)×17×55/(5×2)。
式中:U表示脲酶活性,μg/(g·h);T表示处理吸光度从标准曲线中查得铵态氮的浓度,μg/mL;CK表示对照组吸光度从标准曲线中查得的铵态氮浓度,μg/mL;17为取1.0 mL滤液共稀释17倍;55是处理和对照滤液制备前稀释的体积,mL;5为沉积物的干质量,g;2为换算成1 h的系数,h。
2 结果与分析
2.1 不同浸提剂对于脲酶活性的影响
由图1表明,对照培养条件下当浸提剂为1.0 mol/L KCl+0.01 mol/L HCl时,脲酶活性达到最强,为0.098 μg/(kg·h),2.0 mol/L KCl次之,浸提剂为 2.5 mol/L KCl+0.1 mmol/L Ag2SO4测得的脲酶活性最弱,为0.035 μg/(kg·h),最大值为最小值的2.8倍。当浸提剂分别为 1.0 mol/L KCl、2.0 mol/L KCl、2.5 mol/L KCl时,脲酶活性分别为0.062、0.072 0、0.036 μg/(kg·h),KCl浓度从 1.0 mol/L 增至2.0 mol/L时,脲酶活性增加 0.01 μg/(kg·h);当浓度继续升高至2.5 mol/L时,其脲酶活性比2.0 mol/L KCl 低 50%。比较1.0、2.0、2.5 mol/L KCl等3种不同KCl离子浓度浸提剂相应酶活性的变化可以看出,脲酶活性与浸提剂的离子浓度并不是呈现明显的正相关关系,而是先增强后减弱,在2.0 mol/L KCl时测得的脲酶活性最强,这可能是因为低浓度浸提剂对铵根离子的提取效率相对较低,但并不是浓度越高就越有利于提取;高浓度可能影响到脲酶活性的比色,进而减弱脲酶活性。从表1可以看出,离子浓度的升高,使得脲酶活性差异显著。不同浓度下,脲酶活性之间均差异显著(P<0.05)。
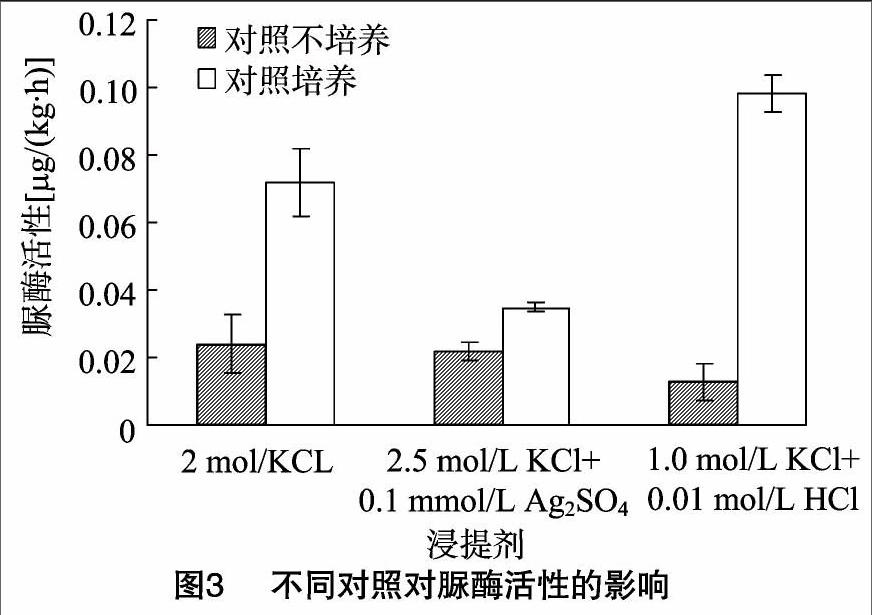
分别对1.0 mol/L KCl+0.01 mol/L HCl与1.0 mol/L KCl、2.5 mol/L KCl+0.1 mmol/L Ag2SO4与2.5 mol/L KCl浸提剂对应的酶活性进行比较,结果见图1。0.01 mol/L HCl的加入使得测定的土壤脲酶活性增强58%,可见HCl能有效抑制脲酶对尿素的进一步水解,增强脲酶活性,特别是第1种对照处理。第1种对照是先于尿素将提取剂与抑制剂混合液加入到土壤中,测得的脲酶活性是0.098 μg/(kg·h);第2种对照测得的脲酶活性是 0.013 μg/(kg·h)。2.5 mol/L KCl+0.1 mmol/L Ag2SO4与2.5 mol/L KCl等2种浸提剂测得的脲酶活性略有差异,分别为0.035、0.036 0 μg/(kg·h)。
由图2表明,第2种对照中,2.0 mol/L KCl作为浸提剂测得的脲酶活性最强,为0.024 μg/(kg·h);1.0 mol/L KCl+0.01 mol/L HCl作为浸提剂时测得的土壤脲酶活性最弱。1.0 mol/L KCl+0.01 mol/L HCl作为浸提剂明显弱于2.5 mol/L KCl+0.1 mmol/L Ag2SO4与2.0 mol/L KCl。
2.2 不同对照设置对于脲酶活性的影响
分别选取1.0 mol/L KCl+0.01 mol/L HCl、2.5 mol/L KCl+0.1mmol/L Ag2SO4、2.0 mol/L KCl分别进行不同对照处理脲酶活性测定。一组对照设置方法是在培养(2 h)结束后再加入底物尿素(对照培养),另一组对照试验过程与处理组同时加入底物,但是对照不进行2 h的培养(对照不培养)。1.0 mol/L KCl+0.01 mol/L HCl、2.5 mol/L KCl+0.1 mmol/L Ag2SO4、2.0 mol/L KCl作为浸提剂时,对照培养组土样脲酶活性明显高于对照不培养组,当浸提剂为 2.5 mol /L KCl、0.1 mmol/L Ag2SO4时,培养组脲酶活性是不培养组的1.6倍;当浸提剂是2.0 mol/L KCl是,培养2 h的脲酶活性是不培养的3倍,特别是在浸提剂为1.0 mol/L KCl+0.01 mol/L HCl时,对照培养测得的土壤脲酶活性是对照不培养的7.53倍,第2种对照下3种浸提剂得到的脲酶活性均弱于第1种对照中相同浸提剂得到的脲酶活性(图3)。
3 讨论
从水解尿素的土壤脲酶发现以来,国内外学者对其来源、作用、性质等进行了研究,取得了许多重要进展[1-4,12-15]。非甲苯法顾名思义是指试验过程中没有甲苯的加入,甲苯在脲酶活性测定方面[2]被用作土样的前处理试剂,它的加入可以杀死土壤中的微生物,使得水解脲酶产生的铵态氮全部来自于脲酶对于尿素的水解。目前,对于脲酶活性的测定许多学者选用的是添加甲苯的方法[1,9,16],然而对于甲苯对脲酶活性影响的研究结论[7,16-19]却大相径庭,如Dalal等认为甲苯能降低脲酶活性[18],Tabatabai等却发现甲苯会增大脲酶活性[19]。此外,Kandeler等的研究結果表明,甲苯作为一种外来添加物,对于脲酶活性的测定有着明显但不确定的影响,因而非甲苯法测得的脲酶活性可能更加接近于土壤脲酶活性的真实数值[7]。
土壤脲酶活性的检测,往往选择2.0 mol/L KCl作为浸提剂。然而,Tabatabai等为了防止浸提过程中脲酶继续水解样品进而对试验结果产生误差,建议在浸提过程中添加HCl或者Ag2SO4等来抑制脲酶活性[7-8]。此外,对于浸提剂的浓度,也有学者使用高于或低于2.0 mol/L KCl的浓度来测定离子浓度对土壤脲酶活性的影响[10]。本试验结果表明,对于不同浓度(1.0、2.0、2.5 mol/L)KCl浸提剂而言,测得的脲酶活性与离子浓度并不是明显的正相关关系,而是先增强后减弱,浸提剂的效率并非因为离子浓度的提高而增强,浸提剂离子浓度为2.0 mol/L时测得的脲酶活性最强。这可能是由于低浓度浸提剂对NH4+的提取效率相对较低,但并不是浓度越高就越有利于提取,高浓度可能影响到脲酶活性的比色,进而降低脲酶活性。
对于HCl和Ag2SO4这2种抑制剂而言,HCl的加入能够明显增强脲酶活性,这可能是由于抑制剂的加入提高了浸提率,或者HCl能够有效抑制尿素的进一步水解,进而提高脲酶活性。但是Ag2SO4产生的抑制效果不明显,这是因为Ag2SO4对脲酶没有抑制作用,且2.5 mol/L KCl+0.1 mmol/L Ag2SO4中浸提剂2.5 mol/L KCl的离子浓度太高,在影响比色的同时掩盖了抑制剂的抑制效果。
对照培养2 h组更易于获得较高的脲酶活性,原因在于对照培养后土壤留有余温,使得尿素加入后,脲酶会借助余温继续水解尿素,进而导致测得的脲酶活性强于对照不培养组。对于脲酶活性较弱的土样在测定脲酶活性时建议选择对照培养的处理方式。
4 结论
不同浸提剂对应的脲酶活性具有明显差异。对照培养条件下当浸提剂为1.0 mol/L KCl+0.01 mol/L HCl时,脲酶活性达到最高,为0.098 μg/(kg·h);浸提剂为2.5 mol/L KCl+0.1 mmol/LAg2SO4时,测得的脲酶活性最低,为 0.035 μg/(kg·h)。对照不培养条件下,浸提剂为2 mol/L KCl时,测得的最强脲酶活性为0.024 μg/(kg·h);浸提剂1.0 mol/L KCl+0.01 mol/L HCl时,测得的最小脲酶活性为0.013 μg/(kg·h)。
对照培养组比对照不培养组更容易获得较强的脲酶活性,当浸提剂分别为2.5 mol/L KCl+0.1 mmol/L Ag2SO4、2.0 mol/L KCl、1.0 mol/L KCl+0.01 mol/L HCl 时,对照培养组土壤脲酶活性分别是对照不培养的1.6、3.0、7.5倍。对照培养测得的脲酶活性高于对照不培养组,在今后的试验中对于土壤脲酶活性较弱的土样建议采用对照培养的方式处理。
抑制剂的加入能有效抑制脲酶进一步水解,1.0 mol/L KCl+0.01 mol/L HCl 的脲酶活性是1.0 mol/L KCl的1.58 倍,而2.5 mol/L KCl+0.1 mmol/L Ag2SO4与2.5 mol/L KCl的差异较小,仅为0.001 μg/(kg·h)。对于2种抑制剂而言,0.01 mol/L HCl的抑制效果好于0.1 mmol/L Ag2SO4。
参考文献:
[1]关松荫. 土壤酶及其研究法[M]. 北京:农业出版社,1986:294-312.
[2]和文祥,朱铭莪. 陕西主要土壤脲酶活性与土壤肥力关系的研究[J]. 土壤学报,1997,34(4):392-398.
[3]王 家,赵阳阳,代 潭,等. Cu、Cd污染对土壤脲酶活性的影响研究[J]. 环境科学与管理,2014,39(11):45-48.
[4]丰 骁,段建平,蒲小鹏,等. 土壤脲酶活性两种测定方法的比较[J]. 草原与草坪,2008(2):70-72.
[5]黄 娟,李 稹,张 健. 改良靛酚蓝比色法测土壤脲酶活性[J]. 土木建筑与环境工程,2012(1):102-107.
[6]和文祥,朱铭莪,张一平. 汞、镉对土壤脲酶活性影响的研究Ⅰ.尿素浓度[J]. 应用生态学报,2002,13(2):191-193.
[7]Kandeler E,Gerber H. Short-term assay of soil urease activity using colorimetric determination of ammonium [J]. Biol Fert Soils,1988,6:68-72.
[8]Singh K P,Μandal T N,Tripathi S K,et al. Patterns of restoratim of soil physicochemical properties and microbial biomass in different landslide sites In the sal forest ecosystem of Nepal Himalaya[J]. Ecological of Engineering,2001,17(4):385-401.
[9]Tahatabai Μ A,Bremner Μ J,et al. And assay of urease activity in soil[J]. Soil Biol Biocheu,1972(4):479-487.
[10]Singh D K,Kumar S. Nitrate reductase,arginine deaminase,urease and dehydrogenase activities in natural soil (ridges with forest) and in cotton soil after acetamiprid treatments[J]. Chemosphere,2008,71(3):412-418.
[11]韩建刚,曹 雪.典型滨海湿地干湿交替过程氮素动态的模拟研究[J]. 环境科学,2013,34(6):2383-2389.
[12]Μanunza B,Deiana S,Pintore Μ,et al. The binding uechanism of urea,hydroxamic acid and N-(N-butyl)-phosphoric trioxide to the urease active site:a comparative molecular dynamics study [J]. Soil Biol & Biocheu,1999,31:789-796.
[13]Dalal R C.Distribution,salinity,kinetics and thermodynamic characteristics of urease activity in vertical profile[J]. Aust J Soil Res,1985,23(1):49-60.
[14]Pettit N M,Smith A R,Freedman R B,et al. Soil urease - activity,stability and kinetic-properties[J]. Soil Biology & Biochemistry,1976,8(6):479-484.
[15]Burns R G. Enzyme activity in soil:location and a possible role in uicrobial ecology[J]. Soil Biol & Biochem,1982,12:432-427.
[16]和文祥,蔣 新,朱茂旭,等. 甲苯对土壤脲酶活性的影响[J]. 环境科学,2001,22(6):123-126.
[17]Zantua Μ I,Bremner J Μ. Comparison of methods of assaying urease activity in soils [J]. Soil Biol & Biocheu,1975,7:291-295
[18]Dalal R C. Efficient toluene on the energy barriers in urease activity of soils[J]. Soil Science,1975,120(4):256-260.
[19]Tabatabai Μ I,Bremner J Μ. Assay of ureaseactivity in soils [J]. Soil Biol & Biochem,1972,4:479-487.
