硫化氢对水稻幼苗叶片中蛋白质表达谱的影响
2017-03-21陈露徐慧芳孟丹
陈露+徐慧芳+孟丹

摘要:硫化氢(H2S)作为重要的信号分子,调控着植物的生长发育。应用双向电泳技术(2-DE)分析了水稻幼苗叶片经不同浓度的H2S处理后蛋白质表达谱的变化,并获得29个表达丰度差异2倍以上的蛋白质。鉴定的差异蛋白质主要涉及到光合作用 (43%),能量代谢 (9%),氧化还原平衡 (13%),蛋白质合成、折叠、加工与降解 (19%),信号转导 (3%)等。gene ontology(GO)分析发现,受硫化氢调控的差异,蛋白主要参与光合作用、防御和非生物胁迫应答等过程。表明不同浓度的硫化氢在调控水稻幼苗的形态变化方面主要涉及到光合过程和胁迫应答。
关键词:水稻,H2S,蛋白质组,双向电泳
中图分类号: S511.01 文献标志码: A
文章编号:1002-1302(2016)11-0081-04
硫化氢(H2S)是近10年来继一氧化氮(NO)和一氧化碳(CO)后在生物体内新发现的第3种内源性气体信号分子[1],在植物体内主要是通过半胱氨酸脱巯基酶(CDes)催化半胱氨酸(Cys)降解生成。相关研究表明,H2S广泛参与调节植物各种生理过程,如植物细胞的信号转导、促进种子萌发、调节光合作用和根系发育、参与气孔运动、缓解逆境胁迫等[2-7]。H2S供体能显著提高小麦种子内β-淀粉酶、酯酶的活性,提供可溶性糖、可溶性蛋白和游离氨基酸,为小麦种子的萌发提供良好的环境从而促进其发芽[8],Wang等研究表明,0.01~0.13 mmol/L NaHS均能不同程度地缓解NaCl对小麦种子萌发率的抑制作用[7]。在干旱胁迫下,王兰香等发现H2O2能够诱导拟南芥L/D-CD基因的表达以提高叶片H2S含量来关闭气孔,防止水分蒸发[9]。方慧慧等研究证明,在植物体内H2S和Ca2+信号存在复杂的关系,H2S能激活Ca2+信号下游相关基因的表达,同时Ca2+能增强H2S的产生,并且它们可以通过调节重金属离子转运蛋白增强谷子对Cr6+的耐受性[10]。在缓解铜胁迫造成的伤害中,Shan等研究表明,外源H2S能调节植物非酶类抗氧化剂维生素C和还原型谷胱甘肽(GSH)循环,增加叶片维生素C、GSH 含量,提高GSH、维生素C清除活性氧速率[11]。
相关研究中我们发现,不同浓度的H2S对水稻幼苗形态和生理生化有不同的效应,低浓度H2S能显著促进幼苗生长,而高浓度的H2S对水稻幼苗生长有明显的抑制作用[12]。为了了解硫化氢影响水稻幼苗生长发育的分子基础,本研究通过蛋白质组技术分析了施加不同浓度硫化氢的水稻幼苗叶片蛋白质表达谱的变化及其参与的生物学过程。
1 材料与方法
1.1 材料及处理
试验材料为圣稻16(Oryza sativa Shengdao 16)。挑选颗粒饱满种子,用0.1% HgCl2消毒10 min,去离子水冲洗数次,25 ℃恒温箱黑暗中浸种催芽48 h。萌发后选取露白一致的种子用镊子整齐摆放在垫有滤纸的培养皿(直径12 cm)中,加入适量清水,水量以不浸没种子为标准,保持皿中水量充足。当苗长至1叶1心时,选择长势一致的幼苗用海绵松松地包裹,嵌入有孔泡沫板(厚度1.5 cm)中,放在盛有1/2 Hoagland营养液(2 L)塑料箱内,置于HP1000GS型智能人工气候箱中水培。昼、夜温度分别为28、25 ℃,相对湿度为60%~70%,白天给予光照12 h[1 000 μmol/(m2·s)]。培养箱适应生长1 d后,用含有NaHS(H2S的供体)的Hoagland营养液,浓度分别为:0(CK)、0.1、0.2、0.4、0.8、1.6、3.2 mmol/L培养,每2 d换1次,共处理3次。每个处理135株苗(3箱),3个重复,每个重复45株苗(1箱)。于开始处理后7 d,液氮取样保存,进行各项蛋白质组学指标的测定。
1.2 蛋白质样品的制备
采用TCA/丙酮沉淀方法[13]提取水稻叶片总蛋白。首先称取1 g左右鲜质量材料于预冷研钵中,液氮研磨并加入10%样品质量的聚乙烯吡咯烷酮(PVP),将研磨好的粉末转移至离心管中,1个样加20 mL-20 ℃预冷的10%TCA-丙酮,之后涡旋至少1.5 h,-20 ℃静置沉淀,后12 000 r/min离心30 min去上清液。然后加20 mL丙酮和0.02 g 0.1% DTT 到离心管中,将沉淀捣碎,重复3次,-20 ℃存放。之后再离心,盖上滤纸,真空干燥后进行第1次裂解,约2 h,用玻璃棒不定时搅动。样品溶解在蛋白质裂解液中,理论上加入 20 μL/mg 裂解液,其配方为每10 mL裂解液中含4.204 2 g 7 moL/L 尿素,1.522 4 g 2 moL/L硫脲,0.4 g 4% CHAPS,60 μL 0.3%CA,100 μL 100 mmoL/L PMSF,0.0215 6 g 14 mmoL/L DTT。第1次裂解后12 000 r/min离心30 min,取上清液到新的10 mL离心管中,加5倍体积的常温丙酮,混匀后常温静置沉淀,再离心30 min,去除上清液,真空干燥。之后进行第2次裂解2 h,再离心30 min,取上清液50 μL/管分装,存于-80 ℃。以牛血清白蛋白(BSA)为对照,采用Bradford法[14]测定提取的水稻叶片蛋白提取液的蛋白浓度。
1.3 蛋白质的双向电泳
首先是固相pH值梯度选择,根据前期试验中蛋白分布情况的摸索,使用pH值为4~7的非线性(NL)胶条,水稻根蛋白点可均匀分布在整块胶上。其次为固相化pH值梯度(IPG)胶条的水化,将IPG胶条胶面朝下置于预先加好 460 μL 水化液和蛋白样品液的混合液的聚焦槽中,中间注意不要有气泡,2 mL矿物油覆盖后于20 ℃水化13 h,然后进行第一向等电聚焦,设置等电聚焦时的温度为20 ℃,每根胶条的极限电流为50 A。等电聚焦结束后进行IPG胶条的平衡,之后进行第二向SDS-PAGE电泳,电泳时使用低恒功率(2 W),待样品在完全跑出IPG胶条、溴酚蓝指示剂浓缩成一条线后,再加大功率(25 W),待溴酚蓝指示剂达到底部边缘2~3 cm时即可停止电泳。电泳结束后用考马斯亮蓝进行凝胶染色,后将脱色好的凝胶放置在扫描板上,调整图像大小后,对凝胶进行图像扫描,保存图像。使用PDQuest 软件分析图像。在蛋白质表达差异分析方面,对每个处理的3塊重复胶的蛋白点相对表达量(体积分数,%) 进行比较,根据单向方差分析(ANOVA)方法验证差异显著性。
1.4 蛋白质的胶内酶解
用剪掉的枪头将蛋白点从胶上人工切取,放置在1 mL离心管中,通过胰蛋白酶进行胶内酶解。酶解后的肽段用MALDI-TOF/TOF MS/MS质谱仪进行分析,并通过MASCOT软件检索水稻蛋白质数据库[15]。
1.5 生物信息学分析
用蛋白质功能数据库Pfam对差异表达的蛋白质进行功能分类[16],用PIR数据库进行GO(gene ontology )分析[17]。
2 结果与分析
2.1 不同浓度硫化氢影响水稻幼苗叶片蛋白质表达谱的差异分析
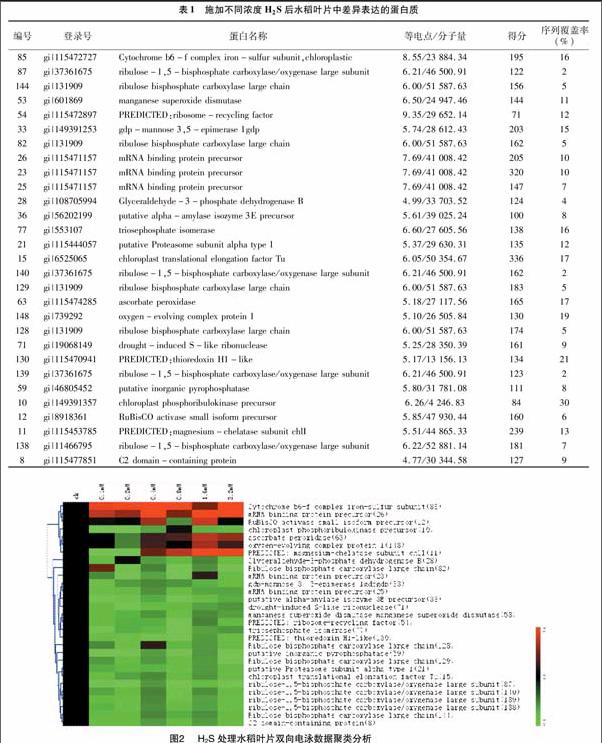
通过对水稻叶片蛋白质表达谱的分析,每块二维凝胶图谱上大约检测到320个蛋白点。不同浓度的硫化氢供体硫氢化钠(NaHS)[0(CK)、0.1、0.2、0.4、0.8、1.6、3.2 mmol/L]对水稻幼苗叶片的蛋白质表达的影响见图1。定量分析发现在至少1个处理梯度上表达丰度上差异2倍以上的蛋白点29个。利用 MALDI-TOF/MS质谱分析结合水稻蛋白质数据库检索,获得了29个蛋白点的身份(表1)。水稻叶片中在硫化氢影响下共有11个蛋白质在至少1个浓度处理下表达增强,有24个蛋白质在至少1个浓度处理下表达丰度下调(图2)。
2.2 差异表达蛋白的功能分析和GO分析
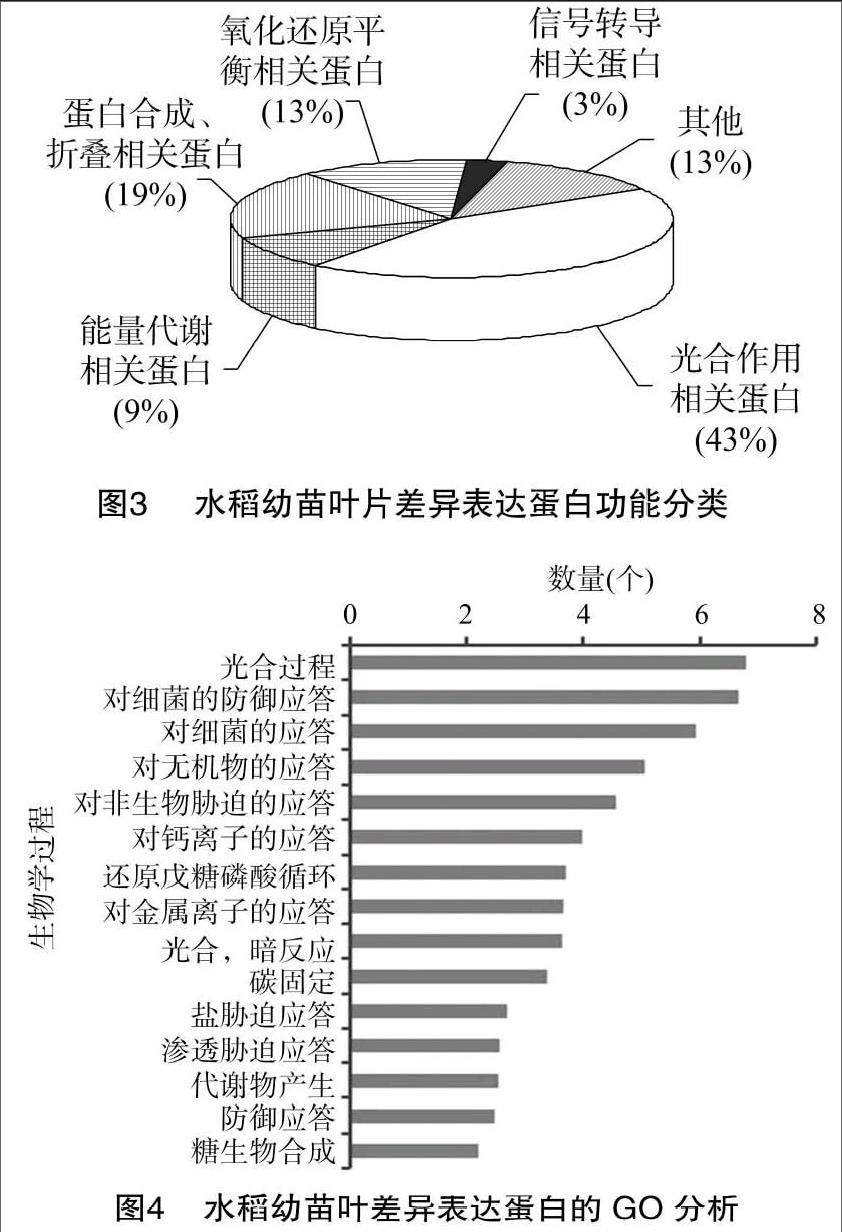
功能分析发现这些差异表达的蛋白质主要涉及到光合作用(43%)、能量代谢 (9%)、氧化还原平衡 (13%)、蛋白质合成、折叠、加工与降解 (19%),信号转导(3%)(图3)。GO分析发现这些蛋白质主要涉及到光合过程、防御和非生物胁迫应答等生物学过程(图4)。
2.3 H2S调控的差异蛋白的功能相关性分析
不同浓度的H2S对水稻幼苗叶片的效应主要是影响叶片的光合作用,还影响蛋白质的合成、折叠,以及植物体内氧自由基的产生和清除系统;H2S还影响能量的合成代谢[18]。
與光合作用相关的蛋白包括1,5-二磷酸核酮糖羧化酶/加氧酶大亚基、二磷酸核酮糖羧化酶大链、细胞色素b6-f复合体铁硫亚基、叶绿体磷酸核酮糖激酶、放氧复合体等。其中细胞色素b6-f是电子传递链中的重要电子传递体,而1, 5-二磷酸核酮糖羧化酶/加氧酶大亚基是羧化酶的活性亚基,3-磷酸甘油醛脱氢酶是CO2还原阶段的重要酶,这2个蛋白在植物光合过程中参与CO2的固定和光呼吸的调节,并且在净光合作用的过程中起关键作用,表明信号分子H2S影响了光合作用的电子传递及碳同化2个主要过程。同时我们亦发现部分与光合作用相关的蛋白表达量在低浓度时上调,在1.6、3.2 mmoL/L时表达量则下调,说明低浓度H2S能促进光合作用,而高浓度时则抑制[12]。
3 结论
通过对硫化氢影响水稻幼苗叶片的差异蛋白质表达谱分析,我们发现硫化氢调控了光合作用、能量代谢、氧化还原平衡、蛋白质合成、折叠、加工与降解、信号转导等生物学过程,这些生物学过程主要参与植物的光合作用、防御,及对非生物胁迫的应答等作用。特别是光合作用过程,其正常的运转是植物生长发育的重要保证,这些蛋白质直接影响与光合作用有关酶的活化、CO2的固定、光系统单位和电子传递链相关构成来调节光合作用,从而影响水稻幼苗的正常代谢而造成的。蛋白质是基因表达的产物,对其了解越多,越能客观准确地揭示相关的生命现象,本试验采用蛋白质组学方面的技术来研究H2S处理下水稻幼苗叶片中的相关蛋白,从而有助于了解硫化氢对水稻幼苗生长发育的影响。
参考文献:
[1]Szabo C. Hydrogen sulphide and its therapeutic potential[J]. Nature Reviews Drug Discovery,2007,6(11):917-935.
[2]Garía-Mata C,Lorenzo L. Hydrogen sulphide,a novel gasotransmitter involved in guard cell signalling[J]. New Phytologist,2010,188:977-984.
[3]Li Z G,Gong M,Liu P. Hydrogen sulfide is a mediator in H2O2-induced seed germination in Jatropha curcas[J]. Acta Physiologiae Plantarum,2012,34(6):2207-2213.
[4]Chen J,Wu F H,Wang W H,et al. Hydrogen sulphide enhances photosynthesis through promoting chloroplast biogenesis,photosynthetic enzyme expression,and thiol redox modification in Spinacia oleracea seedlings[J]. Journal of Experimental Botany,2011,62(13):4481-4493.
[5]李东波,肖朝霞,刘灵霞,等. 外源硫化氢对豌豆根尖及其边缘细胞的影响[J]. 植物学报,2010,45(3):354-362.
[6]Lisjak M,Srivastava N,Teklic T,et al. A novel hydrogen sulfide donor causes stomatal opening and reduces nitric oxide accumulation[J]. Plant Physiology and Biochemistry,2010,48(12):931-935.
[7]Wang Y Q,Li L,Cui W T,et al. Hydrogen sulfide enhances alfalfa (Medicago sativa) tolerance against salinity during seed germination by nitric oxide pathway[J]. Plant and Soil,2012,351(1/2):107-119.
[8]Zhang H,Dou W,Jiang C X,et al. Hydrogen sulfide stimulates β-amylase activity during early stages of wheat grain germination[J]. Plant Signaling & Behavior,2010,5(8):1031-1033.
[9]王兰香,侯智慧,侯丽霞,等. H2O2介导的H2S产生参与干旱诱导的拟南芥气孔关闭[J]. 植物学报,2012,47(3):217-225.
[10]方慧慧,裴雁曦,田保华,等. H2S与Ca2+协同增强谷子对Cr6+胁迫的耐受[J]. 中国细胞生物学学报,2014,36(6):758-765.
[11]Shan C,Dai H,Sun Y. Hydrogen sulfide protects wheat seedlings against copper stress by regulating the ascorbate and glutathione metabolism in leaves[J]. Australian Journal of Crop Science,2012,6(2):248-254.
[12]徐慧芳,陈桢雨,刘 辉,等. H2S对水稻幼苗形态及生理生化的影响[J]. 中国农学通报,2013,29(36):52-58.
[13]Damerval C,de Vienne D,Zivy M,et al. Technical improvments in two-dimensional electrophoresis increase the level of genetic variation detected in wheat-seedling proteins[J]. Electrophoresis,1986,7:52-54.
[14]Bradford M. A rap id and sensitive method for the quantitation of microgram quantities of protein using the principle of protein dye binding[J]. Analytical Biochemistry,1976,72:248-254.
[15]Wan X Y,Liu J Y. Comparative proteomics analysis reveals an intimate protein network provoked by hydrogen peroxide stress in rice seedling leaves[J]. Molecular & Cellular Proteomics,2008,7(8):1469-1488.
[16]Apweiler R,Attwood T K,Bairoch A,et al. The InterPro database,an integrated documentation resource for protein families,domains and functional sites[J]. Nucleic Acids Research,2001,29(1):37-40.
[17]Wu C H,Yeh L S,Huang H,et al. The protein information resource[J]. Nucleic Acids Research,2003,31:345-347.
[18]孟 丹,劉 玲,陈 露,等. 外源硫化氢对铝胁迫下水稻幼苗生长及生理生化的影响[J]. 江苏农业科学,2014,42(6):63-66.
