毛果杨富含谷氨酸蛋白PtrGARP1基因启动子特性
2017-03-20夏德安
鄂 文,夏德安
(东北林业大学,林木遗传育种国家重点实验室,黑龙江 哈尔滨 150040)
毛果杨富含谷氨酸蛋白PtrGARP1基因启动子特性
鄂 文,夏德安
(东北林业大学,林木遗传育种国家重点实验室,黑龙江 哈尔滨 150040)
为了研究PtrGARP1与杨树木质化生长的相关性,明确木材发育及形成的分子机制,以毛果杨幼树为材料,提取各组织的cDNA进行PCR扩增,并构建植物表达载体在模式植物拟南芥中进行PtrGARP1组织表达分析。结果显示,PtrGARP1基因在毛果杨木质化组织内高丰度表达,且表达水平与幼茎木质化程度同步增加;用Gateway技术构建该基因启动子融合报告基因GUS的ProPtrGARP1::GUS植物表达载体,转化野生型拟南芥获得5个稳定表达的转基因株系;GUS活性染色分析显示,PtrGARP1基因启动子活性集中在转基因植株发达的维管组织内。这个结果暗示着PtrGARP1与杨树木质化生长相关,可能参与木材发育及形成。
杨树;富含谷氨酸蛋白;PtrGARP1;启动子
木材源自于树木次生生长,由形成层活动产生次生维管组织(vascular system)而形成,这一过程包括形成层细胞增殖、伸长、分化,次生壁加厚以及细胞程序性死亡(Programmed cell death, PCD)等生理反应[1-5]。近年来,这方面的研究报道主要集中在模式植物拟南芥中[6-8]。研究表明,生长素、细胞分裂素和赤霉素等控制形成层活动[9-11],而MYB、NAC、HD-ZIPⅢ和KNOX等转录因子参与调控木质部次生壁形成[12-14]。此外,木质组织内进化出高丰度、特异表达的Tubulin微管蛋白家族成员与次生壁微纤丝沉积(microfibril deposition)有关,不少微管相关蛋白(microtubule associated proteins, MAPs)也被报道参与了次生壁的形成[15-18]。
最近,通过蛋白组学策略筛选鉴定出多个参与杨树幼茎木质化生长的蛋白质[19]。其中,一个富含谷氨酸的蛋白(Glutamic Acid Rich Protein)简称GARP,虽然功能未知,但其丰度随幼茎木质化生长而剧烈增加,其基因(Potri.014G162800, 被命名为PtrGARP1)转录水平也与幼茎木质化程度同步增加。研究还表明,该基因的表达模式为PtrGARP1基因启动子表达模式,且驱动报告基因GUS的活性主要集中在转基因拟南芥发达的维管组织区域。研究以毛果杨幼树为材料,提取各组织的cDNA进行PCR扩增,并构建植物表达载体在模式植物拟南芥中进行PtrGARP1组织表达分析,以期进一步证实PtrGARP1与杨树木质化生长的相关性,明确木材发育及形成的分子机制。
1 材料与方法
1.1 试验材料
供试材料为温室栽培4个月、株高约1.5 m的毛果杨幼树,取其顶端到基部第1、2、3、4、5和6茎节以及木质部、形成层和韧皮部、幼叶、老叶、叶柄、顶芽、根的组织,进行基因转录表达分析。以Columbia野生型拟南芥为植物表达载体进行PtrGARP1基因启动子的遗传转化研究。
植物总RNA采用pBIOZOL Reagent(Bioflux公司)提取。cDNA第一链采用PrimeScript RT reagent Kit with gDNAeraser(Takara公司)合成。高保真DNA聚合酶为KOD-Plus(Toyobo公司)。胶内DNA采用Silica Bead DNA Gel Extrction Kit (Thermo Scientific公司)回收。质粒采用E.A.N.A Plasmid Mini Kit I(Omega公司)提取。GUS染液:0.1 mol/L Na3PO4(pH值为7.0),10 mmol/L EDTA,2 mmol/L K3[Fe(CN)6], 2 mmol/L K4[Fe(CN)6],1 mmol/L X-Gluc, 0.1% (v/v) Triton X-100。基因引物合成以及DNA测序工作由Invitrogen公司完成。
1.2 试验方法
1.2.1 PtrGARP1氨基酸序列分析 毛果杨PtrGARP1基因信息在植物基因组数据库中查找并获取,其他物种的氨基酸序列在NCBI中查找获取,然后运用BioEdit生物学软件对这些同源基因的氨基酸序列进行比对分析。
1.2.2 植物总RNA、基因组DNA提取和cDNA第一链合成 拟南芥总RNA的提取与cDNA第一链合成参照各试剂盒产品说明书。拟南芥基因组DNA提取采用CTAB法[20]。
1.2.3 RT-PCR和启动子DNA片段扩增 以毛果杨各组织cDNA为模板进行PCR扩增,ACT2为内参基因,基因引物如下:ACT2,5′-CCCAGTGTTGTTGGTAGG CCAAGAC-3′和5′-CATAGCGGGAGAGTTAAAGG TCTC-3′;PtrGARP1,5′-TCTCCAGAGGAAGTAC CTGC-3′和5′-GAACTCAGCGTACGTACTCG-3′;启动子引物:5′-CACCCTTCAACTCCCACAAGACA-3′和5′-TGGAACTGAAAGGAAAATAAAGCAA-3′。扩增体系(20 μL):13.5 μL ddH2O,2 μL dNTPs (2 mmol/L),2 μL 10×Taq Buffer,引物(10 μmol/L)各0.5 μL,cDNA模板或基因组DNA模板1 μL,Taq DNA聚合酶0.5 μL。PCR扩增程序:预变性,94℃ 3 min;循环扩增,94℃ 30 s,60℃ 30 s,72℃ 30 s或2 min;后延伸,72℃ 7 min。ACT2基因扩增24个循环,PtrGARP1基因扩增25个循环,PtrGARP1启动子片段扩增32个循环。
1.2.4 植物表达载体构建 植物表达载体构建采用Gateway系统。扩增的PtrGARP1启动子片段从胶内回收后,连接插入Gateway入门载体pENTR/SD/ D-TOPO vector。连接体系(2.5 μL):0.5 μL TOPO Vector,0.5 μL Salt Solution,1 μL DNA片段(40 ng),0.5 μL ddH2O。将经DNA测序确认含目的片段的入门载体与pGWB3植物表达载体进行LR交换反应。LR反应体系(3 μL):1 μL含基因片段的TOPO质粒(40 ng),0.5 μL pGWB载体(120 ng), 0.5 μL LR Enzyme Mix II,1 μL ddH2O。LR反应条件为22℃、2 h。将交换连接含目的片段的pGWB3重组质粒转入GV3101农杆菌中进行遗传转化实验。
1.2.5 拟南芥栽培与遗传转化 消毒后的拟南芥种子于4℃春化2 d,播种在含1%蔗糖的1/2MS培养基上,萌发、生长7 d后,幼苗移栽到土中,置于长日照环境(16 h光照/8 h黑暗)培养,环境温度20~23℃,光强80~100 µmol/(m2·s)。栽培约8周,采用浸花法[21]进行遗传转化。
1.2.6 GUS组织化学染色 将植物组织浸没在GUS染液中抽真空,负压脱气5 min再回复正常气压,这一操作重复3~5次,然后置于37℃水浴8~10 h。染色结束后加入70%乙醇于37℃下脱色12~16 h,观察拍照。
2 结果与分析
2.1 PtrGARP1氨基酸序列分析
据推测,PtrGARP1蛋白有172个氨基酸,其中谷氨酸有57个,约占氨基酸总数的1/3。用该序列同源性检索显示,毛果杨基因组存在1个高度同源的编码基因(Potri.002G223100)。此外,在NCBI(http:// www.ncbi.nlm.nih.gov/)进行Blast同源性检索显示,胡杨、可可、葡萄、赤杨、雷蒙德氏棉、陆地棉、荷花及甜橙物种均存在PtrGARP1同源蛋白质。对这些氨基酸序列进行一致性比对(图1)显示,这类蛋白质保守氨基酸位点几乎均为谷氨酸,暗示谷氨酸残基是这类蛋白质结构或功能行使的关键。
2.2 PtrGARP1组织转录表达特性
PCR扩增结果显示:PtrGARP1在毛果杨的木质部、形成层和叶柄组织内高丰度转录,其次是老叶和韧皮部,而在幼叶、叶柄、顶芽和根中几乎检测不到(图2b);在第1至6逐渐木质化生长的茎节中,PtrGARP1转录水平逐步升高,且在已木质化的第5和6茎节内高丰度转录(图2a)。这表明,PtrGARP1仅在木质化的组织内高丰度表达,暗示着该基因很有可能与次生细胞壁形成相关,参与了杨树木材发育及形成过程。
2.3 ProPtrGARP1::GUS植物表达载体构建
用Plant CARE(http://bioinformatics.psb.ugent.be/ webtools/plantcare/html/) 分析PtrGARP1基因启动子区域,长度为3 182 bp。以毛果杨基因组DNA为模板,PCR扩增得到相应片段,插入到pENTR/SD/D-TOPO载体中。由图3b可知,PtrGARP1启动子DNA片段成功连接到pENTR/SD/D-TOPO载体。通过LR重组反应将pENTR/SD/D-TOPO载体上ProPtrGARP1片段重组到植物表达载体pGWB3上,以重组质粒为模板使用ProPtrGARP1引物进行PCR扩增鉴定,得到的特异DNA片段长度与目标DNA片段大小相符(图3 d)。这一结果显示ProPtrGARP1::GUS植物表达载体已构建成功,将其转入GV3101农杆菌中用于转化野生型拟南芥。
2.4 转基因植株分子鉴定

图1 PtrGARP1及其同源蛋白推测氨基酸序列比对
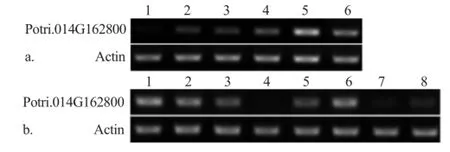
图2 PtrGARP1在不同组织内的转录表达分析
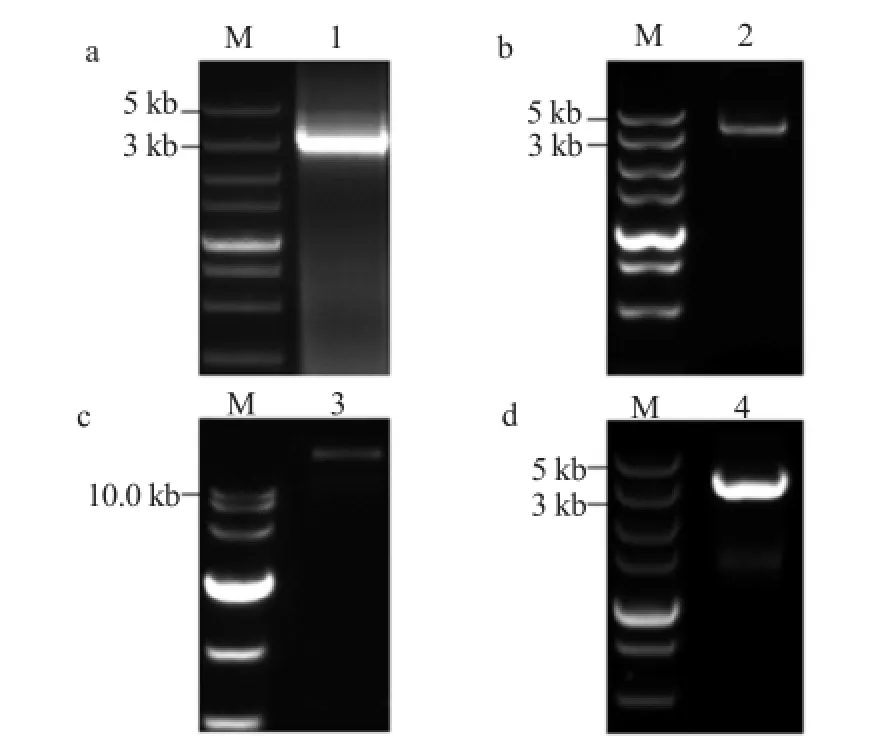
图3 PtrGARP1基因启动子的pGWB3植物表达载体构建
采用浸花法对野生型拟南芥进行遗传转化,通过卡那霉素抗性筛选获得ProPtrGARP1::GUS抗性植株5棵,分别提取各转基因植株的基因组DNA,用上游引物和GUS基因下游引物对基因组DNA 进行PCR扩增。从图4中可以看出,野生型拟南芥无扩增带而ProPtrGARP1::GUS转基因各株系中均可见特异带,表明ProPtrGARP1::GUS融合基因已成功转入野生型拟南芥基因组中。
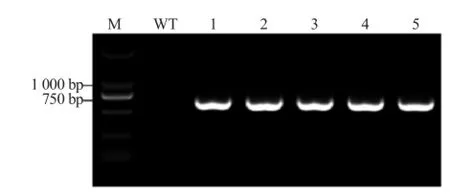
图4 ProPtrGARP1::GUS转基因植株鉴定
2.5 转基因植株GUS组织化学染色
对ProPtrGARP1::GUS转基因材料的幼苗以及生长至开花期的成熟植株进行GUS组织化学染色。由图5可知,蓝色信号主要出现于幼苗叶脉、叶柄、上胚轴和根中柱区域;在成熟植株的茎和花器官中均被观察到强烈的GUS活性;进一步分析显示,在茎组织的维管发达区域的维管束、木质部和束纤维内GUS活性较高。这些数据表明PtrGARP1基因的启动子活性主要存在于维管系统发达的组织内,这暗示PtrGARP1与杨树木质化生长相关,可能参与木材形成。

图5 ProPtrGARP1::GUS转基因植株GUS组织化学染色
3 讨 论
富含谷氨酸蛋白(GARPs)是一类新奇的蛋白质,由于按富含Glu归类则不同源的GARPs功能是不同的。一些非植物GARPs功能被报道,如柱状感光蛋白、人属纤维蛋白原类似蛋白等[22-23]。然而,植物GARPs的文献较少,仅有的几篇文献描述几个不同源GARPs基因克隆、表达或推测性功能[24-26]。目前,还没有植物GARP功能被证实。PtrGARP1同源性检索显示(图1),拟南芥和玉米中不存在GARP1同源基因,而赤杨(A. glutinosa)、木薯(M. esculenta)和葡萄(V. vinifera)等植株中存在GARP1同源基因。
木薯中PtrGARP1同源基因被命名Pt2L4,主要表达在次生维管组织区域[27-28]。前期研究表明,PtrGAPR1蛋白丰度随幼茎木质化生长而剧烈增加[19]。而从RT-PCR分析可知,PtrGAPR1转录水平也随幼茎木质化生长而同步增加(图2),进一步研究表明(图5),PtrGARP1基因启动子活性主要集中在转基因植株的维管组织区域。这些结果均暗示着PtrGARP1与杨树木质化生长相关,可能参与了木材形成过程。植物Tubulin微管蛋白的氨基酸序列中含有多个谷氨酸[17],且可通过微管组织参与细胞壁纤维素微纤丝沉积、介入细胞壁增厚等生理过程[15-16]。由此推测,PtrGARP1很可能与杨树微管组织相关,进而参与次生壁合成(木质化)过程。然而,PtrGARP1的准确功能有待通过其突变体材料鉴定。
[1] Vibe Scheller H,Ulvskov P. Hemicelluloses[J]. Annu Rev Plant Biol,2010,61:263-289.
[2] Mizrachi E,Mansfield S D,Myburg A A. Cellulose factories:advancing bioenergy production from forest trees[J]. New Phytol,2012,194:54-62.
[3] Oda Y,Fukuda H. Secondary cell wall patterning during xylem differentiation[J]. Curr Opin Plant Biol,2012,15:38-44.
[4] Ursache R K,Nieminen,Helariutta Y. Genetic and hormonal regulation of cambial development[J]. Physiol Plant,2013,147:36-45.
[5] Larisch C,Dittrich M,Wildhagen H,et al. Poplar wood rays are involved in seasonal remodeling of tree physiology[J]. Plant Physiol,2012,160:1515-1529.
[6] Caño-Delgado A,Lee J Y,Demura T. Regulatory mechanisms for specification and patterning of plant vascular tissues[J]. Annual Review of Cell and Developmental Biology,2010,26:605-637.
[7] Schuetz M,Smith R,Ellis B. Xylem tissue specification patterning and differentiation mechanisms[J]. Journal of Experimental Botany,2013,64:11-31.
[8] Zhong R,Ye Z H. Secondary cell walls:biosynthesis patterned deposition and transcriptional regulation[J]. Plant and Cell Physiology,2015,56(2):195-214.
[9] Raghavendra,A S. Physiology of Trees[M]. Canada:simaltaneously,1991. 175-178.
[10] Aloni R. Differention of Vascular tissues[J]. Annu Rev Plant Physiol,1957,38:179-204.
[11] Sircar S M,Chakraverty R. The effect of gibberellic acid on jute[J]. Sci Cult,1960,26:141-143.
[12] Du J,Groover A. Transcriptional regulation of secondary growth and wood formation[J]. Journal of Integrative Plant Biology,2010,52(1):17-27.
[13] Demura T,Ye Z H. Regulation of plant biomass production [J]. Current opinion in plant biology,2010,13(3):298-303.
[14] Zhong R,Lee C,Zhou J,et al. A battery of transcription factors involved in the regulation of secondary cell wall biosynthesis in Arabidopsis[J]. The Plant Cell Online,2008,20(10):2763-2782.
[15] Oda Y,Fukuda H. Secondary cell wall patterning during xylem differentiation[J]. Curr Opin Plant Biol,2012,15:38-44.
[16] Oda Y,Fukuda H. Spatial organization of xylem cell walls by ROP GTPases and microtubule-associated proteins[J]. Curr Opin Plant Biol,2013,16:743-748.
[17] Oakley R V,Wang Y S,Ramakrishna W,et al. Differential expansion and expression of α- and β-tubulin gene families in Populus[J]. Plant Physiol,2007,145:961-973.
[18] Spokevicius A V,Southerton S G,MacMillan C P,et al. Beta-tubulin affects cellulose microfibril orientation in plant secondary fibre cell walls[J]. Plant J,2007,51:717-726.
[19] Jinwen L,Guanghui H,Yuxiang C,et al. Comparative proteomic analysis of Populus trichocarpa early stem from primary to secondary growth[J]. Journal of Proteomics,2015,126:94-108.
[20] Springer N M. Isolation of plant DNA for PCR and genotyping using organic extraction and CTAB [J]. Cold Spring Harbor Protocols,2010,(11):1228-1229.
[21] Clough S J,Bent A F. Floral dip:a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana [J]. The Plant Journal,1998,16(6):735-743.
[22] Jia L,Liang T,Yu X,et al. MGARP regulates mouse neocortical development via mitochondrial positioning[J]. Mol Neurobiol,2014,49:1293-1308.
[23] Li W Z,Wang J,Long R,et al. Novel antibody against a glutamic acid-rich human fibrinogen-like protein 2-derived peptide near Ser91 inhibits hfgl2 prothrombinase activity[J]. PLoS One,2014,9(4):e94551.
[24] Liu J,Seul U,Thompson R. Cloning and characterization of a pollenspecific cDNA encoding a glutamic acid-rich protein(GARP)from potato Solanum berthaultii[J]. Plant Mol Biol,1997,33:291-300.
[25] Zhang P,Bohl-Zenger S,Puonti-Kaerlas J,et al. Two cassava promoters related to vascular expression and storage root formation[J]. Planta,2003,218:192-203.
[26] Regina B S C,Joaquim C B C L,Rita P A E,et al. A cDNA sequence coding for a glutamic acid-rich protein is differentially expressed in cassava storage roots[J]. Protein Pept Lett,2006,13(7):653-657.
[27] Beltrán J,Prías M,Al-Babili S,et al. Expression pattern conferred by a glutamic acid-rich protein gene promoter in field-grown transgenic cassava(Manihot esculenta Crantz)[J]. Planta,2010,231(6):1413-1424.
[28] de Souza CR,Aragão F J,Moreira E C,et al. Isolation and characterization of the promoter sequence of a cassava gene coding for Pt2L4,a glutamic acid-rich protein differentially expressed in storage roots[J]. Genet Mol Res,2009,8:334-344.
(责任编辑:成 平)
Characterization of the PtrGARP1 Promoter from Populus trichocarpa
E Wen,XIA De-an
(State Key Laboratory of Tree Genetics and Breeding, Northeast Forestry University, Harbin 150040, PRC)
Reverse transcriptional (RT)-PCR analysis showed that the PtrGARP1 gene was highly expressed in the lignified tissues of Populus trichocarpa and the transcriptional expression levels were significantly increased with the lignification of young stems. DNA fragment of PtrGARP1 promoter was constructed into plant expression vector (ProPtrGARP1::GUS) by fusing GUS reporter gene using Gateway technology. Five transgenic lines were obtained after the transformation of Arabidopsis. Analysis of GUS activity staining showed that the activity existed in the developing vascular tissues of transgenic plants. The result suggests that PtrGARP1 gene function is associated with the lignification of Populus trichocarpa and may be involved in wood development and formation.
Populus trichocarpa; glutamic acid rich protein; PtrGARP1; promoter
Q789
:A
:1006-060X(2017)02-0001-05
10.16498/j.cnki.hnnykx.2017.002.001
2016-12-14
国家863计划课题(2013AA102702)
鄂 文(1991-),女,黑龙江鸡西市人,硕士研究生,研究方向为林木遗传育种。
夏德安
