维医异常黑胆质型COPD大鼠模型肺组织和膈肌的超微结构观察
2017-03-20高振王晶徐丹荆晶李争
高振++王晶++徐丹++荆晶++李争++姜敏++哈木拉提·吾甫尔++李风森

【摘要】目的:电镜观察研究异常黑胆质型COPD大鼠肺组织和膈肌组织的病理改变。方法:利用气道滴注弹性蛋白酶结合熏烟90d基础上叠加干寒环境、干寒饮食和足底电刺激建立异常黑胆质型COPD模型(ASSCOPD)。取肺组织和膈肌组织进行电镜观察。结果:对照组肺泡壁完整、肺泡清晰,肺泡Ⅱ型细胞有板层小体正常;膈肌纤维肌节排列整齐,肌膜下线粒体排列相对整齐。ASSCOPD肺泡腔内有巨噬细胞,溶酶体增多;出现髓样结构;线粒体肿胀、基质密度降低,排列较为松散。ASSCOPD膈肌细胞异常收缩带、局部肌丝、肌原纤维溶解,线粒体肿胀,出现砖墙样改变。结论:异常黑胆质型COPD属于中重度COPD范畴,其不仅存在肺部的超微病理结构改变,而且膈肌的结构改变也较为明显,可能是异常黑胆质型COPD的主要病理变化之一。
【关键词】慢性阻塞性肺疾病;异常黑胆质型;超微结构;肺;膈肌
【中图分类号】R563【文献标志码】 A【文章编号】1007-8517(2017)04-0033-05
Ultrastructural Morphological Study of Pulmonary Tissue and Diaphragm of Abnormal Savda
Syndrome of Chronic Obstructive Pulmonary DiseaseGAO Zhen1,2,3WANG Jing3XU Dan1JING Jing1LI Zheng1JIANG Min3Halmurat Upur1*LI Fengsen1,3
1. National Clinical Research Base of Traditional Chinese Medicine, Traditional Chinese Medicine
Hospital affiliated to Xinjiang Medical University, Urumqi 830000, China
2. Postdoctoral of Traditional Chinese Medicine Hospital of Xinjiang Uygur Autonomous Region, Urumqi 830000, China;
3. Respiratory Disease Research key Laboratory of Xinjiang, Urumqi 830000, China;Abstract:Objective Transmission electron microscope were used to observe the pathological changes of pulmonary tissue and diaphragm of abnormal savda syndrome of chronic obstructive pulmonary disease(ASSCOPD). Methods ASSCOPD model was set up by tracheal dripping PEE+ smoking+ fed with cold food diet under cold-dryness environment, stimulated with electric foot shocks. Pulmonary tissue and diaphragm were observed by Transmission electron microscope. Results pulmonary alveolar wall of normal rats was thin and intact,pulmonary alveoli was clear. Lamellar bodies in the type Ⅱpneumocytes did not show any sigh of abnormal. In abnormal savda syndrome of chronic obstructive pulmonary disease(ASSCOPD) group, There were macrophages in pulmonary alveolar,also lysosome increased, myelinfigure appearance. itochondrial swelling, Reduced density matrix of the mitochondrial, more loosely arranged. Diaphragm cell with abnormal contraction, local muscular filaments, myofibrillar dissolution, swelling of mitochondria, appear brick-like changes. Conclusion ASSCOPD belong to moderate and severe COPD, Ultrapathological structural changes not only appearance in pulmonary but also in diaphragm, It may be one of the major pathological changes of ASSCOPD.
Keywords:Chronic Obstructive Pulmonary Disease; Abnormal Savda Syndrome; Ultrastructural Morphological; Pulmonary; Diaphragm
流行病学调查显示中国七省市40 岁以上群体慢性阻塞性肺疾病(Chronic obstructive pulmonary disease, COPD)患病率为82%[1],新疆农村地区50岁以上人群的COPD检出率>10%(94/743)[2],COPD 是全球范围内一个重要的致残和致死原因,给人类带来了大量且不断增加的经济和社会负担[3],对其进行研究和防治不可忽視。随着COPD研究的不断深入,发现不同的COPD患者在发病危险因素、机制、临床症状、影像学表现、年均急性加重频次等方面存在着较大的差异,对于相同治疗措施的反应区别亦大,故对COPD进行分型研究,以利于个性化防治的开展且临床意义较大。根据维吾尔医(以下简称维医)理论,COPD可分为异常黑胆质型、异常血液质型、异常粘液质型和异常胆液质型等4型,其中以异常黑胆质型最为多见(占4064%)[4],其病情较重、预后较差、容易产生变证和坏证,对患者危害较大。故选择该亚型为研究对象,电镜观察研究异常黑胆质型COPD大鼠肺组织和膈肌组织的病理改变,为后续研究提供参考。
1实验材料
11动物清洁级雄性Wistar大鼠60只,5周龄,体重(150±20)g,购自新疆医科大学实验动物中心,生产许可证号:SCXK(新)2003-0001。在实验动物中心适应性喂养3d,自由进食饮水。
12药物维药异常黑胆质成熟散源自古代著名维吾尔医学家穆哈穆德·艾克拜尔·艾尔扎尼编撰的经典名著《米扎尼·提比也》(医学之规律),由薰衣草、小茴香、破布木果、大枣、牛舌草、香青兰、甘草、铁线蕨、地锦草、刺糖10味维药组成,免煎颗粒购自江苏江阴天江药业有限公司。
13仪器FLI-2000H型人工气候箱(日本EYELA公司);BUXCO MA1320呼吸功能实验平台(美国Buxco公司);BS-1105型电子天平(北京赛多克斯天平有限公司);DM600B-1显微镜(德国Leica公司);JEM-1230型生物用透射电子显微镜(日本电子株式会社);亚克力染毒箱(自制)。
14材料哈德门牌卷烟(山东中烟工业有限责任公司出品,焦油量11mg,烟气烟碱量08mg,烟气一氧化碳量13mg);弹性蛋白酶(批号:H1326040,30U/mg,上海阿拉丁生化科技股份有限公司)。
2实验方法
21分组及模型制备按照随机数字表法分为异常黑胆质型COPD模型组(Abnormal savda syndrome COPD,ASSCOPD),20只、异常黑胆质型异黑成熟剂干预组(Abnormal savda munziq,ASMCOPD)20只,对照组(Control)20只。
异常黑胆质型COPD组:于实验开始后的第30天按每100g体重气管滴注溶于08mL生理盐水的20U弹性蛋白酶;第1至第29天,第31至第90天每天进行熏烟,每次熏烟箱内放置大鼠20只,燃烧卷烟 20支,持续时间1h,上下午各一次。在此基础上叠加以下处理因素[5]:第1天至第97天每天晚上将大鼠置于系统设置为温度(6±2)℃、相对湿度(25%~328%)的人工气候箱,每天10h;给予自制饲料喂养,自制饲料由普通饲料、大麦和芫荽子按照7∶15∶15的比例配制而成;同时采用间断足底电击作为应激源(输出电压20~30V,不定时改变电压,间隔02~05s,每天20min)产生慢性应激;所有证候造模因素持续97d。对照组:置于室温(25±3)℃,相对湿度(60%~80%)的环境中常规饲料喂养,在第30天以与模型组相同术式在大鼠气管滴注等体积的生理盐水。在第90天时给予ASMCOPD组异黑成熟颗粒灌胃,ASSCOPD组,对照组给予等体积生理盐水灌胃,所有组均干预7d。在第97天时对各组大鼠行无创幼物肺功能检测后抽血处死大鼠,取所需组织标本保存待检测。
气管内滴注弹性蛋白酶方法:手术器械术前高压蒸汽灭菌(121℃,120kPa, 30min),将大鼠逐一称重,按50 mg/kg体质量腹腔注射浓度为04%戊巴比妥钠溶液,以钳夹爪尖无反应为麻醉成功标准,将大鼠钝固定于鼠板上,使用16号套管针顺大鼠舌头慢慢送入气管,拔出针,接1mL针管(内含所需剂量的弹性蛋白酶),置头高脚低位,呈45°,向左倾斜,缓慢推入半量溶液,向右倾斜,再缓慢推入另外半量溶液。回到中间,注入1mL空气,使剩余的液体全部进入肺部,再轻拍老鼠背部,使弹性蛋白酶溶液在肺内均匀分布。注意保温,待大鼠清醒后放回原鼠盒中饲养。
22干预方法 ASMCOPD组给予维药异常黑胆质成熟散灌胃,给药量根据人的内服剂量按照“人和动物间按体表面积折算的等效剂量比值表” [6]进行计算,70kg者每天异常黑胆质成熟散剂量为30g,查阅比值表可知,200g大鼠的标准用药量是70kg者用药剂量的0018倍,故而得出200g大鼠每天的用药量为054g。分早晚两次灌胃,每次5mL。ASSCOPD组、COPD组、对照组给予等体积生理盐水灌胃,干预7d。
23检测指标及方法
231大鼠肺组织病理观察在第90天和第97天将大鼠用戊巴比妥钠麻醉后予下腔静脉抽血处死,迅速摘取各组大鼠肺组织,取右肺中叶,部分气管、支气管,10%福尔马林固定,病理制作组织切片程序按常规脱水、浸蜡包埋、切片(2μm),每块组织连续切片3张,行HE染色,于光学显微镜下摄片观察组织形态学改变。
232大鼠肺组织和膈肌超微结构观察在第90天和第97天将大鼠用戊巴比妥钠麻醉后予下腔静脉抽血处死,迅速摘取各组大鼠肺组织和膈肌,取右肺中叶,将肺和膈肌组织切成1mm厚左右小块,25%戊二醛固定24h,磷酸缓冲液冲洗后2%锇酸后固定1h;梯度乙醇脱水,并同时用溶于70乙醇中醋酸铀进行块染;置于苯二甲酸二丙烯脂渗透24h;以PDAP包埋后,63°聚合72h;包埋块进行超薄切片;枸橼酸铅染色后上镜观察并照相。超薄切片,JEOL1230透射电镜观察。
3结果
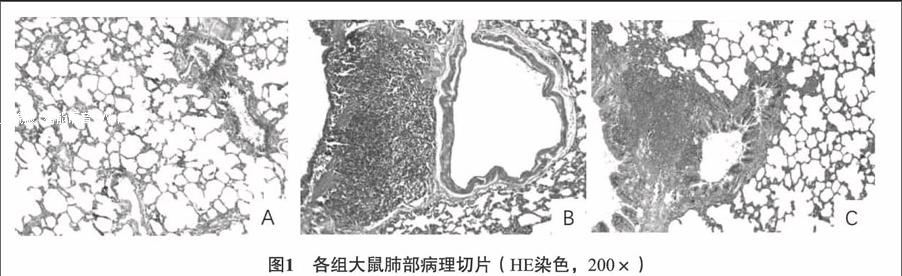
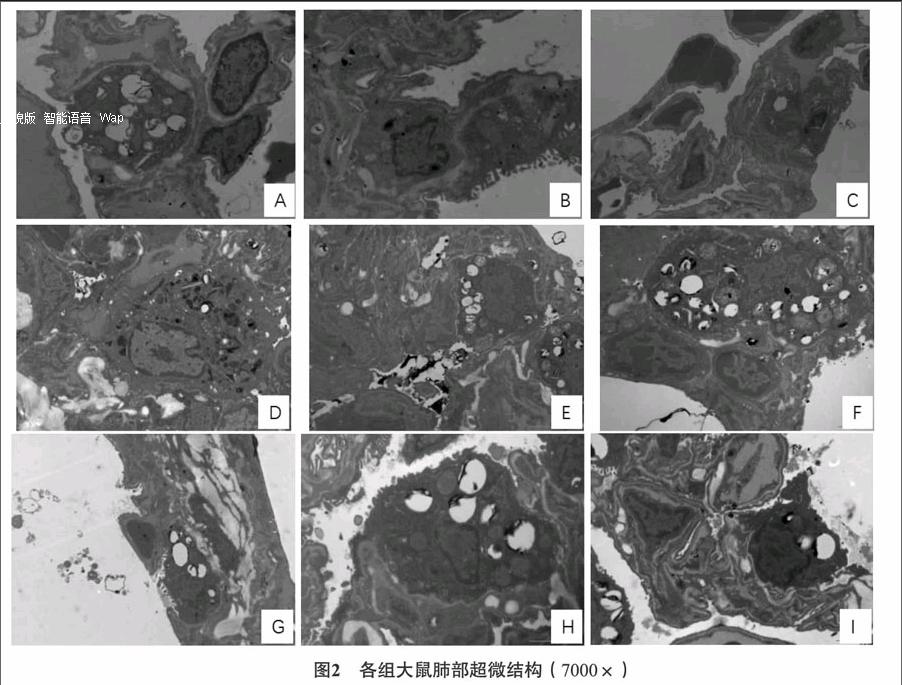
31各组大鼠肺组织病理结果比较对照组肺泡大小基本一致,肺泡壁厚度正常,外周未见炎性细胞浸润,或见极少量炎症细胞散在分布(A);ASSCOPD组见大量炎性浸润,肉芽肿发生,部分肺纤维化(B);ASMCOPD组见炎性浸润发生,较模型改善(C)。见图1。32各组大鼠肺组织超微结构比较对照组见肺泡Ⅱ型细胞,胞内细胞器(板层结构小体)清晰可见,肺泡腔较为干净(A);微绒毛较为丰富,细胞核不规则,线粒体排列紧密(B);肺泡腔较为干净(C)。ASSCOPD组肺泡腔内出现单核巨噬细胞,溶酶体比较多(D);出现髓样结构(E);线粒体肿胀,基质密度降低,排列较为松散(F)。ASMCOPD组肺泡腔有渗出,板层体扩张明显,有髓样结构(G);线粒体密度降低,轻微肿胀(H);表面絨毛减少,肺泡腔内有渗出,板层体扩张(I)。见图2。33各组大鼠膈肌超微结构比较对照组肌纤维肌节排列整齐,肌膜下有线粒体,排列相对整齐(A),出现成纤维细胞(B)。ASSCOPD组出现肌细胞异常收缩带、局部肌丝、肌原纤维溶解,线粒体肿胀(C);肌间质线粒体肿胀明显,肌节排列不整齐,形成砖墙样改变(D);肌浆网扩张,肌丝溶解“Z”线消失(E)。ASMCOPD组肌原纤维发生改变,排列紊乱(F);出现肌卫星细胞,少量肌间纤维,大量线粒体轻微肿胀(G);线粒体个别肿胀,肌纤维排列紊乱,收缩异常(H)。见图3。
4讨论
慢性阻塞性肺疾病由于受到动态肺过度充气和内源性呼气末正压的影响,膈肌长期处于不利的机械学位置,易出现疲劳[7]。膈肌疲劳作为COPD发展过程中的重要环节,直接影响COPD的预后和转归[8]。呼吸肌收缩功能下降是COPD呼吸困难和活动耐力下降的主要原因[9],而膈肌是最主要的吸气肌,平静呼吸时膈肌收缩活动产生的潮气量占总潮气量的80%[10]。因此研究COPD的膈肌变化有着较大的现实意义,本研究同时观察了模型肺部和膈肌的超微结构改变。
研究发现ASSCOPD组肺泡腔内出现炎性细胞(单核巨噬细胞),与肺部HE染色病理切片观察有炎性细胞浸润吻合。溶酶体增多,提示模型机体可能存在自噬-溶酶体系统的激活;出现髓样结构,提示细胞有损伤;线粒体轻微肿胀,基质密度降低,排列较为松散,影响机体能量的提供。而维药异黑成熟颗粒对模型大鼠肺部此类变化的治疗作用不明显。
针对膈肌的研究发现,ASSCOPD膈肌结构的改变很明显,出现肌细胞异常收缩带、局部肌丝、肌原纤维溶解,线粒体肿胀;肌间质线粒体肿胀明显,肌节排列不整齐,形成砖墙样改变;肌浆网扩张,肌丝溶解“Z”线消失等。而研究发现[11]中重度COPD膈肌呈现肌节断裂,Z线消失,肌丝错位和连接蛋白丢失等现象,而轻中度COPD无明显膈肌损伤[12-13]。提示异常黑胆质型应该属于中重度COPD范畴。同样,中、重度COPD患者膈肌纤维内出现巨大线粒体及大量嵴减少、絮状、髓样及空泡样变的线粒体[14]也支持这个观点。而维药异黑成熟散干预后膈肌出现肌卫星细胞和少量肌间纤维。一般来说,肌损伤后会出现炎性反应和肌肉重建,肌肉重建的一个特点是肌卫星细胞活化,它能增殖和分化成新的肌纤维细胞[15]。这是异黑成熟散治疗的可能机制之一。已经有研究发现[16]中药补肺健脾方也可以显著改善COPD大鼠膈肌功能,但干预时间持续11周,故考虑本研究中给药时间过短可能是没有起效的关键因素之一,还有待进一步的实验验证。
从电镜观察结果推测,维医异常黑胆质型COPD属于现代医学中重度COPD范畴,其不仅存在肺部的超微病理结构改变,而且膈肌的形态改变也较为明显,细胞结构的变化可能是异常黑胆质型COPD的病理变化之一。参考文献
[1]Zhong NS,Wang C,Yao WZ,et al. Prevalence of chronic obstructive pulmonary disease in China:a large, population-based survey[J]. Am J Respir Crit Care Med,2007,1 76(8): 753-760.
[2] 凌敏,荣艳,苟安栓,等.新疆农村地区慢性阻塞性肺疾病的危险因素调查[J].中华结核和呼吸杂志,2011,34(9):666-668.
[3] Buist AS,Mcburnie MA,Vollmer WM,et al. International variation in the prevalence of COPD(the BOLD study):A population-based prevalence study[J]. The Lancet, 2007, 370(9589):741-750.
[4] 阿衣努尔·买提斯迪克,于洋,哈木拉提·吾甫尔,等.新疆COPD患者维医异常体液分型的量化诊断入选项专家咨询研究[J].新疆医科大学学报,2011,34(11):1196-1202.
[5]Ablimit A,Kühnel H,Strasser A, et al. Abnormal Savda syndrome:long-term consequences of emotional and physical stress on endocrine and immune activities in an animal model[J]. Chin J Integr Med,2013,19(8):603-9.
[6] 赵伟,孙国志.不同种实验动物间用药量换算[J].畜牧兽医科技信息,2011,27(5): 52-53.
[7] Mador MJ,Kufel TJ,Pineda LA,et al.Diaphragmatic fatigue andhigh- intensity exercise in patients with chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2000, 161(1):118-23.
[8] Sauleda Roig J.Clinical consequences of muscle dysfunction in chronic obstructive pulmonary disease[J]. Nutr Hosp,2006,21(3):69.
[9] Klimathianaki M1,Vaporidi K,Georgopoulos D. Respiratory muscle dysfunction in COPD: from muscles to cell[J].Curr Drug Targets,2011,12(4):478-88.
[10]Wilson TA,Legrand A,Gevenois PA,et al. Respiratory effects of the external and internal intercostal muscles in humans[J]. J Physiol,2001,53(2):319-30.
[11]Orozco-Levi M,Lloreta J,Minguella J,et al. Injury of the human diaphragm associated with exertion and chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med,2001,16(9):1734-9.
[12] Levine S, Kaiser L, Leferovich J,et al. Cellular adaptations in the diaphragm in chronic obstructive pulmonary disease[J].N Engl J Med,1997,33(25):1799-1806.
[13] Stubbings AK, Moore AJ, Dusmet M, et al. Physiological properties of human diaphragm muscle fibres and the effect of chronic obstructive pulmonarydisease[J]. J Physiol,2008,58(10):2637-2650.
[14] Scott A,Wang X,Road JD,et al. Increased injury and intramuscular collagen of the diaphragm in COPD: autopsy observations[J].Eur Respir J,2006,27(1):51-9.
[15] 石磊,田媛,朱曉萍. 慢性阻塞性肺疾病(COPD)患者的膈肌适应和损伤改变[J].复旦学报(医学版),2014,41(2):269-273.
[16] 李素云,李亚,李建生,等. 补肺健脾方对慢性阻塞性肺疾病大鼠膈神经放电和膈肌功能的影响[J].中国中西医结合杂志,2012,32(6):812-816.
(收稿日期:2016-11-29编辑:陶希睿)
