Botryosphaeria dothidea突变体库的构建及分析
2017-03-17郑伟贾晓曼王玉珂王怡霖孙庚午何邦令刘会香
郑伟,贾晓曼,王玉珂,王怡霖,孙庚午,何邦令*,刘会香*
1.山东农业大学植物保护学院,山东泰安271018
2.西北农林科技大学林学院,陕西杨凌712100
3.山东省泰安市第二中学,山东泰安271000
Botryosphaeria dothidea突变体库的构建及分析
郑伟1,2,贾晓曼1,王玉珂3,王怡霖1,孙庚午1,何邦令1*,刘会香1*
1.山东农业大学植物保护学院,山东泰安271018
2.西北农林科技大学林学院,陕西杨凌712100
3.山东省泰安市第二中学,山东泰安271000
Botryosphaeria dothidea是重要的林果溃疡病害病原,分布广,危害重。本研究应用ATMT(Agrobacterium tumefaciens-mediated transformation)介导的B.dothidea遗传转化体系成功构建了1053个转化子的突变体库,并且通过继代培养、PCR验证和Southern blot证明潮霉素B抗性基因整合到B.dothidea基因组中且可稳定遗传。以B.dothideasdau11-126为对照,对526株转化子的菌落形态、生长速率和致病性进行分析,筛选获得了8个变异明显且稳定的突变体,以期为B.dothidea致病基因的分离、克隆和功能鉴定奠定基础。
Botryosphaeria dothidea;农杆菌介导转化(ATMT);突变体;筛选
Botryosphaeria dothidea属子囊菌门,葡萄座腔菌属,是引致林果溃疡病的重要病原,其分布广泛、寄主范围广,可侵染杨树、苹果树、梨树、桃树、桉树以及橄榄树等多个树种[1],引致果实腐烂、叶片斑点、枝干溃疡、顶梢枯死、树体流胶乃至整株树木的死亡[2],危害严重。因此,揭示B.dothidea致病的分子机制是国内外学者关注的热点之一。
酶和毒素是B.dothididea致病机制研究最多的内容。酶和毒素可同时或分别在致病过程中起作用[3]。Ki Woo Kim等人对B.dothidea侵染果实的电镜观察发现,在无伤口和自然孔口存在的情况下,B.dothidea能分泌类似角质层降解酶的物质帮助其顺利侵染[4]。韩国学者对被B.dothidea侵染过的苹果果实的提取物进行了分析,发现其产生多聚半乳糖醛酸酶(Polygalacturonase,PG)、聚甲基半乳糖醛酸酶(pectin methyl galacturonic acid enzymes,PMG)和多聚半乳糖醛酸反式消除酶(poly-galacturonic acidtrans-elimination enzyme,PGTE)等一系列果胶酶[5]。但目前对B.dothidea致病机理的研究还处于初级阶段,并不能直接证明哪种物质在致病过程中起主要作用,更不能在深层次上揭示其致病机理。真菌ATMT突变体库的构建为真菌突变基因的筛选及生长发育相关机理的研究提供了良好的平台[4]。虽然目前多种真菌ATMT突变体库的构建方法及相关基因的分离和克隆已取得了重要研究进展[6-8],但B.dothidea在突变体库方面的研究较少,本研究旨在建立B.dothideaATMT介导的突变体,并从中随机选取部分菌株,对其表型和致病性等进行分析,寻找致病突变体,进而对致病相关基因进行分离和初步注释,为寻找调控B.dothidea生长发育和致病性相关基因奠定基础。为明确其致病机理、掌握其与寄主的互作关系以及明确其发病规律等提供了科学依据,最终为B.dothidea引致病害的有效控制提供新的思路和策略。
1 材料与方法
1.1 实验材料
Botryosphaeria dothideasdau11-126菌株(对照菌株)分离自苹果果实(辽宁,瓦房店E121°13′; N39°45′),经检测为强致病菌株;质粒载体pBHt2(含1.4 kb的潮霉素抗性基因hph),农杆菌AGL-1放于30%甘油中-80℃冻存。上述菌株均保存在山东农业大学林木与病原分子互作研究室。
1.2 实验方法
1.2.1B.dothidea突变体库的构建
1.2.1.1 对照菌株对潮霉素B敏感性测定将对照菌株接种在PDA平板上,28℃的培养箱中黑暗培养4 d,用直径5 mm的灭菌的打孔器在菌落周边打取菌丝块,接种于含不同潮霉素浓度(0µg/mL、25 µg/mL、50µg/mL、75µg/mL)的PDA平板的中央,置于28℃培养,每个处理设3个重复。后用十字交叉法测量菌落直径,筛选出能够抑制菌株生长的最佳浓度。
1.2.1.2 对照菌株原生质体的制备对照菌株在PDA培养基上28℃培养5 d后,加入3 mL无菌水,用火焰灭菌的涂布器将平板上菌丝刮断,将菌丝液转移到200 mL PD培养基中,100 r/min 28℃培养48 h。在超净工作台中,用四层纱布过滤收集菌丝,用0.7 M NaCl溶液冲洗菌丝几次,用灭菌的滤纸和吸水纸滤干水分,用50 mL灭菌离心管盛装菌丝,称量干菌丝的重量备用。用0.7 M NaCl溶液溶解酶,0.7 M/mL NaCl溶解0.015 g崩溃酶和0.015 g裂解酶,酶解液体积与菌丝质量的关系为:3 mL/g。酶完全溶解后用注射器吸取酶液,经过滤器将滤液加到盛菌丝的离心管中,在31℃、100 r/min的摇床中酶解3.5 h。菌丝酶解后用细胞筛过滤除去残渣,用1~2 mL 0.7 M NaCl冲洗残留在细胞筛上的原生质体两次,收集所有的滤液盛于一灭菌的50 mL离心管中,在4℃、3000 r/min条件下离心15 min,小心弃上清,用1~2 mL的STC轻轻用枪头吹打悬浮沉淀,再离心1次,再弃上清,最后用1 mL的STC悬浮原生质体,使其浓度为6×106/mL,于-80℃条件下保存。
1.2.1.3 根癌农杆菌介导转化(Agrobacterium tumefaciens-mediated transformation,ATMT)首先将冻融法转化好的携带标记基因的农杆菌AGL-1,在LB固体平板培养基上划线培养,长出菌落后挑选单菌落克隆,牙签接种到LB液体培养基,200 r/min 28℃过夜培养。
取上述培养液1 mL,12000 r/min离心1 min,弃上清,用200µL AIM液体充分悬浮菌体,12000 r/min离心1 min,弃上清,再用200µL AIM充分悬浮菌体后转移菌体到试管中,调节试管中农杆菌的浓度大约为OD600=0.15,28℃水平摇床培养5~6 h,此时农杆菌的浓度OD600值约为0.5~0.6。
在超净工作台中往用STC保存的原生质体的1.5 mL离心管中加入500µLYPS,放到DNA混合仪上恢复或者摇床28℃条件下100 r/min,6 h。
加热已经准备好的固体AIM使之溶化,等液态AIM凉到不烫手时加入(spore element 500µL/100 mL;乙酰丁香酮(Acetosyringone,AS)200µmol/L;卡那霉素50µg/mL)倒平板,AIM凝固后再其上面覆盖硝酸纤维素膜(NC膜)。100µL培养好的经AS诱导培养的农杆菌和250µL恢复细胞壁的原生质体混合后涂布在贴有硝酸纤维素膜的AIM平板,22℃黑暗条件诱导培养48 h。
农杆菌和原生质体共培养后,将AIM上的NC膜用火焰灭菌的手术刀切成约3 mm宽的细条,转移到筛选培养基中(不含5%山梨醇的PDA加热融化后加入潮霉素50µg/mL;头孢霉素40µg/mL;链霉素50µg/mL),28℃培养7 d左右出现转化子,将转化子再转移到筛选培养基上重复筛选2次。
随机挑选出B.dothidea菌株的转化子转接到含潮霉素的PDA平板上,待长出后,再转接至不含潮霉素的PDA连续继代培养5代后,转接到含潮霉素的PDA平板上,观察转化子是否仍对潮霉素表现出抗性。
分别对上述继代培养后的转化子采用CTAB法提取DNA,然后以DNA为模板,用扩增潮霉素B抗性基因的上下游引物hph1(5’-CAGCCTTGCTATCACATT-3’)序列,hph2(5’-AGCCCTGCTT CTTCCA-3’)序列进行PCR和Southern blot检测。
1.2.2B.dothidea突变体的筛选
1.2.2.1 菌落形态观察和生长速率测定将供试的突变菌株在PDA平板上28℃恒温培养4 d后,观察记录各菌株菌落形状、颜色、气生菌丝的生长情况。分别于2 d、3 d、4 d用十字交叉法测量菌落生长直径,计算菌落生长速率并用SPSS软件分析其差异显著性。每个菌株设3个重复,并重复3次。
1.2.2.2 致病性测定对照菌株和突变体菌株PDA培养基于28℃培养4 d,菌落边缘取直径为5 mm的菌饼作为接种体备用。将红富士苹果果实表面洗净后用75%的酒精表面消毒,最后用无菌水冲洗3次,风干待用。试验采用人工接种法[9,10],28℃下培养。将野生型菌株和突变体菌株分别接种到苹果表面,测量其在相同时间内病斑扩展直径。选用“海棠”叶片,叶片表面处理方法同上,然后用灭菌的湿棉花包住叶柄保湿。接种后的叶片放入托盘内(盘底铺上灭菌的纱布),盘口覆上保鲜膜,于28℃保湿培养。试验采用针刺伤(均匀分布在直径2 mm的圆形区域)的伤口处理方式,刺伤部位避开叶片主脉。将PDA空白饼块、野生型菌株和突变体菌株分别接种到叶片表面,测量其在相同时间内病斑扩展直径。SPSS软件分析其差异显著性。
2 结果与分析
2.1 B.dothidea突变体库的构建
2.1.1 对照菌株在PDA上的菌落形态对照菌株在PDA培养基上,28℃培养4 d后菌落直径约5 cm,菌落边缘初生长的菌丝为白色,中心菌丝为灰黑色,产生黑色色素(见图1a)。
2.1.2 对照菌株对潮霉素B的敏感性测定试验设置不同浓度梯度的潮霉素B对对照菌株进行敏感性测试,结果所示(见图2),当潮霉素浓度为50 μg/mL时,对照菌株不能生长,故本试验中采用50 μg/mL的潮霉素B用于筛选。
2.1.3 原生质体制备获得的原生质体在显微镜下呈圆球形,大小不一,直径在6.72 μm~32.35 μm之间,平均21.71 μm(见图1b)。

图1 a:对照菌株在PDA上菌落形态(4d);b:10×40光学显微镜下原生质体;c:通过ATMT获得的转化子Fig.1 a:The colonial morphology of control strain on PDA (4d);b:Protoplasts were observed under 10×40 optical microscope;c:Transformants were obtained by ATMT
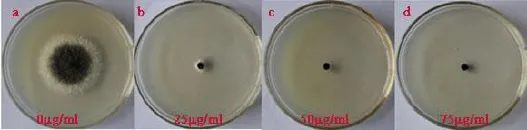
图2 对照菌株对潮霉素B的敏感性测定Fig.2 Assessment of sensitivity of control strain to hygromycin B
2.1.4 根癌农杆菌介导转化农杆菌介导原生质体的转化效率为每106个原生质体产生25~40个转化子。本试验转化pBHt2获得具有潮霉素抗性转化子1053个(见图1c)。
2.1.5 转化子的遗传稳定性分析随机挑选转化子菌株转接在不含潮霉素B的PDA平板上连续继代培养5代后,再接种到含有潮霉素B的培养基上,转化子仍然能够在含有潮霉素B的平板上生长(见图3),表现出对潮霉素B的抗性,而对照菌株在含潮霉素B的PDA上不能生长。说明转化子T-DNA的插入具有遗传稳定性。

图3 转接5代后在含潮霉素B的PDA上生长1:对照菌株,2-6:转化子Fig.3 The fifth generation on PDAcontaining hygromycin B1:cotrol strain,2-6:transformants
2.1.6 转化子潮霉素B抗性基因PCR检测随机挑选的转化子均可以扩增获得一条约1.4 kb的片段,与从质粒扩增出来的潮霉素B抗性基因片段相同,而以对照菌株DNA为模板没有扩增出任何条带(见图4),说明hph基因已经整合进对照菌株的基因组中。以潮霉素B基因片段为探针对转化子进行Southern blot检测,结果显示T-DNA以单拷贝插入基因组中(见图5)。
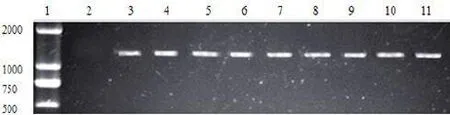
图4 随机插入转化子潮霉素抗性基因PCR检测1:Marker;2:对照菌株;3-11:转化子Fig.4 PCR amplification ofhphgene of random inserted-transformants1:Marker;2:controlstrain;3-11:PCRampliconsoftransformants

图5 转化子T-DNA插入拷贝数检测1:质粒pBHt2;2-7:转化子Fig.5 Copy number of T-DNAinsert of transformants1:plasmid pBHt2;2-7:Transformants
2.2 B.dothidea突变体的筛选
2.2.1 突变体菌落形态观察对照菌株在PDA培养基上28℃培养4d后菌落形态同图1a。在供试526个转化子中有8株菌落形态发生了明显变化,其中突变体LW-31和LW-26气生菌丝疏松且旺盛,菌落正面和反面一直保持为乳白色;突变体LW-27、LW-22气生菌丝稀薄且不旺盛,菌落正面和背面均为淡黄色;LW-100气生菌丝稀薄不旺盛,菌落呈轮纹状,菌落正面和反面都是红褐色;LW-93气生菌丝稀薄不旺盛,菌落边缘有水溶现象,菌落正面和反面都是红褐色;LW-7气生菌丝疏松且旺盛,菌落初期为灰白色,后期变为灰褐色;LW-111菌丝稀松旺盛,菌落为乳白色并有两个同心环状凹陷(见图6)。

图6 对照菌株和突变菌株在PDA上菌落形态(4d)Fig.6 Colony morphology of control strain and mutants strains on PDA(4d)
2.2.2 突变体生长特性测定分析对照菌株和8个突变体菌株菌落直径(见图6)、生长速率(见图7)测定结果发现突变体LW-7、LW-31、LW-111菌株生长速率明显比对照菌株快,生长速率分别增快了27.60%、29.35%、27.83%,并且与对照菌株相比存在显著差异(见表1)。突变体LW-27和LW-26菌株生长速率明显比对照菌株慢,生长速率分别减慢26.84%和24.43%,并且与对照菌株相比存在显著差异。

图7 对照菌株与突变菌株菌落生长速率的比较Fig.7 Comparison of the growth rate between control strain and mutants strains

图8 对照菌株与突变菌株侵染苹果速率比较Fig.8 Comparison of infection rate between control strain and mutants strains

表1 对照菌株和突变菌株在菌落生长速率和致病性两方面方差分析Table 1 Variance analysis of two aspects of colony growth rates and pathogenicity of control strain and mutants strains
2.2.3 突变体致病性测定测量对照菌株和突变菌株在苹果果实上病斑扩展直径(见图9),计算病斑平均扩展速率(见图8)。突变菌株LW-7和LW-31致病性比对照菌株致病性增强,分别增强了13.76%和10.65%,并且与对照菌株存在显著差异;突变菌株LW-27、LW-26、LW-100比对照菌株致病性减弱,分别减弱了54.90%、25.68%、26.86%,并且与对照菌株存在显著差异;突变菌株LW-93、LW-22、LW-111与对照菌株没有差异显著性(见表1)。

图9 对照菌株和突变菌株致病力测定(4 d)Fig.9 Pathogenic force measurement of control strain and mutants strains(4 d)
测量对照菌株和突变体接种于离体海棠叶片上病斑扩展直径(见图10)。经多次重复实验统计后发现:突变菌株在海棠叶片的致病性和在苹果果实的致病性基本一致。突变菌株LW-7和LW-31致病性比对照菌株致病性增强,分别增强了40.38%和54.28%,并且与对照菌株存在显著差异;突变菌株LW-27、LW-26比对照菌株致病性减弱,分别减弱了49.52%、37.14%,并且与对照菌株存在显著差异;突变菌株LW-93、LW-22、LW-111、LW-100与对照菌株没有差异显著性(见表1)。

图10 对照菌株和突变菌株致病力测定(4 d)Fig.10 Pathogenic force measurement of control strain and mutants strains(4 d)
3 讨论
目前,已有很多研究人员运用ATMT方法成功实现了多种病原菌功能基因的定点突变和功能分析。根癌农杆菌介导的真菌遗传转化还具有高效产生标记突变体和分离、克隆相关突变基因的优势。与PEG法相比它可以用原生质体、菌丝、孢子和蘑菇的菌褶组织等材料转化,受体广泛[11];农杆菌介导转化方法得到的突变体单插入较多;根癌农杆菌介导的真菌遗传转化的效率是常规转化效率的100~1000倍;而PEG介导的真菌遗传转化主要特点是操作简单,对原生质体有一定的毒性,变异率高,且转化率也比较低[11]。
本研究对B.dothidea突变体库内526个转化子筛选发现大部分菌株在菌落形态、菌落生长速率、致病性等性状上与对照菌株没有明显差异,仅少数突变体表现出明显的差异。这与宋哲[5]、王梅娟等[7]的报道是一致的。出现这种现象的可能原因有:外源基因是随机插入病原菌基因组的;表型的改变不仅受外源基因的影响,还同时受病原菌本身的株系、遗传转化体系以及插入拷贝数等众多因素影响。
4 结论
本研究在已建立并优化ATMT介导的B.dothidea遗传转化体系的基础上,重点进行了突变体库的构建和表型筛选,使B.dothidea突变体库容达1053个转化子,其转化效率为每106个原生质体产生25~40个转化子,并且通过继代培养、PCR和Southern blot证明hph基因已经整合进对照野生菌株的基因组中,而且可稳定遗传。通过对突变体菌落形态、生长速率、气生菌丝茂密程度及致病性等因子进行系统分析和重复筛选,发现该菌株突变效率较低,比较保守,菌落颜色与该菌株的生长速率和致病性没有相关性,菌株的生长速率与致病性存在正相关性。
[1]Phillips AJL,Alves A,Correia ACM,et al.Two new species ofBotryosphaeriawith brown,1-septate ascospores andDothiorellaanamorph[J].Mycologia,2005,97(2):513-529
[2]Liu HX,Li XD,Zhu XP,et al.First report of pomegranate stem scab caused byBotryosphaeria dothideain China[J]. Plant Pathology,2009,58(2):400
[3]陈亮.Botryosphaeria dothidea和Valsa malivar.mali遗传转化体系的建立[D].泰安:山东农业大学,2014:1-2
[4]Kim KW,Park EW,Kim KS.Glyoxysomal nature of microbodies complexed with lipid globules inBotryosphaeria dothidea[J].Phytopathology,2004,94(9):970-977
[5]宋哲.苹果轮纹病菌突变体库建立和突变体表型分析[D].杨凌:西北农林科技大学,2014:3-5
[6]范雷.灰葡萄孢T-DNA插入突变体库的构建及其致病相关基因研究[D].武汉:华中农业大学,2012:7-13
[7]王梅娟,李坡,吴敏,等.玉米大斑病菌ATMT突变体库的构建及其分析[J].中国农业科学,2012,45(12):2384-2392
[8]朱荷琴.我国棉花黄萎病菌的致病力分化及致病相关基因的克隆与分析[D].杨凌:西北农林科技大学,2013:13-15
[9]韦洁玲,黄丽丽,郜佐鹏,等.苹果树腐烂病室内快速评价方法的研究[J].植物病理学报,2010,40(1):14-20
[10]臧睿.陕西省苹果树腐烂病菌不同分离株的生物学特性及致病性研究[D].杨凌:西北农林科技大学,2006:31-33
[11]王阳.小麦条绣菌遗传转化体系的建立[D].杨凌:西北农林科技大学,2006:10-15
Construction and Evaluation of the Mutant Library ofBotryosphaeria dothidea
ZHENG Wei1,2,JIAXiao-man1,WANG Yu-ke3,WANG Yi-ling1,SUN Gen-wu1, HE Bang-ling1*,LIU Hui-xiang1*
1.College of Plant Protection/Shandong Agricultural University,Tai’an271018,China
2.College of Forestry/Northwest Agriculture and Forestry University,Yangling712100,China
3.Tai’an City Second Middle School in Shandong Province,Tai’an271000,China
Botryosphaeria dothideais an important pathogen of forest and fruit trees and it is widely distributed and causes serious damage.In this study,mutant library ofB.dothideawas constructed via ATMT mediated transformation and 1053 transformants were obtained.Hygromycin B resistance genes were integrated into the genome of theB.dothidea,and mitotically stable after several subcultures were tested by PCR amplification and Southern blot.The strainB.dothideasdau11-126 was used as control to analyze colonial morphology,growth rate and pathogenicity of 526 transformants.Eight stable and obvious mutants were obtained by screening.This study will lay a foundation for isolating,cloning and functional identification of the pathogenic genes.
Botryosphaeria dothidea;Agrobacterium tumefaciens-mediated transformation(ATMT);mutants;screening
S763.1
:A
:1000-2324(2017)01-0001-06
2016-08-01
:2016-10-27
国家重点研发计划(2016YFD0201100);国家科技部基础平台项目中国树木溃疡病重要病原微生物多样性及在中国的生态地理分布和危害调查(2009FY210100)
郑伟(1990-),男,河南安阳人,硕士研究生.E-mail:610965956@qq.com
*通讯作者:Author for correspondence.E-mail:hebangling@126.com;hxliu722@126.com
