APE1/Ref-1、EGR-1在食管鳞癌中的表达及相关性研究
2017-03-17韩立杰董稚明刘伟魏冬冬
韩立杰 董稚明 刘伟 魏冬冬
APE1/Ref-1、EGR-1在食管鳞癌中的表达及相关性研究
韩立杰 董稚明 刘伟 魏冬冬
目的 本研究旨在明确APE1/Ref-1和EGR-1在食管鳞癌及癌旁组织中的表达情况,并结合临床资料评估其表达与组织分级和临床分期之间的关系,为进一步研究食管鳞癌的发生发展机制提供参考依据,并为食管鳞癌的预防、诊治提供临床指标。方法 随机选取2009至2010年接受胸外科手术治疗的86例食管癌标本,术前均未经放化疗等任何抗癌治疗。采用免疫组织化学法(S-P法)测定APE1/Ref-1的蛋白、EGR-1的蛋白表达情况,对其相关性进行分析。结果 APE1/Ref-1 在ESCC组织中细胞质和细胞核联合阳性表达率为68.6%明显高于癌旁组织的联合阳性表达率8.1%,差异有统计学意义(P<0.01)。APE1/Ref-1在癌旁组织中的细胞核阳性表达率为91.9%明显高于ESCC组织的24.4%,差异有统计学意义(P<0.01)。EGR-1在ESCC组织的阳性表达率显著低于癌旁组织(P<0.01)。结论 在ESCC中,APE1/Ref-1胞核胞质联合表达率随着组织学分级降低和临床分期的升高有增强的趋势,EGR-1的阳性表达率随着组织学分级降低和临床分期的升高有降低的趋势。
APE1/Ref-1;EGR-1;免疫组织化学;食管鳞状细胞癌
脱嘌呤脱嘧啶核酸内切酶/氧化还原因子1(apurinic/apyrimidinic endonuclease/redox factor-1,APE1/Ref-1)是一种多功能因子,在多种生物学反应中起着非常重要的作用。研究表明APE1/Ref-1的表达同肿瘤的发生发展有一定的关系,然而此基因与肿瘤相关性的研究主要集中于结直肠癌、肾癌、恶性黑色素瘤、乳腺癌、头颈部肿瘤、前列腺癌、非小细胞肺癌、卵巢癌和骨肉瘤等领域[1-12]。关于APE1/Ref-1与食管鳞癌之间关系的研究国内外鲜有文献报道。早期生长反应基因1(early growth response gene-1,EGR-1)为即刻早期反应基因家族成员之一,它能调控其下游靶基因的转录和表达,并且在细胞增殖与凋亡的过程中发挥重要作用。许多肿瘤的发生发展都与此基因的的异常表达密切相关。有关EGR-1在食管鳞癌发生发展中的作用的研究还很少,值得进一步探讨。
1 资料与方法
1.1 一般资料 收集河北医科大学第四医院2009至2010年接受胸外科手术治疗的86例食管癌标本,男63例,女23例;年龄18~70岁,平均年龄(42±3)岁。依据国际抗癌联盟食管癌TNM分期(2009):Ⅰ、Ⅱ期47例,Ⅲ、Ⅳ期39例;组织类型均为鳞癌;高中分化55例,低分化31例。
1.2 主要试剂与方法 APE1/Ref-1鼠抗人单克隆抗体,购自美国abcam生物技术公司,EGR-1兔抗人多克隆抗体购自美国 SANTA CRUZ 生物技术公司,SP9001兔SP检测试剂盒、SP9002鼠SP检测试剂盒购自北京中杉金桥生物技术有限公司,OLYMPUSBX41光学显微镜购自日本OLYMPUS公司,Q capture图像采集系统购自加拿大QIMAGING公司。采用免疫组织化学法(S-P法)测定APE1/Ref-1的蛋白、EGR-1的蛋白表达情况。食管癌组织标本制成4 μm连续切片,常规脱蜡至水后,同一条件下进行SP法免疫组化染色。
1.3 结果判定 光学显微镜下观察并计数,APE1/Ref-1蛋白表达阳性产物呈棕黄色细颗粒状,有3种细胞内表达模式,分别为细胞核、细胞质、细胞核和细胞质,出现这三种表达的任一种都参加计数,分别记为细胞核表达、细胞质表达和细胞核和细胞质双表达。EGR-1蛋白为细胞核表达,以胞核内出现棕黄色或棕褐色颗粒为阳性染色细胞。采用双盲法:随机选取10个高倍镜视野计数至少500~1 000个鳞状上皮细胞或肿瘤细胞观察其中阳性细胞的染色深浅和占计数细胞的百分比进行评分。评分方法:(1)按细胞染色有无及深浅对染色强度评分:0分为无色,2分为黄色或深黄色,3分为褐或棕褐色;(2)按阳性细胞所占的百分比评分:0分为阴性,1分为阳性细胞≤10%,2分为11%~50%,3分为51%~75%,4分为≥75%。每例染色积分=两种评分相乘(A×B),积分≥3分为阳性;积分<3为阴性。
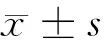
2 结果
2.1APE1/Ref-1在食管鳞癌中的表达 在癌旁组织中APE1/Ref-1的细胞核阳性表达率(91.9%,79/86)明显高于鳞癌组织(24.4%,21/86),差异有统计学意义(P<0.01)。鳞癌组织中细胞质和细胞核联合阳性表达率(68.6%,59/86)明显高于癌旁组织的联合阳性表达率(8.1%,7/86),差异有统计学意义(P<0.01)。见表1。

表1 鳞癌组织和瘤旁组织的APE1/Ref-1蛋白表达 n=86,例(%)
2.2EGR-1在食管鳞癌中的表达EGR-1蛋白的阳性表达定位于胞核,未见细胞质表达。鳞癌组织的阳性表达率(39.5%,34/86)显著低于癌旁组织(93.0%,80/86)。差异有统计学意义(P<0.01)。见表2。

表2 鳞癌组织和癌旁组织的EGR-1蛋白表达 n=86,例(%)
2.3APE1/Ref-1的表达与临床参数的关系 在86例食管癌组织中APE1/Ref-1蛋白胞核胞质联合表达阳性率按组织分级和临床分期的不同进行统计学分析,低分化组的阳性率(87.1%,27/31)明显高于高中分化组的阳性率(54.5%,30/55),差异有统计学意义(P<0.05)。APE1/Ref-1的胞核胞质联合表达与组织学分级呈负相关。临床Ⅲ、Ⅳ期组的阳性表达率(87.2%,34/39)明显高于Ⅰ、Ⅱ期组的阳性表达率(66.0%,31/47)(P<0.05)。APE1/Ref-1的胞核胞质联合表达与临床分期呈正相关。按性别和年龄分组,APE1/Ref-1的表达差异无统计学意义(P>0.05)。见表3。
2.4APE1/Ref-1和EGR-1在ESCC中表达的相关性 在21例APE1/Ref-1胞核表达的食管鳞癌组织中,有13例EGR-1表达阳性,而在65例APE/Ref-1非胞核表达的食管鳞癌组织中,仅有21例EGR-1表达阳性,即EGR-1在APE1/Ref-1胞核表达的ESCC组织中的阳性表达率(61.9%)显著高于其在APE1/Ref-1非胞核表达的ESCC组织中的阳性表达率(32.3%),差异有统计学意义(P<0.05),二者呈明显的相关性(r=0.260)。见表4。

表3 食管鳞癌组织中APE1/Ref-1联合表达与临床的关系 例(%)
2.5 EGR-1的表达与临床参数的关系 在86例食管鳞癌中,EGR-1的阳性表达情况按组织学分级和临床分期的不同进行分析,低分化组的阳性率(22.6%,7/31)明显低于高分化组的阳性率(49.1%,27/55),差异有统计学意义(P<0.05)。EGR-1的阳性表达与组织学分级呈正相关。EGR-1在临床Ⅲ、Ⅳ期组的阳性表达率(25.6%,10/39)明显低于Ⅰ、Ⅱ期组的阳性表达率(51.1%,24/47),差异有统计学意义(P<0.05)。EGR-1的阳性表达与临床分期呈负相关。按性别和年龄分组,EGR-1的表达差异无统计学意义(P>0.05)。见表5。

表4 食管鳞癌组织中APE1/Ref-1和EGR-1的关系 例
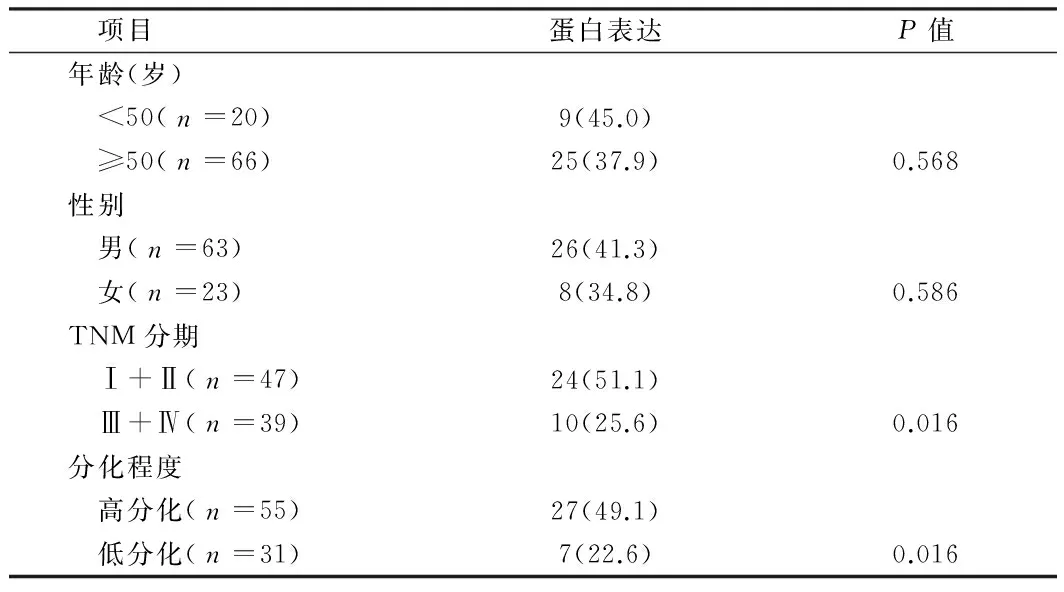
表5 食管鳞癌组织中EGR-1表达与临床的关系 例(%)
3 讨论
APE1/Ref-1广泛表达于多种组织细胞中。APE1/Ref-1 是一种多功能因子。首先,它可以通过改变多种转录因子的氧化还原状态,而调控这些转录因子的活性,其次,它还是DNA碱基切除修复过程中的主要限速酶[13,14]。APE1/Ref-1蛋白表达的多少与DNA修复活性相一致,许多病理生理过程,例如肿瘤形成、细胞凋亡等,都与这种基因的异常表达、异常分布或功能改变密切相关[15,16]。
有研究发现,在恶性黑色素瘤、直肠癌、卵巢癌、非小细胞肺癌、前列腺癌中[7,11],癌细胞中的APE1/Ref-1细胞质表达或细胞核胞质共同表达都与肿瘤的恶性度呈正相关。这些研究与我们的试验结果一致:APE1/Ref-1在食管鳞癌癌旁组织中的细胞核表达率(91.9%)明显高于鳞癌组织(24.4%),鳞癌组织中胞核胞质联合表达率(68.6%)明显高于癌旁组织的联合表达(8.1%),以上差异具有显著性(P<0.01)。这说明APE1/Ref-1在正常组织中大部分为核定位表达,但随着细胞恶变为肿瘤细胞后,APE1/Ref-1在胞质中的表达强度明显增加。这些结果表明此基因蛋白的胞核胞质联合定位可能与食管鳞癌的发生有关。APE1/Ref-1胞核胞质联合表达在低分化食管鳞癌组中的阳性率明显高于高中分化组,差异具有显著性(P<0.05),联合表达率与组织学分级呈负相关。胞核胞质联合表达在临床Ⅲ、Ⅳ期中的阳性率明显高于Ⅰ、Ⅱ期的阳性率,差异具有显著性(P<0.05),联合表达率与临床分期呈正相关;按性别和年龄分组,APE1/Ref-1的胞核胞质联合表达无显著性差异(P>0.05)。APE1/Ref-1胞核胞质联合表达率随着组织学分级降低和临床分期的升高有增强的趋势。提示此基因蛋白的胞核胞质联合表达可能与食管鳞癌的发展有关。由此可见,APE1/Ref-1在食管鳞癌中的发生发展中可能发挥着重要作用,因此可以用它来判断肿瘤发生发展情况及预后。
EGR-1属于即刻早期反应基因家族成员,与细胞的增殖、分化和凋亡有关的多种基因都是EGR-1作用的靶基因[17]。有研究指出,EGR-1可能是通过激活一些抑癌基因(P53基因等)、介导肿瘤坏死因子-α(TNF-α)或者改变细胞内钙离子的浓度来实现其诱导细胞凋亡的作用的[18,19]。EGR-l在细胞增殖和细胞凋亡过程中均有调控作用,两种截然相反的作用具体发挥哪种主要还在于所调控蛋白的表达情况[20]。有文献表明,在c-Jun蛋白、野生型P53蛋白或PTEN蛋白任何一种蛋白高表达的情况下,EGR-1的主要作用为诱导细胞凋亡;在突变型P53蛋白高表达的情况下,EGR-1的主要作用为促进细胞增殖[21,22]。
许多肿瘤的发生发展都与此基因的异常表达密切相关。Aggarwal等[23]研究表明用不同剂量的Co60射线照射宫颈癌Hela细胞株后,EGR-1基因表达随照射量的增加而增加,EGR-1基因的蛋白表达量与Hela细胞株的凋亡率呈正相关。Lee等[24]研究结果显示,用托灭酸诱导结直肠癌细胞中EGR-1的表达增加后,肿瘤生长受抑。李晓斌等[25]用RT-PCR的方法检测食管癌患者EGR-1mRNA表达情况发现,EGR-1mRNA在食管癌组织的表达明显低于癌旁组织。此基因的表达与肿瘤分化程度和临床分期也有关,分化程度越低,表达也越低,临床分期越晚,表达也越低。其表达与年龄性别无关。这与我们的试验结果也基本一致:EGR-1基因在癌旁组织的蛋白表达率明显高于食管鳞癌组织(P<0.05),低分化食管鳞癌组的阳性表达率明显低于高中分化组 (P<0.05),EGR-1的阳性表达随着组织学分级的降低而降低;EGR-1在临床Ⅲ、Ⅳ期中的表达明显低于Ⅰ、Ⅱ期(P<0.05),EGR-1的阳性表达随着临床分期的推迟而降低;按性别和年龄分组,EGR-1的表达无显著性差异(P>0.05)。这表明EGR-1在食管鳞癌中的表达降低与组织学分级、临床分期密切相关。我们推测EGR-1蛋白的表达降低是导致食管鳞癌发生发展的重要原因之一。
然而还有一些相反的结论。EGR-1与胃癌、膀胱癌、前列腺癌发生发展有关系,并且是正相关[20,25,26]。由于EGR-1对肿瘤的调节具有双向性,所以还存在很多问题需要解决,例如,它对哪些肿瘤的发生发展是正向调节,对那些肿瘤是负向调节,以及它对肿瘤细胞的生长抑制或促进作用都是通过调控哪些下游基因实现的等等还有待于进一步研究。
另外,我们还发现在21例APE1/Ref-1胞核表达的鳞癌组织中,有13例EGR-1蛋白表达阳性,而在65例APE1/Ref-1非胞核表达的鳞癌组织中,仅有21例EGR-1表达阳性,即EGR-1在APE1/Ref-1胞核表达的鳞癌组织中的阳性表达率显著高于其在APE1/Ref-1非胞核表达的鳞癌组织中的阳性表达率(P<0.05),二者呈明显的相关性(相关系数r=0.260)。推测两种基因在食管鳞癌的发生过程中相互影响,其共同作用可能与食管鳞癌的发生有关。但是两种基因间相互影响的机制及其在食管鳞癌发生中的具体作用还不清楚,值得进一步研究。
1 仲召阳,王东,李增鹏,等.骨肉瘤中APE1的表达及其与血管生成的关系.第三军医大学学报,2005,27:1045-1048.
2ZielKA,CampbellCC,WilsonGL,etal.Ref-l/Apeiscriticalforformationofthehypoxia-inducibletranscriptionalcomplexonthehypoxicresponseelementoftheratpulmonaryarteryendothelialcellVEGFgene.FasebJ,2004,18:986-988.
3 吕嘉春,何敏,廖永德,等.氧化/还原因子ref-1在肺癌组织中的细胞定位表达及与8-0H-DG的关系.肿瘤,2004,24:35-37.
4 周亚燕,杨东,李先明.APE/Ref-1和CAⅨ在头颈部肿瘤中表达的临床意义.实用医学杂志,2008,24:868-870.
5 张奎美,纪新强,徐平平.卵巢上皮性癌中APE/Ref21的表达及与VEGF和MVD的关系.肿瘤基础与临床,2009,22:11-14.
6 陆进成,钱普东,查文武.食管癌根治术后预防性放射治疗随机研究的Meta分析.循证医学,2005,5:166-171.
7YangS,IraniK,HeffronSE,etal.Alterationsintheexpressionoftheapurinic/apyrimidinicendonuclease-1/redoxfactor-1 (APE/Ref-1)inhumanmelanomaandidentificationofthetherapeuticpotentialofresveratrolasanAPE/Ref-1inhibitor.MolCancerTher,2005,4:1923-1935.
8KimJS,KimJM,LiangZL,etal.Prognosticsignificanceofhumanapurinic/apyrimidinicendonuclease(APE/Ref-1)expressioninrectalcancertreatedwithpreoperativeradiochemotherapy.IntJRadiatOncolBiolPhys,2012,82:130-137.
9ShengQ,ZhangY,WangR,etal.PrognosticsignificanceofAPE1cytoplasmiclocalizationinhumanepithelialovariancancer.MedOncol,2012,29:1265-1271.
10YooDG,SongYJ,ChoEJ,etal.AlterationofAPE1expressioninnon-smallcelllungcancer:theimplicationsofimpairedextracellularsuperoxidedismutaseandcatalaseantioxidantsystems.LungCancer,2008,60:277-284.
11KelleyMR,ChengL,FosterR,etal.ElevatedandalteredexpressionofthemultifunctionalDNAbaseexcisionrepairandredoxenzymeAPE1/Ref-1inprostatecancer.ClinCancerRes,2001,7:824-830.
12PuglisiF,BarboneF,TellG,etal.PrognosticroleofAPE/Ref-1subcellularexpressioninstageI-IIIbreastcarcinomas.OncolRep,2002,9:11-17.
13 封亮,邵福源.无嘌呤无嘧啶核酸内切酶/氧化还原因子1的研究进展.第二军医大学学报,2003,2:214-217.
14TellG,DamanteG,CaldwellD,etal.TheintracellularlocalizationofAPE1/Ref-1:morethanapassivephenomenon.AntioxidRedoxSignal,2005,7:367-369.
15ZouGM,MaitraA.Small-moleculeinhibitoroftheAPendonuclease1/REF-lE3330inhibitspancreaticcancercellgrowthandmigration.MolCancerTher,2008,7:2012-2021.
16ZouGM,KarikariC,KabeY,etal.TheApe-1/Ref-1redoxantagonistE3330inhibitsthegrowthoftumorendotheliumandendothelialprogenitorcells:therapeuticimplicationsintumorangiogenesis.JCellPhysiol,2009,219:209-218.
17 李晓斌,房定珠,桂卫星,等.食管癌组织早期生长反应基因-lmRNA表达与患者生存期关系的研究.中国综合临床,2008,24:524-526.
18AhmedMM,SellsSF,VenkatasubbaraoK,etal.Ionizingradiation-inducibleapoptosisintheabsenceofp53linkedtotranscriptionfactorEGR-1.JBiolChem,1997,272:33056-33061.
19WoroniczJD,CalnanB,NgoV,etal.RequirementfortheorphansteroidreceptorNur77inapoptosisofT-cellhybridomas.Nuture,1994,367:277-281.
20KobayashiD,YamadaM,KamagataC,etal.Overexpressionofearlygrowthresponse-1asametastasis-regulatoryfactoringastriccancer.AnticancerRes,2002,22:3963-3970.
21BaronV,DussS,RhimJ,etal.Antisensetotheearlygrowthresponse-1gene(Egr-1)inhibitsprostatetumordevelopmentinTRAMPmice.AnnNYAcadSci,2003,1002:197-216.
22WeiszL,ZalcensteinA,StambolskyP,etal.TransactivationoftheEGRlgenecontributestomutantp53gain0ffunction.CancerRes,2004,64:8318-8327.
23AggarwalBB,BhardwaiA,AggarwalRS,etal.Roleofresveratrolinpreventionandtherapyofcancer:preclinicalandclinicalstudies.AnticancerRes,2004,24:2783-2840.
24LeeSH,BahnJH,ChoiCK,etal.ESE-1/EGR-lpathwayplaysaroleintolfenamicacid-inducedapoptosisincolorectalcancercells.MolCancerTher,2008,7:3739-3750.
25 李晓斌,房定珠,张军,等.食管癌组织EGR-1基因表达及与临床病例的关系.肿瘤防治杂志,2005,12:675-678.
26EgerodFL,NielsenHS,IversenL,etal.Biomarkerforearlyeffectsofcarcinogenicdual-actingPPARagonistsinraturinarybladderurotheliuminvivo.Biomarkers,2005,10:295-309.
27GitenayD,BaronVT.IsEGR1apotentialtargetforprostatecancertherapy.FutureOncol,2009,5:993-1003.
Expression and correlation of APE1/Ref-1,EGR-1 in esophageal squamous cell carcinoma
HANLijie*,DONGZhiming,LIUWei,etal.
*DepartmentofRadiotherapy,CentralHospitalofCangzhouCity,Hebei,Cangzhou061000,China
Objective To observe the expressions of apurinic/apyrimidinic endonuclease/redox factor-1(APE1/Ref-1) and early growth response gene-1(EGR-1) in esophageal squamous cell carcinoma (ESCC) and in adjacent non-cancerous tissues,and to analyze the correlation between the expressions and clinical grading as well as clinical staging in order to provide reference basis for the researches about the pathogenesis and development of ESCC and to provide clinical indexes for prevention and treatment of ESCC.Methods Eighty-six cases of fresh specimens of ESCC and adjacent non-cancerous tissues that were collected from 2009 to 2010 were enrolled in the study.All the patients with ESCC were not treated by chemoradiotherapy before operation.The expression levels of APE1/Ref-1 and EGR-1 were detected by immunohistochemistry (SP).Results The positive expression rate of APE1/Ref-1 in ESCC tissues (cell nucleus and cytoplasm) was significantly higher than that in adjacent non-cancerous tissues (68.6% vs 8.1%,P<0.01).The positive expression rate of APE1/Ref-1 in adjacent non-cancerous tissues (cell nucleus) was significantly higher that in ESCC tissues (91.9% vs 24.4%,P<0.01).HoweverthepositiveexpressionrateofEGR-1inESCCtissueswassignificantlylowerthanthatinadjacentnon-canceroustissues(P<0.01).Conclusion The combination expression rates in cell nucleus and cytoplasm of ESCC tissues are incresaed with the decrease of histological grade and the increase of clinical stage,however, the positive expression rates of EGR-1 are decresaed with the decresae of histological grade and the increase of clinical stage of ESCC.
APE1/Ref-1;EGR-1;immunohistochemistry;esophageal squamous cell carcinoma
10.3969/j.issn.1002-7386.2017.05.008 ·论著·
061000 河北省沧州市中心医院放疗科(韩立杰、魏冬冬),肿瘤外三科(刘伟);河北医科大学第四医院肿瘤研究所(董稚明)
R 735.1
A
1002-7386(2017)05-0671-04
2016-10-10)
