多种有机胺吸收剂循环利用实验研究*
2017-03-15刘炳成武鲁航董西宝李冠林王泉敏
刘炳成,武鲁航,董西宝,李冠林,王泉敏
(1.青岛科技大学 机电工程学院,山东 青岛 266061;2.陕西鼓风机集团有限公司,陕西 西安 710000)
多年来,以CO2为代表的温室气体对地球的生态系统的稳定造成了巨大破坏,抑制温室效应势在必行[1]。化学吸收法作为燃煤电厂脱碳中最为适用的一种方法,对碳减排有巨大意义[2-3]。在烟气脱碳中采用的有机胺吸收剂主要有单乙醇胺(MEA)、二乙醇胺(DEA)、三乙醇胺(TEA)、羟乙基乙二胺(AEE)等[4]。在各种胺吸收法的CO2捕集工艺中,有机胺吸收剂全部利用高温解吸再生后循环吸收的方法[5-6]。这就要求吸收剂不仅仅关注单次的性能,同时也需要保证吸收剂在多次循环使用后有良好的性能[7]。过去的吸收剂性能测定实验很少提及多次循环之后的性能,因此对多种有机胺吸收剂循环利用进行实验研究具有重要意义[8]。
作者基于有机胺吸收法脱碳的工艺路线,搭建了CO2循环吸收、解吸的实验平台,模拟质量分数10%的MEA、DEA、TEA、AEE溶液的吸收与解吸性能。测定有机胺吸收剂在多次循环利用后的吸收速率、解吸速率和解吸能耗随时间的变化规律,以期为高效、实用的吸收剂开发和工业化推广提供理论支持。
1 反应机理
1.1 伯胺、仲胺反应机理
伯胺是指胺基上有两个氢原子的醇胺,最典型代表是MEA[9];仲胺是指胺基上有一个氢原子的醇胺,最典型代表是DEA。伯胺、仲胺与CO2的反应机理类似[10],目前公认的是两性原子机理,反应方程式如下[11]。

(1)

(2)
1.2 叔胺反应机理
叔胺(如TEA)是指胺基上没有氢原子的醇胺,不能形成两性离子,以催化剂的形式加入到CO2的水解反应中。反应方程式如下[12]。
(3)

(4)
1.3 多氮有机胺反应机理
多氮有机胺以AEE为代表,与传统醇胺相比有吸收量大、反应迅速等优势。AEE与CO2反应的方程式如下[13]。

(5)
2 实验装置与操作方法
2.1 吸收、解吸装置与操作方法
CO2吸收装置见图1,CO2与N2从钢瓶中放出,由质量流量控制器保证混合后CO2与N2的体积比满足电厂烟气脱硫处理后的比例(17∶3)。经过气体玻璃瓶的混合之后进入反应釜与溶液中的有机胺进行吸收反应,恒速搅拌桨保证气液均匀接触,水银温度计测量吸收反应的温度。恒温循环加热炉内有循环导热油,提供油浴加热,确保反应温度恒定在35 ℃。气液接触后的剩余气体从反应釜上部排出,进入饱和Ca(OH)2溶液中吸收未反应的CO2后排放至空气中。

图1 CO2吸收装置
CO2解吸装置见图2。
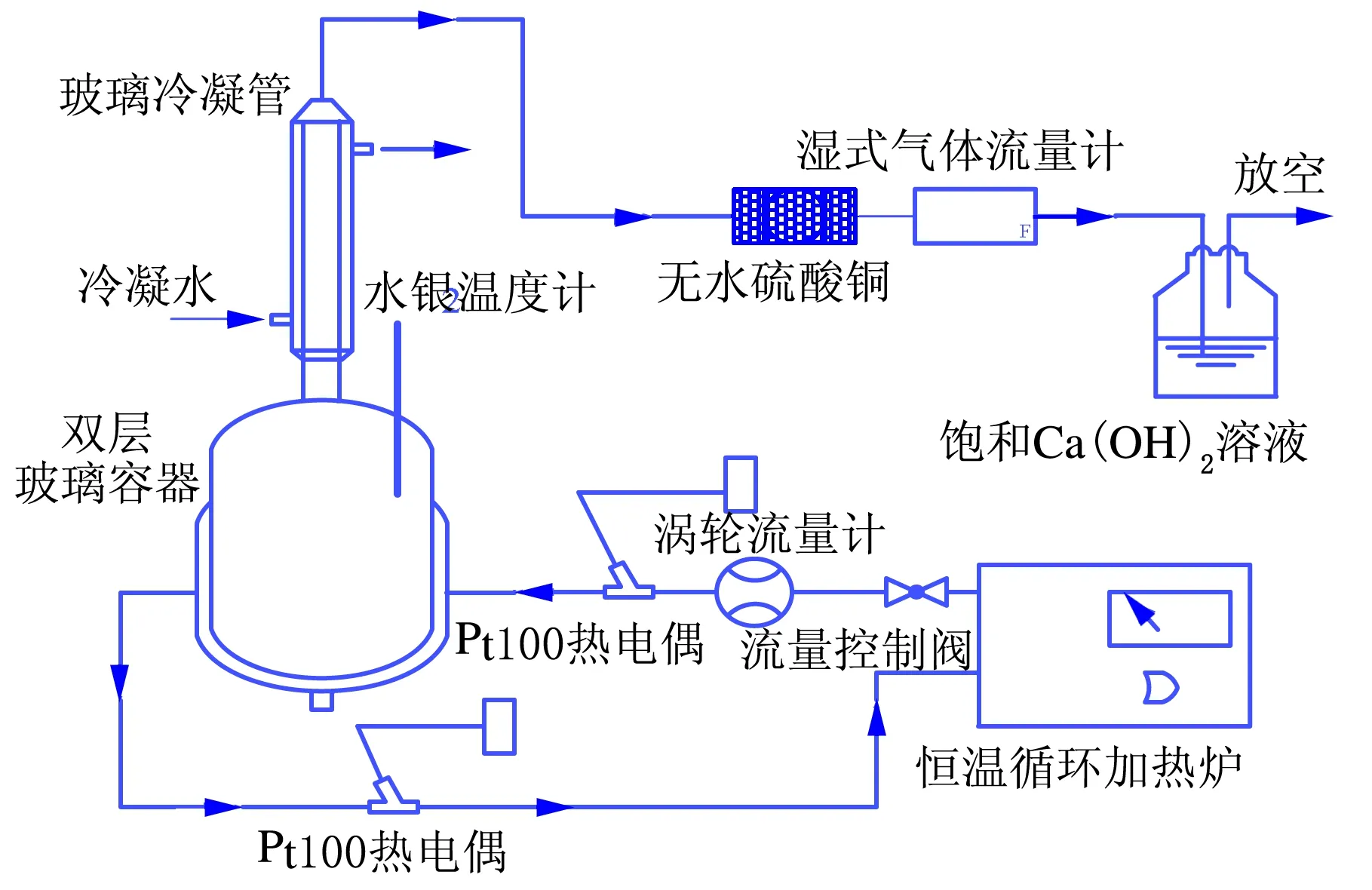
图2 CO2解吸装置
在检查解吸装置的气密性之后,利用恒温循环加热炉对双层玻璃容器进行加热,保证解吸温度稳定在120 ℃并维持约0.5 h,向玻璃容器中加入吸收了CO2的有机胺溶液,并开始解吸反应。有机胺溶液会在高温下重新释放CO2,待湿式气体流量计示数不发生变化时,表示CO2已经完全析出,解吸实验结束。通过热电偶测定循环导热油的温度,涡轮流量计测定循环导热油的流量,进而计算出所需的解吸能耗。
2.2 循环吸收、解吸的操作方法
在经过一次解吸实验之后的有机胺吸收剂,回收并降温至35℃,重新加入到双层玻璃反应釜中进行吸收实验。按照实验的相关步骤重复吸收与解吸实验。在第二次解吸实验结束后的有机胺溶液,重新作为第三次反应的吸收剂。测量每次吸收与解吸反应的实验数据,并进行分析对比。
3 有机胺循环吸收速率的变化规律
3.1 MEA循环吸收速率的变化规律
w(MEA)=10%进行三次循环吸收实验的吸收速率随时间的变化情况见图3。三条曲线规律一致、几乎重叠,表明MEA溶液在数次循环吸收解吸之后仍保持高度的稳定性,证明了MEA适合工业上的大规模使用,且降低了CO2捕集的长时间运行成本。

t/min图3 MEA循环吸收速率随时间的变化
3.2 DEA循环吸收速率的变化规律
w(DEA)=10%循环吸收速率随时间的变化见图4。
如图4所示,DEA三次循环实验的速率变化情况基本吻合。在前20 min内第二次和第三次的吸收速率与第一次相比有所提升,说明DEA溶液在进行了一次吸收解吸之后有新的化学物质产生,并且促进了吸收反应的进行。DEA溶液第一次循环达到饱和的时间在130 min之后,第二次、第三次达到饱和的时间依次有明显缩短,一部分原因是循环过程中有溶液损耗,另一部分也证明了新物质的生成对CO2吸收的促进作用。

t/min图4 DEA循环吸收速率随时间的变化
3.3 TEA循环吸收速率的变化规律
w(TEA)=10%循环吸收速率随时间的变化见图5。

t/min图5 TEA循环吸收速率随时间的变化
观察图5可以发现,TEA的平均吸收速率不及MEA、DEA的一半,而且TEA在吸收反应开始之后速率大幅度下降,之后速率下降较为平稳。由于TEA较低的吸收速率,导致TEA溶液达到饱和的时间在200 min以后,因此并不适合单独作为吸收剂进行CO2的捕集。但是可以尝试加入其它催化剂促进TEA的吸收速率。
3.4 AEE循环吸收速率的变化规律
w(AEE)=10%循环吸收速率随时间的变化见图6。
在图6中,AEE三次循环吸收速率随时间的变化情况主要以约20 min为节点。在20 min之后三次循环的吸收速率几乎一致,影响吸收速率的因素仅为溶液的CO2含量;而在20 min之前,三次循环的吸收速率随着循环次数的增加而降低明显。但是,AEE具有吸收速率快的特点,即使多次循环后速率降低明显,仍比MEA溶液的吸收速率高。
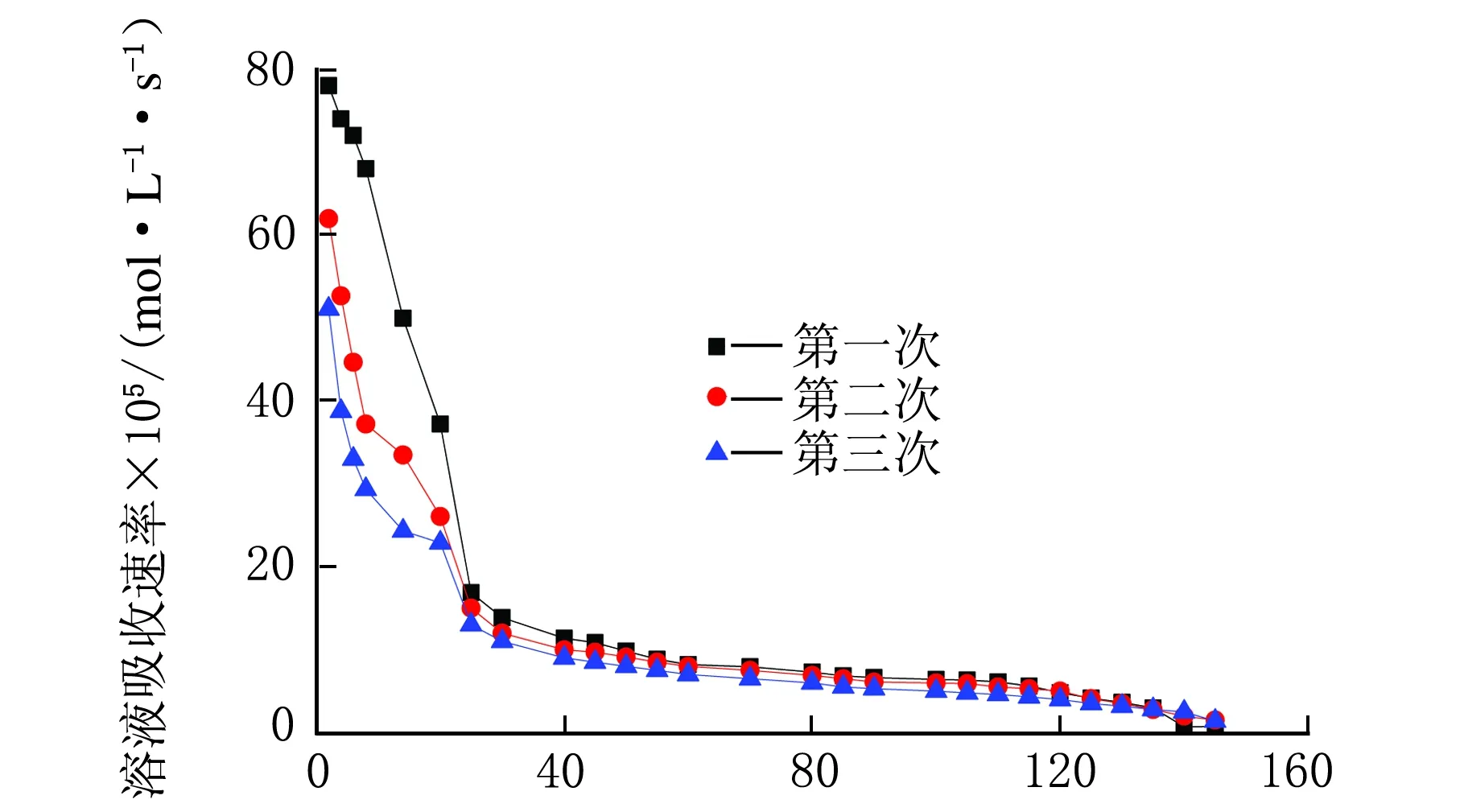
t/min图6 AEE循环吸收速率随时间的变化
4 有机胺循环解吸速率的变化规律
4.1 MEA循环解吸速率的变化规律
w(MEA)=10%循环解吸速率随时间的变化见图7。

t/min图7 MEA循环解吸速率随时间的变化
如图7所示,三条曲线基本重叠,表明MEA溶液在解吸时具有极其稳定的特性。但是从具体的解吸速率来看,三条曲线先是迅速升高,在50 min达到峰值,之后断崖式下降,表明MEA维持在最高解吸速率的时间极短,不利于工业上优化捕集操作条件,操作空间不大。
4.2 DEA循环解吸速率的变化规律
w(DEA)=10%循环解吸速率与随时间的变化见图8。
如图8所示,DEA的三次循环解吸速率变化规律一致,都呈现倒“V”字型,但是三次循环的速率变化明显。随着循环次数的增加,解吸速率在每个时间点都相应的提高,这说明DEA富液中的氨基甲酸盐在高温下发生了化学变化,生成了新的物质促进了解吸速率的提高。

t/min图8 DEA循环解吸速率随时间的变化
4.3 TEA循环解吸速率的变化规律
w(TEA)=10%循环解吸速率随时间的变化见图9。

t/min图9 TEA循环解吸速率随时间的变化
图9显示TEA循环解吸速率随时间的变化规律。TEA的解吸速率随时间大致呈“A”字型,三次循环的曲线变化规律有较大变化。三次循环到达峰值的时间点各不相同,但随着循环次数的增加,TEA的总体解吸速率在提高,特别是在25 min之后解吸速率提高的十分明显。但是与MEA类似,TEA的解吸速率维持在峰值的时间也极短,在工业上调节范围较为苛刻。
4.4 AEE循环解吸速率的变化规律
w(AEE)=10%循环解吸速率的变化规律见图10。
图10显示AEE具有极高的解吸速率,在25 min达到峰值时是前三种醇胺的2~4倍。这是因为MEA、DEA、TEA属于醇胺,分子结构中只有一个胺基,而AEE属于多氮有机胺,分子结构中含有两个氮原子,与CO2结合形成氨基甲酸盐后更容易分解,因此有更高的解吸速率。在反应的前125 min内,AEE溶液随着循环次数的增加,解吸速率有较大的提高,在125 min之后变化情况基本一致。
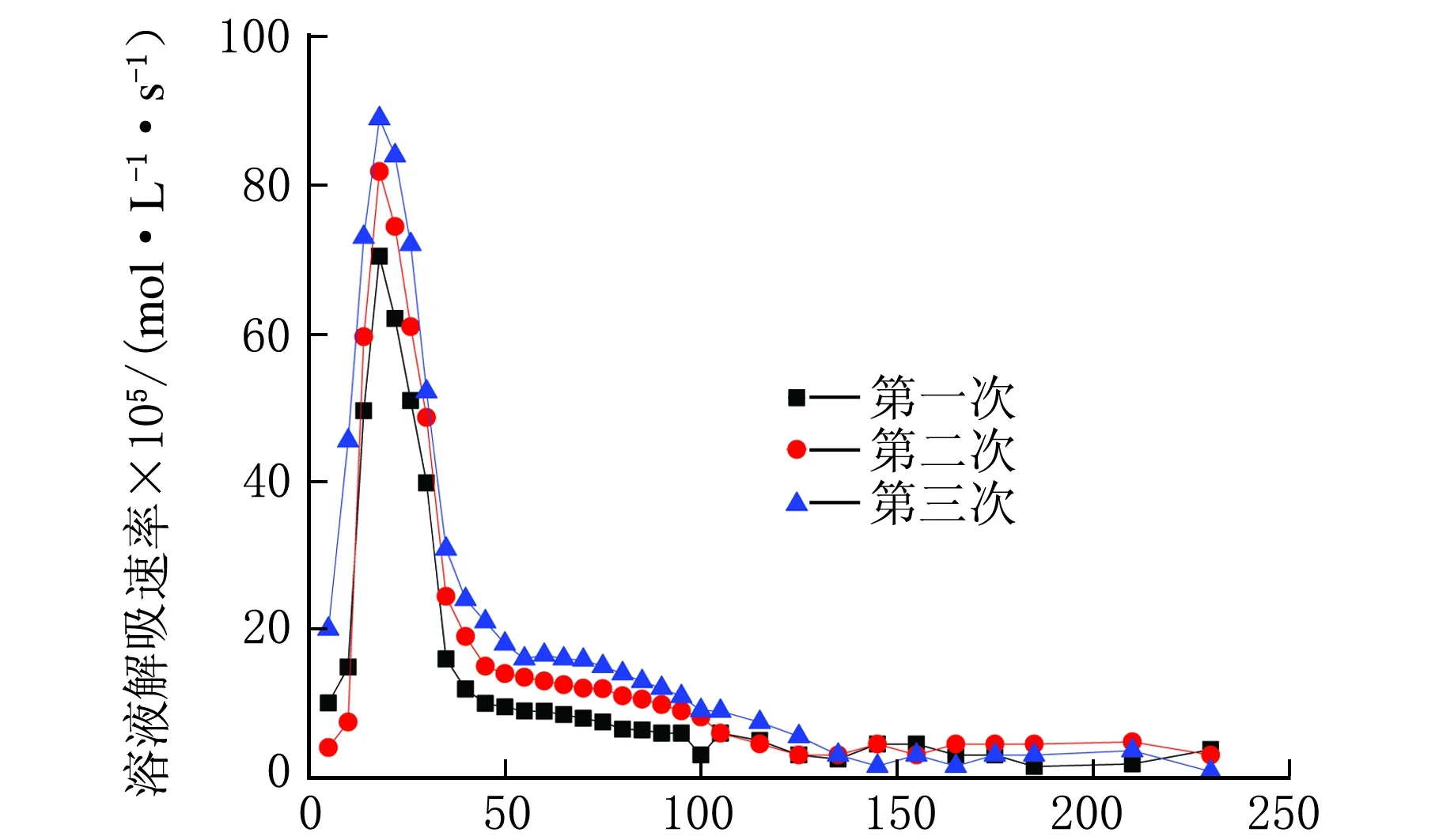
t/min图10 AEE循环解吸速率随时间的变化
5 有机胺循环解吸能耗的变化规律
5.1 MEA循环解吸能耗的变化规律
w(MEA)=10%循环解吸能耗随时间的变化见图11。
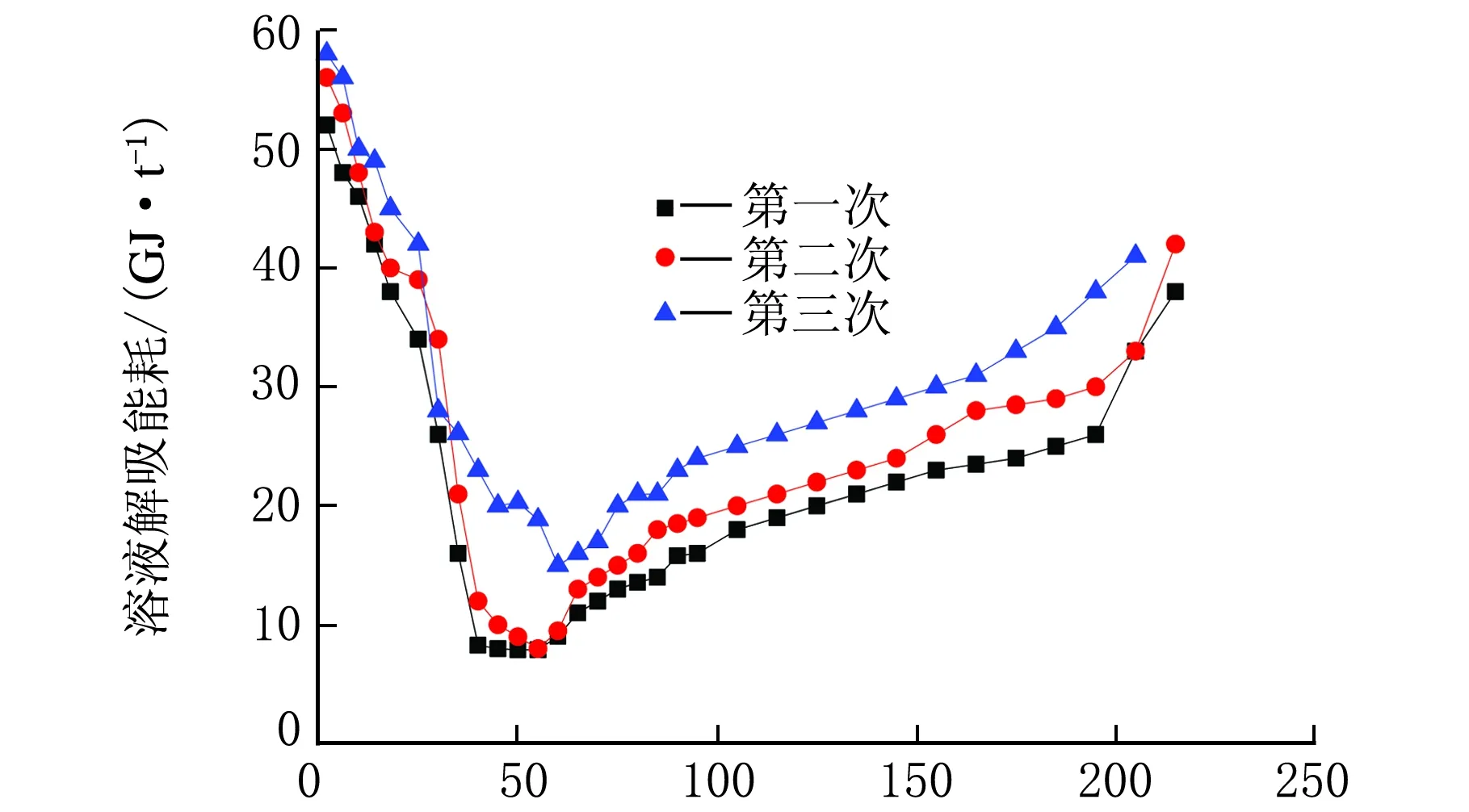
t/min图11 MEA循环解吸能耗随时间的变化
从图11可以得知,MEA解吸能耗随时间的变化趋势大致呈“U”字型,且三次循环的规律类似。
解吸开始时需要的能耗较高,之后逐渐降低,50 min之后能耗又升高。这是因为在解吸实验开始时,循环导热油的大部分热量用于加热溶液,小部分用于解吸CO2,因此单位解吸能耗较高;随着溶液温度升高,绝大部分能耗用于CO2的解吸,单位解吸能耗因此下降;在50 min之后,CO2含量下降,解吸动力降低,单位解吸能耗又有所提高。
5.2 DEA循环解吸能耗的变化规律
w(DEA)=10%循环解吸能耗随时间的变化见图12。
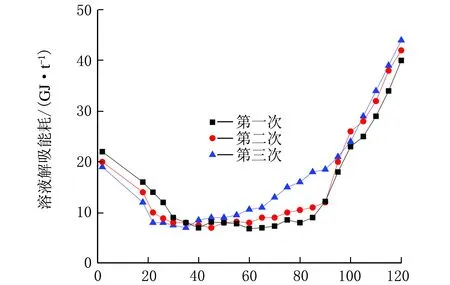
t/min图12 DEA循环解吸能耗随时间的变化
从图12可以看出,DEA解吸所需能耗较低。DEA溶液维持在较低解吸能耗的时间段较长,在40~90 min内随着循环次数的增加解吸能耗略有提高。在工业实际生产中,采用DEA溶液更容易控制时间,使之维持在一个较低的能耗上,但也要避免解吸时间过长导致的能耗大幅升高。
5.3 TEA循环解吸能耗的变化规律
w(TEA)=10%循环解吸能耗随时间的变化见图13。

t/min图13 TEA循环解吸能耗随时间的变化
从图13可以看出,三条曲线变化大致类似,在20~40 min能耗基本相同,都在约55 min达到最低能耗,在此之后能耗迅速上升。
5.4 AEE循环解吸能耗的变化规律
w(AEE)=10%循环解吸能耗随时间的变化见图14。

t/min图14 AEE循环解吸能耗随时间的变化
如图14所示,AEE在解吸能耗方面有极强的稳定性,对比之前三种醇胺吸收剂,AEE多次循环的解吸能耗变化最小。在25~75 min内,AEE始终维持较低的解吸能耗。控制解吸时间,使AEE在低解吸能耗下反应,在工业上有重大意义。
6 结 论
MEA有较好的吸收速率,但解吸速率不易控制,解吸能耗随着循环次数增加有所提高;DEA多次循环的解吸速率变化较大,但维持低解吸能耗时间较长;TEA吸收速率很低,而且多次循环的解吸速率不稳定,不适合单独作为吸收剂,可以尝试复合胺的复配;AEE吸收速率较高,解吸能耗较低且多次循环能耗变化极小,可以作为溶液的活性添加剂,在工业上有巨大潜力。
[1] 费维扬,艾宁,陈健.温室气体CO2的捕集和分离技术面临的挑战与机遇[J].化工进展,2005,24(1):1-4.
[2] RHO S W,YOO K P,LEE J S,et al.Solubility of CO2in aqueous methyldiethanolamine solutions [J].J Chem Eng Data,1997,42:1161-1164.
[3] 叶宁,毕亚军.烟道气回收CO2的工业应用[J].化学工程师,2005,121(10):23-32.
[4] 王洪波.有机胺法吸收CO2的研究[D].上海:上海师范大学,2012.
[5] 王晓宇.燃煤电厂烟道气中CO2捕集技术进展与对比分析[J].油气田地面工程,2013,32(10):7-8.
[6] 冯国琳.CO2气体分离技术研究进展[J].氮肥技术,2011,32(5):35-39.
[7] SINGH P,NIEDERER J P M,VERSTEEG G F.Structure and activity relationships for amine based CO2absorbents [J].Int J Greenhouse Gas Control,2007,1(1):5-10.
[8] 张艳.三元复合胺体系捕集烟气中CO2实验研究[D].青岛:中国石油大学(华东),2012.
[9] 张治山.燃煤电厂烟气CO2化学吸收模拟与分析[D].青岛:山东科技大学,2011.
[10] 周响球.燃煤电厂烟气CO2捕获系统的仿真研究[D].重庆:重庆大学,2008.
[11] 盖群英,张永春.有机醇胺溶液吸收CO2的研究[J].现代化工,2007,395(27):395-397.
[12] 李伟斌,董立户,陈建.仲胺和叔胺水溶液吸收CO2的动力学[J].过程工程学报,2011,11(03):422-428.
[13] TONTLWACHWUTHLKUL P,MELSEN A,LLM C J.Solubility of CO2in 2-amino-2-methyl-1-propanol solutions [J].Chem Eng Data,1991,36(1):130-133.
