芫荽对生物大分子氧化损伤的保护作用及自由基清除能力
2017-03-14韩潆仪王丹丹万慧洁岳锦萍
韩潆仪, 任 虹, 王丹丹, 万慧洁, 岳锦萍
(北京工商大学 食品学院/北京市食品风味化学重点实验室/食品添加剂与配料北京高校工程研究中心, 北京 100048)

芫荽对生物大分子氧化损伤的保护作用及自由基清除能力
韩潆仪, 任 虹*, 王丹丹, 万慧洁, 岳锦萍
(北京工商大学 食品学院/北京市食品风味化学重点实验室/食品添加剂与配料北京高校工程研究中心, 北京 100048)
研究芫荽对生物大分子氧化损伤的保护作用及自由基清除能力,采用福林酚法检测芫荽的多酚含量,利用2,2′-偶氮二异丁基脒二盐酸盐(2,2′-azobis-2-methyl-propanimidamide,AAPH)作为体外氧化诱导剂,采用凝胶电泳检测芫荽对DNA和蛋白质的氧化损伤保护,用1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)法检测芫荽自由基清除率,用氧化自由基吸收能力(oxygen radical absorbance capacity,ORAC)分析检测芫荽的抗氧化能力值。结果表明,芫荽里的多酚类物质质量分数为4.054 μg/mg;芫荽对DNA氧化损伤的最低保护质量浓度为4.0 μg/mL,对牛血清蛋白的损伤保护质量浓度为125.0 μg/mL;芫荽提取物对DPPH·的IC50值为0.17 μg/μL,芫荽提取物的ORAC值为485.3。综上所述,芫荽提取物具有较好的抗氧化活性。
芫荽; DNA; 蛋白质; 损伤保护; 抗氧化; 多酚
DNA储存了机体内遗传物质的所有信息,而蛋白质是所有遗传物质表达后的产物,是生命的物质基础,是生命活动的主要承担者。因此,保证DNA和蛋白质的相对完整对人体健康有着至关重要的作用[1-2]。机体内正常有氧代谢产生的自由基,也称活性氧或游离基,如超氧化自由基、过氧化氢自由基、羟基自由基等,种类繁多,这些自由基会进攻DNA、蛋白质等生物大分子,损伤其结构,造成细胞损伤或突变,激活癌基因或者使抗癌基因失活,从而导致细胞失去控制,引发癌症、心血管疾病、白内障免疫系统疾病、类风湿关节炎和脑功能紊乱等疾病[3-4]。
抗氧化剂是一类能帮助捕获并中和自由基,从而减少自由基对人体损害的一类物质。抗氧化剂按来源可分为人工合成抗氧化剂(如二丁基羟基甲苯(butylated hydroxytoluene,BHT)、丁基羟基茴香醚(butyl hydroxy anisd,BHA)、没食子酸丙酯(propyl gallate,PG)等)和天然抗氧化剂(如茶多酚、植酸等)。天然抗氧化剂主要是来源于动植物或微生物的具有抗氧化活性的物质,如维生素C、多酚、活性硒等。研究表明,蔬菜中的天然抗氧化剂种类丰富,能帮助人体预防心脏病和癌症等多种疾病,并能增进脑力、延缓衰老,抗氧化效果好[5]。因此,近几年人们更趋于使用天然抗氧化剂来避免人工合成抗氧化剂有可能带来的一系列毒副作用[6]。目前,寻找活性高、毒副作用低的天然抗氧化剂,尤其是寻找阻止生物大分子DNA或蛋白质氧化损伤的天然抗氧化剂成为国内外学者研究的热点。
近几十年,香辛食品调料的抗氧化活性得到广泛关注和研究。芫荽(CoriadrumsativumL.),又称香菜,是一种具有较高利用价值的食品和药用资源,风味独特、营养丰富、保健功能强,含有多种对人体有益的活性物质,具有抗菌、抗肿瘤、抗氧化等保健功能[7]。这些特点使芫荽得到广泛关注,其中芫荽的抗氧化功能更是国内外研究者们争相研究的热点。戴国彪等[8]研究证实,芫荽籽精油具有较强的清除·OH、还原Fe3+的能力,其总抗氧化效果与同浓度下常见的人工抗氧化剂BHT、PG及维生素C接近。陆占国等[9]研究表明,芫荽茎叶芳香精油不仅具有明显的NaNO2清除作用,还具有捕捉DPPH自由基的能力。Tang等[10]对芫荽根茎叶籽各部分的抗氧化作用进行了详细的研究,证实了芫荽根部的抗氧化性要弱于其他部位,同时各部位还具有DNA损伤保护的作用。目前,芫荽的抗氧化研究大多注重其清除自由基活性的能力[3,11-12],而芫荽对生物大分子诸如蛋白质、DNA氧化损伤的保护活性研究刚刚起步。实验以芫荽为原料,用体积分数为70%的乙醇提取其有效成分,探索芫荽提取物对DNA、蛋白等生物大分子的抗氧化活性及其对自由基的清除能力,为进一步开发和研究其价值提供新的参考。
1 材料与方法
1.1 实验材料
牛血清蛋白(bovine serum albumin,BSA)购于Sigma-Alorich;pBR322质粒,购于赛默飞世尔科技有限公司。
1.2 芫荽提取方法
称取新鲜饱满的市售芫荽150 g,洗净,用研钵碾碎,浸泡于350 mL体积分数70%乙醇中。浸泡1 h后抽滤,连续萃取3次,合并上清液,浓缩,置于-20 ℃条件下冷冻干燥,得到体积分数70%乙醇提取物。
1.3 多酚含量的测定
多酚含量采用福林酚法测定[13]。
标准曲线绘制:用移液枪精确吸取0,0.05,0.10,0.15,0.20,0.25,0.30,0.35,0.40,0.45,0.50 mL没食子酸标准溶液(100 μg/mL)于洁净离心管中,蒸馏水定容至800 μL,分别加入用蒸馏水稀释1倍的150 μL福林酚试剂。避光反应10 min后,加入600 μL质量分数10% Na2CO3到上述混合物里,蒸馏水稀释至5 mL,此混合物在避光条件下25 ℃ 反应60 min,750 nm波长处测定其吸光度。以吸光度为纵坐标,没食子酸质量浓度为横坐标,绘制福林酚法标准曲线。
样品多酚含量测定:在上述实验步骤中,将800 μL没食子酸的溶液替换成800 μL质量浓度为1 mg/mL的芫荽提取物。根据没食子酸的浓度与吸光度之间的线性关系计算多酚含量。
1.4 芫荽对 DNA 损伤保护活性的测定
参考Harsha等[3]的研究方法,将质粒pBR322用2,2′-偶氮二异丁基脒二盐酸盐(AAPH)氧化处理,然后进行凝胶电泳观察。
AAPH最适损伤浓度的确定:AAPH溶解于PBS磷酸缓冲液。100 ng pBR322与不同浓度的AAPH溶液混合,使得AAPH的终浓度分别为5.0, 10.0,20.0,40.0,80.0 mmol/L。混合后于37 ℃反应1 h。Loading buffer处理后,上样于质量浓度为0.01 g/mL的琼脂糖凝胶电泳板中,于电压180 V电泳35 min。 溴化乙锭染色后即可于凝胶成像分析系统GAS 7001B观察,得出AAPH对pBR322最适损伤浓度。
芫荽提取物对DNA损伤保护活性的测定:最适AAPH损伤浓度处理DNA,加入不同浓度的芫荽提取物,同时用已知的抗氧化剂没食子酸作为阳性对照。37 ℃反应60 min。反应完成后,将样品上样于0.01 g/mL凝胶板上,180 V电压下电泳约35 min,即可观察结果。未被处理的pBR322质粒作为阴性对照。
1.5 芫荽提取物对蛋白质损伤保护活性的测定
采用聚丙烯酰胺凝胶电泳SDS-PAGE检测不同抗氧化剂对蛋白氧化损伤的抑制作用。
AAPH最适损伤浓度的确定:1 mg BSA分别与不同浓度AAPH溶液(溶于PBS)于37 ℃反应24 h,采用SDS-PAGE电泳检测蛋白质氧化损伤情况。
芫荽提取物对蛋白质损伤保护浓度的测定:不同浓度的芫荽提取物加入到有AAPH存在的BSA溶液中,37 ℃孵育24 h,即可上样观察,检测芫荽对其氧化降解的抑制作用。
1.6 芫荽提取物对DPPH·清除能力的测定
DPPH法常用于抗氧化成分的体外抗氧化性评价[14]。1.0 mg/mL芫荽溶液加入到2 mL DPPH溶液中,直到DPPH的紫色完全褪去后,用甲醇定容至3 mL。将此混合物充分混合,室温反应30 min,测定其517 nm处的吸光度值,记录此时的吸光度值为A1, 同时空白对照的吸光度值记录为A0,芫荽提取物对DPPH·清除率IR按式(1)计算:
IR=[(A0-A1)/A0]×100%。
(1)
当50%DPPH·被清除时的芫荽提取物浓度定义为IC50。此测量进行3次,取其平均值。
1.7 ORAC法测芫荽抗氧化活性
氧化自由基吸收能力又称为抗氧化能力。用抗氧化能力作为定量依据,通过体外实验测定芫荽的抗氧化能力。ORAC分析方法的原理是自由基破坏荧光探针,使荧光强度产生变化。Trolox(6-羟基-2,5,7,8-四甲基色烷-2-羧酸,6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid),水溶性维生素E,一种细胞通透的水溶性Ve类似物,具有抗氧化的性质。以 Trolox为定量标准,使用荧光微孔板分析仪进行分析[15],荧光强度的变化大小反映自由基破坏的程度。在抗氧化剂存在时,它可以抑制由自由基引起的荧光变化,抑制程度反映了它对自由基的抗氧化能力[16]。
在现有的方法上稍加改进,用0.1 mmol/L荧光素钠(溶解于PBS)、 100 mmol/L AAPH (溶解于PBS)和抗氧化剂Trolox。20 μL不同浓度(8,6,4,2,0 μmol/L)的Trolox加入到96孔板里。有Trolox溶液的96孔板里分别加入20 μL PBS和20 μL荧光素钠。37 ℃混合反应5 min,加入140 μL AAPH诱发自由基产生反应,使用荧光酶标仪每隔2 min测量358 nm处的荧光强度。作为空白对照,用20 μL甲醇来代替Trolox溶液,得到反应时间与荧光强度的关系,如图1,用ORAC值来表示抗氧化能力,ORAC值即曲线下阴影部分的面积。1ORAC表示1.0 μmol/L Trolox所提供的抗氧化保护能力。芫荽提取物的抗氧化能力可以用公式(2)计算:
ORAC值=AUCTrolox-AUCblank。
(2)
由于ORAC值和Trolox浓度存在明显的线性关系,所以基于Trolox标准曲线即可计算出芫荽提取物的ORAC值。
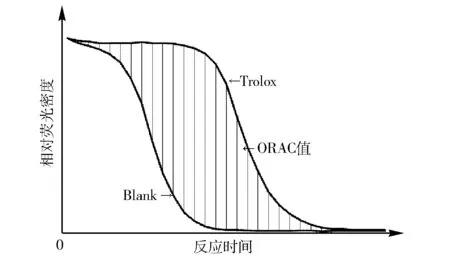
图1 ORAC值的计算Fig.1 Calculation of ORAC values
2 结果与分析
2.1 芫荽提取物中多酚含量分析
多酚类物质富含酚羟基,具有强的自由基清除能力[17]。标准物没食子酸浓度与吸光值之间线性关系见图2,根据标准曲线检测出芫荽提取物中多酚质量分数为4.054 μg/mg。
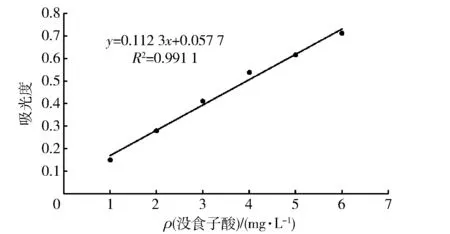
图2 没食子酸标准曲线Fig.2 Stand curve of gallic acid
2.2 芫荽提取物对DNA氧化损伤保护活性的分析
AAPH是一种叠氮化合物, 是公认的自由基诱导剂。在37 ℃,pH 值7.0条件下,AAPH会分解产生氮气和碳自由基,而碳自由基可以与氧气发生反应生成ROS[18]。对于正常的pBR322,在凝胶电泳图谱中,超螺旋DNA是优势条带,但经过AAPH处理的DNA,超螺旋被破坏,DNA分子被氧化断裂,生成线性或开环DNA。与没有经过AAPH处理的DNA相比,AAPH处理后超螺旋DNA明显减少(如图3),当浓度为20 mmol/L时,正常状态下应有的超螺旋DNA条带刚好消失不见,当AAPH浓度大于20 mmol/L,所有形式的DNA都会被降解。说明AAPH对DNA氧化损伤的最佳浓度为20 mmol/L。
随着芫荽提取物浓度的增加,超螺旋DNA随之增多,同时,开环DNA和线性DNA随之减少(如图4)。该结果充分说明了芫荽提取物对DNA氧化损伤具有保护修复作用,此结果与Guerra等[19]的定性研究结果相符。实验发现,在质量浓度2.0 ~8.0 μg/mL,芫荽提取物对DNA氧化损伤保护作用具有
浓度依赖性。当芫荽提取物质量浓度达到4.0 μg/mL时, 刚好保护超螺旋DNA不被氧化,揭示芫荽的最小保护质量浓度是4.0 μg/mL,该结果为芫荽对DNA分子的损伤保护能力提供了定性和定量依据。
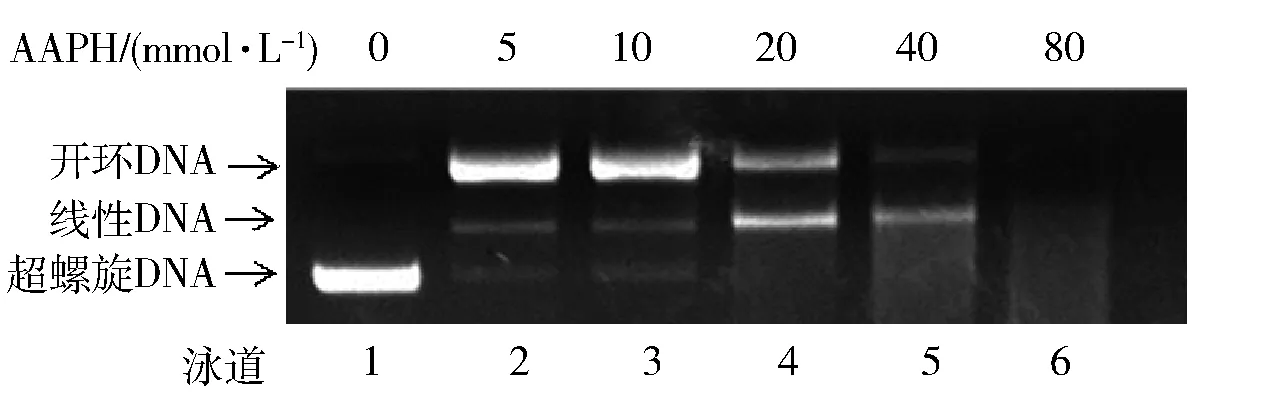
泳道1(control)-DNA; 泳道2-DNA+5 mmol/L AAPH; 泳道3-DNA+10 mmol/L AAPH; 泳道4-DNA+20 mmol/L AAPH; 泳道5-DNA+40 mmol/L DNA; 泳道6-DNA+80 mmol/L AAPH

泳道1(control)-DNA; 泳道2-DNA+20 mmol/L AAPH; 泳道3-DNA+20 mmol/L AAPH+2.0 μg/mL 芫荽; 泳道4-DNA+20 mmol/L AAPH+4.0 μg/mL 芫荽; 泳道5-DNA+20 mmol/L AAPH+6.0 μg/mL 芫荽; 泳道6-DNA+20 mmol/L AAPH+8.0 μg/mL 芫荽; 泳道7-DNA+20 mmol/L AAPH+0.02 μg/μL没食子酸
2.3 芫荽提取物对蛋白质损伤保护活性的分析
AAPH可使BSA发生氧化损伤,用不同浓度的AAPH处理BSA,随着AAPH浓度的提升,蛋白质的条带密度逐渐降低,意味着蛋白质的降解越来越严重。当AAPH浓度上升至40 mmol/L时,蛋白质电泳条带就几乎消失,说明蛋白质刚好被完全降解,如图5,继续升高AAPH浓度,达到80 mmol/L时,蛋白质全部被氧化降解,蛋白条带消失不见。因此,40 mmol/L为AAPH最适损伤浓度。
AAPH浓度为40 mmol/L时,随着芫荽浓度的提高,蛋白电泳条带密度逐渐增多,说明芫荽提取物对蛋白质损伤氧化具有保护作用,并且具有浓度依赖性(见图6)。当芫荽的质量浓度提升至125.00 μg/mL,蛋白表达的条带开始出现从无到有的变化,说明芫荽提取物的最小保护质量浓度为125.00 μg/mL。

泳道1(control)-5 μg BSA; 通道2-5 μg BSA+2.5 mmol/L AAPH; 泳道3-5 μg BSA+5 mmol/L AAPH; 泳道4-5 μg BSA+10 mmol/L AAPH; 泳道5-5 μg BSA+20 mmol/L AAPH; 泳道6-5 μg BSA+40 mmol/L AAPH; 泳道7-5 μg BSA+80 mmol/L AAPH

泳道1(control)-5 μg BSA; 泳道2-5 μg BSA+40 mmol/L AAPH; 泳道3-5 μg BSA+40 mmol/L AAPH+31.25 μg/mL芫荽; 泳道4-5 μg BSA+40 mmol/L AAPH+62.50 μg/mL芫荽; 泳道5-5 μg BSA+40 mmol/L AAPH+125.00 μg/mL芫荽; 泳道6-5 μg BSA+40 mmol/L AAPH+250.00 μg/mL芫荽; 泳道7-5 μg BSA+40 mmol/L AAPH+500.00 μg/mL芫荽; 泳道8-5 μg BSA+40 mmol/L AAPH+1 000.00 μg/mL 芫荽
2.4 芫荽提取物对DPPH·清除能力的分析
DPPH方法被广泛用于自由基清除能力的快速检测。3次平行实验的实验数据平均值和标准差(SD)显示于表1中,图7中的数据点均是表1中的平均值。从图7中可以看到芫荽提取物质量浓度从0.07 μg/μL到0.33 μg/μL,清除能力逐渐提高。芫荽提取物具有中等强度的DPPH自由基清除能力,其IC50值为0.17 μg/μL。此研究与相关文献报道一致,进一步证实了芫荽提取物的自由基清除能力[3,20]。

表1 芫荽提取物对DPPH·的清除率
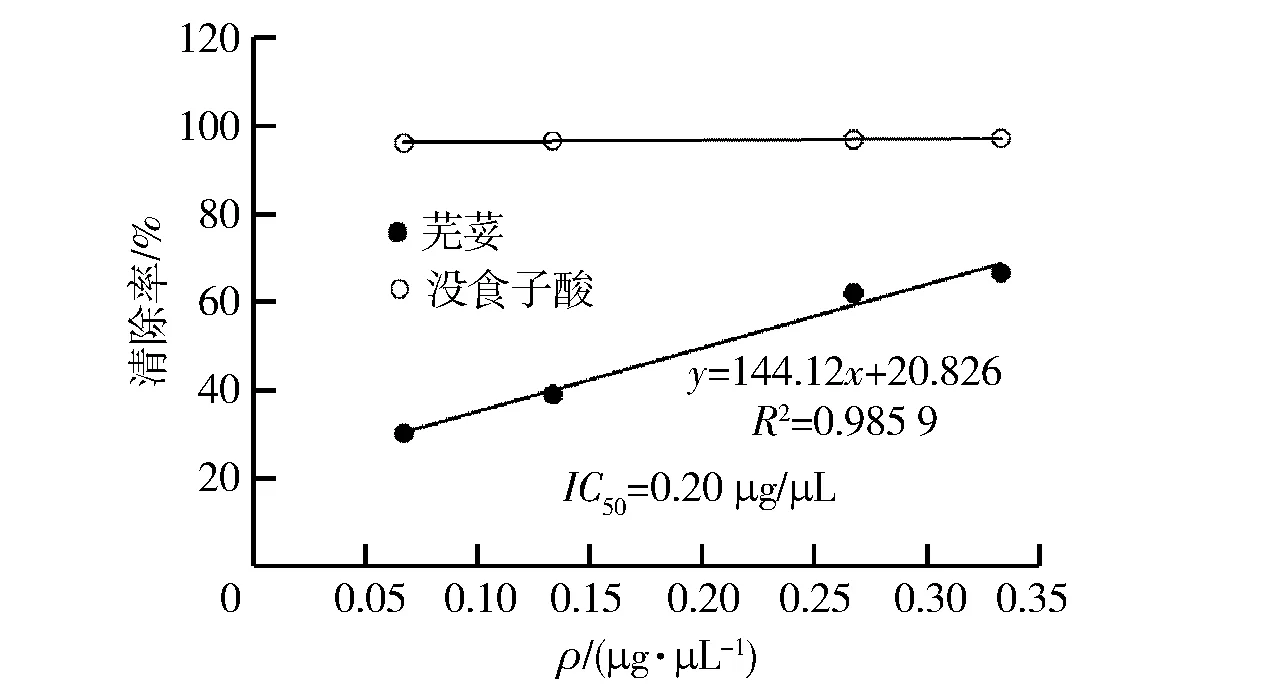
图7 样品浓度与DPPH·清除率之间的关系Fig.7 Correlation between concentration of samples and DPPH· scavenging activity
2.5 ORAC法测芫荽抗氧化能力的分析
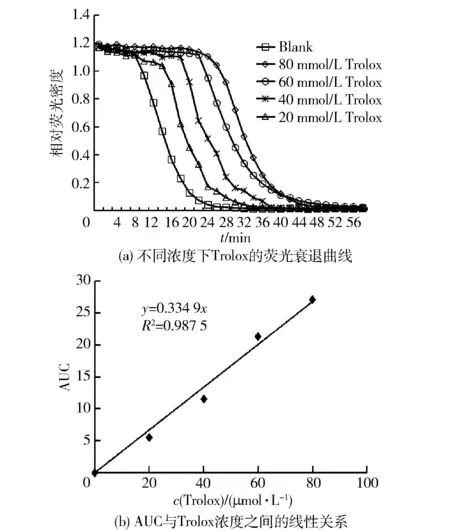
图8 芫荽抗氧化能力图示Fig.8 Antioxidative capacity of coriander
以Trolox为定量标准,荧光强度变化的大小反映自由基破坏的程度[12]。在抗氧化剂存在时,可以抑制由自由基引起的荧光变化,抑制程度反映了它对自由基的抗氧化能力[21]。实验中,AAPH扮演过氧化氢自由基的引发剂,Trolox作为阳性对照。随着Trolox浓度变化,荧光衰退变化的曲线如图8(a)。ORAC值与Trolox浓度之间的线性关系,通过ORAC值的检测对芫荽的抗氧化能力进行了量化,见图8(b)。1ORAC相当于1 mL 1 μmol/L Trolox所产生的抗氧化保护能力,芫荽的ORAC值是485.3。芫荽的ORAC值说明芫荽具有较强抗氧化能力。
3 结 论
近几年来,辛香调料的抗氧化活性已被人们重视[22-23]。实验结果显示,芫荽提取物对生物大分子DNA和蛋白质的氧化损伤均具有保护活性,且呈浓度依赖性,对DNA损伤的最小保护质量浓度为4.0 μg/mL,对BSA的最小保护质量浓度为125.00 μg/mL。同时,检测了芫荽提取物对DPPH自由基的清除能力,其IC50值为0.17 μg/μL。ORAC方法也进一步有效证明了芫荽的抗氧化活性,其ORAC值是485.3,本实验为芫荽的抗氧化活性提供了定性和定量的证据。研究芫荽提取物对生物大分子DNA、蛋白质的氧化损伤保护活性及自由基清除活性,为进一步开发其功能性食品提供了科学依据。目前的研究拓宽了抗氧化活性评价的方法,也为今后研制更多天然、无毒害的抗氧化功能性食品提供了思路。
[1] GORLACH A, DIMOOVA E Y, PETRY A, et al. Reactive oxygen species, nutrition, hypoxia and diseases pro-blems solved [J].Redox Biology, 2015(6):372-385.
[2] FAIZAL P, SATHEESHAN B, ADARSH A K, et al. Antioxidant status and oxidative stress in the circulation of younger and elderly human subjects [J].Indian Journal of Clinical Biochemistry, 2013, 28(4): 426-428.
[3] HARSHA S N, ANILAKUMAR K R.Invitrofree radical scavenging and DNA damage protective property ofCoriandrumsativumL. leaves extract [J]. Journal of Food Science and Technology, 2012, 51:1533-1539.
[4] BARAIBAR M A, AHMED E K, FRIGUET B, et al.Protein oxidative damage at the crossroads of cellular senescence, aging, and age-related diseases[J]. Oxidative Medicine and Cellular Longevity, 2012(3): 832-919.
[5] 杜珍, 王崇峰, 李永华, 等. 维生素E、维生素C、β-胡萝卜素与衰老及其相关疾病的研究进展[J]. 济宁医学院学报,2004,27(1):73-75. DU Z,WANG C F,LI Y H,et al.Progress in aging and related diseases concerning with vitamin E,vitamin C and β-carotene[J]. Journal of Jining Medical College,2004,27(1):73-75.
[6] RICCIONI G, ORAZIO N D, FRANCESCHELLI S, et al. Marine carotenoids and cardiovascular risk markers[J]. Marine Drugs, 2011(9): 1166-1175.
[7] 赵秀玲. 芫荽的成分及保健功能的研究进展[J]. 食品工业科技,2011,32(4):427-433. ZHAO X L. Research progress in functional ingredient and healthy function of coriander[J]. Science and technology of food industry,2011,32(4):427-433.
[8] 戴国彪,姜子涛,李荣,等.芫荽籽精油抗氧化能力研究[J]. 食品研究与开发,2010,31(8):8-10. DAI G B,JIANG Z T,LI R, et al. Antioxidant activity of the essential oil of coriander seeds[J]. Food Research and Development,2010,31(8):8-10.
[9] 陆占国,郭红转,刘向阳.香菜挥发油功能性研究[J].北京工商大学学报(自然科学版),2007, 25(2): 5-8. LU Z G, GUO H Z,LIU X Y. Study on functionality of coriander essential oil[J].Journal of Beijing Technology and Business University(Natural Science Edition),2007,25(2):5-8.
[10] TANG S L, RAJARAJESWARAN J, FUNG S Y, et al. Antioxidant activity ofCoriandrumsativumand protection against DNA damage and cancer cell migration[J]. BMC Complementary and Alternative Medicine, 2013, 13(1):1-13.
[11] 陈志红,徐美奕. 香菜乙醇提取液的体外抗氧化活性[J]. 食品研究与开发,2009,30(11):69-71. CHEN Z H,XU M Y. Study on antioxidant activities of ethanol extracts fromCoriandrumsativuminvitro[J]. Food Research and Development,2009,30(11):69-71.
[12] 卢冬梅,蔺红萍,文静,等. 香菜提取液的抗氧化活性初步研究[J]. 食品工业,2015, 36(7): 54-57. LU D M, LIN H P,WEN J, et al. Antioxidant activity ofCoriandrumsativumextract[J]. Food Industry,2015,36(7):54-57.
[13] 卜彦花,周娜娜,王春悦,等. 福林酚试剂法和紫外分光光度法测定冬枣多酚含量的比较研究[J]. 中国农学通报, 2012,28(1):212-217. BU Y H,ZHOU N N,WANG C Y,et al. Comparative study on determination of total phenolics content of jujube fruit with FC and UV-spectrophotometric method[J]. Chinese Agricultural Science Bulletin,2012,28(1): 212-217.
[14] SHARMA OM P, BHAT TEI K. DPPH antioxidant assay revisited[J]. Food Chemistry, 2009, 113(4):1202-1205.
[15] 赵建,宋亮楠,刘薇,等. ORAC法测定保健食品抗氧化能力的体内外实验对比分析[J]. 食品科学, 2011, 32(15):103-108. ZHAO J,SONG L N,LIU W, et al. Comparative analysis of antioxidant activityinvitroandinvivoof health foods by ORAC assasy[J]. Food Science, 2011, 32(15):103-108.
[16] CAO G, ALESSIO H M, CUTLER R G. Oxygen-radical absorbance capacity assay for antioxidants[J].Free Radical Biology and Medicine, 1993, 14(3), 303-311.
[17] BAO Y F, LI J Y, ZHENG L F, et al. Antioxidant activities of cold-nature Tibetan herbs are significantly greater than hot-nature ones and are associated with their levels of total phenolic components[J].Chinese Journal of Natural Medicines, 2015,13(8):609-617.
[18] NAKAJIMA A, MATSUDA E, MASUDA Y, et al. Characteristics of the spin-trapping reaction of a free radical derived from AAPH: further development of the ORAC-ESR assay[J]. Analytical and Bioanalytical Chemistry, 2012, 403(7):1961-1970.
[19] GUERRA N B, MELO E D A,FILHO J M. Antioxidant compounds from coriander (CoriandrumsativumL.) etheric extract[J].Journal of Food Composition and Analysis, 2005, 18(2): 193-199.
[20] WANGEMSTEEN H, SAMUELSEN A B, MALTERUD K E. Antioxidant activity in extracts from coriander[J].Food Chemistry, 2004, 88(2): 293-297.
[21] 续洁琨 , 姚新生, 栗原博. 抗氧化能力指数(ORAC)测定原理及应用[J]. 中国药理学通报,2006, 22(8):1015-1021. XU J K,YAO X S,LI Y B. Oxygen radical absorbance capacity assay and its application[J]. Chinese Pharmacological Bulletin,2006, 22(8):1015-1021.
[22] RUSSO A, IZZO A A,BORRELLI F, et al. Free radical scavenging capacity and protective effect ofBacopamonnieraL. on DNA damage[J]. Phytotherapy Research, 2003, 17(8): 870-875.
[23] CHOI C W, KIM S C, HWANG S S, et al. Antioxidant activity and free radical scavenging capacity between Korean medicinal plants and flavonoids by assay-guided comparison[J].Plant Science, 2002, 163(6): 1161-1168.
(责任编辑:檀彩莲)
Bio-molecules Damage Protective Effect and Free Radical Scavenging Capacity ofCoriandrumsativumL.
HAN Yingyi, REN Hong*, WANG Dandan, WAN Huijie, YUE Jinping
(SchoolofFoodandChemicalEngineering/BeijingKeyLaboratoryofFlavorChemistry/BeijingHigherInstitutionEngineeringResearchCenterofFoodAdditivesandIngredients,BeijingTechnologyandBusinessUniversity,Beijing100048,China)
In order to study bio-molecules damage protective effect and free radical scavenging capacity ofCoriandrumsativumL. (coriander), Folin-phenol assay was used for estimating total polyphenol of coriander. Gel electrophoresis was performed for detecting DNA and protein damage protective effect of coriander. Free radical scavenging capacity of coriander extract was evaluated using DPPH assay. ORAC assay was used to confirm the value of oxygen radical absorbance capacity. The result showed that the content of total polyphenol was 4.054 μg/mg and the minimum protective concentrations on DNA and bull serum albumin were 4.0 μg/mL and 125.00 μg/mL. TheIC50value for DPPH radical scavenging ability was 0.17 μg/μL while the ORAC value for antioxidant capacity was 485.3. The result indicated that the coriander extract had distinct antioxidant activity.
coriander; DNA; protein; damage protection; antioxidant; polyphenols
2016-10-26
韩潆仪,女,助理实验师,主要从事分子和细胞生物学方面的研究;
10.3969/j.issn.2095-6002.2017.01.010
2095-6002(2017)01-0064-06
韩潆仪,任虹,王丹丹,等. 芫荽对生物大分子氧化损伤的保护作用及自由基清除能力[J]. 食品科学技术学报,2017,35(1):64-69. HAN Yingyi, REN Hong, WANG Dandan, et al. Bio-molecules damage protective effect and free radical scavenging capa-city ofCoriandrumsativumL. [J]. Journal of Food Science and Technology, 2017,35(1):64-69.
TS201.2; TS255.2
A
*任 虹,女,副教授,主要从事生物制品分析等方面的研究,通信作者。
