氨基葡萄糖、骨碎补和虾青素对大鼠急性骨关节炎的干预研究
2017-03-14陈世杰劳文艳周艳丽李艳梅赵晓红
陈世杰,劳文艳,2,周艳丽,李艳梅,赵晓红,2,*
(1.北京联合大学功能食品科学技术研究院,北京 100191;2.北京联合大学应用文理学院生物活性物质与功能食品北京市重点实验室,北京 100191;3.北京绿色金可生物技术股份有限公司,北京 100081)
氨基葡萄糖、骨碎补和虾青素对大鼠急性骨关节炎的干预研究
陈世杰1,劳文艳1,2,周艳丽1,李艳梅3,赵晓红1,2,*
(1.北京联合大学功能食品科学技术研究院,北京 100191;2.北京联合大学应用文理学院生物活性物质与功能食品北京市重点实验室,北京 100191;3.北京绿色金可生物技术股份有限公司,北京 100081)
目的:观察氨基葡萄糖(Glucosamine,GLU)、骨碎补(Drynaria rhizome,DR)和虾青素(Astaxanthin,AST)单独和联合干预对大鼠急性骨关节炎的影响及其差别,为研发对骨关节炎有预防和改善作用的功能性食品提供理论依据。方法:120只雄性SD大鼠随机分为10组:空白对照组、模型对照组、阳性对照组和7个受试物组(GLU、DR、AST、GLU+DR、GLU+AST、DR+AST、GLU+DR+AST组),空白组和模型组灌胃给予蒸馏水(10 mL/kg),阳性对照组灌胃给予双氯芬酸钠(2 mg/kg),GLU、DR、AST的灌胃剂量分别为:1000、250、120 mg/kg。采用关节腔注射白陶土与λ-鹿角菜胶诱发大鼠关节炎,在实验后的第1、3、5、7 d测量大鼠关节肿胀度,第7 d处死动物,取膝关节制作石蜡组织切片,观察关节软骨组织学病理变化,评价蛋白聚糖的减少程度,取滑膜用ELISA测定大鼠滑膜组织中IL-1β和TNF-α的水平。结果:与模型对照组相比,各受试物组大鼠膝关节肿胀度均有不同程度减小,其中变化较显著的是GLU、DR、GLU+DR组(p<0.01);各受试物组组织病理学评分、滑膜组织中TNF-α和IL-1β含量均有不同程度的降低,其中变化较显著的是GLU+DR、GLU+DR+AST、GLU、DR组(p<0.01)。结论:氨基葡萄糖、骨碎补对大鼠急性关节炎具有预防和保护作用,联合作用效果更好,而虾青素的作用效果相对差些。
氨基葡萄糖,骨碎补,虾青素,骨关节炎,关节软骨
骨关节炎(Osteoarthritis,OA)为一种慢性退行性病变,系由于劳损、创伤、增龄、肥胖、遗传等多种因素引起的关节软骨退化损伤、软骨下骨和关节边缘反应性增生[1]。因其具有较高的发病率和致残率而受到医学界的普遍关注[2]。据研究估计,全世界范围内大约有10%的男性、18%的女性和60%~65%的60岁以上的人群均患有症状性骨关节炎,并且80%的此类患者活动受限[3]。随着社会人口的老龄化,OA的发病率也呈逐渐上升的趋势,已成为我国一个重大的公共健康问题,对其进行深入研究刻不容缓[4]。
骨关节炎的发病机制尚不明确,临床也缺乏根治措施,目前治疗药物以非甾体抗炎药为主[5],其作用是减轻疼痛,并不能减慢和阻止OA的病理发展,长期使用可导致严重的胃肠道不良反应及其他并发症[6]。近年来的研究发现,硫酸软骨素[7]、氨基葡萄糖(GLU)、骨碎补(DR)和鹿茸多肽等植物提取物在一定程度上能够减轻软骨损伤,起到保护及修复软骨,抑制OA病理进程的作用,且无明显毒副作用。氨基葡萄糖是一种天然的氨基单糖,可刺激软骨细胞合成蛋白聚糖以补充软骨基质的流失,促进关节软骨的修复[8],在一定程度上阻断OA的病理进程[9-10]。骨碎补是水龙骨科多年生蕨类植物[11],能有效抑制关节滑膜细胞凋亡,促进关节软骨组织形态的恢复[12]。虾青素(AST)是类胡萝卜素的衍生物,具有抗氧化、提高免疫力、抗骨质疏松等作用[13],可提高软骨细胞抗炎能力,有效降低软骨细胞的氧化损伤[14]。上述三种物质联合作用于OA大鼠是否具有更强的治疗和保护作用还少有报道,因此,本实验选取这三种物质,研究它们单独或联合作用的效果,为进一步开展预防和治疗OA的研究及开发具有保护功能的生物活性物质提供科学依据。
1 材料和方法
1.1 材料与仪器
SD雄性大鼠 120只,160~180 g,购于北京维通利华实验动物技术有限公司,饲养于北京联合大学应用文理学院保健食品功能检测中心SPF级动物房,许可证号:SYXK(京)2012-0031;基础饲料 由北京华阜康生物科技股份有限公司提供,许可证号:SCXK(京)2014-012;白陶土、λ-鹿角菜胶、氨基葡萄糖、番红-O-固绿染料、伊红、苏木色精、双氯芬酸钠 Sigma,USA;水合氯醛 阿拉丁,上海;虾青素、骨碎补提取物 北京绿色金可生物技术股份有限公司;甲醛溶液、无水乙醇、二甲苯、甲酸、KCl、NaH2PO4·2H2O、Na2HPO4·12H2O 北京化工厂;TNF-α、IL-1βELISA试剂盒 上海沪尚生物科技有限公司;石蜡 Leica,USA;病理级载玻片 江苏世泰实验器材有限公司。
HZS-H恒温水浴振荡器 东联电子技术开发有限公司,哈尔滨;多功能酶标仪 Thermo,美国;E220型生物显微镜、RM2245型半自动轮转切片机、AUTOSTAINER XL型全自动染色机、EG1150HC型石蜡包埋机、HI1210型推片机、HI1220型烘片机 Leica,德国。
1.2 实验方法
1.2.1 动物分组与给药 大鼠随机分成10组,按表1剂量称取各组样品后用无菌水稀释至10 mL,按体质量比(10 mL/kg)灌胃给药,每日1次,连续7 d。空白对照组和模型对照组每日灌胃蒸馏水,体积与实验组相同。

表1 实验分组及剂量Table 1 Experiment grouping and dose
注:GLU+DR组为GLU和DR联合干预组,GLU+AST组为GLU和AST联合干预组,DR+AST组为DR和AST联合干预组,GLU+DR+AST组为GLU、DR和AST联合干预组。
1.2.2 模型建立 第1 d灌胃给予受试物或蒸馏水1 h后,采用关节腔注射白陶土与λ-鹿角菜胶诱发模型对照组、阳性药物组及各受试物组大鼠急性关节炎[15],方法如下:动物经水合氯醛(350 mg/kg体重)腹腔注射麻醉后,常规消毒右后肢膝关节部位,然后用1 mL注射针穿过髌骨韧带向膝关节腔内注入灭菌生理盐水配制的质量体积比4%白陶土与2% λ-鹿角菜胶的混悬液0.1 mL,并缓慢曲伸关节持续5 min。
1.2.3 指标检测方法
1.2.3.1 关节肿胀度测定 在造模后的第1、3、5和7 d,用游标卡尺测量每组大鼠左右膝关节横向直径(mm),按以下公式计算膝关节肿胀度(%)。
关节肿胀度(%)=(右腿膝关节直径-左腿膝关节直径)/左腿膝关节直径×100
式(1)
1.2.3.2 组织病理学检查及评分 实验结束后大鼠经水合氯醛麻醉后处死,剪下右膝关节,置10%中性缓冲福尔马林中固定,用5%甲酸-福尔马林脱钙后,石蜡包埋,切片。分别进行苏木精-伊红(HE)[16]和番红-O-固绿(SOFG)[17]染色。本研究采用记分系统对关节软骨、软骨细胞数量和形态、关节软骨中的蛋白多糖等4类病损进行分类记分,然后用总分综合评价膝关节的组织病理改变程度,其评分标准见表2[18]。

表2 组织病理学评分标准(总分12分)Table 2 Histopathological scoring criteria(total score of 12 points)

表3 不同处理对大鼠关节肿胀度的影响(n=10)Table 3 Effects of different treatments on the degree of joint swelling in rats(n=10)
注:与空白组比较,##表示差异极显著(p<0.01);与模型组比较,*表示差异显著(p<0.05),**表示差异极显著(p<0.01);表4、表5同。
1.2.3.3 ELISA测定大鼠关节滑膜组织细胞因子TNF-α、IL-1β水平 取关节滑膜组织,放入组织研磨器中,加入PBS(10 mL/g),制成匀浆,然后置于-20 ℃过夜。经过2次反复冻融处理以破坏细胞膜,于2~8 ℃、12000×g离心15 min取上清,用ELISA(酶联免疫吸附法)检测大鼠关节滑膜组织细胞因子TNF-α、IL-1β含量(详细步骤参照说明书)。
1.3 数据处理
2 结果与分析
2.1 不同处理对大鼠关节肿胀度的影响
观察不同时间不同处理对大鼠关节肿胀度的影响,结果见表3。由表3可知,诱发大鼠右膝关节炎后第1、3、5和7 d,模型对照组大鼠关节肿胀度极显著大于空白对照组(p<0.01),表明模型诱导成功;与模型对照组相比,双氯芬酸钠组和GLU组大鼠关节肿胀度均极显著降低(p<0.01)。诱发关节炎后第3、5和7 d,与模型对照组相比,DR组和GLU+DR+AST组大鼠关节肿胀度明显小于模型对照组(p<0.05)。GLU+DR组大鼠第5、7 d测量的关节肿胀度极显著小于模型对照组(p<0.01)。DR+AST组大鼠第5 d测量的关节肿胀度明显小于模型对照组(p<0.05)。AST和GLU+AST组大鼠关节肿胀度与模型对照组差异不显著(p>0.05)。以上结果表明,各受试物均能减轻大鼠由关节炎引起的肿胀损伤,其中,GLU、DR单独和联合作用的效果更优,AST可能对关节肿胀损伤的作用效果不明显。
2.2 不同处理对大鼠关节软骨的病理学改变的影响
2.2.1 大鼠膝关节组织切片HE染色的组织病理学征象 由图1可见,空白对照组大鼠关节软骨表面光滑,完整,软骨层无裂缝、侵蚀;软骨细胞规则排列于软骨陷窝内,呈柱状排列,软骨细胞数量、形态无异常。模型对照组大鼠关节软骨表面粗糙、不平整,有垂直裂缝,可深达放射层及钙化层,部分软骨层脱落,大范围骨侵蚀和软骨破坏;表层内的软骨细胞明显减少,细胞排列紊乱,放射层细胞则增多明显,钙化层可见有大量肥大的软骨细胞,有细胞团存在,部分有血管翳形成。阳性对照组大鼠组织病理学所见则明显轻于模型组,表现为关节软骨侵蚀较轻,细胞排列较规则,细胞增生减少。各组大鼠关节软骨组织病理学征象均明显轻于模型对照组,其中,GLU、GLU+DR、GLU+DR+AST、DR、DR+AST组大鼠组织病理学征象减轻较明显,GLU+AST、AST组次之。以上结果提示,各受试物均能减轻大鼠关节软骨组织病理学异常现象,其中,GLU、DR单独和联合作用的效果更优。

图1 大鼠膝关节代表性组织病理学征象(HE染色,100×)Fig.1 Representative of histopathological features of knee joint in rats(stained with HE,100×)
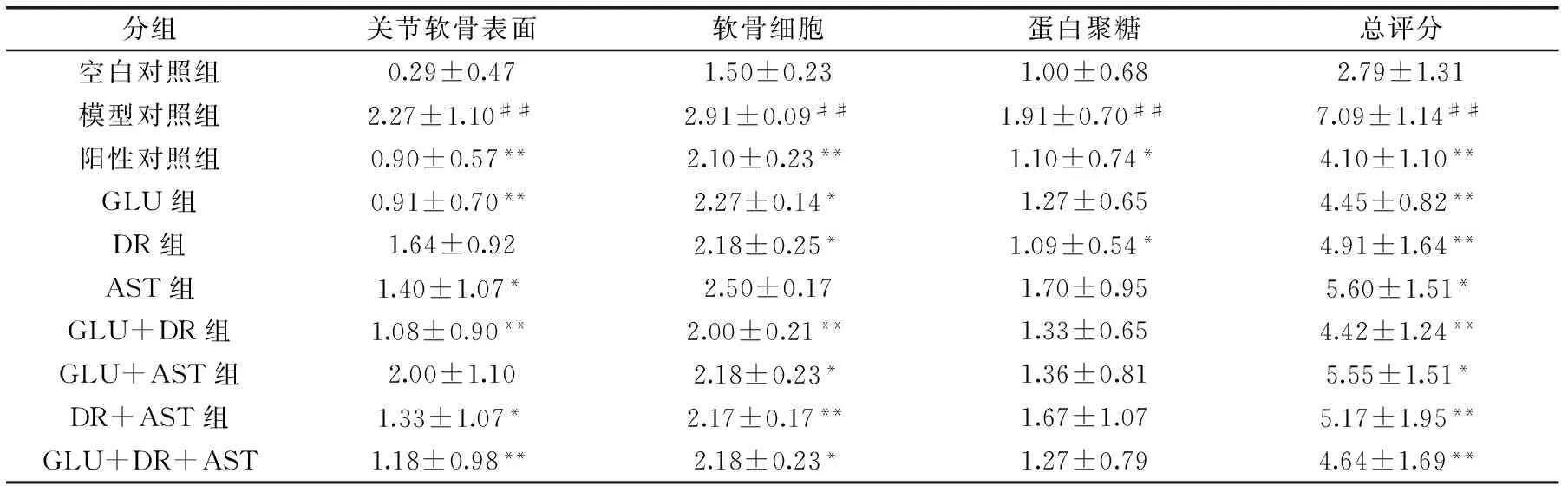
表4 大鼠膝关节切片的组织病理学评分结果(n=10)Table 4 Histopathological scores of section of knee joint in rats(n=10)
2.2.2 大鼠膝关节组织切片SOFG染色的组织病理学征象 如图2所示,空白对照组关节软骨蛋白聚糖染色正常(颜色鲜红且均匀);模型对照组关节软骨基质中蛋白聚糖染色重度减退,说明造模后大鼠关节软骨细胞外基质中蛋白聚糖含量明显降低,模型诱导成功;与模型组相比,阳性对照组蛋白聚糖染色变化确实明显小于模型组,各受试物组除GLU、DR组外,其他各组改善作用不明显,可能是由于本实验采用关节腔注射法造成大鼠膝关节急性损伤,短期内蛋白聚糖的变化不明显。

图2 大鼠膝关节代表性组织病理学征象(SOFG染色,100×)Fig.2 Representative of histopathological features of knee joint in rats(stained with SOFG,100×)
2.2.3 不同处理对大鼠关节软骨组织病理学评分的影响 组织病理学评分结果(表4)显示,模型对照组大鼠关节软骨的各项组织病理学评分均极显著高于空白对照组(p<0.01)。阳性对照组大鼠的各项组织病理学评分均显著低于模型对照组(p<0.05)。GLU、GLU+DR、DR+AST和GLU+DR+AST组大鼠关节软骨表面、软骨细胞、总评分均显著(p<0.05)小于模型对照组,蛋白聚糖评分与模型对照组间无明显差别。DR组大鼠关节软骨细胞、蛋白聚糖和总评分显著(p<0.05)小于模型对照组,关节软骨表面评分与模型对照组间无明显差别。AST组大鼠关节软骨表面和总评分显著(p<0.05)小于模型对照组。GLU+AST组大鼠关节软骨细胞和总评分显著(p<0.05)小于模型对照组。由总评分可见,各受试物对组织病理学异常现象均具明显改善作用,除GLU+AST、AST具有显著改善作用外,其他各受试物均具有极显著的改善作用。
2.3 不同处理对大鼠关节滑膜组织TNF-α、IL-1β水平的影响
由表5可见,与空白对照组相比,模型对照组大鼠关节滑膜组织中TNF-α和IL-1β含量均极显著(p<0.01)升高,说明诱发大鼠急性OA后,大鼠滑膜组织发生炎症性改变,炎性因子TNF-α和IL-1β水平明显升高。阳性对照组大鼠关节滑膜组织中TNF-α和IL-1β含量均极显著(p<0.01)低于模型对照组。除AST组外,其余配方组TNF-α、IL-1β含量均极显著(p<0.01)小于模型对照组。上述结果表明,除AST外,各受试物均能明显降低大鼠关节滑膜组织炎性因子IL-1β、TNF-α水平,对OA引起的大鼠关节滑膜炎症具有良好的改善作用。

表5 不同配方对大鼠关节滑膜细胞因子TNF-α和IL-1β水平的影响(n=10)Table 5 Effects of different formula on synovial cytokine TNF-α and IL-1β in rats(n=10)
3 讨论
良好的疾病模型是研究的基础,更是实验结论可靠性的保证[19]。骨关节炎动物模型的建立可以通过模拟一种或数种致病因素诱发关节软骨退变来实现,其模型大致可分为自发模型和诱发模型两大类[20]。自发性动物模型能较好地模拟发病过程,是研究OA发病机制、关节软骨生化改变及防治效果的良好模型[21],但此类模型需要的动物数量大,实验周期长,研究费用高,目前实际应用较少[22]。诱发性动物模型是指通过各种实验性的干预措施来诱导骨关节炎的产生[21],主要有关节制动、关节腔注射[23]、寒冷刺激等模型以及关节内手术诱发模型(Hulth模型、关节划痕、半月板或前交叉韧带切除等)[24-25]、关节外手术诱发模型(改变关节应力、卵巢切除法等)[26-27]、饮食诱导模型[28]和运动性损伤模型[29]等。其中,关节腔注射法建模所需时间短,可模拟软骨破坏的终末环节,适于软骨病理、药物和活性物质防治的研究,在药物疗效及活性物质筛选等方面优势明显,因此,本实验采用关节腔注射法建立大鼠急性骨关节炎模型,通过关节肿胀度、滑膜组织炎性因子和组织病理学变化,研究氨基葡萄糖、骨碎补、虾青素单独或联合干预对大鼠骨关节炎的影响。
通过关节腔注射白陶土与鹿角菜胶诱发大鼠急性骨关节炎后,大鼠膝关节持续肿胀,滑膜组织炎性因子TNF-α和IL-1β水平显著升高,组织病理学检查可见关节软骨侵蚀、软骨细胞数量和形态异常及软骨蛋白聚糖染色缺失,表明模型诱导成功。灌胃给予大鼠各受试物后,大鼠关节肿胀损伤均有不同程度的缓解,滑膜组织炎性因子TNF-α、IL-1β水平降低,由骨关节炎引起的组织病理学异常现象均得到改善。分析比较氨基葡萄糖、骨碎补、虾青素单独和联合作用的结果,效果最好的是GLU+DR与GLU+DR+AST,其次是GLU与DR,进一步证明了氨基葡萄糖和骨碎补有较强的缓解关节肿胀,减轻滑膜炎症,改善关节软骨组织病理学异常的保护作用,且联合作用效果更好,而虾青素的保护作用相对要差一些。
4 结论
本实验选用关节腔注射法建立大鼠OA模型,首次研究了GLU、AST、DR三种物质联合作用对OA的干预效果,结果显示,GLU、DR能明显减小大鼠膝关节肿胀度,改善由OA引起的关节软骨侵蚀、软骨细胞数量和形态异常及软骨蛋白聚糖缺失现象,并能明显减轻滑膜炎症,对大鼠急性OA具有一定的预防和保护作用,且联合作用效果更好,而AST的作用效果相对要差一些。本研究的模型属于急性模型,有待于建立合适的慢性模型,进一步研究这三种物质对慢性OA的干预效果以及研究三种物质在不同剂量下联合作用的效果,为进一步开展预防和治疗OA的研究及开发功能性食品提供科学依据。
[1]Prietoalhambra D,Judge A,Javaid M K,et al. Incidence and risk factors for clinically diagnosed knee,hip and hand osteoarthritis:influences of age,gender and osteoarthritis affecting other joints.[J]. Annals of the Rheumatic Diseases,2014,73(9):1659-1664.
[2]MOYER R F,RATNESWARAN A,BEIER F,et al. Osteoarthritis year in review 2014:mechanics-basic and clinical studies in osteoarthritis[J]. Osteoarthritis and Cartilage,2014,22(12):1989-2002.
[3]Bijlsma J,Berenbaum F,Lafeber F. Osteoarthritis:An update with relevance for clinical practice[J]. Lancet,2011,377(9783):2115-2126.
[4]黄洪容. 我国社区中老年人膝骨关节炎的发病趋势分析[J]. 当代医学,2012,18(12):59-60.
[5]杨艺,李志昌,林剑浩,等. 从门诊处方看骨关节炎指南的现实意义[J]. 北京大学学报:医学版,2013,45(2):255-259.
[6]Balmaceda C M. Evolving guidelines in the use of topical nonsteroidal anti-inflammatory drugs in the treatment of osteoarthritis[J]. Bmc Musculoskeletal Disorders,2014,15(1):1-5.
[7]BAUEROVA K,PONIST S,KUNCIROVA V,et al. Chondroitin sulfate effect on induced arthritis in rats[J]. Osteoarthritis and Cartilage,2011,19(11):1373-1379.
[8]Henrotin Y,Mobasheri A,Marty M. Is there any scientific evidence for the use of glucosamine in the management of humanosteoarthritis?[J]. Arthritis Research & Therapy,2012,14(1):201.
[9]Kanzaki N,Saito K,Maeda A,et al. Effect of a dietary supplement containing glucosamine hydrochloride,chondroitin sulfate and quercetin glycosides on symptomatic knee osteoarthritis:a randomized,double-blind,placebo-controlled study[J]. Journal of the Science of Food & Agriculture,2012,92(4):862-869.
[10]Gonzalez EB. ACP Journal Club. Review:Glucosamine(sulfate or hydrochloride)does not reduce pain in knee or hip osteoarthritis[J]. Annals of Internal Medicine,2013,159(12):2568-2568.
[11]陈瑶,刘忠良,赵勇. 骨碎补化学成分和药理作用研究进展[J]. 解放军药学学报,2012,28(5):454-457.
[12]郑忠辉. 骨碎补对骨性关节炎家兔实验研究[D]. 沈阳:辽宁中医药大学,2015.
[13]Rao A R,Phang S M,Sarada R. Astaxanthin:sources,extraction,stability,biological activities and its commercial applications-a review[J]. Marine Drugs,2014,12(1):128-152.
[14]裴凌鹏,白岩,惠伯棣. 虾青素对骨关节炎软骨细胞氧化损伤及炎性的影响[J]. 中国老年学杂志,2012,32(23):5182-5184.
[15]王大利,耿成燕,姜丽平,等. 关节软骨及骨破坏模型大鼠经盐酸氨基葡萄糖干预的最佳剂量[J]. 中国组织工程研究与临床康复,2011,15(28):5145-5148.
[16]李会贤,朱顺英,戚亦萍,等. 一种制作大鼠膝关节和椎间盘石蜡组织切片的方法[J]. 中国细胞生物学学报,2009(1):125-129.
[17]Tuncay I C,Özdemir B H,Demirörs H,et al. Pedunculated Synovium Grafts in Articular Cartilage Defects in Rabbits[J]. Journal of Investigative Surgery the Official Journal of the Academy of Surgical Research,2005,18(3):115-122.
[18]Mankin H J,Dorfman H,Lippiello L,et al. Biochemical and Metabolic Abnormalities in Articular Cartilage from Osteo-Arthritic Human Hips[J]. Journal of Bone & Joint Surgery American Volume,1971,53(3):523-537.
[19]Guzman R E,Evans M G,Bove S,et al. Mono-Iodoacetate-Induced Histologic Changes in Subchondral Bone and Articular Cartilage of Rat Femorotibial Joints:An Animal Model of Osteoarthritis[J]. Toxicologic Pathology,2003,31(6):619-624.
[20]Mccoy A M. Animal Models of Osteoarthritis:Comparisons and Key Considerations[J]. Veterinary Pathology,2015,52(5):803-818.
[21]Kalliopi L A,Pavlos L,Karadimas E V,et al. Useful animal models for the research of osteoarthritis[J]. European Journal of Orthopaedic Surgery & Traumatology Orthopédie Traumatologie,2014,24(3):263-271.
[22]Vincent T L,Williams R O,Rose M,et al. Mapping pathogenesis of arthritis through small animal models[J]. Rheumatology,2012,51(11):1931-1941.
[23]Burnham L J,Dickenson A H. The anti-nociceptive effect of milnacipran in the monosodium iodoacetate model of OA pain and its relation to changes in descending inhibition[J]. Journal of Pharmacology & Experimental Therapeutics,2013,344(3):696-707.
[24]Knights C B,Gentry C,Bevan S. Partial medial meniscectomy produces osteoarthritis pain-related behaviour in female C57BL/6 mice[J]. Pain,2012,153(2):281-292.
[25]Khorasani M S,Diko S,Hsia A W,et al. Effect of alendronate on post-traumatic osteoarthritis induced by anterior cruciate ligament rupture in mice[J]. Arthritis Research & Therapy,2015,17(1):1-11.
[26]Palmoski M J,Colver R A,Brandt K D. Marked suppression by salicylate of the augmented proteoglycan synthesis in osteoarthritic cartilage[J]. Arthritis & Rheumatism,1980,23(1):83-91.
[27]Pernille HA,Laszlo BT,Thomas LA,et al. Ovariectomized rats as a model of postmenopausal osteoarthritis:validation and application[J]. Arthritis Research & Therapy,2004,6(2):169-180.
[28]Louer C R,Furman B D,Huebner J L,et al. Diet-induced obesity significantly increases the severity of posttraumatic arthritis in mice[J]. Arthritis & Rheumatism,2012,64(10):3220-3230.
[29]Lee YJ,Park JA,Yang SH,et al. Evaluation of osteoarthritis induced by treadmill-running exercise using the modified Mankin and the new OARSI assessment system[J]. Rheumatology International,2011,31(12):1571-1576.
Intervention effects of glucosamine,drynaria rhizome and astaxanthin on acute osteoarthritis in rats
CHEN Shi-jie1,LAO Wen-yan1,2,ZHOU Yan-li1,LI Yan-mei3,ZHAO Xiao-hong1,2,*
(1.Beijing Key Laboratory of Bioactive Substances and Functional Foods,College of Applied Arts and Science of Beijing Union University,Beijing 100191,China;2.Research Institute for Science and Technology of Functional Food,Beijing Union University,Beijing 100191,China;3.Beijing Gingko-group Biological Technology Co.,Ltd.,Beijing 100081,China)
Objective:To investigate and compare the individual and combined effects of glucosamine,astaxanthin,drynaria rhizome on acute osteoarthritis in rats,so as to provide theoretical basis for the development of functional foods with preventive and improvement effects on osteoarthritis. Methods:120 male SD rats were randomly divided into 10 groups:the control group,model group,positive group and 7 treatment groups(GLU,DR,AST,GLU+DR,GLU+AST,DR+AST,GLU+DR+AST group). The control and model group were orally given distilled water(10 mL/kg),the positive group received diclofenac sodium(2 mg/kg),the gavage dose of GLU,DR and AST was respectively 1000,250,120 mg/kg. The arthritis was induced by injecting the articular cavity with kaolin and carrageen-λ,the degree of joint swelling was measured on 1 th,3 th,5 th,and 7 th days after modeling. The knee joints were subjected to prepare paraffin tissue sections to observe the pathological changes of articular cartilage and to evaluate the reduction of proteoglycan. The contents of TNF-αand IL-1βin synovium were detected with ELISA kits. Results:Compared with model group,the swelling of the knee joint showed different degrees of reduction in each treatment group,the changes were more significant in GLU,DR and GLU+DR group(p<0.01).The histopathological score and the contents of TNF-αand IL-1βin synovium were decreased in different degrees in each treatment group,the GLU+DR,GLU+DR+AST and GLU DR group displayed a more significant reduction(p<0.01). Conclusion:GLU and DR had preventive and protective effects on acute osteoarthritis in rats,and the combined effect was better. While AST had relatively minimum effect.
osteoarthritis;glucosamine;drynariae rhizome;astaxanthin;articular cartilage
2016-08-12
陈世杰(1991-),女,硕士研究生,研究方向:生物活性物质的生理功能研究,E-mail:chenshijie5569@126.com。
*通讯作者:赵晓红(1961-),女,博士,研究员,研究方向:食品安全与功能学,E-mail:xiaohong@buu.edu.cn。
北京联合大学生物活性物质与功能食品北京市重点实验室开放课题(Zk70201501)。
TS201.4
A
:1002-0306(2017)04-0365-06
10.13386/j.issn1002-0306.2017.04.061
