广西巴马小型猪PERV-env基因克隆及其组织表达谱分析
2017-03-13潘汉世陈凤莲廖艳娟唐海波吴健敏
钟 华,潘汉世,马 玲,龙 寒,陈凤莲,廖艳娟,唐海波,吴健敏
(1. 广西民族大学海洋与生物技术学院,南宁,广西 530006; 2. 广西兽医研究所 广西兽医生物技术重点实验室, 南宁,广西 530001)
研究报告
广西巴马小型猪PERV-env基因克隆及其组织表达谱分析
钟 华1,潘汉世2,马 玲2,龙 寒1,陈凤莲2,廖艳娟1,唐海波2,吴健敏2
(1. 广西民族大学海洋与生物技术学院,南宁,广西 530006; 2. 广西兽医研究所 广西兽医生物技术重点实验室, 南宁,广西 530001)
目的 克隆广西巴马小型猪PERV-env部分基因,并研究其在不同组织中的表达差异。方法 利用RT-PCR方法从巴马小型猪外周血白细胞中扩增PERV-env基因,并与部分国内外已发表的PERV-env 基因序列进行同源性及遗传进化分析。以扩增获得的广西巴马小型猪PERV-env基因为模板设计引物,利用半定量RT-PCR的方法对广西巴马小型猪不同组织中PERV mRNA表达情况进行分析。结果 在所检测的9个组织样品中PERV mRNA相对表达水平存在差异,肾及外周血淋巴细胞中PERV mRNA丰度最高,肺、心、肝、脾、胸腺、卵巢次之,且表达丰度差异不显著(P>0.05),胰腺PERV mRNA表达丰度最低。结论 以巴马小型猪胰岛细胞进行异种移植发生PERV感染的潜在危险性可能要低于其它器官,但仍需进一步研究证实。
巴马小型猪;PERV-env基因;半定量RT-PCR;组织表达谱
广西巴马小型猪具有遗传性能稳定,遗传相似性及近交系数高等优点,是国家重点扶持发展的小型猪种之一。目前在医学及生物学方面的应用涉及到肿瘤、心血管病、糖尿病、皮肤烧伤、血液病、遗传病、营养代谢病、新药评价等等。它不仅是发展高级医学实验用猪的优良品系,同时也有望成为异种移植的最佳供体之一。
自从猪内源性反转录病毒(Porcine endogenous retrovirus,PERV)被认为在猪—人异种移植中存在潜在危险以来,有关PERV病原安全性问题成为研究的热点[1]。PERV基因组结构由5′、3′非编码区及gag、pol、env 3个编码基因组成,它能够以前病毒DNA形式整合进猪细胞基因组中,并随细胞染色体复制而复制。PERV-env基因编码病毒的囊膜蛋白(Env蛋白), 由贯穿病毒囊膜的穿膜(transmembrane,TM)蛋白及暴露于囊膜表面的表面蛋白(surface glycoprotein,SU)组成。SU有许多糖基化位点,不但具有受体结合的功能,与PERV A、B、C亚型的分类、细胞的嗜性、宿主感染范围等相关,还具有诱导宿主产生中和抗体的作用,同时还非常容易变异[2]。而TM蛋白则相对保守,参与感染过程中病毒与宿主细胞膜的融合,因此Env蛋白一直是PERV研究的重点。
本试验通过RT-PCR技术从巴马小型猪外周血淋巴细胞中克隆PERV-env基因,并以巴马小型猪PERV-env基因中TM蛋白编码区为模板设计引物,应用半定量RT-PCR方法对巴马小型猪各个组织中PERV-env基因的mRNA丰度进行检测,以了解广西巴马小型猪各组织器官中PERV的表达情况,为临床异种移植选择低拷贝负载的猪器官、组织或细胞提供依据,同时也为进一步开展异种移植的安全性评估打下基础。
1 材料和方法
1.1 检测样品
6月龄的巴马小型猪3头,由广西大学巴马小型猪封闭养殖场提供[SCXK桂2013-0003]。实验在广西丽原生物股份有限公司实验动物中心内进行[SYXK桂2012-0002],所有的操作必须遵守实验动物中心的规章制度和操作规程(SOP)进行。猪宰杀后迅速采集肺、心、肝、肾、脾、胰、胸腺、卵巢、外周血,液氮速冻,-80℃冰箱保存,用于总RNA的提取。
1.2 工具酶及试剂
M-MLV反转录酶、Pyrobest Taq DNA聚合酶、pGEM-T载体、琼脂糖等购自Promega公司,Trizol试剂为Invitrogen公司产品,BioredTM全血基因组DNA小量纯化试剂盒、DNA marker DL2000购自大连宝生物公司(TaKaRa),E.coliDH 5α为本室保存。
1.3 基因的选择及引物设计
根据 Genbank已发表的PERV核苷酸序列(登录号:AJ133817),设计一对引物,用于扩增PERV-env全基因。此外,由于PERV有A、B、C三种亚型,其分型主要由Env蛋白中的SU蛋白的差异来决定[2],因此本试验以扩增获得的巴马小型猪PERV-env基因为模板,选择避开SU蛋白编码区,以相对保守的TM蛋白编码区设计引物,扩增PERV-env部分基因作为检测PERV表达谱的待测目的基因。同时以管家基因(house-keeping genes)β肌动蛋白(β-actin)为内参基因。β-actin是细胞的一种重要骨架蛋白,在不同物种之间高度保守。因此在进行半定量RT-PCR时,选择管家基因可以通过计算目的基因和内参的比值,得到基因表达的相对浓度。根据Genebank已发表的β-actin基因序列(登录号:U07786)设计引物,引物序列见表1。

表1 PERV-env基因和β-actin基因引物序列
1.4 RNA的制备及含量测定
总RNA的制备:按Trizol 试剂盒说明书进行操作,提取巴马小型猪各种组织及外周血白细胞的总RNA,取5 μL按一定的倍数稀释,以紫外分光光度计检测总RNA纯度并进行RNA含量的测定。总RNA含量计算方法:(A260× 核酸稀释倍数 × 40)/1000,单位为 μg/μL。提取的总RNA储存于-80℃备用。
1.5 cDNA的合成
分别取巴马小型猪各个组织提取的总RNA 2 μg,分别加到1.5 mL EP管中,然后各加1 μL的Olige(dT)17(50 pmol/μL)混匀,再加无RNA酶水至15 μL,于PCR仪中70℃ 变性5 min后,迅速冰浴2 min。短暂离心后再加入5× buffer 5 μL、dNTP (2.5 mmol/L) 4 μL、RNasin 0.5 μL、M-MULV 0.5 μL。于PCR仪中42℃作用 1 h 后,70℃15 min灭活反转录酶。再加入1μL RNase H (2U/μL) 37℃消化20 min,立即使用或-20℃保存备用。
1.6 PCR扩增
1.6.1 PERV-env全基因扩增及分析: 参照文献[3]的方法,利用PERV-env全基因引物,从巴马小型猪外周血白细胞中扩增PERV-env全基因。具体扩增条件为:94℃ 5 min,94℃30 s、56℃ 30 s、72℃ 2 min循环35次,最后72℃延伸10 min。扩增产物经克隆后送北京奥科生物有限公司测序。测序结果登录GenBank并与国内外已发表的PERV-env 全基因序列进行同源性及遗传进化分析。
1.6.2 PERV-env部分基因及β-actin基因的扩增:
1.6.2.1 PCR反应条件:PERV-env部分基因与β-actin基因PCR反应条件为: 0.5 μL cDNA模板,0.25 μL Taq酶,上、下游引物各0.25 μL(50 pmol),dNTP (2.5 mmol/L each) 1 μL,10× PCR buffer 2.5 μL,MgCl2(25 mmol/L) 1.5 μL,最后加无RNA酶水至25 μL。将上述各成分置PCR 管混匀后于PCR仪上进行反应,反应程序: 94℃ 4 min; 94℃ 30 s,退火温度45 s(温度待定),72℃ 30 s;72℃ 5 min。PCR产物以1.0%琼脂糖凝胶电泳检测。
1.6.2.2 最佳Mg2+浓度的确定:在其它条件相同的情况下,观察Mg2 +终浓度在1.0、1.25、1.5、1.75、2.0 mmol/L 的情况下,PCR扩增结果。根据其亮度和特异性,确定适宜的MgCl2浓度。
1.6.2.3 PCR扩增最佳循环数的确定:循环次数决定PCR扩增程度。在其它条件相同的情况下,观察PERV-env部分基因在循环数为:26、28、30、32、34;β-actin基因在循环数为22、24、26、28、30时PCR 扩增结果。根据其亮度确定适宜的PCR扩增循环数。
1.7 电泳图片的获得和定量分析
将PCR产物按常规方法电泳,经凝胶成像仪拍照后,用定量分析软件UN-SCAN-IT分别测定目的基因片段OD值和内参β-actin基因片段A值。以待测目的基因片段实测A值/β-actin基因片段实测A值的比值,代表目的基因片段mRNA的相对含量。每个反应重复3次,然后用SAS软件对数据进行统计分析。
目的基因mRNA相对含量=
2 结果
2.1 PERV-env全基因扩增及分析结果
通过RT-PCR从巴马小型猪外周血白细胞中扩增得到长度约2 000 bp的片段,将该片段克隆、测序,结果获得的广西巴马小型猪PERV-env全长基因大小为1 983 bp,编码660 aa,GenBank登录号为:EU086225。将该毒株序列与国外AF417232(美国)、AY534306(德国)、EU789636(俄国)、LC03396(日本)、HQ540591(韩国)、AJ288588(法国)、AF014162(英国)及国内AY751803(中国版纳小型猪)、AF507940(中国实验小型猪)、AY850198(中国五指山小型猪)进行同源性比较,结果同源性在75.7-99.3之间,与法国毒株同源性最低,与中国实验小型猪及韩国毒株同源性最高,与国内五指山猪PERV及版纳猪PERV的同源性分别为96.2和95.4。遗传进化分析亦可看出巴马小型猪PERV与中国实验小型猪及韩国毒株位于同一簇(图1)。由此看出要想较准确的测定广西巴马小型猪PERV组织表达谱,应该选用来自广西巴马小型猪PERV-env基因序列设计引物。
2.2 半定量RT-PCR反应条件的筛选
2.2.1 内参基因β-actin及目的基因PERV-env退火温度的确定 :β-actin基因扩增片段大小为447 bp,经测序证实扩增得到的基因序列与参考序列同源性为99%。按方法1.6.2.1,选择了58℃、60℃、62℃、64℃等4个退火温度,经PCR反应后,通过测定目的片段的净灰度,确定其最佳退火温度为64℃(图2A)。按同样的方法,PERV-env部分基因PCR扩增片段大小约265 bp,通过测定目的片段的净灰度,确定其最佳退火温度为58℃(图2B)。
2.2.2 Mg2+浓度对PERV-env部分基因和β-actin扩增效率的影响 :扩增结果显示:PERV-env部分基因和β-actin基因在Mg2+浓度为1.0、1.25、1.5和2.0 mmol/L时PCR扩增效率均过低,只有在1.75 mmol/L 时PCR的特异性和扩增效率良好(图3 A;B)。
2.2.3 PCR扩增循环数对PERV-env部分基因和β-actin扩增产物的影响:试验结果显示目的基因PERV-env和内参β-actin PCR产物量均随着PCR循环数的增加而增强(图4A,B),说明PCR反应均未达到反应的平台期。为避免平台效应的影响,选择扩增反应在到达平台期前的线性范围内且电泳条带清晰的相应循环数作为PCR反应最佳循环数。
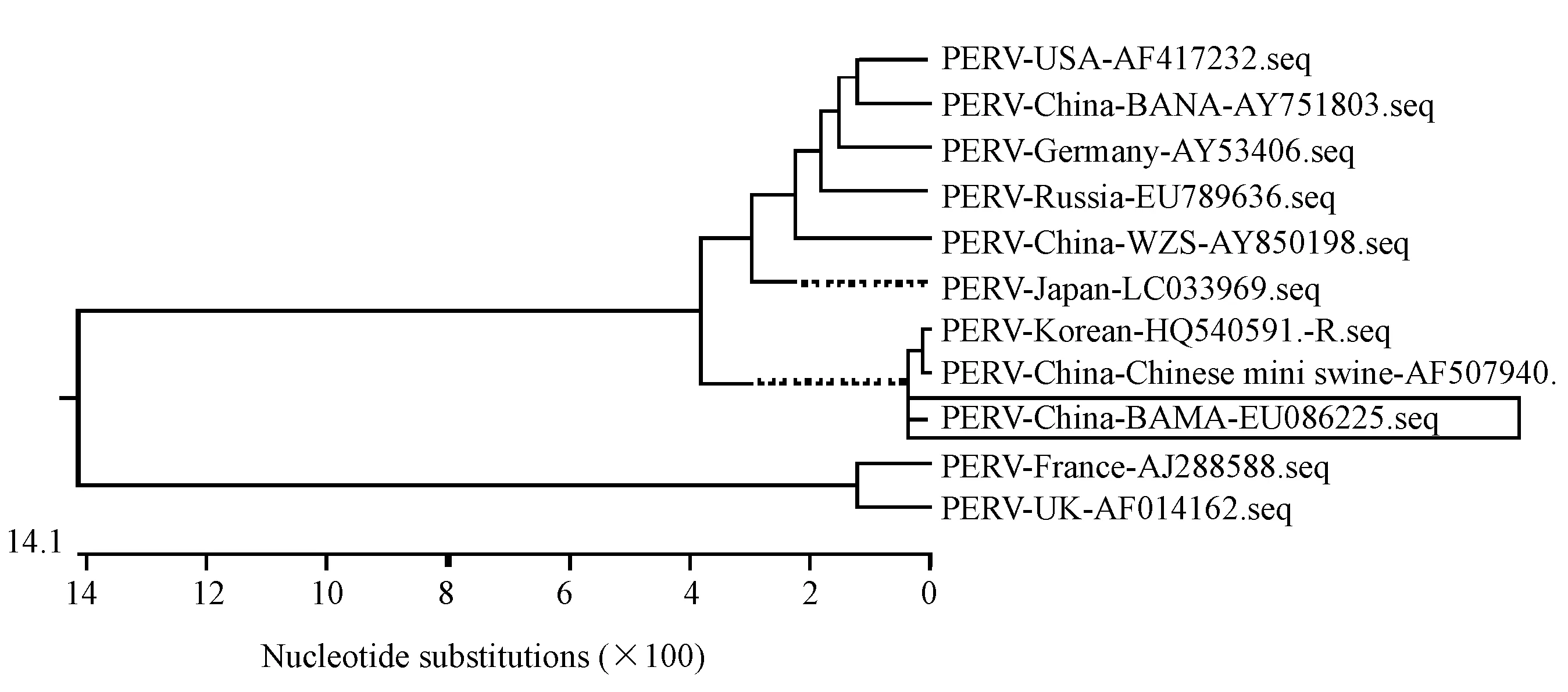
图1 巴马小型猪PERV-env基因遗传进化树分析Fig.1 Phylogentic analysis of PERV-env genes in the Bama minipigs
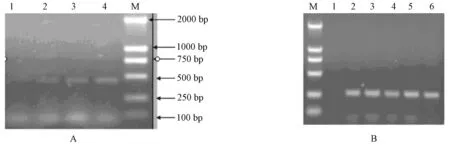
A:β-actin基因; B: PERV-env部分基因图A泳道:1. 58℃;2. 60℃;3. 62℃;4. 64℃;M. DL-2000 DNA marker图B泳道:M. DL-2000 DNA marker;1. 54℃;2. 56℃;3. 58℃;4. 60℃;5. 62℃,6. 64℃图2 不同退火温度下β-actin基因及PERV-env部分基因扩增结果A:β-actin:1. 58℃;2. 60℃;3. 62℃;4. 64℃;M. DL-2000 DNA marker.B:PERV-env:M. DL-2000 DNA marker;1. 54℃;2. 56℃;3. 58℃;4. 60℃;5. 62℃;6. 64℃.Fig.2 Amplification products of β-actin and PERV-env at different annealing temperatures

A:PERV-env部分基因;B:β-actin基因图A、图B泳道(相同):1. 1.0 mmol/L;2. 1.25 mmol/L;3. 1.5 mmol/L;4. 1.75 mmol/L;5. 2.0 mmol/L图3 不同Mg2+浓度对PERV-env部分基因和 β-actin基因扩增效率的分析Note. A:PERV-env; B:β-actin. 1. 1.0 mmol/L; 2. 1.25 mmol/L; 3. 1.5 mmol/L; 4. 1.75 mmol/L; 5. 2.0 mmol/L.Fig.3 Analysis of amplification efficiency of PERV-env and β-actin with different Mg2+ concentration
本试验选取30个循环作为待测PERV-env基因的最佳循环数;而选取28个循环为内参β-actin基因最佳循环数。
2.3 以β-actin为内参对PERV-env部分基因定量测定
以β-actin为内参,采用双管法对不同组织样品进行半定量RT-PCR分析,分别测定各自PCR产物电泳条带的OD值,每个反应重复3次取均值,经计算各个组织mRNA相对含量分别为:肝脏:0.85;心脏:0.90;胰腺:0.70;肾脏:1.31;脾脏:0.89;胸腺:0.86;肺:0.85;卵巢:0.84;外周血:1.28。以SAS软件统计分析结果表明PERV-env在mRNA上述组织中均有表达,但在不同组织中表达存在明显差异,肾脏和外周血白细胞表达丰度最高(P<0.05),胰腺的表达丰度最低,其它组织表达丰度差异无显著性(P>0.05)。
3 讨论

A:PERV-env部分基因;B:β-actin基因图A泳道:1. 34循环;2. 32循环;3. 30循环;4. 28循环;5. 26循环图B泳道:1. 22循环;2. 24循环;3. 26循环;4. 28循环;5. 30循环图4 不同循环数对PERV-env部分基因及 β-actin扩增效率影响Note. A:PERV-env:1. 34 cycles; 2. 32 cycles; 3. 30 cycles; 4. 28 cycles; 5. 26 cycles.B:β-actin:1. 22 cycles; 2. 24 cycles; 3. 26 cycles; 4. 28 cycles ; 5. 30 cycles.Fig.4 Effects of different cycles on the amplification efficiency of PERV-env partial gene and β-actin.
目前用于定量分析mRNA表达量主要方法有:半定量RT-PCR、Northern印迹杂交、cDNA微阵列和寡聚核苷酸微阵列技术以及目前发展迅速的实时荧光定量PCR等。后几种方法特异性好、具有较高的敏感性和准确性,但是成本高,对仪器设备和样品处理要求高且步骤繁琐。半定量RT-PCR以其简单、快速、方便、可同时测定几个基因且所需费用低、普通实验室均可开展等优点而被广泛应用。但利用半定量RT-PCR法分析基因表达水平的影响因素较多,要提高半定量RT-PCR法的准确性,最关键的是优化试验条件。首先必须选择一个表达稳定的基因作为参照,如常用的有GAPDH、β-actin、18S等;其次所提的mRNA纯度要高,完整性要好并达到一定的浓度,以紫外分光光度计测定,其吸光度值A260/A280在1.8~2.0 时,符合实验要求。在优化试验条件中,选择合适的循环数是PCR 半定量方法的关键因素,但它必须在指数内进行PCR扩增,保证产物与循环数呈线性关系。此外合适的退火温度与Mg2+浓度也会对试验结果造成影响。
自从发现PERV对异种移植存在潜在的病毒生物安全性以来,寻找无PERV或低拷贝PERV的小型猪,开展小型猪中内源性反转录病毒的存在状况调查及其潜在的危害性的研究一直是研究的热点[4-6]。目前的研究发现PERV在不同的猪种之间负载不平衡,不同猪种携带PERV亚型也不尽相同[7,8]。虽然PERV在肾、肝、脾、肺、胸腺、胰腺、卵巢、脑神经、外周血白细胞及内皮细胞等组织均有表达,但表达的拷贝数有差异。靳二辉[9]采用RT-PCR技术对近交系五指山小型猪15种组织内PERV的表达情况进行了检测,发现PERV在心脏、肝脏、肾脏表达较弱,在免疫组织表达较强。因此检测PERV mRNA在不同猪种、不同组织中的表达情况对医学实验用猪的挑选及猪—人异种器官移植均具有重要意义。在进行猪—人异种移植时,可以选用病毒负载较低组织作为供体,可以降低异体移植潜在的危险性。
本试验采用半定量RT-PCR方法,首次对PERV-env mRNA在巴马小型猪各个组织中表达量进行测定。结果发现在所采集的十个组织样品中均可以检测到PERV-env mRNA的表达。SAS软件统计分析结果表明,肾、外周血白细胞中PERV表达丰度最高,肺、心、肝、脾、胸腺、卵巢次之,胰腺中PERV表达丰度最低。肺、心、肝、脾、胸腺、卵巢表达丰度差异不显著(P>0.05),这与国内外的研究结果基本一致[10,11]。
关于选择PERV低拷贝猪及PERV表达丰度较低的器官进行异种移植,以降低其潜在的危害性问题学者们进行了大量研究。Patience 等[1]在1997年首先提出PERV5′端或部分结构基因的缺失会造成部分拷贝失去转录活性和功能,因此并不是所有的拷贝都具有感染活性。然而,PERV各基因可以通过互补或重组产生具有生物活性的病毒颗粒,因此可以通过选择性育种降PERV的拷贝数以达到降低异种移植风险的目的。Clemenceau等[10]在1999年通过试验发现,猪胰岛细胞和脑神经细胞所含PERV前病毒的负荷相对较低,认为进行猪胰岛细胞和脑神经细胞异种移植发生PERV感染的潜在危险性可能要比移植猪肾、肝等器官要小。最近,国际异种器官移植协会发表了一份联合声明,启动在上个世纪九十年代被停止的猪胰岛产品在1型糖尿病治疗方面的临床试验, 重新评价胰岛在异种移植方面的安全性[12]。总之,在未来的5到10年,在适当的指导和监管控制下,猪的胰岛异种移植材料被认为是一种可行的手段,解决临床上胰岛远远不能满足需求的问题[13]。本研究发现巴马小型猪胰腺中PERV表达丰度最低,可初步认为以巴马小型猪胰岛细胞进行异种移植发生PERV感染的潜在危险性可能要低于其它器官。由于本实验所用动物个体数量有限,只得出了初步的结论,还需要做更多细致的工作。
[1] Patience C, Takeuchi Y, Weiss RA. Infection of human cells by an endogenous retrovirus of pigs [J]. Nat Med, 1997, 3(3): 282-286.
[2] Takeuchi Y, Patience C, Magre S, et al. Host range and interference studies of three classes of pig endogenous retrovirus [J]. J Virol, 1998, 72: 9986-9991.
[3] 吴健敏,吕茂民,陈凤莲,等.中国特有小型猪内源性反转录病毒囊膜基因的克隆及进化分析 [J].中国人兽共患病学报, 2006, 22 (10): 925-928.
[4] Ma Y, Yang Y, Lv M, et al. Real-time quantitative polymerase chain reaction with SYBR green I detection for estimating copy numbers of porcine endogenous retrovirus from Chinese miniature pigs [J].Transplant Proc, 2008, 28(3): 160-163.
[5] 李金泽, 岳敏, 张建明,等. 四种小型猪内源性逆转录病毒基因研究 [J]. 实验动物与比较医学, 2008, 28(3): 160-163.
[6] 连正兴, C. Rogel-Gaillard, 李宁, 等. 利用半定量PCR方法分析中国地方猪种内源病毒序列拷贝数的多态性 [J]. 畜牧兽医学报, 2002, 33(6): 521-524.
[7] Heneine W, Tibell A, Switzer WM, et al. No evidence of infection with porcine endogenous retrovirus in recipients of porcine islet-cell xenografts [J]. Lancet, 1998, 352(9129): 695-699.
[8] Blusch JH, Roos C, Nitschko H. A polymerase chain reaction-based protocol for the detection of transmission of pig endogenous retroviruses in pig to human xenotransplantation [J]. Transplantation, 2000, 69(10): 2167-2172.
[9] 靳二辉. 近交系五指山小型猪解剖和组织学研究及内源性反转录病毒(PERV)的检测 [D]. 华中农业大学, 2008.
[10] Clemenceau B, Lalain S, Martignat L, et al. Porcine endogenous retroviral mRNA in pancreas and a panel of tissues from specific pathogen free pig [J]. Diabetes Metab,1999, 25(6): 518-525.
[11] 丁生财,陈意生,魏私,等. PERV在猪外周血白细胞DNA和组织mRNA中的表达及其差异性分析 [J]. 实验生物学报,2004, 37(5): 351-358.
[12] Matsumoto S,Tomiya M, Sawamoto O. Current status and future of clinical islet xenotransplantation [J]. J Diabetes. 2016, 10: 1753-0407.
[13] Spizzo T, Denner J, Gazda L, et al. First update of the International Xenotransplantation Association consensus statement on conditions for undertaking clinical trials of porcine islet products in type 1 diabetes — Chapter 2a: source pigs-preventing xenozoonoses [J]. Xenotransplantation, 2016, 23(1): 25-31.
Cloning of PERV-env in GXBM minipig and analysis of its tissue expression profile
ZHONG Hua1,PAN Han-shi2,MA Ling2, LONG Han1, CHEN Feng-lian2, LIAO Yan-juan1, TANG Hai-bo2, WU Jian-min2
(School of Marine Sciences and Biotechnology, Guangxi University for Nationalities, Nanning 53001, China; 2. Guangxi Key Laboratory of Veterinary Biotechnology, Guangxi Veterinary Research Institute, Nanning 53001 )
Objective To clone partial env genes of porcine endogenous retrovirus (PERV) isolated from Guangxi Bama minipigs and study their expression differences in different organ tissues. Method The PERV-env genes from peripheral blood leukocytes of Bama minipigs were amplified by RT-PCR, and their homology and phylogenetic analysis were compared with those of some other PERV-env genes published home and abroad. The PERV-env genes obtained by amplification from Bama minipig were used as templates to design primers for analysis on the expressions of PERV mRNA in different tissues of the Bama minipig with a semi-quantitative RT-PCR analysis. Result Differences in the expression levels of PERV mRNA were detected in nine organ tissues of Bama minipig, in which the abundance of PERV mRNA in kidney and peripheral blood lymphocytes was the highest, followed by that in lung, heart, liver, spleen, thymus and ovary, but the expression differences among the six organs were not significant (P>0.05), while the expression abundance of PERV mRNA in pancreas was the lowest. Conclusions The potential risk of PERV infection in using the islet cells of Bama mini pig for xenotransplantation is probably lower than using the other organs. However, further research is still needed.
Bama minipig; PERV-env genes; Semi-quantitative RT-PCR; Tissue expression profile; Xenotransplantation
国家自然科学基金(31260613);广西自然科学基金(2013GXNSFBA019123); 广西兽医生物技术重点实验室开放基金(12-071-28-B-3)。
钟华(1981-),女,硕士,助理研究员,研究方向:生物化学与分子生物学。Email: 17737290@qq.com。
吴健敏(1963-),女,研究员,博士生导师,研究生方向:动物传染病与分子免疫学。E-mail: wu-jm20@163.com。
R-33
A
1671-7856(2017) 02-0001-06
10.3969.j.issn.1671-7856. 2017.02.001
2016-08-05
