水温改变对斑马鱼脊髓损伤修复的影响
2017-03-13李强郑苏林冯瑜菲杨振国张晶晶
李强,郑苏林,冯瑜菲,杨振国,张晶晶
(广东医科大学附属医院,广东 湛江 524001)
研究报告
水温改变对斑马鱼脊髓损伤修复的影响
李强#,郑苏林#,冯瑜菲,杨振国,张晶晶*
(广东医科大学附属医院,广东 湛江 524001)
目的 利用斑马鱼脊髓损伤模型,研究水温改变对脊髓损伤修复的影响,并检测在脊髓修复过程中,损伤处细胞数目以及脑内相关基因表达的变化情况。方法 利用手术构建斑马鱼脊髓损伤模型;通过改变斑马鱼生活的水温来观察其脊髓损伤后游动能力的变化情况;用振动切片技术及免疫组织化学观察脊髓损伤处不同时间点细胞数目的改变情况;实时荧光定量PCR法分析脑内相关基因gdnf、nos的表达差异。结果 28℃、30℃、32℃水温均不会导致未手术组与假手术组斑马鱼游动能力的改变(P>0.05);32℃水温环境能够使脊髓损伤组斑马鱼比28℃、30℃水温环境的斑马鱼恢复游动的能力明显增强(P<0.05)。脊髓切片染色实验结果显示,脊髓损伤后损伤处细胞数目明显增多(P<0.05)。相同时间点,水温为32℃比28℃、30℃细胞数目增多更加明显(P<0.05)。实时荧光定量实验,gdnf基因在脊髓损伤术后与对照组相比在24 h、7 d、14 d均明显升高(P<0.05);nos基因在脊髓损伤术后24 h明显升高(P<0.05),7 d时与相同时间点假手术组相比无明显差异(P>0.05),而14 d时与相同时间点假手术组相比明显降低(P<0.05)。结论 适当提高水环境温度可促进斑马鱼脊髓损伤后恢复。
脊髓损伤;水疗;斑马鱼;gdnf;nos
脊髓损伤(spinal cord injury,SCI)是指由于外界直接或间接因素损伤脊髓,造成损伤节段以下躯体运动、感觉及自主神经功能障碍[1-3]。脊髓损伤后,首先是脊髓的连续性及完整性遭到破坏,导致神经传导功能中断,损伤后脊髓灰质和白质出血、水肿、血管活性物质释放,导致血栓形成和微血管痉挛。同时,缺氧、炎症、细胞内外钙离子失衡、自由基产生过多、兴奋性氨基酸和细胞毒性物质释放等继发性病理改变进一步加重神经细胞坏死[4-7]。脊髓损伤急性期后进入修复期,由于神经细胞不可再生,胶质细胞增殖、分裂填补死亡的神经细胞,形成胶质瘢痕,最终导致神经功能永久丧失。在修复过程中,胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor, GDNF)和一氧化氮(NO)对神经损伤修复具有重要影响[8-11]。
脊髓损伤治疗主要包括急性期治疗和康复期治疗。急性期治疗主要应用脱水剂、类固醇制剂、促进神经再生药物、抗氧化药和自由基清除剂等药物,减轻或消除脊髓损伤性水肿,改善血供,保护神经元,促进神经修复,从而改善脊髓损伤患者的神经功能。而康复期治疗主要是促进肢体肌力、肌张力恢复,从而提高患者生活、工作和回归社会的能力。水疗(aquatic therapy)是康复治疗中的一种新兴手段,它是利用水的不同因素(如水温、水流速度等)作用于机体全身或局部,促进肢体功能恢复,从而减轻患者脊髓损伤后遗症。
斑马鱼(zebrafish)是一种水生鱼类,其基因组与人类基因同源性高达87%,是研究人类疾病的理想动物模型。斑马鱼具有非凡的组织再生能力,如视网膜、肝脏、心脏及视神经等[12-15]。众多研究显示斑马鱼脊髓损伤后显示出了强大的神经修复能力,使其成为研究脊髓损伤的理想动物模型[16,17]。同时,其生活环境依赖于水,因此便于通过改变水环境各因素来观察脊髓损伤康复情况。
本文通过建立斑马鱼脊髓损伤模型,并应用于不同水温环境,研究水温对斑马鱼脊髓损伤恢复的影响。同时观察斑马鱼脊髓损伤处细胞的变化情况,并检测在神经恢复过程中,脑内gdnf和nos基因的表达情况。
1 材料与方法
1.1 实验动物与分组
本实验所用动物为4~6月龄成年AB系斑马鱼,体长2~4 cm,由广东医科大学附属医院临床研究中心斑马鱼平台提供,斑马鱼的饲养和实验均严格按照《广东省实验动物管理条例》的标准及广东医科大学实验动物伦理委员会的审批要求进行。术前斑马鱼集中养殖于28℃水环境中, 每天给予14 h光照和10 h无光照。将成年斑马鱼随机分为未损伤组、假手术组和脊髓损伤组。术后分别养殖于28℃、30℃、32℃水环境中,每尾鱼置于单独鱼缸中,每日给予14 h光照和10 h无光照,换水1次,喂食2次。在脊髓切片免疫荧光实验中,观察各条件组在脊髓损伤后24 h、7 d、14 d时损伤处细胞的变化情况。在实时荧光定量 PCR 实验中,假手术组与脊髓损伤组分别于术后24 h、7 d、14 d时取全脑存于-80℃保存备用。
1.2 脊髓损伤动物模型制备
参照Schachner研究小组[18]的方法制作斑马鱼脊髓损伤模型。术前使用0.033% 3-氨基苯甲酸乙酯甲基磺酸盐 (MS 222, Sigma-Aldrich)麻醉30 s~2 min,待斑马鱼呼吸停止后,转移至过滤纸上,并保持头向左侧的平卧位。在体视显微镜(SMZ-161-BLED, Motic, China)视野下,以鳃盖后缘和背鳍连线的中点为手术点,去除鱼鳞(约4片)后,用眼科剪沿手术点纵行剪开皮肤(约2 mm),再用眼科镊逐层钝性分离皮下组织及肌肉层,直至暴露脊髓。手术组用眼科剪切断脊髓;假手术组仅暴露而不切断脊髓。手术完成后,用组织粘合剂(B. Braun, Melsungen, Germany)封闭伤口。SCI 手术成功标志:手术时在显微镜下能够看到脊髓完全横断的截面, 并且术后 3 d 斑马鱼无游泳能力, 同时体型保持直线型。
1.3 脊髓切片及免疫组织化学染色
手术取斑马鱼脊髓手术截断点前、后两端脊髓各约0.5 mm处组织,用4%多聚甲醛4℃固定6~8 h,再用4%低熔点琼脂包埋,用振动切片机(Leica VT1000S, Germany)将脊髓组织水平切片,每个样本收集5张切片,厚度90 μm,用DAPI(1∶1000;Sigma)和罗丹明(1∶500;Invitrogen)于室温染色2 h,最后封片并用激光共聚焦显微镜(Leica TCS SPS II,Germany)观察拍照。
1.4 实时荧光定量PCR
1.4.1 基因组总 RNA 的提取及 cDNA的合成
参照Trizol®reagent (Invitrogen,USA)说明书提取斑马鱼大脑总RNA, -80℃储存备用。将提取RNA 用反转录试剂盒(PrimeScriptTMRT reageng Kit,TaKaRa,Dalian)反转录合成 cDNA。
1.4.2 引物设计
根据 NCBI网站中gdnf、nos及内参基因gapdh的mRNA序列并结合斑马鱼全基因组测序公布的序列(gdnfGenBank 登录号:BC150163.1,神经系统nosGenBank 登录号:AF219519.1,gapdhGenBank登录号:NM_213094.2),利用Primer premier 5.0设计引物。引物序列如表1所示。
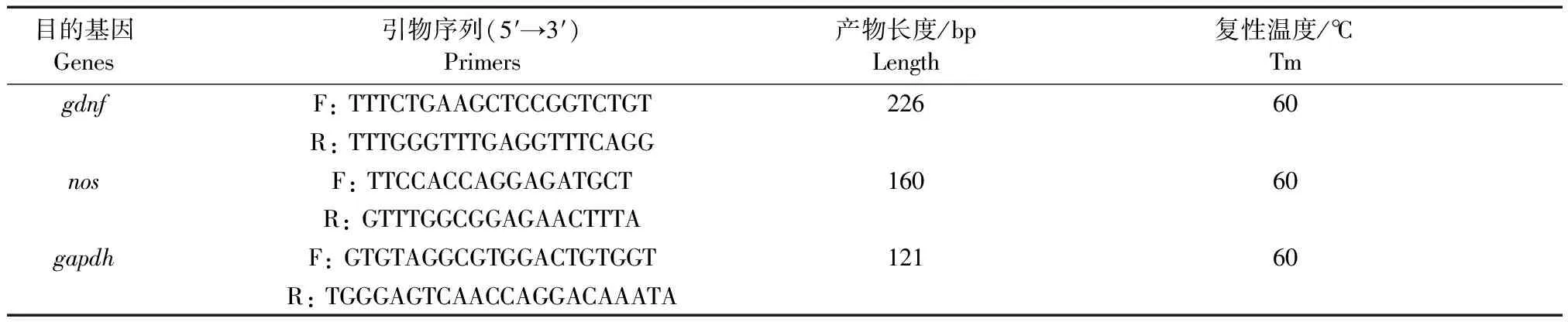
表1 实时荧光定量PCR引物合成表
1.4.3 PCR 扩增体系和条件
采用实时荧光定量 PCR 技术对斑马鱼脊髓损伤后不同时间点各个基因表达量进行相对定量分析。荧光染料为SYBR Green I (SYBR© Premix Ex TaqTMII,TaKaRa,Dalian),以gapdh作为内参基因,反应体系总体积为 20 μL, 包括:SYBR 10 μL,ddH2O 6.4 μL,上、下游引物(F、R) (10 μmol/L)各 0.8 μL,模板 2 μL。反应条件:95℃预变性 30 s;95℃变性 5 s, 60℃,退火/延伸30 s,40个循环;融解曲线95℃ 5 s ,60℃ 1 min,95℃, 1个循环。由Roche LightCycler480 II型荧光定量 PCR 仪收集荧光信号。每个待测样品设置 3 个重复, 对得到的 3 个 Ct 值取平均值, 用2-ΔΔCt[19]法进行计算。1.5 数据收集
2 结果与分析
2.1 行为学结果
实验证实,在水温28 ℃时,未手术组与假手术组相比较,斑马鱼在1周时5 min内游动距离分别为(1206±84) cm和(1184±83) cm,两者之间差异无显著性(P>0.05),且在1、2、4、6、8周时,未手术组与假手术组组内及组间均无差异(P>0.05)。在室温30℃时,未手术组与假手术组斑马鱼在1周时其5 min内游动距离分别为(1185±108) cm和(1155±133) cm,两者之间差异无显著性(P>0.05)。且分别在1、2、4、6、8周比较,组内及组间差异均无显著性(P>0.05)。在室温32℃时,未手术组与假手术组斑马鱼在1周时其5 min内游动距离分别为(1199±85) cm和(1175±106) cm,两者之间差异无显著性(P>0.05),且分别在1、2、4、6、8周比较,组内及组间差异均无显著性(P> 0.05)。同时,将30℃和32℃的未手术及假手术组斑马鱼同28℃时的对应时间点相比较,各组内、组间差异均无显著性(P>0.05)(图1)。

注:水环境温度升高至30 ℃、32 ℃时,不会对未手术组斑马鱼和假手术组斑马鱼游动能力产生影响。实验数据以平均数 ± 标准差 ± s )表示,采用单因素方差分析,每组有9尾斑马鱼。non-injury:未手术组斑马鱼;sham:假手术组斑马鱼。 图1 未手术组及假手术组斑马鱼的游动能力Note. The water temperature changed from 28℃ to 32℃ did not affect the swimming ability of the zebrafish of the non-injury and sham-injury groups. Data are mean±standard deviation (SD). One-way ANOVA was used for statistical analysis. Fig.1 Swimming ability of the zebrafish in the sham-injury and non-injury groups.
斑马鱼脊髓损伤后,其游动能力明显减弱。在水温 28℃、术后1周时,其5 min内游动距离为(83±11) cm,仅相当于对应时间点假手术组斑马鱼游泳距离7%。术后2、4、6、8周游动距离分别为(174± 28)、(471±78)、(606±34)、(713±30) cm,至第8周末,手术组斑马鱼游动能力逐渐恢复了62 %。在水温30℃时,术后1、2、4、6、8周其5 min内游动距离分别为(101 ±30)、(188±60)、(480±89)、(724±92)、(801±82) cm。在水温32℃时,术后1、2、4、6、8周其5 min内游动距离分别为(102±24)、(238±92)、(560±102)、(740±74)、(838±149) cm,第8周末时,手术组斑马鱼游动能力恢复了70 %,与水温28℃和30℃相同时间点比较,其恢复能力明显增强(P<0.05)(图2)。
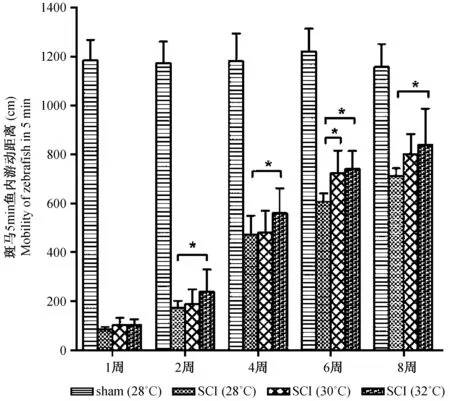
注:斑马鱼脊髓损伤后,游动能力明显减弱,随后逐渐恢复。水温32℃比30℃、28℃恢复能力明显增加(P<0.05)。实验数据以平均数 ± 标准差 ± s )表示,采用单因素方差分析,每组有9尾斑马鱼。*(P<0.05)代表与水温为28℃组差异有显著性。sham:假手术组斑马鱼;SCI:脊髓损伤组斑马鱼。图2 脊髓损伤组斑马鱼的游动能力Note. The swimming ability recovers at post spinal cord injury. At 32℃, the swimming ability recovers faster than at 28℃ or at 30℃. Data are mean±standard eviation (SD). One-way ANOVA was used for statistical analysis. n=9.*P< 0.05 means it is significantly different compared with the 28℃ water temperature group. sham: sham-injury; SCI: spinal cord injury.Fig.2 Mean swimming distances for 5 min of the zebrafish at 8 weeks after spinal cord injury.
2.2 斑马鱼脊髓损伤后细胞数量变化情况
实验证实,与对应时间点假手术组相比,脊髓损伤组斑马鱼在术后24 h损伤处细胞数开始增多,但各条件组差异无显著性(P>0.05)。术后1周,脊髓损伤处细胞明显增多,与对应时间点假手术组相比,差异有显著性(P<0.05);且水温32℃时的细胞数较28℃增多明显(P<0.05)。术后14 d,损伤处细胞数进一步增多,与对应时间点假手术组相比,差异均有显著性(P<0.05),且水温32℃时的脊髓损伤处细胞数与28℃、30℃相比,差异有显著性(P<0.05),提示脊髓在修复期细胞总数明显增多,且适当提高水温对脊髓修复具有促进作用(图3、4)。
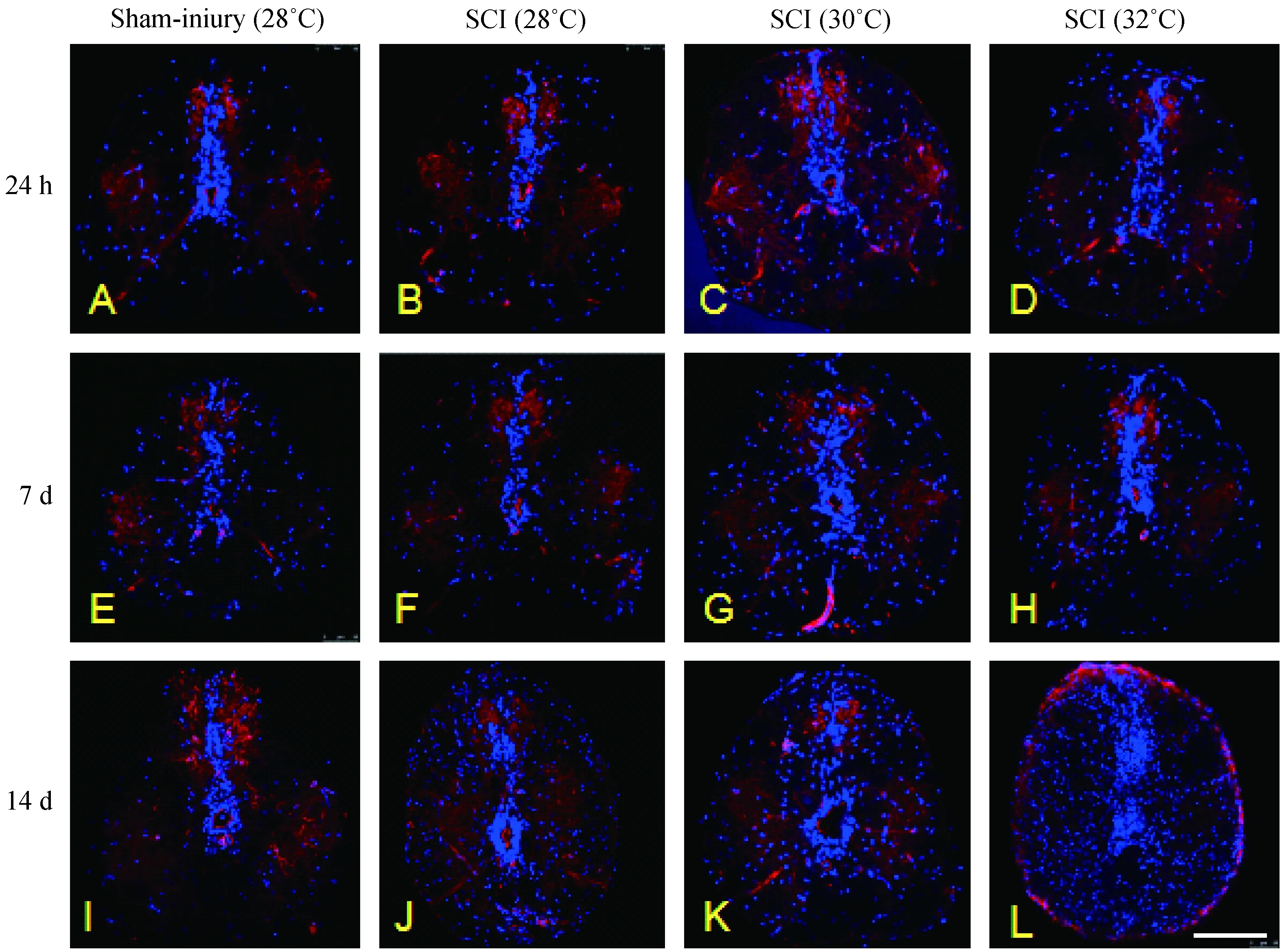
注:斑马鱼脊髓损伤后,损伤处细胞数目明显增多。与28℃、30℃相比,32℃时细胞数目增加更加明显。sham-injury:假手术组;SCI:脊髓损伤组;红色:细胞间质;蓝色:细胞核。图3 脊髓损伤后细胞数量的变化情况(标尺=100 μm)Note. The cell proliferation increases obviously following spinal cord injury. The proliferation of cells surrounding the injured spinal cord was stronger in SCI fish incubated in 32℃water than in 28℃ or 30℃ water. SCI: spinal cord injury. Red: rhodamine phalloidin for F-actin staining; Blue: DAPi for nuclear staining.Fig.3 Changes of cell amount following spinal cord injury (Bar=100 μm, ×40).
2.3gdnf、nos基因在脊髓损伤修复过程中表达量的变化
2.3.1gdnf基因的表达变化
实验证实, 与对应时间点假手术组相比,脊髓损伤手术后 24 h, 三组不同水温条件斑马鱼gdnf基因在脑中表达量均升高(P<0.05);术后7 d, 在水温为28℃、30℃时,gdnf基因在斑马鱼脑中的表达量大约是同时间点假手术组的4.5倍(P<0.05),而在水温32℃时,gdnf基因在斑马鱼脑中的表达量大约是同时间点假手术组的8.5倍(P<0.05);到手术后14 d时,各条件组斑马鱼gdnf基因的表达量下降,但仍维持在较高水平上(P<0.05)(图5)。
2.3.2nos基因的表达变化
实验证实, 与对应时间点的假手术组相比,nos基因的表达在术后 24 h 的斑马鱼脑中明显升高(P<0.05)。在术后7 d,nos基因表达量呈降低趋势,与7 d时假手术组相比,nos表达量未见明显差异(P>0.05)。术后 14 d时,nos基因表达量进一步降低,显著低于 14 d 假手术组nos表达量(P<0.05),提示其在脊髓损伤急性期,脑内nos基因高表达参与炎症反应,而在修复期低表达则促进脊髓修复(图6)。
3 讨论
脊髓损伤(SCI)分为原发性损伤和继发性损伤。继发性损伤往往是脊髓功能难以恢复的主要原因,包括脊髓出血、水肿、炎症反应、细胞内外离子失衡、脂质过氧化等,最终导致神经元和胶质细胞的坏死或凋亡,胶质瘢痕形成、阻碍轴突再生。斑马鱼在脊髓损伤后血-脊髓屏障遭到破坏,炎症细胞渗透到损伤部位,导致大量组织丧失,这些过程发生在损伤后的早期阶段,但持续时间很短[20]。且有研究显示这些早期炎症反应对中枢神经系统神经再生具有促进作用[21-24],可能是急性炎症反应提供了一个有利于神经再生的微环境。在脊髓损伤修复过程中,神经胶质细胞释放许多神经因子如神经生长因子(NGF)、神经营养素-3(NT-3)等均促进神经修复。同时良好的损伤微环境对脊髓损伤后修复也具有重要的作用。本实验研究证实,在脊髓损伤后修复过程中,斑马鱼脑内gdnf较长时间维持较高水平,这表明gdnf基因参与了斑马鱼脊髓损伤修复的病理过程,升高可以促进神经元的再生与分化,改善了神经再生的微环境,更利于神经轴突的修复。而nos在损伤后24 h明显升高,之后逐渐降低,到14 d时则明显低于对照组。这表明nos在损伤早期参与炎症反应,但持续时间短,且很快降低,从而为损伤局部维持了一个利于神经再生与修复的微环境。同时,这也提示我们, 在脊髓损伤后, 不仅应重视损伤处的病理变化, 脑内的病理生理变化亦对神经的再生具有重要影响。

注:实验数据以平均数 ± 标准差±s )表示,采用单因素方差分析,每组有5个样本。*(P<0.05)代表两组比较差异有显著性。Sham:假手术组斑马鱼;SCI:脊髓损伤组斑马鱼。图4 脊髓损伤后细胞增殖数量的变化情况Note. Data are mean±standard deviation (SD). One-way ANOVA is used for statistical analysis. n=5. *(P<0.05) means that it is significantly different between the two groups. sham: sham-injury; SCI: spinal cord injury.Fig.4 Changes of cell number during the proliferation after spinal cord injury.
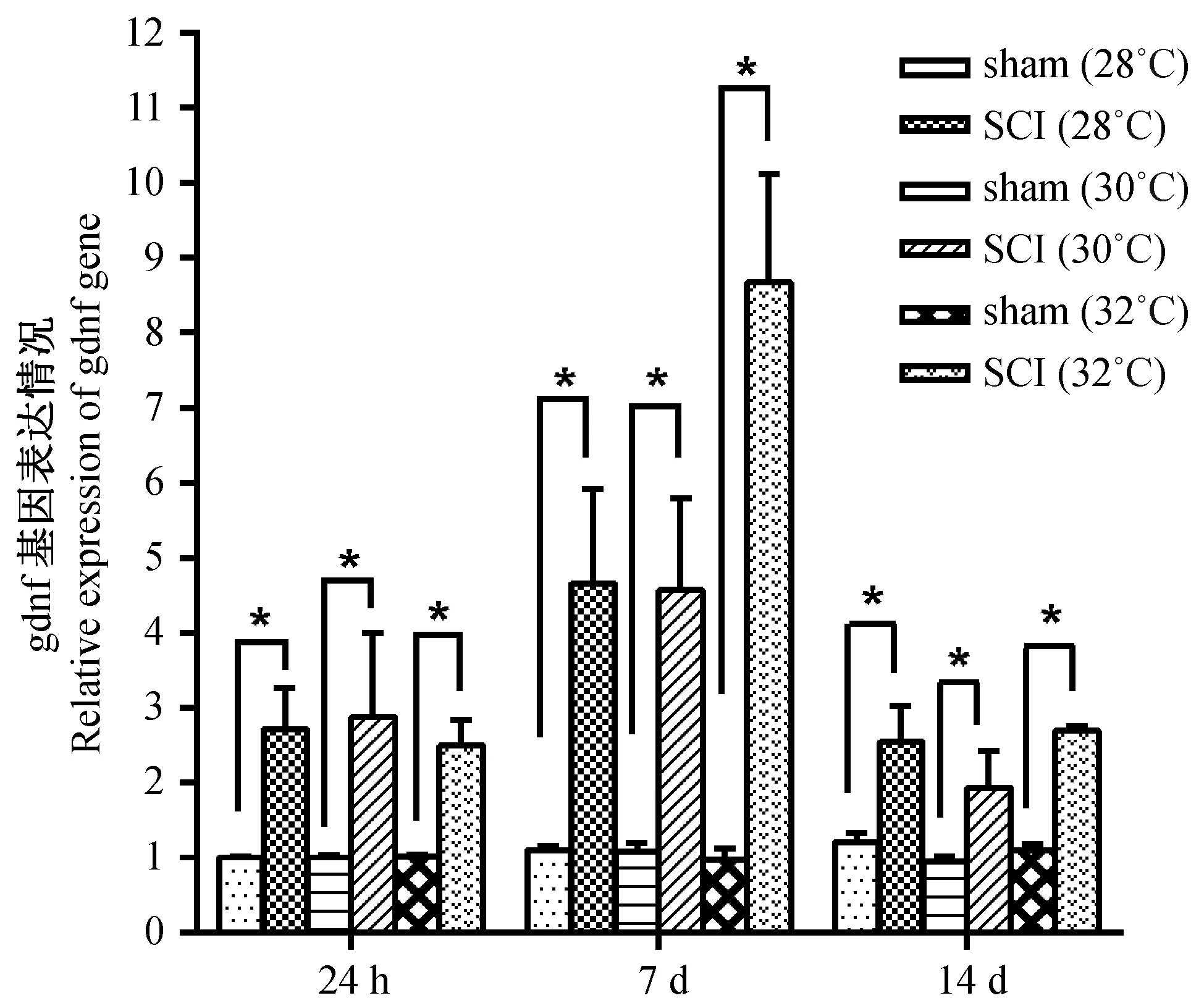
注:实时定量 PCR 显示, 斑马鱼脑中 gdnf 基因表达在脊髓损伤后 24 h、 7 d及 14 d, 与对应时间点的假手术斑马鱼组相比, 表达均出现显著性升高。采用两独立样本t-test,每组实验重复3次,*(P<0.05)代表两组比较差异有显著性。sham:假手术组斑马鱼;SCI:脊髓损伤组斑马鱼。图5 gdnf 基因在斑马鱼脊髓损伤后的表达变化Note. Real-time PCR assay shows that gdnf is up-regulated in all groups post SCI at 24 h, and 7 and 14 days. Student’s t test is used for statistical analysis, each group of experiment is repeated for 3 times.*(P<0.05) means it is significantly different between the two groups. sham: sham-injury; SCI: spinal cord injury.Fig.5 Changes of the expression of gdnf following spinal cord injury

注:实时定量 PCR 显示,与对应时间点的假手术组样本相比,斑马鱼脑中 nos基因表达在脊髓损伤后24 h 显著性升高。脊髓损伤后14 d,斑马鱼脑中 nos 基因表达与假手术组相比出现显著性降低。采用两独立样本t-test,每组实验重复3次,*(P<0.05)代表两组比较差异有显著性。sham: 假手术组斑马鱼;SCI:脊髓损伤组斑马鱼。图6 nos基因在斑马鱼脊髓损伤后的表达变化Note. Real-time PCR assay shows that the nos expression is up-regulated in all groups at 24 h and 7 days after SCI. There is no significant difference between the SCI group and sham-injury group. While after 14 days, the expression of nos is reduced in the SCI group compared with the sham-injury group. Student’s t test is used for statistical analysis, each experiment of the groups is repeated for 3 times. *(P <0.05) means it is significantly different between the two groups. sham: sham-injury; SCI: spinal cord injury.Fig.6 Changes of the expression of nos following spinal cord injury.
在斑马鱼脊髓损伤急性期,各种炎性细胞浸润到损伤处参与炎症反应,局部细胞数目明显增多,此时以红细胞、巨噬细胞、白细胞为主。进入脊髓损伤修复期后,细胞数目进一步增多,而此时则以放射状胶质细胞增多为主。放射状胶质细胞在脊髓损伤修复期逐渐形成胶质桥梁,为轴突形成提高支架,对斑马鱼脊髓损伤修复过程具有非常重要的作用。同时损伤后中央管背腹侧的祖细胞区域被损伤所激活,出现室管膜放射状胶质细胞增生,产生新的运动神经元[25,26]。研究表明,中央管室管膜放射状胶质细胞可能是脊髓运动神经元的祖细胞,其能在不同部位再生不同类型的中间神经元[27]。
水疗是脊髓损伤后治疗的重要手段。其对感觉末梢具有良性刺激,改善血管功能,促进局部和全身循环,松弛并缓解肌肉痉挛。临床研究也显示[28],水疗对促进患者肢体功能恢复具有一定效果。但水疗促进脊髓损伤修复的具体机制仍未明确。本实验利用模式动物斑马鱼研究水温对脊髓损伤修复的影响,且实验证实适当提高水温可促进脊髓修复,为进一步研究水疗促进脊髓修复的具体机制提供依据。
[1] Ward RE, Huang W, Kostusiak M, et al. A characterization of white matter pathology following spinal cord compression injury in the rat [J]. Neuroscience, 2014, 260:227-239.
[2] McEwen ML, Springer JE. Quantification of locomotor recovery following spinal cord contusion in adult rats [J]. J Neurotrauma 2006, 23(11):1632-1653.
[3] Wu Q, Zhang YJ, Gao JY, et al. Aquaporin-4 mitigates retrograde degeneration of rubrospinal neurons by facilitating edema clearance and glial scar formation after spinal cord injury in mice [J]. Mol Neurobiol, 2014, 49 (3):1327-1337.
[4] Donnelly DJ, Popovich PG.Inflammation and its role in neuroprotection,axonal regeneration and functional recovery after spinal cord injury [J]. Exp Neurol, 2008, 209(2): 378-388.
[5] Kwon BK, Tetzlaff W, Grauer JN, et al. Pathophysiology and pharmacologic treatment of acute spinal cord injury [J]. Spine J, 2004, 4(4):451-464.
[6] Dumont RJ, Okonkwo DO, Verma S, et al. Acute spinal cord injury,part I: pathophysiologic mechanisms [J]. Clin Neuropharmacol, 2001, 24(5): 254-264.
[7] Kozlowski P, Raj D, Liu J, et al. Characterizing white matter damage in rat spinal cord with quantitative MRI and histology [J]. J Neurotrauma 2008, 25(6): 653-676.
[8] Mocchetti I, Wrathall JR. Neurotrophic factors in central nervous system trauma[J]. J Neurotrauma, 1995, 12(5):853-870.
[9] Chu TH, Wang L, Guo A, et al. GDNF-treated acellular nerve graft promotes motoneuron axon regeneration after implantation into cervical root avulsed-spinal cord[J]. Neuropathol Appl Neurobiol, 2012,38(7):681-695.
[10] Reid AJ, Terenghi G, Kingham PJ et al. Nerve repair with adipose-derived stem cells protects dorsal root ganglia neurons from apoptosis[J]. Neuroscience, 2011, 199:515-522.
[11] Lee MY, Chen L, Toborek M. Nicotine attenuates iNOS expression and contributes to neuroprotection in a compressive model of spinal cord injury[J]. J Neurosci Res,2009, 87(4): 937-947.
[12] Bernhardt RR, Anzini P, Schachner M,et al. Increased expression of specific recognition molecules by retinal ganglion cells and by optic pathway glia accompanies the successful regeneration of retinal axons in adult zebrafish[J]. J Comp Neurol, 1996, 376(2):253-264.
[13] Sadler KC, Gaur NA, Ukomadu C et al. Liver growth in the embryo and during liver regeneration in zebrafish requires the cell cycle regulator,uhrf1[J]. Proc Natl Acad Sci U S A, 2007,104(5): 1570-1575.
[14] Poss KD, Wilson LG, Keating MT. Heart regeneration in zebrafish[J]. Science, 2002, 298(5601):2188-2190.
[15] Becker CG,Becker T.Repellent guidance of regenerating optic axons by chondroitin sulfate glycosaminoglycans in zebrafish[J].J Neurosci,2002, 22(3):842-853.
[16] Becker CG, Becker T, Schachner M et al. L1.1 is involved in spinal cord regeneration in adult zebrafish[J]. J Neurosci, 2004, 24(36):7837-7842.
[17] Vajn K, Suler K, Oudega M. Temporal profile of endogenous anatomical repair and functional recovery following spinal cord injury in adult zebrafish. PLoS One. 2014, 9(8):e105857.
[18] Fang P, Shen YQ, Schachner M. A Surgery protocol for adult zebrafish spinal cord injury[J].J Genet Genomics. 2012, 39(9):481-487.
[19] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4):402-408.
[20] Hui SP, Dutta A, Ghosh S. Cellular response after crush injury in adult zebrafish spinal cord[J]. Dev Dyn,2010,239(11): 2962-2979.
[21] Kroehne V, Freudenreich D, Brand M et al. Regeneration of the adult zebrafish brain from neurogenic radial glia-type progenitors[J].Development,2011, 138( 22):4831-4841.
[22] Kyritsis N, Iltzsche A, Brand M,et al. Acute inflammation initiates the regenerative response in the adult zebrafish brain[J].Science,2012, 338( 6112):1353-1356.
[23] Kyritsis N, Kizil C, Brand M. Neuroinflammation and central nervous system regeneration in vertebrates[J].Trends Cell Biol, 2014, 24(2): 128-135.
[24] Fang P, Schachner M, Shen YQ,et al. HMGB1 contributes to regeneration after spinal cord injury in adult zebrafish[J]. Mol Neurobiol, 2014, 49(1):472-483.
[25] Reimer MM, Becker CG, Becker T,et al. Motor neuron regeneration in adult zebrafish [J]. J Neurosci, 2008, 28(34): 8510-8516.
[26] Reimer MM, Kuscha V, Becker CG, et al. Sonic hedgehog is a polarized signal for motor neuron regeneration in adult zebrafish[J]. J Neurosci, 2009, 29(48): 15073-15082.
[27] Briona LK, Dorsky RI. Radial glial progenitors repair the zebrafish spinal cord following transaction [J]. Exp Neurol, 2014, 256: 81-92.
[28] 张志杰,刘春龙。温泉水疗对改善胸段不完全性脊髓损伤患者肌痉挛的疗效观察.中国康复理论与实践,2009,15 (5):472-473.
Effect of water temperature on the recovery of spinal cord injury in zebrafish
LI Qiang#, ZHENG Su-lin#, FENG Yu-fei, YANG Zhen-guo, ZHANG Jing-jing*
(Affiliated Hospital of Guangdong Medical University, Zhanjiang 524001, China)
Objective Using zebrafish to analyze the effect of water temperature on the recovery of spinal cord injury. To detect the cell proliferation and changes of gene expression at the injury site during the process of recovery. Methods Surgical operation was performed to induce spinal cord injury (SCI) on adult fish. Water at a series of temperature was applied to culture the fish. Swimming ability was adopted to observe the recovery of spinal cord injury following surgery. Vibration sections and immunohistochemistry were performed to observe the cell number post SCI at different stages. The changes ofgdnfandnosgene expression were determined by real-time PCR. Results The water temperature changes from 28℃ to 32℃ did not affect the swimming ability of non-injured and sham-injured fish (P>0.05). The swimming ability recovered mostly in 8 weeks post spinal cord injury. At 32℃, the swimming ability recovered faster than at 28℃ or at 30℃ (P<0.05). The cell proliferation increased obviously following spinal cord injury (P<0.05). The proliferation of cells surrounding the spinal cord in jury was more extensive in SCI fishes incubated in 32℃ water than in 28℃ or 30℃ water (P<0.05). Real-time PCR assay showed thatgdnfwas up-regulated in all groups post SCI at 24 h, and 7 and 14 days (P<0.05). Thenosexpression was up-regulated in all groups following SCI in 24 h (P<0.05) and 7 days. There was no significant difference between the SCI group and sham-injury group (P<0.05), while after 14 days, the expression ofnoswas reduced in the SCI group compared with the sham-injury group (P<0.05). Conclusions A slight increase of incubating water temperature can accelerate the recovery of spinal cord injury in zebrafish.
Spinal cord injury; Aquatic therapy; Zebrafish;gdnf;nos
ZHANG Jing-jing, E-mail: gdmccrc@163.com
国家自然科学基金(31370824);广东省“培养高层次人才特殊支持计划”专项基金(粤人才办〔2015〕8号);广东省高等学校优秀青年教师培养计划〔YQ2015081〕;湛江市非资助科技攻关项目。
李强(1987-),男,硕士研究生,研究方向:发育神经生物学,E-mail: 330938901@qq.com;郑苏林(1982-),男,康复治疗师,研究方向:运动与康复医学,E-mail: 39069986@qq.com;#为同等贡献作者。
张晶晶,博士,教授,硕士生导师,研究方向:发育神经生物学。E-mail: gdmccrc@163.com。
Q95-33
A
1005-4847(2017) 01-0001-07
10.3969/j.issn.1005-4847.2017.01.001
2016-07-28