乳腺叶状肿瘤与单纯型黏液癌的MRI征象及鉴别诊断
2017-03-09曲宁罗娅红李森
曲宁, 罗娅红, 李森
·乳腺影像学·
乳腺叶状肿瘤与单纯型黏液癌的MRI征象及鉴别诊断
曲宁, 罗娅红, 李森
目的:探讨乳腺叶状肿瘤(PT)和单纯型黏液癌(PMBC)的MRI表现和鉴别诊断。方法:回顾性分析经手术病理证实的16例PT和23例PMBC的临床及MRI资料,包括发病年龄、MRI征象、Fischer评分结合BI-RADS分类、早期增强率(EER),对两者的上述资料进行统计学分析。结果:PT的发病年龄比PMBC小(t=-2.189,P<0.05);PT和PMBC在T1及T2信号特征、内部强化特征、时间-信号强度曲线(TIC)类型上差异均具有统计学意义(P均<0.05);PT和PMBC在病灶大小、形态、边缘、低信号分隔、邻近血管征象(AVS)、Fischer评分结合BI-RADS分类上均无统计学差异(P均>0.05);PT的EER高于PMBC(P<0.05),EER鉴别诊断PT和PMBC的受试者操作特征(ROC)曲线下面积为0.750,最佳界值为136.25%,诊断试验的敏感度为68.8%,特异度为81.8%,诊断符合率为76.3%。结论:虽然PT和PMBC的MRI表现多有重叠,但结合多个征象进行综合分析有助于两者的鉴别诊断。
乳腺肿瘤; 叶状肿瘤; 黏液癌; 磁共振成像; 诊断,鉴别
乳腺叶状肿瘤(phyllodes tumor,PT)和单纯型黏液癌(pure mucinous breast carcinoma,PMBC)均为少见的乳腺肿瘤,由于临床工作中对两者的认识不足,且X线对两者的鉴别诊断价值有限,常给它们的鉴别诊断带来困难。PT和PMBC的治疗方法不同,预后亦有差异,因此术前明确诊断极为重要。相对于乳腺X线成像,超声检查,乳腺MRI可提供更准确的诊断信息[1]。本文回顾性比较术前进行MRI动态增强检查且经手术病理证实的16例PT和23例PMBC的MRI特征,旨在为两者的鉴别诊断提供依据。
材料与方法
1.一般资料
搜集2009年1月-2015年2月本院经手术病理证实的16例乳腺PT患者的病例资料。16例PT中,良性7例,交界性9例;16例均为女性,年龄14~55岁,平均(42.88±10.71)岁;未绝经12例,绝经4例。同时期PMBC患者23例,均为女性,年龄34~75岁,平均(51.13±12.14)岁;未绝经12例,绝经11例。所有患者均以乳腺肿块为主诉入院,临床查体均可触及乳腺肿块。
2.MRI检查方法
采用GE 1.5T Excite HD超导MRI扫描仪,8通道乳腺表面阵列线圈。患者取俯卧位,双侧乳腺自然下垂。双侧乳腺矢状面脂肪抑制快速自旋回波(fat-saturated fast spin echo,FSFSE)T2WI扫描,扫描参数:TR 4040~4160 ms,TE 81 ms,回波链长度19,激励次数 2,视野22 cm×22 cm,矩阵320×224,层厚5.0 mm,层间距1.0 mm,扫描层数36,扫描时间101 s。横轴面脂肪抑制梯度回波(fat-saturated gradient recalled echo,FSGRE)T1WI扫描,扫描参数:TR 6.1 ms,TE 2.9 ms,TI 13 ms,翻转角10°,激励次数0.8,视野36 cm×36 cm,矩阵350×350,层厚3.2 mm,层间距0 mm,扫描层数48,扫描时间58 s。MRI动态增强扫描:对比剂使用Gd-DTPA(剂量15 mL,流率2.0~3.0 mL/s),采用横轴面三维FSGRE T1WI进行乳腺动态增强容积成像(volume imaging for breast assessment,VIBRANT),扫描时相8,扫描层数384,扫描时间464 s,其余参数同FSGRE T1WI扫描。将动态增强第2时相图像与T1WI平扫图像相减后进行最大强度投影(maximum intensity projection,MIP)重建。

匀,内部可见亚急性期出血高信号(箭); d) 矢状面T2WI示右乳肿块内囊变区呈高信号(箭); e) 横轴面T1WI增强扫描示右乳肿块内囊变区呈低信号,无强化(箭); f) MIP图像示右乳肿块呈不均匀强化,AVS阳性; g) TIC曲线呈速升平台型。
图1 女,14岁,右乳PT。a) 横轴面T1WI平扫示右乳肿块信号不均匀,内部可见亚急性期出血高信号(箭); b) 横轴面T1WI平扫示右乳肿块内囊变区呈低信号(箭); c) 矢状面T2WI示右乳内卵圆形肿块,边缘光整,信号不均
3.图像分析
扫描结束后将图像传至GE ADW 4.3工作站,利用Functool软件进行后处理。由2位专门从事乳腺MRI诊断的放射科医师共同阅片,通过协商达成一致诊断意见。MRI图像分析依据美国放射学会提出的第二版MRI乳腺影像报告和数据系统(BI-RADS-MRI 2013)。分析内容包括:肿块大小、信号强度、形态、边缘、内部强化特征、时间-信号强度曲线(time-signal intensity curve,TIC)类型、低信号分隔及邻近血管征象(adjacent vessel sign,AVS)。AVS是指减影图像上显示的、进入病灶内的血管影[2]。绘制TIC曲线时,ROI选取肿块强化最明显的部位,避开肉眼可分辨的出血、坏死囊变及黏液变性区。对病灶进行Fischer评分(表1),并根据Fischer评分确定BI-RADS分类,Fischer评分为1、2、3分分别对应BI-RADS 1、2、3类,4~5分归为BI-RADS 4类,6~8分归为BI-RADS 5类[3]。将增强第2回合的病灶强化区域的信号强度增强率作为早期增强率(early enhancement rate,EER)。

表1 Fischer评分标准
4.统计学方法
应用SPSS 19.0软件进行统计学分析,计量资料以均数±标准差来表示。发病年龄、肿块大小、EER采用独立样本t检验;发病时绝经与否、形态、边缘、信号强度、低信号分隔、AVS、Fischer评分结合BI-RADS分类采用Fisher′s确切概率法检验;内部强化特征、TIC类型应用χ2检验;应用受试者操作特征(ROC)曲线分析EER对PT和PMBC的鉴别诊断意义。P<0.05认为差异具有统计学意义。
结 果
1.一般资料
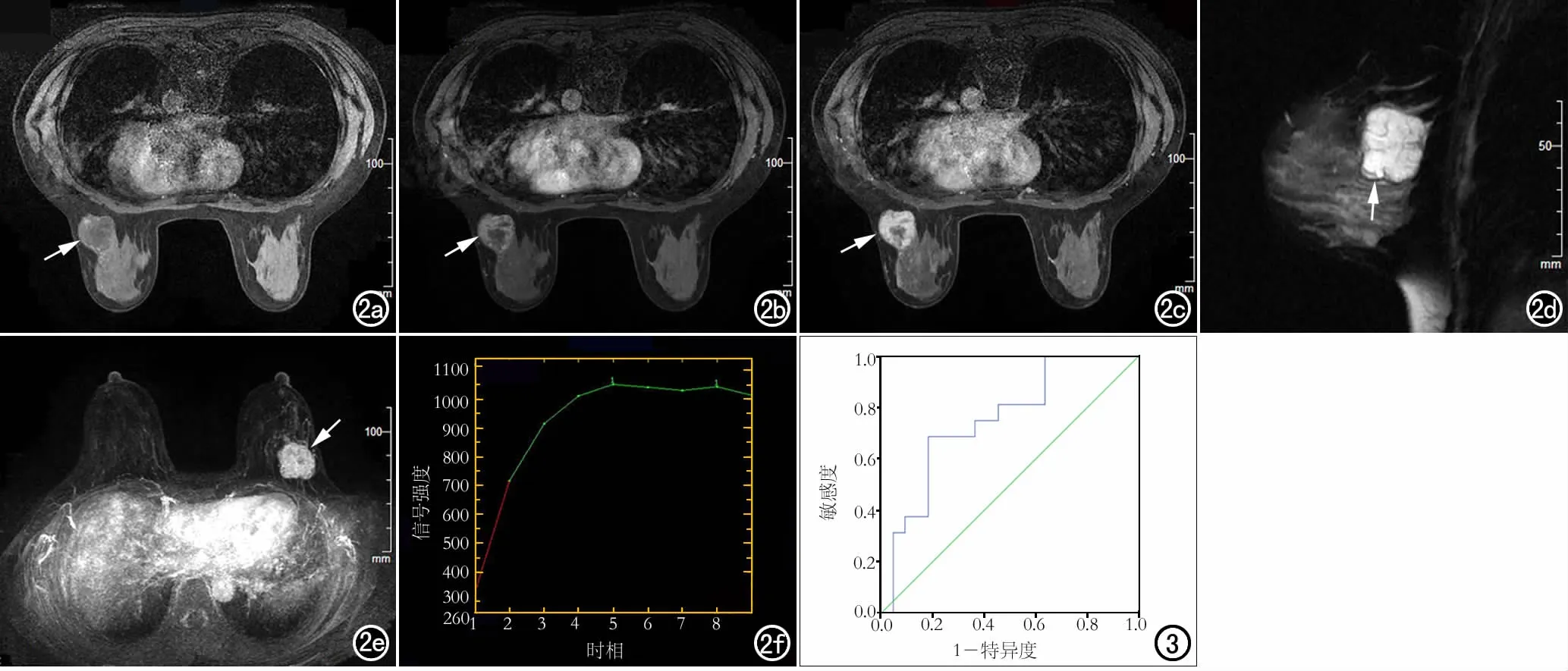
呈环形强化(箭),与图b对比,强化呈周边向中心渗透; d) 矢状面T2WI示右乳内卵圆形肿块(箭),边缘光整,肿块呈高信号伴多发低信号分隔; e) MIP图像示右乳肿块呈环形强化(箭),AVS阳性; f) TIC曲线呈速升平台型。 图3 EER鉴别诊断PT和PMBC的ROC曲线分析,AUC为0.750。
图2 女,34岁,左乳PMBC。a) 横轴面T1WI平扫示右乳肿块呈周边等信号、中心低信号(箭); b) 横轴面T1WI增强扫描早期示右乳肿块呈环形强化(箭); c) 横轴面T1WI增强扫描晚期示右乳肿块仍
PT和PMBC的发病年龄分别为(42.88±10.71)和(51.13±12.14)岁,两者间差异具有统计学意义(-2.189,P=0.035<0.05);但绝经与否在PT和PMBC间无明显差异(P=0.192>0.05)。
2.MRI表现
16例PT和23例PMBC的MRI征象分别见图1、2,对照分析表见表2。
所有病灶均单侧单发。两组病例的T1及T2信号特征、内部强化特征、TIC类型的差异均具有统计学意义(P均<0.05);肿块大小、形态、边缘、低信号分隔、AVS、Fischer评分结合BI-RADS分类差异均无统计学意义(P均>0.05)。PT和PMBC的EER差异具有统计学意义(P<0.05),以EER作为诊断指标进行ROC曲线分析(图3),曲线下面积(AUC)为0.750(95%可信区间为0.592~0.908),采用约登指数最大法确定最佳界值为136.25%,诊断的敏感度为68.8%,特异度81.8%,符合率为76.3%。
讨 论
PT是一种少见的乳腺肿瘤,具有上皮细胞及间叶细胞双向分化的特点,属于纤维上皮性肿瘤,约占所有乳腺肿瘤的0.3%~0.5%,纤维上皮性肿瘤的2%~3%[4,5]。PT根据肿瘤基质细胞数量、有丝分裂和基质细胞异型程度分为良性、交界性和恶性3个亚型。良性PT细胞密度较低,分布均匀,无间质过度增生,细胞少量异型性,核分裂象<4个/10HPF,肿瘤边界清晰;恶性PT具有明显的间质过度增生,具有明显的增殖活性,核分裂象>10个/10HPF,细胞异型性明显,肿瘤边界不清,浸润周边组织;交界性PT的特征介于良性与恶性之间[6]。交界性和恶性PT具有经血液循环系统向远处转移的倾向,主要转移至肺,其次是软组织、骨和胸壁[7];仅<1%的高度恶性PT可发生腋窝淋巴结转移。所有PT(包括良性、交界性和恶性)均行扩大范围(非肿瘤区1cm)局部切除,较大者需行乳腺单纯切除术,一般情况下没有必要进行区域淋巴结清扫。而PMBC是一种少见的特殊类型浸润癌,起源于乳腺导管上皮,其病理组织学特点是癌细胞产生大量黏液,在细胞外积聚成黏液湖,细胞分化通常较好,呈小簇状或巢片状漂浮在黏液湖中,发病率不足2%[8]。PMBC属于低度恶性肿瘤,腋窝淋巴结转移率较低,预后较好[9]。目前认为<3 cm、未侵及皮肤的PMBC可采取保乳手术加前哨淋巴结活检,不适合保乳手术治疗的患者推荐乳腺单纯切除术加前哨淋巴结活检[10]。
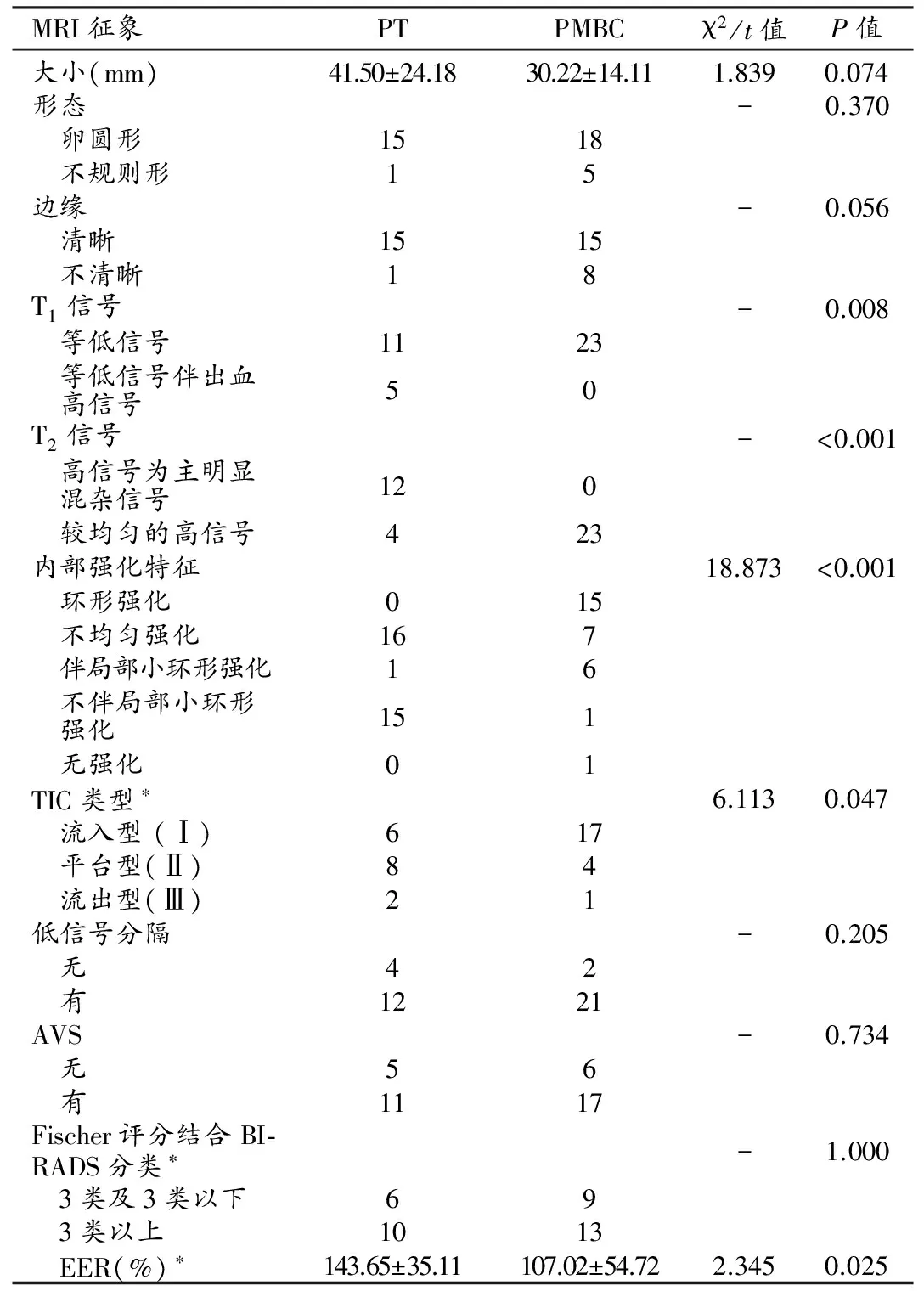
表2 PT与PMBC的MRI征象对照表
注:*代表1例无强化的PMBC不参与统计学分析。
PT好发于中年妇女,平均发病年龄为40.4岁[11],另有研究[7]认为其发病年龄有年轻化趋势(≤35岁者占44%)。PMBC好发于绝经后的女性,其发病年龄为57.0岁[12],中国女性的发病年龄普遍低于西方国家。本研究中,PT和PMBC的平均发病年龄分别为(42.88±10.71)和(51.13±12.14)岁,前者较后者约年轻10岁(P=0.035<0.05);另外,本组PT患者中,最小发病年龄为14岁,与既往报道基本一致。因为中国女性PMBC发病年龄偏低,所以绝经与否并不能作为鉴别中国女性PT和PMBC的依据。
PT和PMBC的大小均为数毫米至数厘米不等,对鉴别诊断没有价值。PT和PMBC在MRI上多表现为卵圆形,大多数病灶边缘光整,少数不规则,两者间无统计学差异,亦无鉴别诊断价值。虽然PT和PMBC在T1WI上均呈等低信号,T2WI上的高信号表现亦有重叠,但PT因常伴出血、坏死囊变和黏液样变性,导致T1WI、T2WI上内部信号明显不均匀:病灶内出血在T1WI上可呈条片状高信号,坏死囊变和黏液变性区于T2WI上呈明显高信号。病灶越大,内部越易出现囊变,文献报道PT的囊变率约33.3%(8/24),交界性和恶性多见[7]。囊变主要与肿瘤生长较迅速、体积增大,出现供血障碍有关[13]。PMBC是生长缓慢的低度恶性肿瘤,继发性改变少见[14],因此无论T1还是T2信号通常不会像PT那样混杂。本组16例PT患者中,5例T1WI上出现出血高信号影,而PMBC未见此征象,因此T1WI内部出血高信号对提示PT诊断具有重要意义。本组12例PT的T2信号明显混杂,多出现在>3 cm的肿块(10/12),另4例<3 cm的PT,其T2信号较均匀;23例PMBC无论肿块大小,T2信号相对于PT均较均匀,因此T2信号明显混杂的大肿块对提示PT诊断有价值,而对<3 cm的PT和PMBC的鉴别诊断,T2信号的价值有限。
PT呈不均匀强化,绝大多数病灶内部强化极不均匀;而PMBC则以环形强化为主、呈周边向中心渗透的强化趋势[15],而不均匀强化也是PMBC仅次于环形强化的第二大类强化方式。对于同为不均匀强化的PT和PMBC,其表现也有细微差别。本研究结果显示,PMBC的不均匀强化多伴局部小环形强化(6/7),而PT的不均匀强化仅1例伴局部小环形强化(1/16),可能是由于PMBC局部区域的肿瘤细胞分布呈现周边高于中心而产生的特征性表现,因此对于同为不均匀强化的PT和PMBC,病灶内局部是否存在小环形强化对二者鉴别诊断同样具有重要价值。PMBC的强化方式取决于肿瘤内黏液、肿瘤细胞含量和两者的空间分布:强化明显的区域,对应肿瘤细胞密度高;而强化不明显的区域则相反[14,16]。当PMBC病灶内肿瘤细胞成分极少而黏液含量足够高时,可表现为无强化[17],虽然该征象并不像环形强化和不均匀强化常见(本组PMBC中有1例呈无强化表现),但本组PT并未出现此种表现,故无强化对提示PMBC的诊断可能有意义。PT的TIC类型分为3种,沈茜刚等[18]的研究认为恶性PT更易见Ⅲ型曲线,但本组PT无恶性病例,可能是本组Ⅲ型曲线少见的原因。PMBC以Ⅰ型TIC多见,主要原因为肿瘤内大量黏液成分导致对比剂在肿瘤内扩散延迟[19]所致。尽管本组PT无恶性病例,但PT和PMBC的TIC类型差异仍有统计学意义,PT以Ⅱ型多见,PMBC以Ⅰ型多见,可能是两者不同的病理基础所致。PT富含肿瘤细胞,而PMBC富含黏液,即使是多细胞型PMBC,与PT相比,其肿瘤细胞含量仍较低,肿瘤细胞越丰富,微血管密度越大,随着微血管密度的增高,TIC类型由流入型逐渐向平台型至流出型过渡[20]。
低信号分隔是PT和PMBC常见的征象,本文结果显示,该征象在两者之间的差异无统计学意义。由于PT信号混杂,需结合T2WI和增强图像观察才能提高低信号分隔的检出率;而PMBC的低信号分隔在T2WI肿块高信号背景的衬托下清晰可见,增强后低信号分隔反而和相邻的、因黏液含量高无明显强化的区域融为一体导致无法区分。值得一提的是,低信号分隔曾被认为是纤维腺瘤的特征性表现,这一观点应得到改变。AVS也是两者的常见表现,本文的结果显示,其对PT和PMBC的鉴别诊断没有价值(P>0.05)。
既往研究采用Fischer评分结合BI-RADS分类对乳腺良恶性病变进行鉴别诊断,其敏感性、特异性、诊断符合率、阳性预测值及阴性预测值均较高[3]。本研究采用此方法对PT和PMBC进行鉴别诊断的结果显示,Fischer评分结合BI-RADS分类对PT和PMBC的鉴别诊断没有价值;不仅如此,PT和PMBC的BI-RADS分类为3类及以下的均占较大比例(前者为37.50%,后者为40.91%),因BI-RADS分类为3类及以下的病变不需要进行临床干预,从而可能延误这两类疾病的治疗,因此,不建议根据Fischer评分对PT和PMBC进行BI-RADS分类和鉴别诊断。
本文的结果显示:PT的EER明显高于PMBC,且两者差异有统计学意义;EER鉴别诊断PT和PMBC的ROC曲线下面积为0.750,95%可信区间为0.592~0.908,表明EER具有中等程度的鉴别诊断效能;以约登指数最大法确定的最佳界值136.25%进行鉴别诊断,其敏感度为68.8%,特异度为81.8%,诊断符合率为76.3%。综上,笔者认为EER对PT和PMBC的鉴别诊断有一定价值,但因两者的EER存在部分重叠,因此鉴别诊断时应结合其它特征进行综合分析。
本文具有一定的局限性:①PT和PMBC均为少见病例,本文的样本量较小,且缺乏恶性PT病例,因此可能无法完整涵盖两种肿瘤的特点;②随着PT恶性程度增高,其MRI表现会有所差异[21],另外,PMBC可根据黏液含量的多少划分为少细胞型和多细胞型[22],而本文未根据PT的恶性程度和PMBC黏液含量的多少进行分层分析,这有待于增加样本量后进一步研究。
总之,虽然PT和PMBC的MRI表现复杂且存在重叠,但综合分析两者的多个征象,尤其是T1、T2信号及动态增强MRI特点,可为两者的鉴别提供依据。
[1] 胡益棋,冉玲平,冯梦丹,等.RSNA 2015乳腺影像学[J].放射学实践,2016,31(2):102-107.
[2] Wang L,Wang D,Fei X,et al.A rim-enhanced mass with central cystic changes on MR imaging:how to distinguish breast cancer from inflammatory breast diseases?[J].PLoS One,2014,9(3):90355-90362.
[3] 刘伟,叶春涛,林光武,等.Fischer评分结合MR影像报告数据系统鉴别乳腺良恶性病变的价值[J].实用放射学杂志,2012,28(9):1366-1370.
[4] 应建明,孙耘田.乳腺叶状肿瘤[J].诊断病理学杂志,2002,9(6):365-367.
[5] 罗冉,汪登斌,王丽君.乳腺叶状肿瘤的MRI特征及鉴别诊断[J].国际医学放射学杂志,2014,37(5):426-429.
[6] Tan BY,Acs G,Apple SK,et al.Phyllodes tumours of the breast:a consensus review[J].Histopathology,2016,68(1):5-21.
[7] 张玲,廖昕,徐维敏,等.乳腺叶状肿瘤的影像学分析[J].实用放射学杂志,2013,29(7):1087-1090.
[8] Cyrta F,Andreiuolo F,Azoulay S,et al.Pure and mixed mucinous carcinoma of the breast:fine needle aspiration cytology findings and review of the literature[J].Cytopathology,2013,24(6):377-384.
[9] 李潇潇,汪登斌.乳腺黏液癌的临床及影像诊断[J].放射学实践,2014,29(10):1140-1142.
[10] 杨猛,李忻,庞春红,等.单纯乳腺黏液癌的临床病理特点及治疗[J].中华内分泌外科杂志,2011,5(2):114-116.
[11] 葛玲玉,王丽君,许顺良,等.乳腺叶状瘤的X线表现与病理特征[J].中华放射学杂志,2002,36(11):977-980.
[12] Liu H,Tan H,Cheng Y,et al.Imaging findings in mucinous breast carcinoma and correlating factors[J].Eur J Radiol,2011,80(3):706-712.
[13] 姜蕾,周意明,李惠章,等.应用乳腺影像报告和数据系统分析乳腺叶状肿瘤的影像表现[J].实用放射学杂志,2012,28(7):1031-1036.
[14] Monzawa S,Yokokawa M,Sakuma T,et al.Mucinous carcinoma of the breast:MRI features of pure and mixed forms with histopathologic correlation[J].AJR,2009,192(3):125-131.
[15] 刘佩芳,尹璐,牛昀,等.乳腺黏液癌MRI表现特征及其与病理对照研究[J].中华放射学杂志,2009,43(5):470-475.
[16] Okafuji T,Yabuuchi H,Sakai S,et al.MR imaging features of pure mucinous carcinoma of the breast[J].Eur J Radiol,2006,60(3):405-413.
[17] Linda A,Zuiani C,Girometti R,et al.Unusual malignant tumors of the breast:MRI features and pathologic correlation[J].Eur J Radiol,2010,75(2):178-184.
[18] 沈茜刚,谭红娜,彭卫军.乳腺叶状瘤的MRI表现及病理对照分析[J].中华放射学杂志,2011,45(12):1108-1112.
[19] Kawashima M,Tamaki Y,Nonaka T,et al.MR imaging of mucinous carcinoma of the breast[J].AJR,2002,179(1):179-183.
[20] 李敏,金真,李功杰,等.乳腺动态增强MRI参数与肿瘤血管的相关性及其鉴别诊断价值[J].磁共振成像,2010,1(1):36-42.
[21] Yabuuchi H,Soeda H,Matsuo Y,et al.Phyllodes tumor of the breast:correlation between MR findings and histologic grade[J].Radiology,2006,241(3):702-709.
[22] Kryvenko ON,Chitale DA,Joon J,et al.Precursor lesions of mucinous carcinoma of the breast:analysis of 130 cases[J].Am J Surg Pathol,2013,37(7):1076-1084.
MRI features and differential diagnosis of phyllodes tumor and pure mucinous breast carcinoma
QU Ning, LUO Ya-hong,LI Sen.
Department of Radiology,Cancer Hospital of China Medical University,Liaoning Tumor Hospital,Shenyang 110042,China
Objective:To investigate MRI features and differential diagnosis of phyllodes tumor (PT) and pure mucinous breast carcinoma (PMBC).Methods:The clinical data and MR findings of 16 patients with PT and 23 patients with PMBC confirmed by operation and pathology were analyzed retrospectively.The features included age,MRI findings,the Fischer score binding with BI-RADS classification and early enhancement rate (EER),the above data were statistically analyzed.Results:The age of PT patients was younger than that of PMBC (P<0.05).There were significant differences in the signal features of T1and T2,enhancement pattern and time-signal intensity curve (TIC) between the two groups (P<0.05).However,there were no significant statistical differences in the lesion size,shape,edge,internal dark signal separation,adjacent vascular signs (AVS),Fischer score and BI-RADS classification between PT and PMBC.The values of EER of PT were higher than that of PMBC (P<0.05),area under ROC curve was 0.750,the optimal cut-off value was 136.25% with the sensitivity,specificity and accuracy as 68.8%,81.8%,76.3% respectively.Conclusion:MRI features of PT and PMBC may overlap,however,the comprehensive analysis combined with multiple characteristics is beneficial for the differential diagnosis.
Breast neoplasms; Phyllodes tumor; Mucinous carcinoma; Magnetic resonance imaging; Diagnosis,differential
110042 沈阳,中国医科大学肿瘤医院、辽宁省肿瘤医院医学影像科
曲宁(1979-),女,辽宁瓦房店人,硕士,副主任医师,主要从事乳腺影像学诊断工作。
R737.9; R445.2
A
1000-0313(2017)02-0139-05
10.13609/j.cnki.1000-0313.2017.02.009
2016-05-04
2016-07-11)
