外科手术重建生殖管道和辅助生殖技术治疗梗阻性无精子症的疗效对比
2017-03-09李冬宏周辉良郭玉佳唐松喜陈杏婷
李冬宏, 周辉良, 郭玉佳, 唐松喜, 陈杏婷, 林 晨
据世界卫生组织统计显示,不孕不育的发生率占育龄夫妇的15%~20%,其中男性原因引起的不育近50%。在这些男性不育患者中约有10%为无精子症,而梗阻性无精子症(obstructive azoospermia,OA)患者占40%左右。OA患者具有正常的染色体、睾丸体积及性激素水平,活检显示生精功能正常,不育常由先天及后天因素导致的生殖管道梗阻引起[1-4]。
目前,治疗OA主要方式为外科手术重建生殖管道和附睾或睾丸取精行辅助生殖技术[5-6]。自1994年利用睾丸或附睾精子行卵胞浆内单精子注射(intracytoplasmic sperm injection,ICSI)成功助孕后,该方法在治疗OA患者上得到了广泛应用[7]。有部分学者认为,显微外科手术治疗OA效果显著,其复通率高达60%~87%,累计妊娠率为10%~43%,且比ICSI技术更经济[8-9]。由于业界学者对OA患者的治疗方式持有一定的争议,因此,本研究将分析笔者医院2015年1月-2016年12月收治的78例OA不育患者采用外科手术治疗和经皮附睾穿刺取精(percutaneous epididymal sperm aspiration,PESA)或睾丸精子抽取术(testicular aspiration,TESA)行ICSI治疗的疗效,分析2组患者的临床妊娠结局,探讨其原因,以期为OA患者治疗方法的选择提供参考依据。
1 对象与方法
1.1一般资料 78例中,年龄(28.65±4.73)岁(22~42岁),病程(4.99±3.58)年(1.2~8年),按随机数字表法均分为A组和B组:A组年龄(28.97±4.12)岁(23~42岁),病程(5.12±3.66)年(1.2~8年);B组年龄(28.14±4.80)岁(22~42岁),病程(4.64±3.47)年(1.3~7.7年)。A组术后仍不孕者根据精液精子浓度分为体外受精(A-invitrofertilization,A-IVF)组和单精子显微注射(A-intracytoplasmic sperm injection,A-ICSI)组。
研究对象纳入标准:(1)男方至少3次精液检查未见精子,经附睾穿刺有精子或行睾丸活检提示生精功能正常并可见各级生精细胞和少量成熟精子;(2)夫妻双方染色体检查均为正常;(3)血清激素水平均属正常范围;(4)女方各项检查均属正常,不孕不育单纯由男方所致;(5)男方患者治疗前均未行任何手术治疗;(6)行附睾、输精管探查发现系附睾或输精管不同段梗阻。所有患者均签署知情同意书,自愿参加此项研究。
1.2方法 A组患者术前2周口服抗生素、抗氧化物质(维生素C、E及谷氨酸),术前3 d口服强的松。手术当日行输精管、附睾探查术后,采取输精管输精管吻合术及输精管附睾管显微吻合术,术后7 d口服强的松,术后3~6月应用抗氧化物质、锌剂及促生精药物(如克罗米芬)。复通后的A组患者经自然备孕1年后未孕者采用辅助生殖技术助孕。B组患者行PESA或TESA-ICSI治疗,女方促排采用经典长方案,人绒毛膜促性腺激素(HCG)10 000 IU诱发促排36 h后取卵,所有患者均培养至囊胚后再移植。
1.3观察指标 观察试管婴儿IVF实验各项指标:获卵数、受精情况、D3胚胎情况以及D5囊胚情况。移植后10 d测血hCG,后42 d B超观察妊娠囊及胎心搏动,确定妊娠情况。
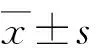
2 结 果
2.1A组患者治疗情况 A组患者术后1月复查精液可见精子者31例,复通率为79.49%,其后每间隔1月再连续复查2次精液,其中精液浓度≥15×106mL-1者7例(22.58%),≤5×106mL-1者20例(64.52%),介于二者之间者4例(12.90%)。39例中,31例经1年自然备孕,其中6例(19.35%)精液浓度≥15×106mL-1患者配偶妊娠;1例(3.23%)精液浓度≥15×106mL-1患者经人工授精后其配偶妊娠;余24例行试管婴儿辅助技术(含IVF 5例,ICSI 19例),其中A-IVF组精子浓度为(5~15)×106mL-1,A-ICSI组精子浓度为<5×106mL-1。
2.2临床妊娠结果 A组患者经手术治疗后,随访发现其中6例患者经1年时间配偶自然受孕妊娠;1例经人工授精后患者配偶妊娠;3例经IVF后配偶妊娠;10例经ICSI后配偶妊娠,即39例患者中20例临床妊娠(51.28%)。B组39例患者直接经PESA或TESA-ICSI,21例临床妊娠(53.85%)。2组临床妊娠率比较差别无统计学意义(P<0.05)。
2.3实验室各项观察指标 A-IVF组总获卵数78枚,平均(15.6±4.1)枚;A-ICSI组总获卵数277枚,平均(14.6±3.5)枚;B组总获卵数588枚,平均(15.1±3.9)枚。经比较各组平均获卵数差别无统计学意义(P>0.05)。A-IVF组和A-ICSI组受精率分别为80.77%及79.42%,明显高于B组受精率72.79%,差别有统计学意义(P<0.05)。但A-IVF组和A-ICSI组平均D3优质胚胎数、囊胚形成数和移植胚胎数与B组之间均无显著差异(P>0.05);A-IVF组临床妊娠率60.00%明显高于A-ICSI组和B组的52.63%与53.85%,但A-IVF组与A-ICSI组及B组比较差别无统计学意义(P>0.05,表1)。

表1 2组患者实验室各项指标比较
表中数据为n(%). IVF:体外受精; ICSI:卵泡浆内单精子注射. 与B组比较,△:P<0.05.
3 讨 论
无精子症是指育龄男性3次精液常规检查均未见精子,且精液离心沉淀中仍未发现精子。OA患者具有正常的染色体、睾丸体积及性激素水平,其活检显示生精功能正常,无精症常由先天及后天因素导致的生殖管道梗阻引起。目前治疗OA的主要方式为外科手术重建生殖管道和附睾或睾丸取精行辅助生殖技术,但究竟如何选择治疗方式一直存在争议。随着显微外科手术的发展,使得输精管吻合术的精度也越来越高,复通率及妊娠率也显著上升,且在治疗时手术创伤小、费用低廉,能够得到OA患者的普遍认可[9-10]。但也有学者认为,治疗OA常用方法为PESA或TESA-ICSI,因为该方法治疗不育症效果显著且快捷,而且通过PESA或TESA获取的精子足够用于ICSI和冷冻保存,为患者失败后再次治疗提供了保证,避免了反复手术造成的心理或生理的伤害[11-12]。
在本组资料中,A组患者采取输精管-输精管吻合术及输精管-附睾管显微吻合术,术后1月复查复通率为79.49%,仍有8例复通失败。分析失败原因发现,1例是医源性、4例是输精管梗阻位置及长短、2例是附睾梗阻部位、1例不明原因。江专新等研究证实,附睾梗阻部位、输精管梗阻段的位置以及长短等是影响吻合手术成功的关键因素,它使得部分患者仍无法复通输精管道[13]。因此,即使手术使得输精管道复通,但仍有一些原因,如长期的梗阻使得生精环境改变、生精功能低下、输精管道损伤导致功能降低、吻合术后出现抗精子抗体阳性等可使得吻合术后出现少精,甚至是重度少精[14-15]。
本研究复通成功的A组31例患者经1年时间自然备孕,随访发现6例患者配偶妊娠,其余25例患者借助人工受精以及试管婴儿等辅助生殖技术,14例配偶妊娠,即A组共有20例(51.28%)患者配偶妊娠,而B组有21例(53.85%)妊娠,可见2组患者经手术或是辅助生殖技术后都能获得相近的临床妊娠率,但A组中仍有大部分患者行外科手术复通后因少精需借助辅助生殖技术。分析这部分患者发现,一方面由于自然备孕只是1年期限较短,另一方面手术复通后没有长期(>6月)给予相应的药物治疗。因此,下一步的研究中将在延长自然受孕时间的同时给予适当的药物治疗,提高患者精子的数量,增加自然受孕的成功率[14]。但是,针对那些吻合手术难度大或严重影响复通后精子数量的OA患者,可推荐直接行PESA或TESA-ICSI助孕。另外,本研究IVF实验室数据发现,直接手淫取精患者的实验室各项数据均要优于直接穿刺获精患者的数据。分析其原因,可能是因为精子的质量引起,经手术复通后手淫排出的精子比睾丸或附睾精子直接穿刺获取的精子具有更好的活力和成熟度,致使其受精率较高[16-17]。
笔者认为,外科手术重建生殖管道和附睾或睾丸取精行辅助生殖技术治疗梗阻性无精子症患者均能取得一定的疗效,但针对不同类型的OA患者应选择合理的治疗方式。如对手术吻合易成功的OA患者可考虑行外科手术重建生殖管道;另外有医源性因素、附睾梗阻部位、输精管梗阻段的位置、长短以及功能等严重影响吻合手术成功或精子数量的OA患者应考虑行PESA或TESA-ICSI。
[1] 周 猷,旁 成,何 电,等. 我国不孕症研究进展[J]. 中国计划生育学杂志, 2011,1(7):63-64.
[2] Bernie A M,Ramasamy R,Schlegel P N. Predictive factors of successful microdissection testicular sperm extraction[J].BasicClinAndrol, 2013,23(5):1-7.
[3] Kamal A,Fahmy I,Mansour R,etal. Does the outcome of ICSI in cases of obstructive azoospermia depend on the origin of the retrieved spermatozoa or the cause of obstruction? A comparative analysis[J].FertilSteril, 2010,94(6):2135-2140.
[4] Miyaoka R,Esteves S C. Predictive factors for sperm retrieval and sperm injection outcomes in obstructive azoospermia: Do etiology, retrieval techniques and gamete source play a role[J].Clinics, 2013,68(Suppl1):111-119.
[5] Wosnitzer M S,Goldstein M. Obstructive azoospermia[J].UrolClinNorthAm, 2014,41(1):83-95.
[6] 谢 婧. 显微外科治疗梗阻性无精子症的研究进展[J]. 医学研究生学报, 2011,24(6):634-636.
[7] Ketabchi A A. Intracytoplasmic sperm injection outcomes with freshly ejaculated sperms and testicular or epididymal sperm extraction in patients with idiopathic cryptozoospermia[J].NephrourolMon, 2016,8(6):e41375.
[8] Silber S J,Grotjan H E. Microscopic vasectomy reversal 30 years later: A summary of 4010 cases by the same surgeon[J].JAndrol, 2004,25(6):845-859.
[9] 平 萍,陈向锋,王鸿翔,等. 显微外科技术在男性不育症治疗中的应用及疗效分析[J]. 中国计划生育和妇产科, 2015,7(1):20-22.
[10] 张峰彬,梁忠炎,李乐军,等. 梗阻性无精子症的显微外科治疗(附76例报告)[J]. 中华男科学杂志, 2015,21(3):239-244.
[11] 詹绪新,万长春,李海波,等. 附睾或睾丸精子对梗阻性无精子ICSI治疗结局影响的系统评价[J]. 中华男科学杂志, 2016,22(12):1122-1130.
[12] Practice Committee of the American Society for Reproductive Medi-cine in collaboration with the Society for Male Reproduction and Urology. The management of infertility due to obstructive azoospermia[J].FertilSteril, 2008,90(5):121-124.
[13] 江专新,黄 健,覃云凌,等. 交叉输精管附睾显微吻合术治疗复杂梗阻性无精子症[J]. 中华男科学杂志, 2016,22(4):373-375.
[14] 张 磊,黄 坪,任飞强,等. 梗阻性无精子症患者术后应用麒麟丸疗效观察[J]. 中华男科学杂志, 2016,22(9):823-826.
[15] Kathrins M,Niederberger C. Diagnosis and treatment of infertility-related male hormonal dysfunction[J].NatureReviewsUrology, 2016,13(6):309.
[16] Esteves S C,Lee W,Benjamin D J,etal. Reproductive potential of men with obstructive azoospermia undergoing percutaneous sperm retrieval and intracytoplasmic sperm injection according to the cause of obstruction[J].JUrol, 2013,189(1):232-237.
[17] 张 帆,葛红山,朱春芳,等. 不同来源及不同处理方式的精子对人卵子胞浆内单精子注射结局的影响[J]. 实用医学杂志, 2014,30(4):591-593.
