芍药甘草汤对哮喘大鼠辅助性T细胞17及其细胞因子白细胞介素-17的影响
2017-03-09何飞汝触会沈晓强徐俭朴
何飞 汝触会 沈晓强 徐俭朴
1.浙江中医药大学附属中西医结合医院 杭州 310003
芍药甘草汤对哮喘大鼠辅助性T细胞17及其细胞因子白细胞介素-17的影响
何飞 汝触会 沈晓强 徐俭朴
1.浙江中医药大学附属中西医结合医院 杭州 310003
[目的]观察芍药甘草汤对支气管哮喘SD大鼠辅助性T细胞(T helper cells,Th)17及白细胞介素-17(interleukin17,IL-17)的干预情况,探讨芍药甘草汤防治哮喘的作用机制。[方法]雄性SD大鼠40只,随机均分为正常对照组、模型组、芍药甘草汤组、地塞米松组、中西医结合组,每组8只。除正常对照组外其余各组大鼠以卵白蛋白致敏并诱发哮喘以制作模型。正常对照组和模型组生理盐水灌胃,其余各组给予对应药物。实验结束后对大鼠左肺行肺泡灌洗术,肺泡灌洗液(bronchoalveolar lavage fluid,BALF)细胞计数后离心取细胞进行瑞氏染色细胞分类计数。用酶联免疫法测定肺匀浆中IL-17的水平,用流式细胞仪检测脾脏单个核细胞液中Th17细胞含量。[结果]与模型组比较,芍药甘草汤组、地塞米松组及中西医结合组均可显著降低BALF细胞总数和嗜酸性粒细胞(P<0.01),同时能显著降低Th17和IL-17水平(P<0.01),地塞米松组大鼠IL-17表达较芍药甘草汤组及中西医结合组降低(P=0.049和0.006),地塞米松组大鼠Th17表达与芍药甘草汤组比较差异无统计学意义(P>0.05)。[结论]芍药甘草汤防治哮喘的作用机制可能与其调节哮喘大鼠Th17细胞及其IL-17的作用有关。
芍药甘草汤;BALF;哮喘;Th17细胞;IL-17;实验研究
目前,全球哮喘患者至少有3亿,中国哮喘患者大约3000万[1],全球范围内哮喘病人经济负担巨大。哮喘是一种异质性疾病,虽然有哮喘管理和预防的全球策略标准化治疗方案,但临床效果不尽相同。中医药在防治支气管哮喘方面具有较大优势[2],芍药甘草汤系张仲景《伤寒论》中的著名方剂,现代药理研究证实芍药甘草汤具有明显的解痉、镇痛、抑制气道重构等多种作用而被广泛用于临床[3-4]。本实验研究主要观察芍药甘草汤对哮喘大鼠辅助性T细胞(T helper cells,Th)17和白细胞介素-17(interleukin17,IL-17)的干预情况,以探讨芍药甘草汤防治哮喘的作用机制。
1 材料
1.1 实验动物 雄性SD大鼠40只,体质量(200± 20)g,由浙江省实验动物中心提供 [使用许可证号:SCKX(浙)2014-0001,合格证号:0010439]。饲养条件为:温度18~22℃,相对湿度40%~60%,自由饮水,标准普通饲料喂食。
1.2 实验药物及试剂 芍药甘草汤由浙江中医药大学附属中西医结合医院中药制剂室制成流浸膏(芍药和甘草的比例为1:1),生药含量1g·mL-1;醋酸地塞米松片(浙江仙琚制药股份有限公司,批号:140653);卵白蛋白(Sigma公司,批号:A5253);氢氧化铝(上海凌峰化学试剂有限公司,批号:Lot.NO. 20130818);大鼠IL-17酶联免疫检测试剂盒(南京建成生物工程研究所,批号:Lot#R 20150115)。
2 方法
2.1 分组、造模与给药 取40只雄性SD大鼠,按随机数字表法分为5组:正常对照组、模型组、芍药甘草汤组、地塞米松组和中西医结合组,每组8只。哮喘模型参照文献[5]介绍的方法进行,除正常对照组外,其余各组大鼠在第1、7d腹腔注射造模液1mL(含卵白蛋白120mg、氢氧化铝100mg)致敏,正常对照组用1mL生理盐水腹腔注射代替。从第15d开始,除正常组外,其余各组大鼠分组放进自制容器(30L),用配制好的2%卵白蛋白激发液,使用压缩雾化机雾化激发,每组激发时间30min/d,正常对照组用生理盐水代替雾化刺激,时间为30min/d,连续4周。给药方法:各组大鼠均从造模第15d起雾化激发后半小时灌胃给药至末次激发。正常对照组和模型组用蒸馏水代替给药,芍药甘草汤组给予芍药甘草流浸膏5g· kg-1,地塞米松组给予地塞米松溶液1mg·kg-1;中西医结合组给予芍药甘草流浸膏5g·kg-1及地塞米松溶液0.5mg·kg-1。药物用量按体型系数的折算公式,将人体临床用药剂量估算为实验动物用药剂量。
2.2 标本采集和处理 各组大鼠在最后1次激发18~24h之间用乌拉坦(浓度为20%)麻醉,行左肺肺泡灌洗收集灌洗液,无菌取出右上肺用10%甲醛固定观察病理形态学变化,留取右下肺冷冻保存制备肺组织匀浆。留取脾脏,放入EP管中,并于-20℃冷冻保存。
2.3 肺泡灌洗液(bronchoalveolar lavage fluid,BALF)收集及细胞计数 暴露气管,在气管正中剪一楔形小切口,插入灌胃针至左肺并结扎,用4℃生理盐水行支气管肺泡灌洗,每次3mL,反复灌洗3次,回收率均大于50%,BALF细胞计数后离心取细胞进行瑞氏染色细胞分类计数。
2.4 大鼠肺组织病理形态学观察 将右上肺组织置于10%甲醛溶液中固定,脱水,石蜡包埋,切片,苏木精-伊红染色,树脂封片,光镜下观察肺病理形态学表现。
2.5 大鼠肺匀浆 IL-17测定 将冷冻保存的肺组织室温解冻,在冰冷的生理盐水中漂洗,除去血液,滤纸拭干,称重;然后用移液管量取生理盐水,生理盐水体积总量应该为组织重量的9倍,冰浴情况下在培养皿中用眼科剪剪碎组织块,用组织匀浆机10000~15000r/min研磨制成10%组织匀浆。将制备好的10%肺组织匀浆用离心机2000r/min离心10min,留上清液进行IL-17的检测,具体实验步骤同操作说明书。
2.6 大鼠脾脏Th17细胞流式分析 将脾脏取出后,立即浸入装有冷PBS的培养皿中,剪去白色结缔组织,换入另1个装有冷PBS的培养皿中清洗脾脏;再次换个装有冷PBS的培养皿,用眼科剪剪切脾脏成3mm×3mm左右的小块,用5mL一次性注射器的尾部轻轻研磨脾脏小块;然后200目筛网过滤获得单细胞悬液,用冷PBS洗涤2次,每次1000r/min离心10min;最后将细胞重悬于RPMI1640(含灭活FBS)中,用台酚蓝染色计数活细胞数(应在95%以上),并使用RPMI 1640调节细胞浓度为2×106/mL。在调节好细胞浓度的样本中加入250×PMA/Ionomycin 2uL 和250×Monensin/BFA 2uL刺激脾细胞,于37℃、5% CO2培养5h,期间相隔1~2h混匀1次。FITC-CD4抗体进行表面标记。固定破膜后,PE-IL17A抗体行胞内染色,每个样品均设同型对照,24h内采用BD流式细胞仪检测分析。
2.7 统计学方法 应用SPSS 22统计软件,数据以均数±标准差(±S)表示,多样本均数比较采用单因素方差分析,方差齐性两两比较采用SNK法检验,方差不齐性则两两比较采用Tamhane’sT2法,以P< 0.05为差异具有统计学意义。
3 结果
3.1 BALF细胞总数及嗜酸性粒细胞计数 各组BALF细胞总数和嗜酸性粒细胞比有统计学差异(F= 63.70,P<0.01和F=65.13,P<0.01)。与正常对照组比较,模型组和各药物组大鼠BALF细胞总数均显著增加,差异有统计学意义(P<0.01),模型组和芍药甘草汤组嗜酸性粒细胞比显著增加,差异有统计学意义(P<0.01);与模型组比较,芍药甘草汤组、地塞米松组及中西医结合组均可显著降低BALF细胞总数及嗜酸性粒细胞水平,差异有统计学意义(P<0.01);地塞米松组和中西医结合组均较芍药甘草汤组显著减少BALF细胞数及嗜酸性粒细胞水平,差异均有统计学意义(P<0.01),中西医结合组和地塞米松组差异无统计学意义(P>0.05)。见表1。
表1 各组大鼠BALF细胞总数及嗜酸性粒细胞计数比较(±s)Tab.1 Comparison of the total number of cells and the number of eosinophils(Eos)in BALF among different groups of rats(±S)

表1 各组大鼠BALF细胞总数及嗜酸性粒细胞计数比较(±s)Tab.1 Comparison of the total number of cells and the number of eosinophils(Eos)in BALF among different groups of rats(±S)
注:与正常对照组比较,ΔΔP<0.01;与模型组比较,**P<0.01;与芍药甘草汤组比较,##P<0.01。Note:Compared with blank control group,ΔΔP<0.01;Compared with model group,**P<0.01;Compared with Shaoyao Gancao Decoction group,##P<0.01.
组别 n 细胞总数(107/L) 嗜酸性粒细胞比(%)正常对照组 8 16.38±3.54**1.31±0.23**模型组 8 104.37±13.73△△10.25±2.18△△芍药甘草汤组 8 69.00±11.82**△△6.25±1.91**△△地塞米松组 8 37.75±11.42**△△##1.50±0.26**##中西医结合组 8 52.37±14.95**△△##2.65±0.67**##F值 63.70 65.13 P值 0.000 0.000
3.2 肺组织病理学观察 正常对照组各支气管管腔光整通畅,未见闭塞和粘液栓,气道粘膜未见明显水肿,气道和血管周围未见明显炎症细胞浸润,以巨噬细胞为主。模型组小气管粘膜水肿较为明显,支气管管腔较正常组缩小,有的甚至闭塞,部分可见粘液栓。高倍镜下观察气道粘膜上皮细胞肿胀,多数细胞核被挤压至细胞边缘,杯状细胞增多,部分上皮细胞呈空泡样变性、部分坏死、脱落,气道周围小血管充血,部分扩张,粘膜基底层较正常组增厚,气道各层和血管周围组织有较多的炎症细胞浸润,主要以淋巴细胞和嗜酸性粒细胞为主。其余各组气道和血管周围可见不同程度的炎症细胞浸润,但均较哮喘模型组明显减轻。见图1。
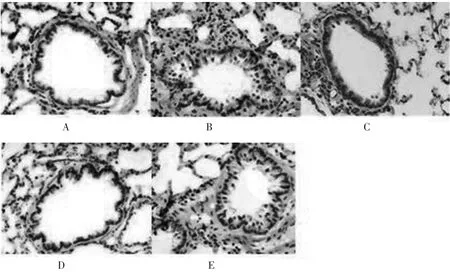
图1 各组大鼠肺组织病理形态学(HE,200×)Fig.1 Pathomorphology of lung among different groups of rats(HE,200×)
3.3 大鼠肺匀浆IL-17测定结果 各组大鼠肺匀浆IL-17含量差异有统计学意义(F=23.83,P<0.01)。与正常对照组比较,模型组大鼠肺匀浆IL-17表达显著增加,差异有统计学意义(P<0.01);与模型组比较,芍药甘草汤组、地塞米松组和中西医结合组均可显著降低IL-17水平,差异均有统计学意义(P<0.01);地塞米松组IL-17表达比芍药甘草汤组及中西医结合组均显著降低,差异均有统计学意义(P=0.049和 0.006)。见表2。
表2 各组大鼠肺匀浆IL-17及大鼠脾脏单个核细胞液中Th17细胞百分比比较(±S)Tab.2 Comparison of expression of IL-17 in lung homogenate and numbers of Th17 cells in spleen among different groups of rats(±S)
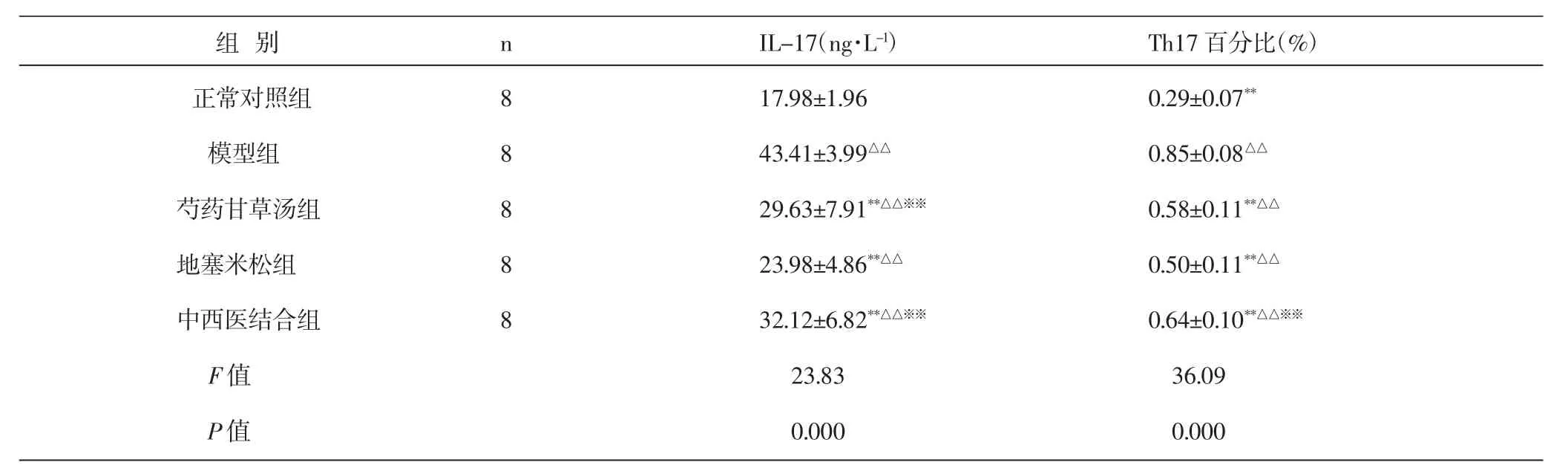
表2 各组大鼠肺匀浆IL-17及大鼠脾脏单个核细胞液中Th17细胞百分比比较(±S)Tab.2 Comparison of expression of IL-17 in lung homogenate and numbers of Th17 cells in spleen among different groups of rats(±S)
注:与正常对照组比较,△△P<0.01;与模型组比较,**P<0.01;与地塞米松组比较,※※P<0.01。Note:Compared with blank control group,△△P<0.01;Compared with model group,**P<0.01;Compared with dexamethasone group,※※P<0.01.
组别 n IL-17(ng·L-1) Th17百分比(%)正常对照组 8 17.98±1.96 0.29±0.07**模型组 8 43.41±3.99△△0.85±0.08△△芍药甘草汤组 8 29.63±7.91**△△※※0.58±0.11**△△地塞米松组 8 23.98±4.86**△△0.50±0.11**△△中西医结合组 8 32.12±6.82**△△※※0.64±0.10**△△※※F值 23.83 36.09 P值 0.000 0.000
3.4 各组大鼠脾脏Th17细胞含量比较 各组大鼠脾脏Th17细胞含量差异有统计学意义(F=36.09,P< 0.01)。与正常对照组比较,模型组大鼠Th17比例显著上升,差异有统计学意义(P<0.01);与模型组比较,芍药甘草组、地塞米松组及中西医结合组均能显著降低Th17比例,差异均有统计学意义(P<0.01);芍药甘草组与地塞米松组之间差异无统计学意义(P>0.05);地塞米松组较中西医结合组能显著降低Th17比例,差异均有统计学意义(P=0.008)。见表2、图2。
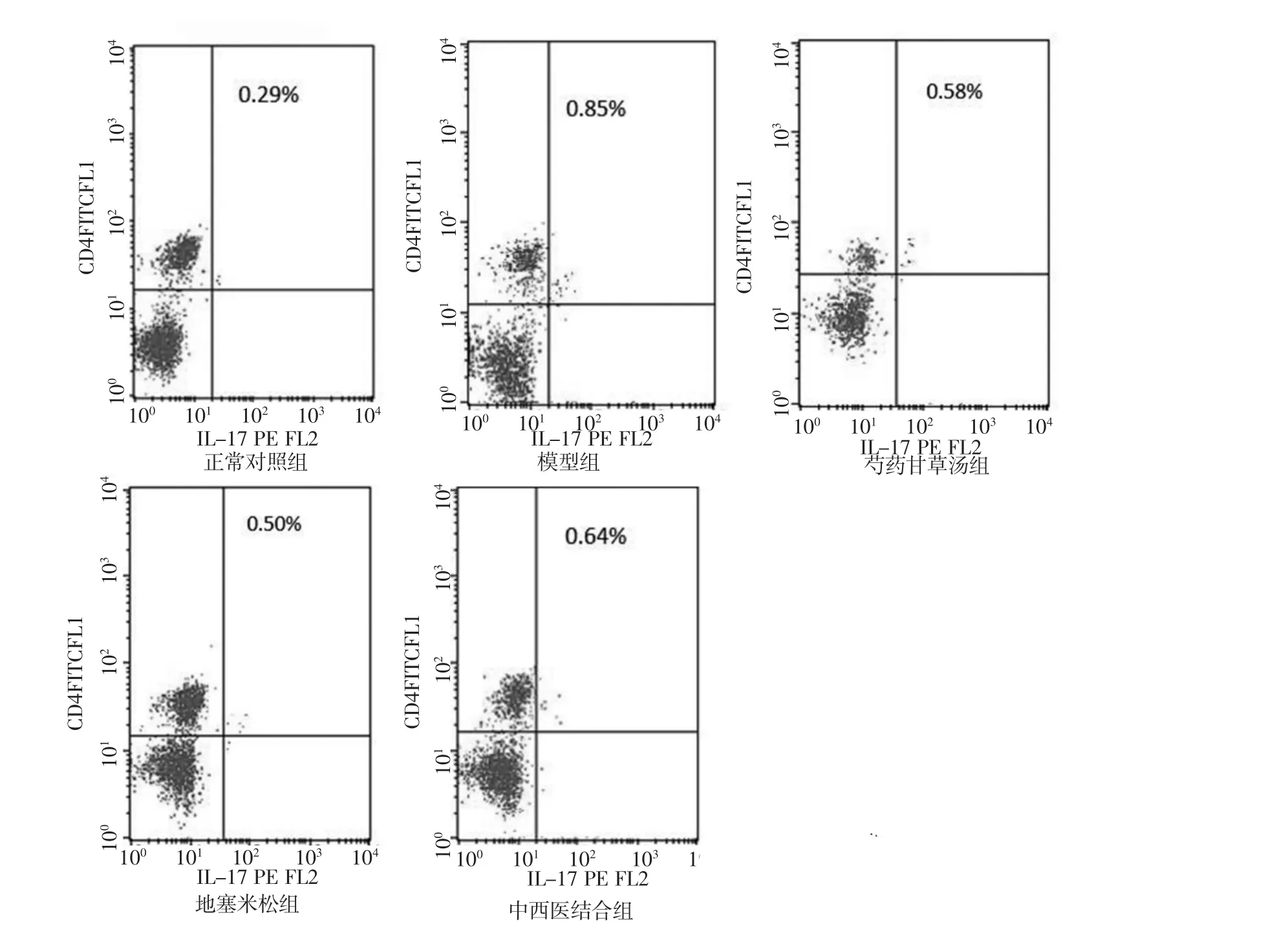
图2 Th17细胞流式细胞仪分析图Fig.2 Analysis graphics of numbers of Th17 cells in spleen among different groups of rats with flow cytometry
3 讨论
免疫学机制在哮喘发病机制中占有重要地位,既往研究发现Th1/Th2失衡表达是哮喘发病的主要免疫学机制[6],但目前发现该机制无法完全解释哮喘发病的免疫学机制。Th17细胞及其分泌的IL-17在哮喘的发病过程中起到重要作用。Th17细胞主要分泌IL-6、IL-17A、肿瘤坏死因子α(TNF-α)等炎性细胞因子。IL-17作为Th17细胞相关细胞因子,参与了哮喘的免疫学机制[7]。IL-17具有强大的致炎作用[8],同时参与了哮喘气道平滑肌细胞迁移、新生血管形成等作用[9],共同参与了气道重构。在此过程中嗜酸性粒细胞也起到了一定作用[10]。
芍药甘草汤系张仲景《伤寒论》中的著名方剂。主要由芍药和甘草二味中药等量组成。现代药理研究证实芍药甘草汤具有明显的解痉、镇痛、抑制气道重构等多种作用,并对支气管哮喘具有一定防治作用[3-4]。本实验研究表明,哮喘模型组大鼠BALF细胞总数和嗜酸性粒细胞含量均显著升高,三种药物干预后均可显著下降BALF细胞总数及嗜酸性粒细胞含量(P<0.01),同时本项目组发现芍药甘草组嗜酸性粒细胞水平较地塞米松组显著升高,说明芍药甘草汤降低嗜酸性粒细胞作用不及地塞米松明显,但中西医结合组嗜酸性粒细胞水平较芍药甘草汤组显著下降,说明中西医结合治疗可提高疗效。另一方面,哮喘模型大鼠肺匀浆中IL-17表达和单个核细胞液中Th17细胞含量均显著升高,经芍药甘草汤方干预后,其表达均显著下降(P<0.01),表明芍药甘草汤防治支气管哮喘作用机制可能与通过抑制Th17细胞及其细胞因子IL-17有关。三组药物组比较,地塞米松组IL-17表达比芍药甘草汤组及中西医结合组均显著降低,说明地塞米松抗IL-17细胞因子效果较好。地塞米松组Th17比例较中西医结合组显著降低(P=0.008),芍药甘草汤组较地塞米松组差异无显著性,说明芍药甘草汤抗Th17作用与地塞米松相似。需要指出的是中西医结合组采用的中药剂量与芍药甘草汤组相同,加用一半剂量地塞米松后两者Th17比例差异仍无统计学意义,但与地塞米松组比较,中西医结合组却显著升高Th17,而芍药甘草汤组与地塞米松组差异却无显著性,需要考虑实验的误差。同时本项目组研究还发现,虽然地塞米松组Th17比例较中西医结合组均显著降低,但是中西医结合组减少了地塞米松使用剂量,大鼠一般状态较地塞米松组好,提示中西医结合治疗哮喘能减少激素用量,减少其相关副作用。本研究只着眼于哮喘大鼠Th17细胞及其相关细胞因子IL-17表达变化,其上游信号通路有待进一步深入研究,同时在今后课题设计上可增加中药、西药单独用一半剂量的实验组,进一步完善实验研究,并进一步摸索实验方法,减少实验误差。
References:
[1] 中华医学会呼吸病分会哮喘学组.中国支气管哮喘防治指南(2016年版)[J].中华结核和呼吸杂志,2016,39(9):675-697. Asthma group of the respiratory disease branch of Chinese medical association.The guideline of prevention and treatment of bronchial asthma(2016)[J].Chinese Journal of Tuberculosis and Respiratory Diseases,2016,39(9):675-697.
[2] 刘斐,虞坚尔,白莉,等.中药内服治疗支气管哮喘的Meta分析[J].中华中医药学刊,2016,34(2):299-303. LIU Fei,YU Jian’er,BAILi,etal.Meta-analysison TCM in Treatment of Bronchial Asthma[J].Chinese Archives of Traditional Chinese Medicine,2016,34(2):299-303.
[3] 董雷,蔡宛如.芍药甘草汤对哮喘大鼠气道重塑的影响及相关机制研究[J].中药材,2016,39(4):887-890. DONG Lei,CAI Wanru.Researches of Effect of Shaoyao Gancao Decoction on Airway remodeling of Asthma Rats [J].Journal of Chinese Medicinal Materials,2016,39(4):887-890.
[4] 蔡宛如,钱华,朱渊红,等.芍药甘草汤平喘和抗过敏作用的实验研究[J].中国中西医结合急救杂志,2000,7(6):341-342. CAI Wanru,QIAN Hua,ZHU Yuanhong,et al.Experimental Study on The Anti-allergic and Anti-asthmatic Effects of Shaoyao Gancao Decoction[J].Chinese Journal of Integrated Traditional and Western Medicine in Intensive and Critical Care,2000,7(6):341-342.
[5] 吴滨,蔡宛如.芍药甘草汤对哮喘模型大鼠血清白细胞介素-4、白细胞介素-6及IgE影响的实验研究[J].福建中医药,2008,39(5):47-48. WU Bin,CAI Wanru.Effect of Shaoyao Gancao Decoction on IL-4,Il-8 and IgE of Asthma Rats[J].Fujian Journal of Traditional Chinese Medicine,2008,39(5):47-48.
[6] 李振球,麦志广,卢鉴财,等.支气管哮喘缓解期中医证型与Th1/Th2失衡的相关性研究[J].中国中医急症,2015,24 (10):1728-1730. LI Zhenqiu,MAI Zhiguang,LU Jiancai,et al.Research on the Correlation of the Types of Syndrome of Traditional Chinese Medicine in the Stable Phase of Asthma and the Unbalanced Rate-Th1/Th2[J].Journal of Emergency in Traditional Chinese Medicine,2015,24(10):1728-1730.
[7] Oboki K,Ohno T,Saito H,et al.Th17 and Allergy[J]. Allergology International Official Journal of the Japanese Society of Allergology,2008,57(2):121-134.
[8] Semik.Orzech A,Bawzyk A,Pierzchala W.The role of intedeukin 17A in inducing neutrophilie inflammation in the pulmonary track[J].Pol Merkur Lekarski,2007(22):163-168.
[9] Ying C,Laila A A,Paul-André R,et al.Th17-associated cytokines promote human airway smooth muscle cell proliferation[J].Faseb Journal Official Publication of the Federation of American Societies for Experimental Biology, 2012,26(12):5152-5160.
[10]张方琪,杨学敏,唐元元,等.嗜酸性粒细胞在哮喘发病机制中的研究进展[J].中华肺部疾病杂志:电子版,2013,6(2): 55-58. ZHANG Fangqi,YANG Xuemin,TANG Yuanyuan,et al. Research progress of eosinophils in the pathogenesis of asthma[J].Chin J Lung Dis(Electronic Edition),2013,6(2): 55-58.
Effects of Shaoyao Gancao Decoction on the Th17 and Its Cytokine IL-17 in Rats with Asthma
HE Fei,RU Chuhui,SHEN Xiaoqiang,et al 1.Integrated Chinese and Western Medicine Hospital of Zhejiang Province,Hangzhou(310003),Zhejiang,China;2.HangZhou Medical College
[Objective]To observe the effects of Shaoyao Gancao Decoction on Th17 and IL-17 in rats with asthma,and to explore its mechanism in treating asthma.[Methods]Male SD rats were randomly divided into normal control group,model group,Shaoyao Gancao Decoction group,dexamethasone group and integrated TCM-WM group(n=8 for each group).Asthma was induced by intraperitoneal injection of ovalbumin(OVA)and forced inhalation of atomized OVA. BALF cells in each group were collected.Expression of IL-17 was detected by Elisa method.Numbers of Th17 cells in spleen were analyzed by flow cytometry.[Results]Compared with model group,the total number of cells and the number of eosinophils(Eos)in BALF were decreased significantly in the treated groups(P<0.01).Compared with model group,expression of IL-17 in lung homogenate was decreased significantly in the treated group(P<0.01). Expression of IL-17 was decreased significantly in the dexamethasone group than other treated groups(P=0.049 and 0.006.Compared with model group,Shaoyao Gancao Decoction group decreased the percentages of Th17 cells(P<0.01).There was no significant difference of expression of Th17 between Shaoyao Gancao Decoction group and the dexamethasone group(P>0.05).[Conclusion]Shaoyao Gancao Decoction can efficiently regulate the numbers of Th17 cells and IL-17,which may be one of its mechanisms in preventing and treating asthma.
Shaoyao Gancao Decoction;bronchoalveolar lavage fluid;asthma;Th17 cells;IL-17;experimental study
R331
:A
1005-5509(2017)02-0112-05
10.16466/j.issn1005-5509.2017.02.004
2016-10-17)
浙江省自然科学基金(LY17H290004);杭州市科技发展计划项目(20120533Q27)
Fund projects:Natural Science Foundation ofZhejiang Province(LY17H290004);Hangzhou science and technology development plans(20120533Q27)
徐俭朴,E-mail:xujianpul@163.com
