枯草芽孢杆菌对香菇发酵液中蛋白质降解规律的影响
2017-03-06李新晶任清云王瑞娜柴昕源
李新晶,王 斌,任清云,王瑞娜,柴昕源,徐 睿
(绥化学院食品与制药工程学院,黑龙江绥化152061)
枯草芽孢杆菌对香菇发酵液中蛋白质降解规律的影响
李新晶,王 斌*,任清云,王瑞娜,柴昕源,徐 睿
(绥化学院食品与制药工程学院,黑龙江绥化152061)
通过探究枯草芽孢杆菌对香菇发酵液中蛋白质降解规律,以其为开发香菇为原料的益生菌保健品提供理论依据。本试验以香菇子实体为主要原料配制发酵培养液,接入枯草芽孢杆菌纯培养物种子液,分别在25、35、45℃下进行发酵培养,动态监测0~96 h内发酵液中蛋白质含量变化。结果表明:发酵温度对发酵液中蛋白质降解率有明显影响,发酵至96 h时发酵液中蛋白质降解率分别为42.58%、69.53%、83.96%,发酵温度决定了降解程度的峰值。45℃发酵温度有利于提高香菇发酵液中蛋白质等大分子的降解率、缩短发酵时间、提高发酵生产效率。
枯草芽孢杆菌;香菇;发酵液;蛋白质
香菇隶属于真菌门、担子菌亚门、层菌纲、伞菌目、侧耳科、香菇属,在我国素有“山珍”之称。研究表明,常食香菇有预防佝偻病、感冒、降低血压和血脂、提高机体免疫力、抗肿瘤、调节免疫和刺激干扰素形成的功能,其功能与香菇中的麦角甾醇(刘宏,2007)、多糖(梅光明等,2014;汲晨锋等,2013;阮海星等,2005)、黄酮 (李利华,2015、2009)、核苷酸(吴关威等,2010;边洪荣等,2002)等成分有关。以香菇为主要原料开发了香菇罐头、香菇片、香菇脆片、香菇营养薯片、香菇灵芝口香糖等食品 (糜志远等,2007),香菇酒 (赵贵红,2006;李兰等,2006)、香菇酸奶(郭红珍等,2005)和香菇可乐(李玲,2005)等香菇系列饮料,香菇酱(翟众贵等,2014;王莹钰等,2013)、香菇精(吴关威,2010;李波等,2009)等香菇系列调味品,并受到人们的青睐。香菇中的蛋白质含量较高,其干品蛋白质含量为18%~36%,高于鸡蛋和猪肉,但以缔合状态的非水溶性蛋白质为主 (何建芬等,2011;何晋浙等,1999),如何提高香菇中蛋白质的溶解性及吸收利用率成为研究热点问题。
枯草芽孢杆菌属于革兰氏阳性好气性细菌,是对人和动物安全有益的微生物,分泌蛋白酶、纤维素酶、几丁质酶、淀粉酶等胞外酶能力较强,其活菌制剂可治疗肠炎 (边连全等,2012;惠明等,2009)、腹泻(龚建刚等,2016;王强等,2010)等多种疾病。研究表明,枯草芽孢杆菌在20~50℃范围内,在多种常用培养基中均能良好生长。本试验以香菇子实体为主要原料配制成培养液,接入纯培养的枯草芽孢杆菌,分别在25、35、45℃发酵温度下探究枯草芽孢杆菌对香菇子实体蛋白质的降解规律,为开发香菇为原料的益生菌保健品提供理论支持。
1 材料与方法
1.1 材料与试剂 香菇(烘干品)购于黑龙江省绥化市华辰超市、枯草杆菌二联活菌颗粒(北京韩美药品有限公司);牛肉膏、蛋白胨、氯化钠、琼脂、葡萄糖、磷酸二氢钾、浓硫酸、硫酸钾、硫酸铜、硼酸、氢氧化钠、盐酸等均为分析纯。
1.2 仪器与设备 K9840全自动凯氏定氮仪,济南海能仪器有限公司;SH220石墨炉消解仪,济南海能仪器有限公司;FW100粉碎机,天津市泰斯仪器有限公司;FA2104电子天平,上海舜宇恒平科学仪器有限公司;SW-CJ-2F超净工作台,苏州净化设备有限公司;YXQ-LS-50SII型立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;SHA-B水浴恒温振荡器,天津市泰斯仪器有限公司;HPX-9162MBE数显电热培养箱,上海博迅实业有限公司医疗设备厂;电子万用炉,天津市泰斯仪器有限公司。
1.3 试验方法
1.3.1 枯草芽孢杆菌发酵菌株的分离 从活菌制剂枯草杆菌二联活菌颗粒中分离试验用枯草芽孢杆菌菌株,枯草杆菌二联活菌颗粒主要成分是枯草芽孢杆菌和屎肠球菌,根据枯草芽孢杆菌可耐受60℃高温而屎肠球菌不能耐受来分离枯草芽孢杆菌。取少量药品粉末溶解于灭菌生理盐水,连续十倍浓度梯度稀释至10-5,置于60℃培养箱中热处理120 min,取样0.2 mL涂布于牛肉膏蛋白胨琼脂培养基平板,培养平板先置于60℃培养箱培养50 min后再放入37℃培养箱中培养36 h,得灰白色不透明菌落,采用连续划线法传代纯化培养2次,经显微鉴定得到枯草芽孢杆菌纯培养物,作为后续发酵试验的菌种。
1.3.2 发酵培养液的配制 用香菇子实体干粉配制发酵培养液,香菇子实体中的蛋白质作为发酵培养液的唯一氮源。香菇子实体样品60℃干燥12 h,粉碎成粉,过80目标准筛,称取32.4 g过筛的香菇细粉,先悬浮于500 mL蒸馏水中,在磁力搅拌的条件下依次加入10.8 g葡萄糖,2.16 g磷酸二氢钾,最后加蒸馏水定容至1000 mL,得香菇子实体质量百分含量为3.24%的发酵培养液。搅拌均匀后平均分装到18个三角瓶中,即每个三角瓶培养液装量为55 mL(折合每瓶装入1.80 g的香菇粉,发酵液葡萄糖初始浓度为1.08%),用棉塞封口双层牛皮纸包扎瓶口,121℃高压蒸汽灭菌20 min。
1.3.3 发酵过程控制与取样 无菌条件下,向每个三角瓶中接入枯草芽孢杆菌种子液1mL(种子液用PDA培养基培养,种龄为24 h,活菌浓度为1.8×108cfu/mL)。按发酵温度将上述装有接种枯草芽孢杆菌发酵培养液的三角瓶平均分成三组,分别置于25、35、45℃气浴恒温振荡器中进行发酵培养,振荡频率为160 r/min,在发酵至12、24、36、48、72、96 h分别取3个发酵温度下三角瓶1瓶,以每瓶发酵液为测定对象(另留取1 mL发酵液用于菌落测定),进行蛋白质含量测定。称取1.80 g的香菇粉末,加入55 mL的蒸馏水、1 mL枯草芽孢杆菌种子液搅拌均匀,然后立即进行抽滤得滤饼并测定蛋白质含量,作为发酵0 h的对照试验。上述各组试验平行3次。
1.3.4 蛋白质含量测定与蛋白质降解率计算 发酵过程中按上述1.3.3步骤的要求定期取样,发酵液抽滤后收集全部滤渣,用K9840全自动凯氏定氮仪测定发酵液滤渣的蛋白质含量。发酵过程中,枯草芽孢杆菌产生蛋白酶、纤维素酶、几丁质酶等降解酶,各种酶协同作用于香菇子实体细胞壁及胞内蛋白质,其中蛋白质降解成可溶性多肽和氨基酸,未被降解的蛋白质则在过滤时滞留于滤渣,通过测定各个发酵阶段发酵液滤渣蛋白质含量变化可反映香菇子实体蛋白质随发酵时间的动态降解规律,发酵培养液中蛋白质降解率的计算公式如下:
发酵培养液中香菇蛋白质的降解率/%=(发酵前培养液中蛋白质的总含量-发酵各阶段样品滤渣中蛋白质的含量)/发酵前培养液中蛋白质的总含量×100。
1.3.5 发酵液中枯草芽孢杆菌的菌落数 发酵至12、24、36、48、72、96 h时,分别取三个发酵温度下的发酵液1 mL用于菌落测定,采用连续稀释涂布平板法测定发酵液中的活菌浓度。取无菌试管6只,各加入无菌生理盐水9 mL,吸取发酵液1 mL注入第一管中,并依次作10倍递增稀释,得到10-1、10-2、10-3、10-4、10-5、10-6、10-7七个浓度,用移液器分别吸取所选定的各种稀释液0.1 mL涂布于无菌琼脂培养皿中,每个浓度做3个平行,35℃培养36 h统计菌落数(cfu),菌落数乘以相应的稀释倍数即得到每mL发酵液中所含的枯草芽孢杆菌菌落数。
2 结果与分析
2.1 发酵温度对香菇发酵液中蛋白质降解率的影响 由图1可知,发酵温度对香菇子实体蛋白质的降解率产生了明显影响,在发酵96 h时,25、35、45℃发酵的蛋白质降解率分别为 42.58%、69.53%、83.96%。在0~96 h的发酵过程,蛋白质的降解率随着发酵时间的延长降解率逐渐增大,虽然25、35、45℃三个发酵温度下发酵液中的蛋白质降解率呈现了相似的变化趋势 (即在发酵的0~24 h内蛋白质降解速率较快,而24 h以后降解速率显著下降),但不同发酵时间段还是有较大差别,25℃发酵前12 h内降解速率非常缓慢,12~ 24 h才进入加速降解阶段,发酵24 h时的降解率为27.92%,发酵96 h的降解率为42.58%,与24 h相比仅增加了14.66%,相对增幅为52.51%,这说明25℃条件下发酵24 h后发酵时间对降解率影响较小,表明25℃低温下菌体难以利用或降解香菇蛋白,推测原因可能是此温度下蛋白酶的种类及数量较少,或蛋白酶在此温度下活性较低。而35℃、45℃发酵降解率在24 h内接近直线增长,始终处于加速降解状态,发酵24 h时的降解率分别为35.04%、54.56%,发酵24 h后的降解趋势产生了较大差别,发酵96 h的降解率与发酵24 h相比,分别增加了34.79%、29.40%,相对增幅分别为99.29%,53.89%,这说明45℃在发酵24 h后降解率有所减慢,但仍保持旺盛的降解能力,35℃~ 45℃的发酵温度下,发酵时间是影响降解率的决定性因素,可通过适当延长发酵时间的策略提高发酵液中蛋白质的降解率。
2.2 发酵时间对香菇发酵液中枯草芽孢杆菌数量的影响 图2表明,25、35、45℃三个发酵温度下枯草芽孢杆菌的增殖方式有很大差别,在0~ 96 h的测试范围内,高温发酵菌体数量变化幅度较大,而低温下发酵菌体数量变化幅度较小。25℃条件下,0~72 h菌体数量保持增加但增幅很小,发酵至72 h时菌落数达到峰值,达峰值浓度的时间滞后于35、45℃条件36 h,达峰时的菌落数,35℃是其1.46倍(第1次达峰),45℃是其4.37倍。35℃的发酵条件下,菌体数量呈先增加后降低再增加而后降低的二次增长现象,即分别在发酵至36、72 h出现两次菌体高峰值且后者高峰数值高于前者高峰数值,相差约2倍,推测其原因是发酵液中除了蛋白质外,碳源是限制菌体繁殖的营养物质,当发酵液中的葡萄糖消耗竭尽后菌体因为缺少碳源而死亡,而后开始分解利用香菇子实体中的多糖作为碳源,从而产生第二次增殖高峰。45℃的发酵条件下,菌落数的变化趋势与35℃相似,但变化幅度更大,且进入第一次菌体浓度低谷值和第二次菌体数量高峰值时间有较大差别,45℃下发酵至72 h时才进入第一次菌体浓度低谷值,滞后于35℃条件24 h,而后两者发酵液中的菌体数量又开始升高逐渐开始了二次增长阶段。
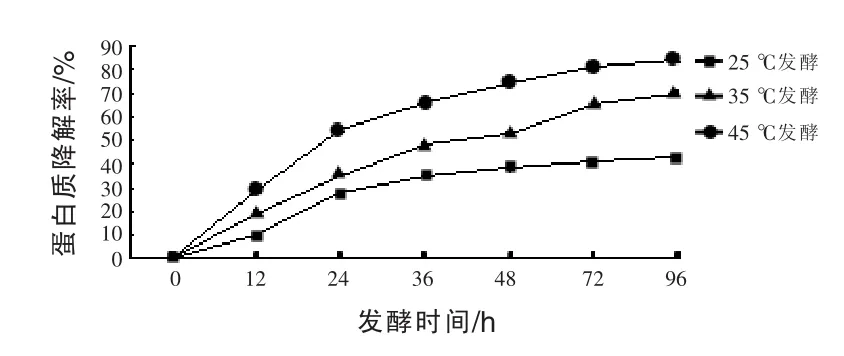
图1 发酵温度对香菇发酵液中蛋白质降解率的影响
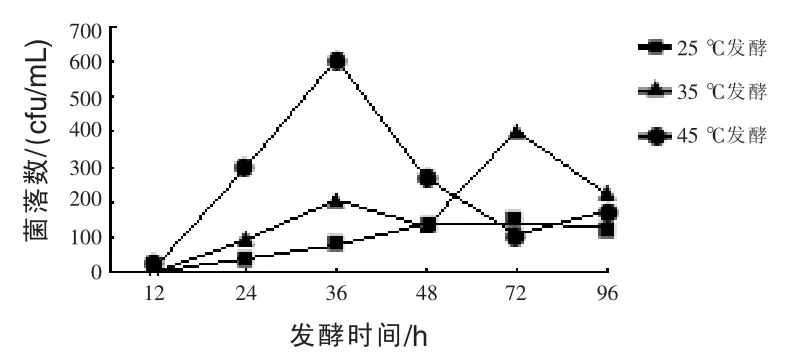
图2 发酵时间对香菇发酵液中枯草芽孢杆菌菌落数的影响
3 结论
本试验结果表明,发酵温度对香菇子实体蛋白的降解率有明显影响,提高发酵温度可明显提高发酵液中香菇蛋白的降解率,缩短发酵时间。另外,三个发酵温度下枯草芽孢杆菌的增殖方式有很大差别,高温发酵菌体数量变化幅度较大,而低温下发酵菌体数量变化幅度较小。35℃和45℃发酵过程中,菌体数量均出现二次增长现象,并且45℃下发酵进入第一次菌体浓度低谷值的时间,滞后于35℃条件24 h。
[1]边洪荣,李小娜,潘海宇,等.香菇有效成分提取分离及分析方法研究进展[J].中草药,2002,9:附1~附2.
[2]边连全,杜欣,刘显军.枯草芽孢杆菌—菊糖合生元对断奶仔猪生长性能及体液免疫功能的影响[J].动物营养学报,2012,24(2):280~284.
[3]龚建刚,邵丽玮,冯志华,等.一种枯草芽孢杆菌 ~刺五加多糖合生元的制备[J].中国饲料,2016,17:23~26.
[4]郭红珍,张燕.金针菇与香菇酸奶的研制[J].乳品加工,2005,9:37~39.
[5]何建芬,王东明.几个常见香菇品种营养成分的分析与评价[J].食药用菌,2011,19(4):18~19.
[6]何晋浙,孙培龙,朱建标,等.香菇营养成分的分析[J].食品研究与开发,1999,20(6):44~46.
[7]惠明,窦丽娜,田青,等.枯草芽孢杆菌的应用研究进展[J].安徽农业科学,2008,36(27):11623~11624.
[8]汲晨锋,岳磊.香菇多糖的化学结构及抗肿瘤作用研究进展[J].中国药学杂志,2013,18:1536~1539.
[9]李波,聂磊,索晓敏,等.香菇精粉喷雾干燥工艺研究[J].农产品加工(学刊),2009,3:87~89.
[10]李兰,郭丹钊,熊庆伟.香菇酒发酵工艺条件优化[J].酿酒,2006,33(1):68~70.
[11]李利华.香菇中总黄酮含量的测定及抗氧化活性研究[J].光谱实验室,2009,26(3):680~684.
[12]李玲.香菇可乐加工工艺及营养分析[J].食品科技,2005,3:79~80.
[13]刘宏.食用菌营养价值及开发利用[J].中国食物与营养,2007,12:25~27.
[14]梅光明,张小军,郝强,等.酸提香菇多糖的抗氧化活性研究[J].浙江海洋学院学报自然科学版,2014,33(5):406~413.
[15]糜志远,张迎庆.香菇深加工产品开发进展[J].食品工程,2007,4:15~17.
[16]阮海星,张卫国,付家华,等.香菇多糖及营养成分分析[J].微量元素与健康研究,2005,22(2):35~36.
[17]王强,彭开松,严兵,等.枯草芽孢杆菌源抗生素研究进展[J].动物医学进展,2010,31(9):97~101.
[18]王莹钰,王雨生,陈海华,等.麻辣香菇酱制作工艺和配方的研究[J].青岛农业大学学报(自然科学版)2013,30(1):46~52.
[19]吴关威,李敏,刘吟,等.纤维素酶法提取香菇柄中呈味核苷酸工艺研究[J].中国调味品,2010,35(12):41~13,59
[20]吴关威.香菇柄中滋味成分释放研究及香菇精的研制:[硕士学位论文] [D].湖北武汉:华中农业大学,2010.
[21]翟众贵,李宏梁,张婷.香辣香菇酱加工工艺的研究[J].中国调味品,2014,39(2):62~66.
[22]赵贵红.芦笋香菇保健酒的研制[J].食用菌,2006,2:45.■
参考文献
[1]Adler-Nissen J.Enzymatic hydrolysis of food proteins[M].London:Elsevier Applied Science Publishers,1986.110~169.
[2]Ahn C B,Jeon Y J,Kim Y T,et al.Angiotensin I converting enzyme (ACE)inhibitory peptides from salmon byproduct protein hydrolysate by Alcalase hydrolysis[J].Process Biochemistry,2012,47(12):2240~2245.
[3]Ambigaipalan P,Al-Khalifa A S,Shahidi F.Antioxidant and angiotensin I converting enzyme(ACE)inhibitory activities of date seed protein hydrolysates prepared using Alcalase,Flavourzyme and Thermolysin[J].Journal of Functional Foods,2015,18:1125~1137.
[4]Bakris G L,Ritz E,World Kidney Day Steering C.The message for World Kidney Day 2009:hypertension and kidney disease:a marriage that should be prevented[J].Journal of the American Society of Hypertension,2009,3(2):80~83.
[5]Bernardini D R,Mullen A M,Bolton D,et al.Assessment of the angiotensin-I-converting enzyme(ACE-I)inhibitory and antioxidant activities of hydrolysates of bovine brisket sarcoplasmic proteins produced by papain and characterisation of associated bioactive peptidic fractions[J].Meat Science,2012,90(1):226~235.
[6]Chen J,Liu S,Ye R,et al.Angiotensin-I converting enzyme(ACE)inhibitory tripeptides from rice protein hydrolysate:Purification and characterization[J].Journal of Functional Foods,2013,5(4):1684~1692.
[7]Correa A P,Daroit D J,Fontoura R,et al.Hydrolysates of sheep cheese whey as a source of bioactive peptides with antioxidant and angiotensin-converting enzyme inhibitory activities[J].Peptides,2014,61:48~55.
[8]Jang H L,Liceaga A M,Yoon K Y.Purification,characterisation and stability of an antioxidant peptide derived from sandfish(Arctoscopus japonicus)protein hydrolysates[J].Journal of Functional Foods,2016,20:433~442.
[9]Jia J,Ma H,Zhao W,et al.The use of ultrasound for enzymatic preparation of ACE-inhibitory peptides from wheat germ protein[J].Food Chemistry,2010,119(1),336~342.
[10]Jia J,Wu Q,Yan H,et al.Purification and molecular docking study of a novel angiotensin-I converting enzyme(ACE)inhibitory peptide from alcalase hydrolysate of ultrasonic-pretreated silkworm pupa(Bombyx mori)protein[J]. Process Biochemistry,2015,50(5):876~883.
[11]Jin J,Ma H,Wang B,et al.Effects and mechanism of dual-frequency power ultrasound on the molecular weight distribution of corn gluten meal hydrolysates[J].Ultrasonics Sonochemistry,2016b,30:44~51.
[12]Kuba M,Tanaka K,Sesoko M,et al.Angiotensin I-converting enzyme inhibitory peptides in red-mold rice made by Monascus purpureus[J].Process Biochemistry,2009,44(10):1139~1143.
[13]Qu W,Ma H,Jia J,et al.Enzymolysis kinetics and activities of ACE inhibitory peptides from wheat germ protein prepared with SFP ultrasound-assisted processing[J].Ultrasonics Sonochemistry,2012,19(5):1021~1026.
[14]Qu W,Ma H,Zhao W,et al.ACE-inhibitory peptides production from defatted wheat germ protein by continuous coupling of enzymatic hydrolysis and membrane separation:Modeling and experimental studies[J].Chemical Engineering Journal,2013,226:139~145.
[15]Sokolowski A,Richard P,Fichet D,et al.Application of trichloroacetic acid(TCA)to extraction of soft body for the determination of tissue Cd,Cu,Pb and Zn in the prosobranch Hydrobia ulvae(Pennant)[J].Marine Pollution Bulletin,2003,46(10):1326~1333.
[16]Vercruysse L,Smagghe G,Beckers T,et al.Antioxidative and ACE inhibitory activitiesin enzymatic hydrolysatesofthe cotton leafworm,Spodoptera littoralis[J].Food Chemistry,2009,114(1):38~43.
[17]Zhong F,Zhang X,Ma J,et al.Fractionation and identification of a novel hypocholesterolemic peptide derived from soy protein Alcalase hydrolysates[J]. Food Research International,2007,40(6):756~762.
[18]Zhu K,Zhou H,Qian H.Antioxidant and free radical-scavenging activities of wheat germ protein hydrolysates(WGPH)prepared with alcalase[J].Process Biochemistry,2006,41(6):1296~1302.■
The rule degradation of protein in Lentinus edodes fermentation broth of Bacillus subtilis was studied in order to provide theoretical support for the development of probiotic health care products of raw materials.Access pure culture of the Bacillus subtilis to Lentinus edodes as the main raw material preparation of culture liquid,fermentation in 25,35,45℃respectively,the protein content and Bacillus subtilis colony number in fermentation liquid 0~90 h were determined.The results showed that the fermentation temperature has a significant effect on the degradation rate of the Letinous edodes seed protein.The degradation rate of protein in fermentation broth at 96 h were 42.58%,69.53%,83.96%. The fermentation temperature determined the peak value of the degree of degradation.The fermentation temperature of 45℃is beneficial to improve the degradation rate of protein and other macromolecules in letinous edodes fermentation broth,shorten the fermentation time and improve the production efficiency.
Bacillus subtilis;Lentinus edodes;fermentation broth;protein
S816.7
A
1004-3314(2017)03-0020-03
10.15906/j.cnki.cn11-2975/s.20170306
黑龙江省大学生创新创业训练计划项目(201510236015);绥化学院“天然药物与食药用菌质量评价及功能保健品开发研究团队”阶段性研究成果
*通讯作者
