胚胎干细胞转染外源基因教学实验优化
2017-03-02王敏君刘清桂胡以平
陈 费, 王敏君, 姚 浩, 刘清桂, 胡以平
(第二军医大学 基础部细胞生物学教研室, 上海 200433)
胚胎干细胞转染外源基因教学实验优化
陈 费, 王敏君, 姚 浩, 刘清桂, 胡以平
(第二军医大学 基础部细胞生物学教研室, 上海 200433)
针对胚胎干细胞的培养和外源基因转染实验教学过程中,存在学生培养的胚胎干细胞状态较差、转染外源基因效率偏低等问题,通过实验探索,发现通过控制接种滋养层细胞的密度、悬浮转染代替传统贴壁转染的方法,可显著改善上述问题。该探索不仅优化了转染方法、提高了教学效果,也为学生培养科研能力奠定了基础。
胚胎干细胞; 基因转染; 实验优化
胚胎干细胞(embryonic stem cells, ES)一般是指由分离自哺乳动物胚泡(blastocyst)的内细胞团所建立的细胞系,它们具有无限增殖能力和多向分化潜能。因此,研究胚胎干细胞无论是对个体生长、发育以及调控的认识,还是其在疾病、制药和组织再生的应用都有至关重要的作用[1]。在高等院校生命科学和医学相关专业中,胚胎干细胞的培养和基因改造是兼具重要性和探索性的实验课之一[2];同时其作为一项综合性实验,在整个过程中学生可学会无菌操作、细胞培养、质粒抽提、细胞转染以及染色等一系列基本的实验操作步骤和技能,为后继的实验和科学研究奠定基础[3]。然而由于实验本身半自主性的特点,容易造成细胞基因改造的结果不稳定,甚至全部阴性的结果,导致学生不自信、对实验没有兴趣等后果。为此,本文结合常见问题和本校实验室条件,优化了胚胎干细胞转染基因的转染方法,并得到了显著成效。
1 实验原理
1.1 小鼠胚胎干细胞的培养
小鼠胚胎干细胞的培养采用文献[4]报道的培养方法。滋养层为经过丝裂霉素C处理的小鼠胚胎成纤维细胞,培养基为含有谷氨酰胺、丙酮酸钠、非必须氨基酸、β-巯基乙醇、抗生素以及胎牛血清的DMEM(dulbecco’s modified eagle’s medium),小鼠胚胎干细胞为实验室自留细胞系。
1.2 小鼠胚胎干细胞的转染
胚胎干细胞采用脂质体Lipofectamin 2000转染法[5]。其原理:脂质体表面带正电荷,通过静电作用将带有负电荷的核酸(本实验用携带β-半乳糖苷酶基因的完整质粒)包裹入内,形成脂质体-DNA复合物;与此同时,脂质体也可被带有负电荷的细胞膜吸附,通过膜流或者胞吞将脂质体-DNA复合物传递进入细胞,进而表达外源基因。
1.3 外源基因转染结果检测
外源基因转入胚胎干细胞的检测采用β-半乳糖苷酶活性检测法[6]。β-半乳糖苷酶由β-半乳糖苷酶基因编码,本实验转入的是大肠杆菌β-半乳糖苷酶基因(LacZ基因),小鼠胚胎干细胞本身不表达,因此可通过酶活性显色的方法来判断外源基因是否转染成功。其显色采用美国Invitrogen公司的试剂盒来检测,该试剂盒中含有β-半乳糖苷酶的作用底物5-溴-4-氯-3-吲哚-β-D半乳糖苷(X-gal),水解后产物呈蓝色,易于显微镜检和观察。
2 实验方法
2.1 滋养层的制备
选取第3—第5代状态较好的小鼠胚胎成纤维细胞,按照适当比例进行传代;其中实验组按照1∶4传代并接种细胞至T25的培养瓶中,对照组按照1∶2传代并接种细胞至T25的培养瓶中。第二天对细胞进行丝裂霉素C处理4 h后,洗净并换用正常培养基,放入培养箱等待接种胚胎干细胞[7-8]。
2.2 小鼠胚胎干细胞的接种和转染
将预混的脂质体和质粒室温静置20 min(具体配比参考Invitrogen公司脂质体说明书以及文献[9])。
实验组:接种胚胎干细胞的同时,加入脂质体-质粒预混液,补入培养基后混匀,放入培养箱,6 h后换液。
对照组:接种胚胎干细胞,于第二天细胞贴壁后加入脂质体-质粒预混液,补入培养基后混匀,放入培养箱,6 h后换液[10]。
2.3 外源基因的表达检测
转染24 h后,可对细胞进行外源基因的检测。染色使用Invitrogen公司的β-gal Staining Kit,详细步骤参考相关说明书和文献[11]。
3 实验结果
3.1 50%~70%汇合度的滋养层细胞更利于胚胎干细胞的生长
小鼠胚胎干细胞分别接种于不同汇合度的滋养层细胞。其中实验组滋养层细胞为1∶4传代获得,接种胚胎干细胞时细胞汇合度约为60%;对照组滋养层细胞为1∶2传代获得,接种时细胞汇合度>95%,细胞近乎长满。两组对比可发现,实验组的较低汇合度滋养层细胞,胚胎干细胞克隆外周光亮,克隆立体感强,相同培养时间克隆数更多,克隆更大更为饱满,见图1;对照组滋养层细胞已接近长满,干细胞克隆相对较小,克隆数也相对较少,见图2。由此发现,滋养层的汇合度对胚胎干细胞的生长状态的影响很关键,同样条件下,50%~70%汇合度滋养层细胞比长满的滋养层细胞更利于胚胎干细胞的生长。
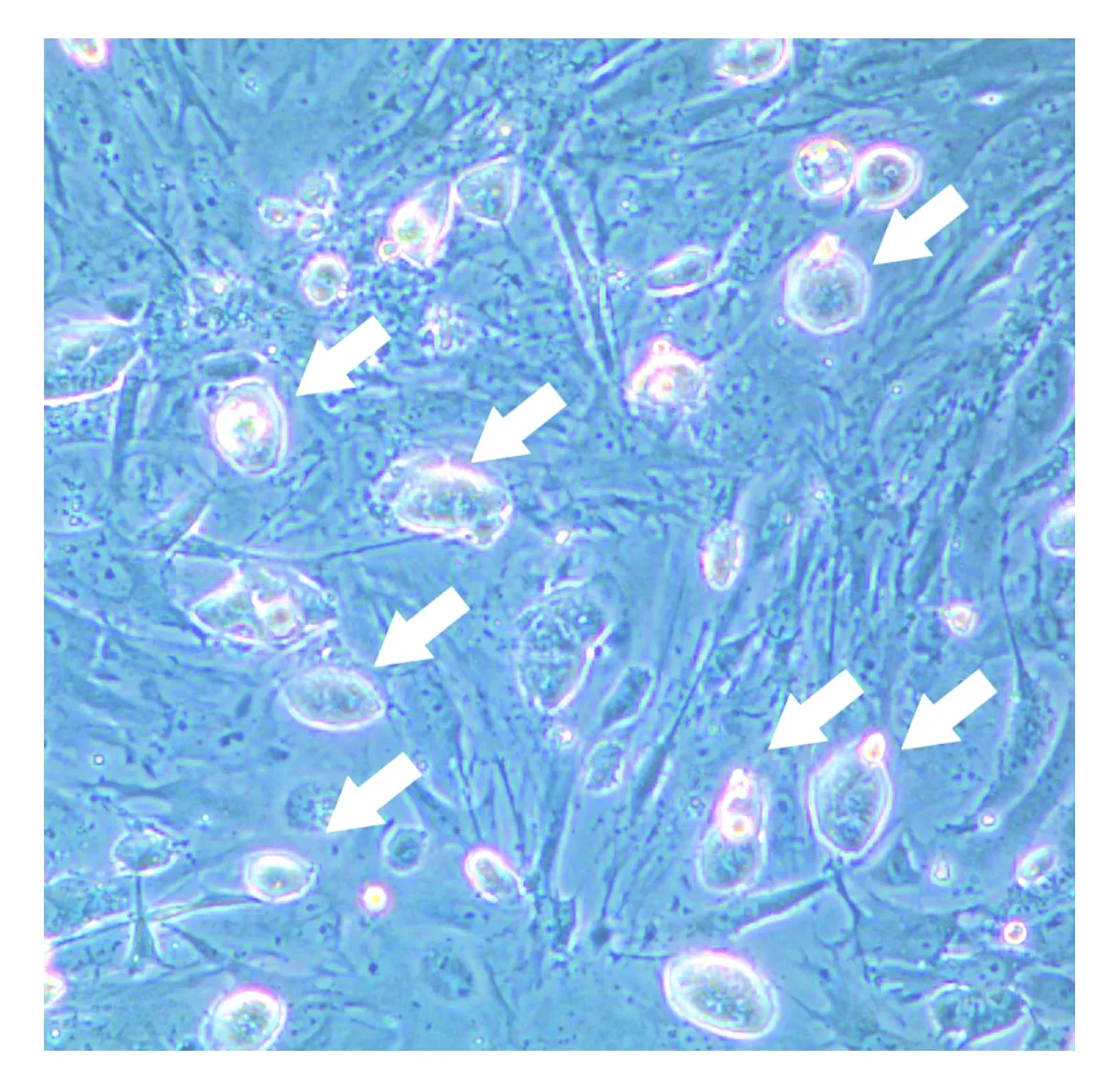
图1 实验组滋养层细胞在60%汇合度时小鼠胚胎干细胞生长状态光学显微镜照片(100倍,箭头指示克隆)
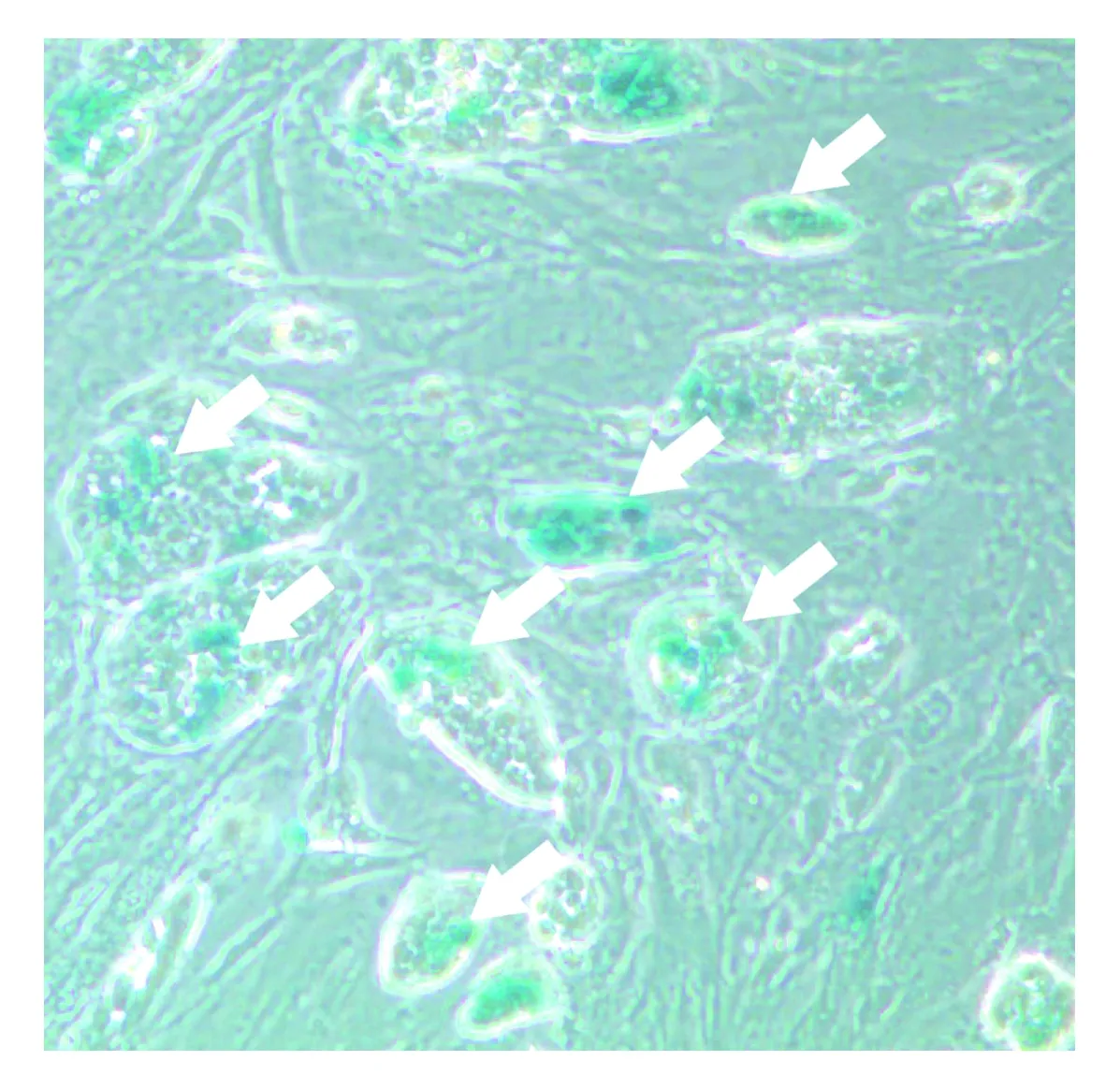
图2 对照组滋养层细胞在>95%汇合度时小鼠胚胎干细胞生长状态光学显微镜照片(100倍,箭头指示克隆)
3.2 悬浮转染法可显著提高胚胎干细胞转染效率
转染后的细胞经染色和显微镜观察,其中蓝色的颗粒状沉淀(见图3和图4)为外源转入基因的表达显色。通过比较和统计可发现,悬浮状态下转染胚胎干细胞的效率要明显高于贴壁时的效率;转染效率实验组为81.5%±4.3%(见图3);对照组为26.7%±5.6%(见图4)。因此,悬浮转染法可显著提高胚胎干细胞的转染效率。

图3 实验组小鼠胚胎干细胞转染外源基因β-半乳糖苷酶底物显色光学显微镜照片(100倍,箭头指示阳性)
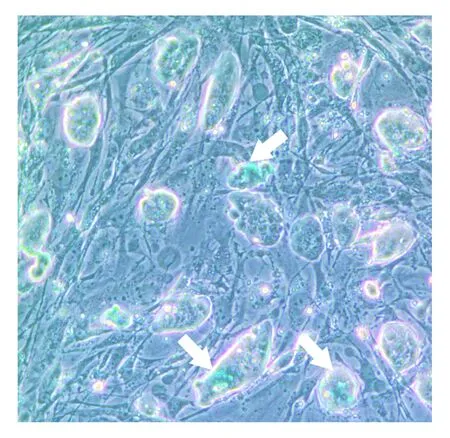
图4 对照组小鼠胚胎干细胞转染外源基因β-半乳糖苷酶底物显色光学显微镜照片(100倍,箭头指示阳性)
4 讨论与总结
本实验的改进,是前期教学探索的成果。在探索过程中,积极发挥了学生的作用,让学生与教师一起发现问题,并在开放实验中共同解决问题。当然,本实验的改进也只是其中一个方面,整个实验过程连续而复杂,还有很多值得细究和考虑的因素。比如,用来制备滋养层细胞时小鼠胚胎成纤维细胞的质量,外源质粒本身的特点,以及质粒和脂质体配比等其他原因,都是将来值得师生共同探索的着手点。
基础实验操作是生命科学以及医学类相关专业本科生培养过程中必备的技能之一。通过实验教学,不仅可以使学生掌握动手能力,让学生体验亲身验证所学到的理论知识,更重要的是通过实验来培养和开拓学生的思维能力[12]。胚胎干细胞的培养与基因改造是经典和重要的基础实验,通过学生的学习和反馈能发现问题并改进,锻炼学生操作技能的同时也培养了学生的科研思维[13],为学生将来的学习奠定基础。
References)
[1] Nishikawa S, Jakt L M, Era T. Embryonic stem-cell culture as a tool for developmental cell biology [J]. Nat Rev Mol Cell Biol, 2007,8(6):502-507.
[2] 李建秀,张红霞,谢东甫,等. 生物技术专业细胞工程实验教学的设计与体会[J]. 山西医科大学学报(基础医学教育版), 2011,13(5):457-459.
[3] 王敏君,陈费,刘长城,等. 细胞工程实验教学改革的实践与探讨[J]. 基础医学教育, 2015,17(3):220-222.
[4] Ko B S, Chang T C, Shyue S K, et al. An efficient transfection method for mouse embryonic stem cells [J]. Gene Ther, 2009,16(1):154-158.
[5] 陈天姬,杜娟,卢光琇. 小鼠胚胎干细胞转染条件的优化[J]. 西北农林科技大学学报(自然科学版), 2010,38(12):20-24.
[6] 张莉,李庆章,田雷. β-半乳糖苷酶研究进展[J]. 东北农业大学学报, 2009,40(7):128-131.
[7] 黄林,莫曾南,覃敏. 昆明小鼠胚胎干细胞滋养层制备条件的实验研究[J]. 现代生物医学进展, 2010(1):62-65.
[8] 周结学,刘东,郑克立,等.鼠胚成纤维细胞的培养条件及滋养层制备[J]. 中国组织工程研究与临床康复, 2008,12(34):6607-6611.
[9] Silver D L. A carboxyl-terminal PDZ-interacting domain of scavenger receptor B, type I is essential for cell surface expression in liver [J]. 2002,277(37):34042-34047.
[10] 陈红,钱坤,张苏明. 不同转染方法及GFP表达载体对小鼠胚胎干细胞转染效率的比较[J]. 华中科技大学学报(医学版),2006,35(4):536-537.
[11] Ghanekar A, Mendicino M, Liu H, et al. Endothelial induction of fgl2 contributes to thrombosis during acute vascular xenograft rejection [J]. J Immunol, 2004,172:5693-5701.
[12] 黄卫锋,盛德乔,张忠寿,等.在医学细胞生物学实验教学中培养学生创新能力的几点建议[J]. 教育教学论坛,2013(32):123-124.
[13] 张伟. 细胞生物学实验教学中学生科研能力培养的措施研究[J]. 高等理科教育, 2012(1):130-133.
Optimization of teaching experiment on transfecting exogenous gene into embryonic stem cell
Chen Fei, Wang Minjun, Yao Hao, Liu Qinggui, Hu Yiping
(Teaching and Research Section of Cell Biology, Second Military Medical University, Shanghai 200433, China)
Aiming at the problems existing in the experimental teaching of culturing embryonic stem cells and transfecting exogenous gene such as the poor state of embryonic stem cells cultured by the students, the low efficiency of transfecting exogenous gene, etc., and through the experimental exploration, this paper finds that the above-mentioned problems can be significantly improved by the method of controlling the density of inoculation of trophoblast cells and the suspensive transfection instead of the traditional adherent transfection. This exploration not only optimizes the transfecting method and improves the teaching effect, but also lays the foundation for cultivating the students’ scientific research ability.
embryonic stem cells; gene transfection; optimization of experiment
10.16791/j.cnki.sjg.2017.02.014
2016-08-25 修改日期:2016-10-17
国家自然科学基金青年基金项目(31601101)
陈费(1988—),女,安徽当涂,博士,讲师,从事组织干细胞特性鉴定、细胞移植研究以及细胞生物学教学工作
E-mail:twinkky@163.com
胡以平(1954—),男,四川射洪,博士,教授,研究方向为肝脏干细胞.
E-mail:yphu@smmu.edu.cn
Q813;G642.423
B
1002-4956(2017)2-0050-03
