自噬与A型流感病毒感染
2017-03-01徐利军刘秀梵
徐利军,刘秀梵,顾 敏
(1.扬州大学兽医学院,江苏扬州 225009;2.扬州出入境检验检疫局,江苏扬州 225009;3.江苏省人兽共患病学重点实验室,江苏扬州 225009;4.江苏高校动物重要疫病与人兽共患病防控协同创新中心,江苏扬州 225009)
专论与讲座
自噬与A型流感病毒感染
徐利军1,2,刘秀梵1,3,4*,顾 敏1,3,4*
(1.扬州大学兽医学院,江苏扬州 225009;2.扬州出入境检验检疫局,江苏扬州 225009;3.江苏省人兽共患病学重点实验室,江苏扬州 225009;4.江苏高校动物重要疫病与人兽共患病防控协同创新中心,江苏扬州 225009)
自噬是广泛存在于真核细胞内的新陈代谢过程,对于维持细胞自稳具有关键作用。在病毒感染过程中,自噬表现出两面性,既可被利用来促进病毒复制,又在宿主抗感染免疫应答中发挥重要作用。论文以严重危害畜禽生产和人类健康的A型流感病毒为例,论述了细胞自噬与病毒感染及在宿主免疫应答过程中的相互关系,旨在进一步深入理解A型流感病毒的致病分子机制,为抗流感病毒感染的相关研究提供参考。
自噬;A型流感病毒;感染;免疫应答
自噬(autophagy)是一个高度受控的细胞内代谢过程,用于消化降解自身的成分,在细胞内发挥“持家”的作用[1]。正常情况下,细胞保持较低水平的自噬以维持内环境的稳定,当营养缺乏、处于应激状态或有病原感染时,细胞内自噬水平显著提高。研究表明,自噬在病毒感染和宿主免疫应答过程中扮演着重要角色[1-2]。已知多种亚型的A型流感病毒可以对人/动物造成严重危害,威胁公共卫生安全[3-6],了解其致病的相关分子机制对于科学地防控流感具有重要指导意义。然而,目前国内外关于细胞自噬与A型流感病毒感染的研究报道相对较少。本文从自噬的基本过程、流感病毒如何利用自噬进行自我复制以及自噬在宿主免疫应答中的抗病毒作用机制等方面对相关的研究进展进行综述,以期为抗流感病毒感染的研究提供参考。
1 细胞自噬概述
1.1 细胞自噬的概念
细胞自噬又称为Ⅱ型细胞死亡,是细胞在自噬相关基因(autophagy-related gene,ATG)的调控下利用溶酶体降解自身受损的细胞器和大分子物质的过程,最早由Ashford和Porten于1962年用电子显微镜在人的肝细胞中观察到并命名[7]。自噬是一种广泛存在的细胞程序性死亡机制,是真核细胞维持自稳状态的正常的分解代谢过程。自噬通过溶酶体对细胞内衰老的细胞器、长寿命蛋白(long-lived protein)以及外源病原微生物进行吞噬、降解,将其分解成可利用的小分子物质,进入细胞内的能量再循环系统。根据生理功能及降解物进入溶酶体方式的不同,自噬主要分为3类,即分子伴侣介导的自噬(chaperone-mediated autophagy)、微自噬(microautophagy)和巨自噬(macroautophagy)[1,8]。目前研究最深入的为巨自噬,本文主要论述巨自噬。
1.2 细胞自噬的基本网络调控过程
一系列自噬相关基因构成了自噬过程的调控网络(图1)。Unc-51样自噬活化激酶(Unc-51-like autophagy-activating kinase,ULK)复合物和磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)复合物Ⅲ均可触发自噬膜的形成,前者包含ULK1 (哺乳类动物的ATG1)、FIP200、ATG13和ATG101蛋白,后者包含BECN1(Beclin-1)、VPS34、VPS15和ATG14蛋白[8-10]。通常情况下,ULK复合物和PI3K复合物Ⅲ由于被腺苷酸活化的蛋白激酶(AMP-activated protein kinase,AMPK)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)磷酸化,均处于非活化的形式[8-9]。当自噬被启动进行自噬体膜延伸时,涉及两条泛素样连接通路(ubiquitin-like ligation pathway)。第一条通路中,ATG12经激活、转运后结合形成ATG5/ATG12/ATG16L复合物,定位于自噬体膜上;第二条通路中,微管相关蛋白轻链3(microtubule-associated protein light chain 3,LC3)前体蛋白(Pro-LC3)被ATG4裂解成LC3-Ⅰ,在ATG7和ATG3的辅助下与PE(磷脂酰肌醇胺,phosphatidylethanolamine)偶联形成LC3-Ⅱ[9-11]。LC3-Ⅱ作为活化形式,辅助自噬体膜的延伸以及自噬泡中降解底物的募集,最终形成自噬体。自噬体随后与溶酶体融合形成自噬溶酶体以降解底物,降解生成的氨基酸等生命活动所需的基质被释放到细胞浆中[11]。
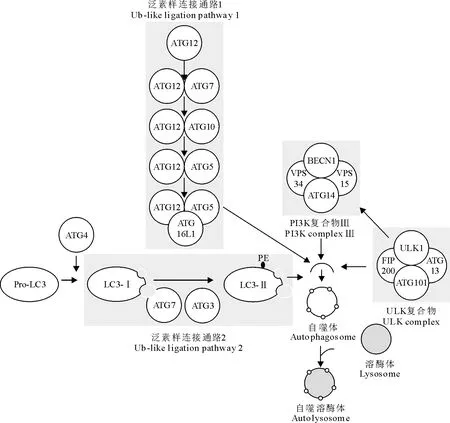
图1 哺乳类细胞自噬经典通路(引自参考文献[9])
2 A型流感病毒劫持细胞自噬利于自身增殖
自噬体是自噬过程中最为核心的中间结构,自噬体的存在表明自噬被诱导发生[1]。研究表明,流感病毒感染后可以促进胞浆中自噬体的形成,随后通过抑制自噬体的降解以利于自身复制。
2.1 流感病毒诱导自噬体的形成并抑制其降解
mTOR是最重要的一类自噬抑制物,因此通过使mTOR失活可以刺激自噬的发生。雷帕霉素作为mTOR活性的抑制物,可以用来诱导自噬。多项研究表明,用H1N1、H3N2、H5N1或H9N2亚型流感病毒感染A549细胞,或用雷帕霉素处理细胞,均可以显著提高细胞的自噬水平[12-17]。
LC3是自噬体形成的标志物[1,18-19],常通过绿色荧光蛋白(green fluorescent protein,GFP))与LC3的共表达对其进行检测。经雷帕霉素处理和流感病毒感染的细胞,在荧光显微镜下均可观察到GFP-LC3点状聚集,且通过电镜可观察到含有细胞器或细胞内含物的膜泡,表明两者均可诱导自噬的发生[12,20]。此外,流感病毒感染细胞后,细胞内出现大量广泛分布的具有流动性的小的自噬体并在核周腔附近出现一个大的囊泡;而非感染细胞的胞浆中,仅能观察到极少的自噬体[12]。
自噬体作为自噬发生过程的中间结构,通常情况下,很快就会被溶酶体降解。研究证实,流感病毒感染不仅诱导自噬体的形成,而且抑制自噬体和溶酶体的融合,阻止自噬体的成熟降解。流感病毒感染细胞后,荧光显微镜下观察不到染色的溶酶体相关膜蛋白1(lysosome associated membrane protein 1,LAMP1)和GFP-LC3的共定位现象,表明自噬体的成熟过程被阻止[12,17]。
2.2 自噬促进病毒的复制
化学药物和基因操作技术通常被用来调节自噬的水平[1],研究者可以通过下调自噬的水平来进一步理解病毒增殖和自噬之间的关系。体外研究表明,经渥漫霉素等PI3K化学抑制剂下调自噬水平后,流感病毒的滴度及蛋白量显著下降。通过药物抑制自噬,A549细胞培养上清中的H9N2及H1N1亚型流感病毒的滴度及成分均下降[12]。用ATG7缺陷型小鼠胚胎成纤维细胞ATG7(-/-)MEFs进行H1N1亚型流感病毒感染试验时,也可得出相似的结论[21],即病毒蛋白、mRNA表达水平及病毒基因组RNA水平均出现了下降。相关研究还发现,自噬缺陷不仅可以降低流感病毒感染后分子伴侣蛋白Hsp90的诱导表达水平,而且可以改变mTOR信号通路下游蛋白4E-BP1和p70S6K的磷酸化水平;由于上述这些蛋白在病毒的RNA和蛋白合成过程中均发挥重要作用,提示自噬可能通过调节Hsp90的诱导表达及mTOR/p70S6K信号通路参与病毒RNA和蛋白的合成[21]。
2.3 流感病毒通过调节Akt-TSC2-mTOR信号途径诱导自噬
高致病性H5N1亚型流感病毒可以对机体造成严重损伤,可能与其诱导产生的自噬型细胞死亡有关[14,16]。一方面,mTOR可以通过和ULK1相互作用以激活ULK1和ATG13蛋白来抑制自噬;另一方面,通过RNA干扰技术将mTOR的上游抑制蛋白肿瘤抑制蛋白(tumor suppressor protein 2,TSC2)进行基因沉默后,H5N1病毒诱导的自噬被显著抑制且细胞的死亡明显减少,表明H5N1病毒可能通过调节TSC2的表达来诱导mTOR相关的自噬途径。进一步研究证实,H5N1病毒可以显著降低AKT激酶的磷酸化,而AKT激酶又可以下调TSC2的表达水平。因此推测,H5N1亚型流感病毒可以通过AKT-TSC2-mTOR 途径来调节自噬[14]。
2.4 流感病毒M2蛋白在扰乱自噬的进程中发挥关键作用
单独的A型流感病毒M2蛋白即可促发自噬体的形成,而其他蛋白如HA、NS、PA及PB2等则可能需要协同作用,才能刺激自噬的发生[12,17,20]。研究发现,M2蛋白可能通过和BECN1蛋白的相互作用来抑制自噬溶酶体的形成;M2蛋白可以负调控BECN1的活性,而这种活性又是自噬溶酶体形成所必需[17]。当仅保留N末端60个氨基酸时,M2蛋白依然可以诱导自噬体的积聚并与BECN1发生免疫共沉淀,提示M2蛋白和BECN1互作的功能域可能主要存在于该末端区域。
由于M2蛋白可以停留在细胞膜及核周腔的自噬泡上,通过介导离子通道活性,调节内环境pH,而有助于内吞小体中流感病毒粒子的脱壳。但前期的研究表明,抑制这种离子通道的活性,并不能够阻止自噬体的积聚[17]。近期,有相反的研究结果指出,当用金刚烷胺处理对其敏感的流感病毒感染的细胞或表达M2蛋白的细胞时,自噬体的积聚可以被显著抑制[22]。因此,M2蛋白的离子通道活性在阻断自噬体和溶酶体的融合过程中至少扮演了部分角色。也表明M2蛋白可能通过多种机制参与抑制自噬对病毒成分的降解。
M2蛋白不但可以通过一定途径来抑制细胞对病毒蛋白的自噬降解过程,还可以通过模拟宿主细胞的蛋白-蛋白互作基序,来扰乱自噬的进程,以利于自身出芽[23]。LC3/ATG8家族伴侣结合蛋白(binding partners)具有典型的LC3互作域(LC3-interacting region,LIR)。LIR和LC3/ATG8家族蛋白通过共有基序W/FxxI/L形成分子内的β片层,且该基序前通常为酸性残基。M2蛋白的胞浆末端可以和LC3蛋白直接作用,使LC3蛋白重新定位于胞膜上,而非自噬体上。M2蛋白通过自身一段高度保守的LIR和LC3结合;且该LIR序列是LC3蛋白在胞膜上再分布所必需的,如果将其突变,则会影响病毒的丝状出芽(filamentous budding)以及病毒的稳定性[23]。
3 自噬在抗流感病毒的免疫应答过程中扮演重要角色
自噬是经过长期进化且高度保守的一个过程,在真核细胞的新陈代谢过程中极为关键。自噬不仅保留有原始的直接降解外源性病原微生物的能力,而且还与免疫系统协作,共同参与抵抗外源微生物入侵的免疫过程,在天然免疫和获得性免疫之间起到桥梁作用,在细胞因子合成、抗原提呈及免疫记忆等方面均发挥重要作用[24-26]。
3.1 自噬在抗流感病毒的天然免疫应答过程中的作用
炎症反应是天然的抗病毒免疫机制,其中树突状细胞(dendric cell,DC)作为重要的天然免疫细胞,可以产生多种炎性细胞因子。用2009甲型H1N1亚型流感病毒进行BMDC(小鼠骨髓来源树突状细胞)感染试验发现,与敲除BECN1基因的自噬缺陷型小鼠相比,来自野生型小鼠的BMDC具有更成熟的表型,能够分泌更高水平的IL-6、TNF-α、IFN-β、IL-12p70和IFN-γ等[27]。而CXCL10和IFN-ɑ也是已知在天然免疫应答中发挥重要作用的细胞因子,研究发现当用H9N2亚型流感病毒感染人的血液巨噬细胞时,敲除ATG5基因的感染细胞其诱导产生的CXCL10和IFN-ɑ水平下降幅度可达50%[28]。此外,自噬还可以将胞浆中复制的病毒成分提呈给TLR7受体以供溶酶体识别,从而参与病毒识别和诱导干扰素生成以发挥抗病毒作用[27]。
3.2 自噬在维持抗流感病毒感染的特异性免疫应答中的作用
研究发现,自噬可以介导MHC分子的抗原提呈过程。与敲除BECN1基因的自噬缺陷型小鼠相比,来自野生型小鼠的BMDC具有更高效的激活CD4+T、Th1、Th2 和Th17细胞增殖分化的能力,且分泌产生的IL-12等效应因子可以进一步促进MHC I类分子交叉提呈2009甲型H1N1亚型流感病毒抗原的能力[27]。
自噬在维持机体记忆性B细胞的存活过程中不可或缺。研究认为,流感病毒感染后,记忆性B细胞内的自噬水平显著高于本底水平,自噬调节相关基因以及自噬体成熟基因的表达水平均显著增高[29]。在对长寿B细胞和生发中心的B细胞同时进行检测时发现,自噬形成标志物LC3仅在长寿B细胞中发生了点状聚集。为了研究自噬是否可以保护长寿B细胞,研究者对自噬标志物LC3进行检测,并与初始B细胞和其他的B细胞亚类进行对比研究,发现与自噬起始相关的一些关键基因,如ULK1 (ATG1)、BECN1 (ATG6)、Rb1cc1、ATG14、Uvrag,及与自噬成熟的一些相关基因,如ATG5、ATG7、Map1lc3a、Map1lc3b等的表达水平显著增高,表明长寿记忆性B细胞中存在着持续的自噬活动[29]。通过对敲除了B细胞中ATG7 基因的小鼠进行相关研究发现,流感病毒接种小鼠后,小鼠仍具有正常的产生初次抗体应答的能力;但当重复使用流感病毒进行攻击保护试验时,小鼠却失去了产生再次抗体应答的能力,导致其体内病毒载量增高、广泛的肺部损伤以及致死率升高[29]。
同样,自噬在维持记忆性CD8+T细胞的存活过程中也具有关键作用。当发生感染时,CD8+T细胞数量经过初始的大量增殖后,即发生大部分的凋亡,仅留下一小部分记忆性长寿细胞;在敲除小鼠T细胞中的ATG7基因后,小鼠无法建立CD8+记忆性T细胞以抵抗流感病毒的感染[30]。类似地,将T细胞中的另一个自噬关键基因ATG5敲除后,ATG5-/-CD8+T细胞在效应阶段同样无法维持长期的活性,当重新受到流感病毒攻击时,无法启动有效的再次免疫应答;且此T细胞中p53的表达量明显上调,并伴随有高水平的活性氧(reactive oxygen species,ROS),进而诱导ROS依赖的细胞凋亡;而有趣的是,该细胞凋亡过程又可以被活性氧的清除剂N-乙酰半胱氨酸所拯救,进一步表明CD8+效应T细胞需要自噬来维持其存活以抵抗流感病毒的再次感染[30]。
4 结语
在病毒感染过程中,细胞自噬犹如一把双刃剑,一方面能够在宿主抗感染免疫应答中发挥重要作用。另一方面也可被病毒利用来促进病毒复制。尽管目前关于细胞自噬在流感病毒感染方面的研究报道相对较少,已取得的研究结果中也存在着一些有争议之处,如自噬对病毒复制效率的影响[12,22]以及自噬在宿主抗病毒感染中的作用[29,31]等方面,推测可能与感染病毒的毒株特异性及宿主特异性相关[32],且某些自噬相关基因也具有功能的多样性[31]。但当病毒与自噬发生互作时,如何通过精准的细胞内分子调控,使自噬的进程向着有利于机体的方向发展,或基于自噬的过程开发药物靶标进行抗感染的治疗[33]及新型疫苗的研制[34]等则具有非常诱人的前景。这就要求研究者们对自噬相关的功能机制进行更深入的研究与探索,为更有效地防控流感提供新思路。
[1] Jackson W T,Swanson M S.Autophagy,Infection,and the Immune Response[M].Wiley Blackwell,2014.
[2] Jheng J R,Ho J Y,Horng J T.ER stress,autophagy,and RNA viruses[J].Front Microbiol,2014,5:388.
[3] Refaey S,E A,Amin M M,.Increased number of human cases of influenza virus A(H5N1) infection,egypt,2014-15[J].Emerg Infect Dis,2015,21(12):2171-2173.
[4] Xu W,Li X,Bai T,et al.A fatal case of infection with a further reassortant,highly pathogenic avian influenza (HPAI) H5N6 virus in Yunnan,China[J].Infect Genet Evol J Mol Epidemiol Evol Genet Infect Dis,2016,40:63-66.
[5] Takayama I,Hieu N T,Shirakura M,et al.Novel reassortant A(H5N1) avian influenza virus identified in a human infection case in southern Vietnam,2014[J].Emerg Infect Dis,2016,22(3):557-559.
[6] Beigel J H,Farrar J,Han A M,et al.Avian influenza A (H5N1) infection in humans[J].New Engl J Med,2005,353(13):1374-1385.
[7] Ward C,Martinezlopez N,Otten E G,et al.Autophagy,Lipophagy and lysosomal lipid storage disorders[J].Biochim Biophys Acta,2016,1861(4):269-284.
[8] Choose Delicately K S,Adequately R.The newly revealed process of autophagy[J].Biol Pharmac Bull,2015,38(8):1098-1103.
[9] Lindqvist L M,Simon A K,Baehrecke E H.Current questions and possible controversies in autophagy[J].Cell Death Discov,2015,1: 15036.
[10] Yang Z,Klionsky D J.Mammalian autophagy:core molecular machinery and signaling regulation[J].Curr Opin Cell Biol,2010,22(2):124-131.
[11] Durrant L G,Metheringham R L,Brentville V A.Autophagy,citrullination and cancer[J].Autophagy,2016:1-2.
[12] Zhou Z,Jiang X,Liu D,et al.Autophagy is involved in influenza A virus replication[J].Autophagy,2009,5(3):321-328.
[13] Pei J,Zhao M,Ye Z,et al.Autophagy enhances the replication of classical swine fever virusinvitro[J].Autophagy,2014,10(1):93-110.
[14] Ma J,Sun Q,Mi R,et al.Avian influenza A virus H5N1 causes autophagy-mediated cell death through suppression of mTOR signaling[J].J Genet Genomics,2011,38(11):533-537.
[15] Pan H,Zhang Y,Luo Z,et al.Autophagy mediates avian influenza H5N1 pseudotyped particle-induced lung inflammation through NF-κB and p38 MAPK signaling pathways[J].Am J Physiol-Lung Cell Mol Physiol,2014,306(2):L183-L195.
[16] Jiang C.Inhibition of autophagy ameliorates acute lung injury caused by avian influenza A H5N1 infection[J].Sci Signal,2012,5(212):567-580.
[17] Gannagé M,Schmid D,Albrecht R,et al.Matrix protein 2 of influenza A virus blocks autophagosome fusion with lysosomes[J].Cell Host & Microbe,2009,6(4):367-380.[18] Kabeya Y,Mizushima N,Ueno T,et al.LC3,a mammalian homologue of yeast Apg8p,is localized in autophagosome membranes after processing[J].Embo J,2000,22(17):4577-4577.
[19] Kuma A,Matsui M,Mizushima N.LC3,an autophagosome marker,can be incorporated into protein aggregates independent of autophagy:caution in the interpretation of LC3 localization[J].Autophagy,2007,3(4):323-328.
[20] Zhirnov O P,Klenk H D.Influenza A virus proteins NS1 and hemagglutinin along with M2 are involved in stimulation of autophagy in infected cells[J].J Virol,2013,87(24):13107-13114.
[21] Liu G,Zhong M,Guo C,et al.Autophagy is involved in regulating influenza A virus RNA and protein synthesis associated with both modulation of Hsp90 induction and mTOR/p70S6K signaling pathway[J].Int J Biochem Cell Biol,2016,72:100-108.
[22] Ren Y,Li C,Feng L,et al.Proton channel activity of influenza A virus matrix protein 2 contributes to autophagy arrest[J].J Virol,2015,90(1):591-598.
[23] Beale R,Wise H,Stuart A,et al.A LC3-interacting motif in the influenza A virus M2 protein is required to subvert autophagy and maintain virion stability[J].Cell Host & Microbe,2014,15(2):239-247.
[24] Shaw S Y,Tran K,Castoreno A B,et al.Selective modulation of autophagy,innate immunity,and adaptive immunity by small molecules[J].Acs Chem Biol,2013,8(12):2724-2733.
[25] Yordy B,Iwasaki A.Autophagy in the control and pathogenesis of viral infection[J].Curr Opin Virol,2011,1(3):196-203.[26] Richetta C,Faure M.Autophagy in antiviral innate immunity[J].Cell Microbiol,2013,15(3):368-376.
[27] Zang F,Chen Y,Lin Z,et al.Autophagy is involved in regulating the immune response of dendritic cells to influenza A (H1N1) pdm09 infection[J].Immunology,2016,148(1):56-69.
[28] Law A H,Lee D C,Yuen K Y,et al.Cellular response to influenza virus infection:a potential role for autophagy in CXCL10 and interferon-alpha induction[J].Cell Mol Immunol,2010,7(4):263-270.
[29] Chen M,Hong M J,Sun H,et al.Essential role for autophagy in the maintenance of immunological memory against influenza infection[J].Nat Med,2014,20(5):503-510.
[30] Puleston D J,Zhang H,Powell T J,et al.Autophagy is a critical regulator of memory CD8(+) T cell formation[J].eLife,2014,3:e03706.
[31] Lu Q,Yokoyama C C,Williams J W,et al.Homeostatic control of innate lung inflammation by vici syndrome gene epg5 and additional autophagy genes promotes influenza pathogenesis[J].Cell Host & Microbe,2016,19(1):102-113.
[32] Dumit V I,Dengjel J.Autophagosomal protein dynamics and influenza virus infection[J].Front Immunol,2012,3:43.
[33] Dai J P,Li W Z,Zhao X F,et al.A drug screening method based on the autophagy pathway and studies of the mechanism of evodiamine against influenza A virus[J].PLoS One,2012,7(8):e42706.
[34] Hu D,Wu J,Zhang R,et al.Autophagy-targeted vaccine of LC3-LpqH DNA and its protective immunity in a murine model of tuberculosis[J].Vaccine,2014,32(20):2308-2314.
Autophagy and Infection of Influenza A Virus
XU Li-jun1,2,LIU Xiu-fan1,3,4,GU Min1,3,4
(1.CollegeofVeterinaryMedicine,YangzhouUniversity,YangzhouJiangsu,225009,China; 2.YangzhouEntry-ExitInspectionandQuarantineBureau,Yangzhou,Jiangsu,225009,China; 3.JiangsuKeyLaboratoryofZoonosis,Yangzhou,Jiangsu,225009,China; 4.JiangsuCo-innovationCenterforthePreventionandControlofImportantAnimalInfectiousDiseaseandZoonoses,Yangzhou,Jiangsu, 225009,China)
Autophagy is a widely existed metabolic process in eukaryotic cells and is critical for keeping cel-luar homeostasis.During virus infection,autophagy displays duality as that it could be used to promote virus proliferation on one side,and also it could play key roles in host immune response against viral infection on the other side.In this review,we focused on influenza A virus,which is seriously harmful to animal industry and human health,to discuss the relationship between autophagy and virus infection or host immune response,in order to further deeply understand the molecular mechanism of the viral pathogenicity and to provide reference for anti-influenza virus research.
autophagy;Influenza A virus; infection; immune response
2016-07-18
国家蛋鸡产业技术体系项目(nycytx-41-G07);江苏省自然科学基金项目(BK20130442);江苏省高校自然科学研究项目(13KJB230004);江苏高校优势学科建设工程资助项目(PAPD)
徐利军(1984-),男,江苏沭阳人,博士研究生,主要从事动物流感病毒的致病机理研究。*通讯作者
S852.43;S852.659.5
A
1007-5038(2017)01-0094-06
