替吉奥与氟尿嘧啶治疗中国晚期胃癌患者的Meta分析*
2017-03-01陈小东何馥倩
陈小东,何馥倩,陈 密
(1.四川省肿瘤医院·研究所/四川省癌症防治中心胃肠外科,成都 610041;2.电子科技大学医学院,成都 610054;3.四川大学华西医院老年医学中心,成都 610041)
替吉奥与氟尿嘧啶治疗中国晚期胃癌患者的Meta分析*
陈小东1,2,何馥倩3,陈 密1
(1.四川省肿瘤医院·研究所/四川省癌症防治中心胃肠外科,成都 610041;2.电子科技大学医学院,成都 610054;3.四川大学华西医院老年医学中心,成都 610041)
目的 比较替吉奥(S-1)与氟尿嘧啶(5-FU)在中国晚期胃癌患者中的有效性及安全性。方法 检索中国知网、万方数据及PubMed,查找在中国晚期胃癌患者中应用S-1与5-FU的多中心随机对照试验(mcRCTs),采用RevMan 5.2软件进行Meta分析。结果 纳入4个mcRCTs。Meta分析显示S-1可以显著提高客观缓解率[OR=1.90,95%CI(1.36~2.65),P<0.01]和疾病控制率[OR=2.08(1.43~3.03),P<0.01],但未显示出总生存优势[HR=0.76(0.39~1.50),P=0.82]。S-1组的白细胞减少[1~4级:OR=2.40(1.41~4.07),P<0.01;3~4级:OR=3.09(1.94~4.93),P<0.01]、中性粒细胞减少[1~4级:OR=2.23(1.60~3.10),P<0.01;3~4级:OR=2.90(1.40~6.02),P<0.01]、血小板减少[1~4级:OR=2.40(1.56~3.69),P<0.01]、贫血[3~4级:OR=1.78(1.11~2.87),P=0.02]及腹泻[3~4级:OR=2.51(1.13~5.58),P=0.02]的发生率均高于5-FU组,而其他的消化系统不良事件发生率相对低于5-FU组,但仅1~4级恶心的发生率显著低于5-FU组[OR=0.59(0.42~0.81),P<0.01]。结论 对于中国晚期胃癌患者,S-1可以显著提高客观缓解率及疾病控制率,但增加血液系统不良事件及腹泻的发生率;而在生存时间方面虽不劣于5-FU。
胃肿瘤;氟尿嘧啶;Meta分析;替吉奥;有效性
胃癌是我国常见恶性肿瘤之一,其病死率居恶性肿瘤第3位[1]。由于尚未开展广泛的人群筛查,因此大部分患者确诊时已属于进展期,而且相当一部分属晚期,包括不能手术切除的局部晚期、远处转移及根治性术后复发者。姑息化疗可以延长晚期胃癌患者的总生存期和改善生活质量。目前,5-氟尿嘧啶(5-FU)依然是治疗晚期胃癌的基础用药,但其有效率较低,且存在较明显的消化道及血液系统不良反应。替吉奥(S-1)是20世纪90年代由日本大鹏药品研发的口服5-FU前体药物,已成为日本胃癌治疗的一线用药[2]。近年来,S-1在我国晚期胃癌患者中亦得到广泛使用,但其有效性及安全性尚待评价。本文采用Meta分析的方法就上述问题进行探讨。
1 资料与方法
1.1 资料 计算机检索网络数据库中国知网(CNKI)、万方数据(WANFANG DATA)及PubMed。所有检索均采用主题词与自由词相结合的方式,检索式根据具体数据库适当调整。中文数据库检索词为:“胃癌”“替吉奥”“s-1”“氟尿嘧啶”“5-fu”“随机”;英文检索词为:“gastric/stomach/esophagogastric junction/gastroesophageal junction cancer/carcinoma/adenocarcinoma”“fluorouracil”“S-1”,“TS-1”“random*” “China” “Chinese”。所有数据库检索时间截止到2015年12月31日。
1.2 方法
1.2.1 文献纳入 通过阅读标题与摘要去除重复文献及非随机对照试验,对剩余文献检索全文并仔细阅读,按如下标准纳入文献:(1)研究类型,多中心随机对照试验(mcRCTs),无论是否采用盲法;(2)研究对象,经病理确诊为胃癌而临床上属于不能手术切除或根治术后复发或远处转移的患者,且卡氏功能状态评分(KPS评分)大于或等于60分或者东部肿瘤协作组织体力状态评分(ECOG PS评分)小于或等于2分,年龄大于或等于18岁、心肝肾功能及血液学检查基本正常;(3)干预措施,试验组S-1单药或S-1+其他细胞毒药物,对照组5-FU单药或5-FU+同种细胞毒药物,即两组的干预措施除S-1和5-FU外保持一致;(4)结局指标,包含如下指标之一,客观疗效、生存数据或不良事件;(5)排除标准,非多中心随机对照试验,对重复发表的研究选取方法学报道更严谨及内容更翔实者。
1.2.2 文献评价 按照如下7项标准对纳入研究进行质量评价[3]:(1)是否为真正随机分配;(2)是否正确进行分配方案隐藏;(3)是否描述纳入标准;(4)两组基线特征是否一致;(5)结果评价是否采用盲法;(6)是否描述失访;(7)是否采用意向性治疗分析(intention to treat analysis,ITT)。 评价为6~7个“是”的文献被认为质量“高”,4~5个为“一般”,而3个或更少为“低”。 质量评价由2位研究者独立进行,并交叉核对,如遇分歧通过讨论或请第3位研究者协助解决。
1.2.3 资料提取 由2位研究者独立地对纳入的文献进行资料提取,填写资料提取表,再交叉核对,如遇分歧通过协商或由第3位研究者协助解决。内容主要包括:(1)一般资料,即文题、作者、发表日期和文献来源;(2)研究特征,即研究对象的一般情况和干预措施;(3)研究的随机方法、分配隐藏、盲法、失访/退出情况;(4)测量指标,包括客观疗效:客观缓解率(objective response rate,ORR)=完全缓解(complete response,CR)+部分缓解(partial response,PR),疾病控制率(disease control rate,DCR)=CR+PR+疾病稳定(stable disease,SD),其判断标准为实体瘤治疗疗效评价标准(RECIST 1.0);生存数据为总生存期(overall survival,OS,即从随机化开始到因各种原因导致患者死亡之间的时间),无进展生存期(progression-free survival,PFS,即从随机分组开始至出现肿瘤客观进展或死亡之间的时间),疾病进展时间(time to progression,TTP,即从随机分组开始至出现肿瘤客观进展之间的时间)和治疗失败时间[(treatment failure time,TTF,即从随机化开始到无论何种原因(包括疾病进展、治疗毒性和死亡)导致治疗终止之间的时间)];不良事件包括血液系统(白细胞、中性粒细胞、血小板、贫血/血红蛋白减少),消化道(恶心/呕吐、厌食、腹泻、脱水、口腔黏膜炎),肝肾功能的影响,疲劳,手足和神经症状等,按美国国立肿瘤研究所 “不良反应常用术语标准”(NCI-CTCAE)评定。
1.3 统计学方法 采用Cochrane协作网提供的RevMan 5.2软件进行Meta分析。采用χ2检验及I2判断统计学异质性,计数资料采用比值比(OR)作为效应量,生存数据采用风险比(HR)作为效应量,各效应量均给出其95%置信区间(CI)。当各研究结果不存在统计学异质性时(P≥0.10,I2≤50%),采用固定效应模型进行分析;如各研究结果间存在统计学异质性(P<0.10,I2>50%),首先分析异质性产生的原因,若无临床异质性,采用随机效应模型进行分析,若有临床异质性可根据其来源做亚组分析或是敏感性分析,若异质性过大,则行描述性分析。无法合并的指标采用描述性方法。
2 结 果
2.1 文献检索结果 共检出相关文献253篇,去除重复文献85篇,通过阅读标题及摘要排除163篇,5篇文献检索全文,排除报告同一组患者文献2篇[4-5],通过手工检索纳入参考文献1篇[8],最终纳入4 篇mcRCT[6-9]。
2.2 纳入研究的基本特征 4篇文献均涉及10个以上研究中心,共计纳入789例患者(755例患者进行了疗效评价),其中S-1组435例,5-FU组354例,平均(中位)年龄53.3~58.0岁。3篇文献比较了S-1联合顺铂(SP)与5-FU联合顺铂(FP)[6-8],1篇文献比较了S-1联合紫杉醇(SPtx)与5-FU联合紫杉醇(FPtx)[9],见表1。
2.3 纳入研究的质量评价 纳入的4篇文献均为组织实施良好的全国性多中心随机对照试验,3篇文献质量评价为“高”[6,8-9],1篇为“一般”[7],均采用中心动态随机法,均有明确的入组排除标准,两组的基线特征一致性良好,但仅有1篇文献说明在结果评价时采用了盲法,均描述了失访并采用意向性治疗分析,见表2。
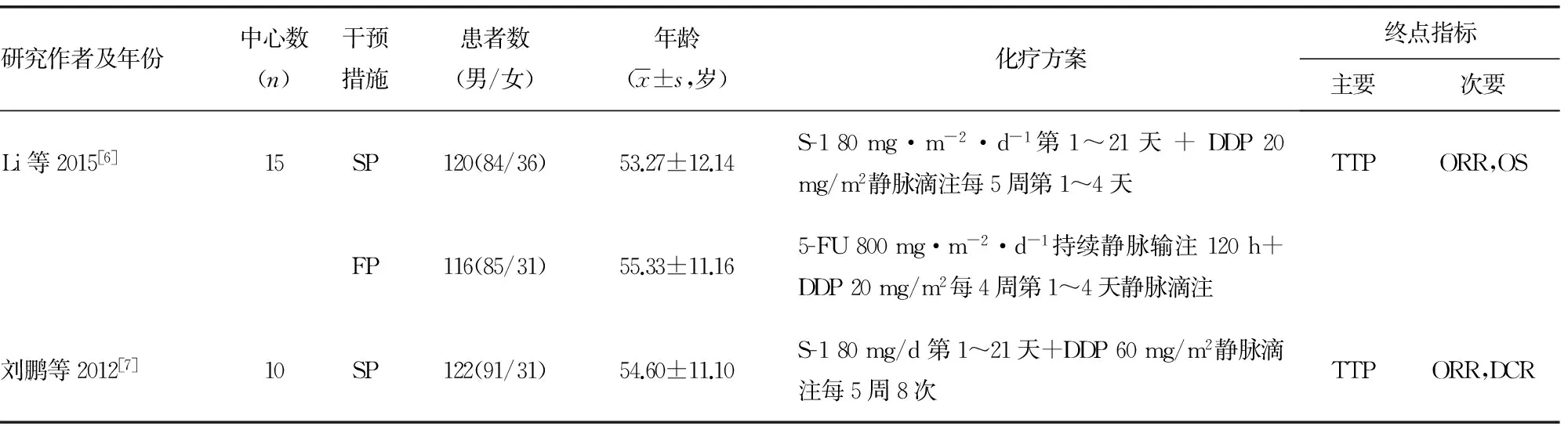
表1 纳入研究的基本特征

续表1 纳入研究的基本特征

表2 纳入研究的质量评价
a:同时采用意向性治疗分析(ITT)及符合方案集分析(PP)。
2.4 客观缓解率的Meta分析 4篇文献均采用实体瘤疗效评价标准(RECIST)评估客观疗效,均报告了ORR,S-1组为22.5%~42.0%,合计为33.7%,而5-FU组为15.9%~24.8%,合计为21.3%,各研究结果间无统计学异质性(P=0.17,I2=41%),采用固定效应模型进行Meta分析显示S-1组显著高于5-FU组,差异有统计学意义[OR=1.90(1.36~2.65),P<0.01],见图1。
2.5 疾病控制率的Meta分析 3篇文献[7-9]报告了DCR,S-1组为68.9%~79.7%,合计为74.0%,而5-FU组为52.3%~60.6%,合计为57.7%,各研究结果间无统计学异质性(P=0.22,I2=33%),采用固定效应模型进行Meta分析显示S-1组显著高于5-FU组,差异有统计学意义[OR=2.08(1.43~3.03),P<0.01],见图2。
2.6 生存分析 4篇文献报告的生存数据包括OS[6,8]、PFS[9]、TTP[6-7]、TTF[8-9],尽管S-1组显示出一定的生存优势,但报告每一指标的研究数少,且存在较明显的统计学异质性,采用随机效应模型进行Meta分析显示两组OS、TTF差异无统计学意义(P>0.05),见表3。
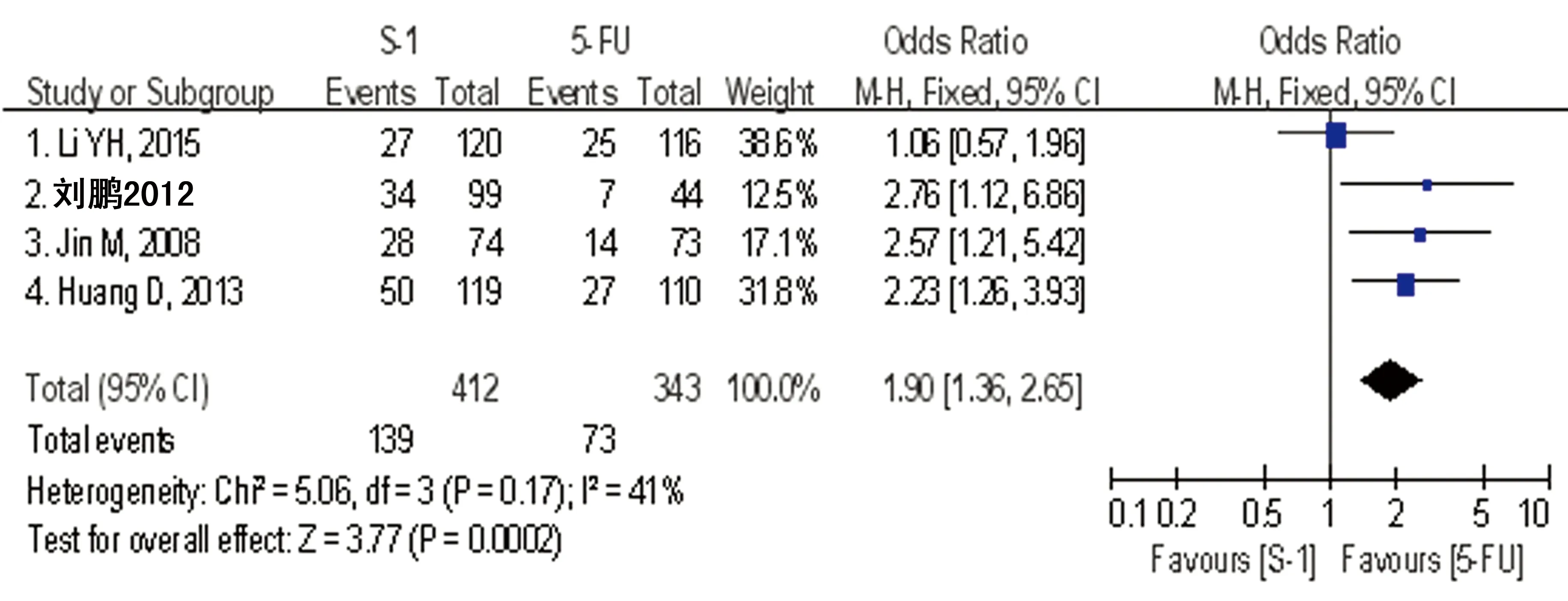
图1 S-1与5-FU在中国晚期胃癌患者中的客观缓解率(ORR)比较的森林图
2.7 不良事件 安全性的Meta分析 4篇文献报告的不良事件主要包括血液系统(白细胞减少、中性粒细胞减少、血小板减少、贫血)及消化系统(恶心、呕吐、食欲减退、腹泻、便秘、口腔黏膜炎)两方面,其他如乏力、脱发、周围神经炎及肝功能损伤等发生率低且轻微;仅有2篇文献报告了治疗相关性死亡的数据,发生率低,两组间没有显著性差异,见表4。
S-1组血液系统不良事件发生率显著高于5-FU组,主要表现为白细胞减少[1~4级:OR=2.40(1.41~4.07),P<0.01;3~4级:OR=3.09(1.94~4.93),P<0.01]、中性粒细胞减少[1~4级:OR=2.23(1.60~3.10),P<0.01;3~4级:OR=2.90(1.40~6.02),P<0.01]、血小板减少[1~4级:OR=2.40(1.56~3.69),P<0.01]及贫血[3~4级:OR=1.78(1.11~2.87),P=0.02]的发生率均高于5-FU组。
S-1组腹泻的发生率高于5-FU组[1~4级:21.9%和16.7%,OR=1.48(0.99~2.24),P=0.06;3~4级:5.5%vs. 2.3%,OR=2.51(1.13~5.58),P=0.02],而其他的消化系统不良事件发生率相对低于5-FU组,但仅1~4级恶心的发生率显著低于5-FU组[OR=0.59(0.42~0.81),P<0.01]。
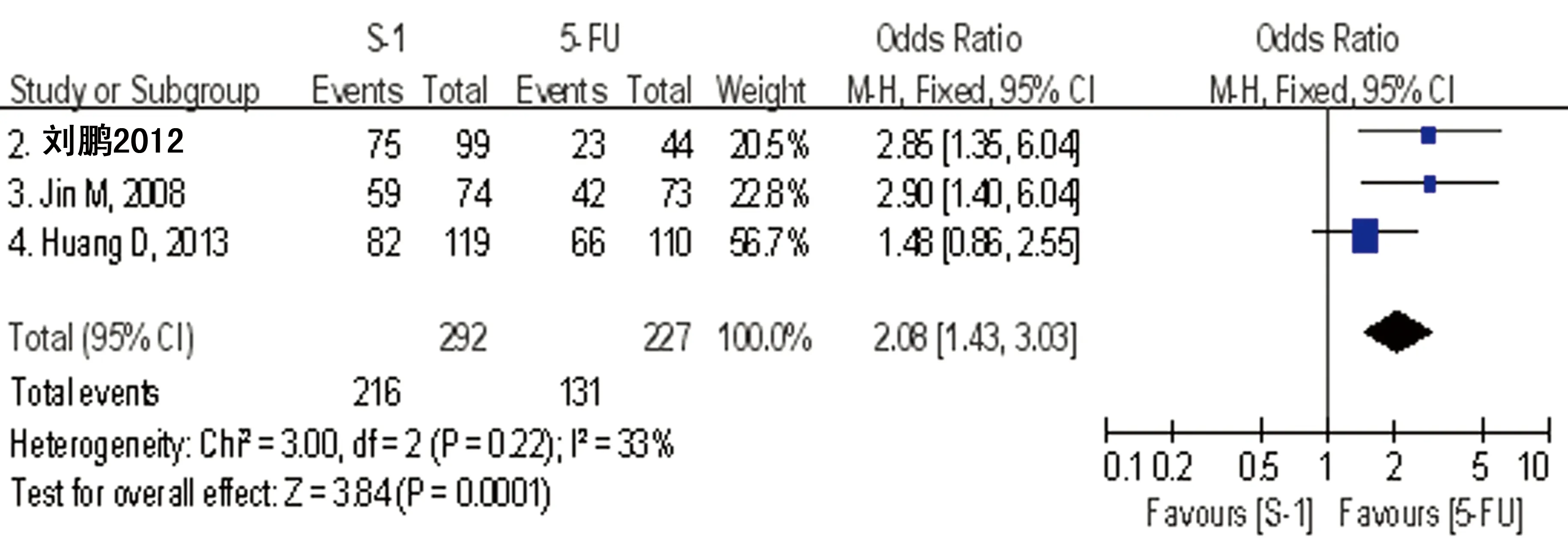
图2 S-1与5-FU在中国晚期胃癌患者中的疾病控制率(DCR)比较的森林图
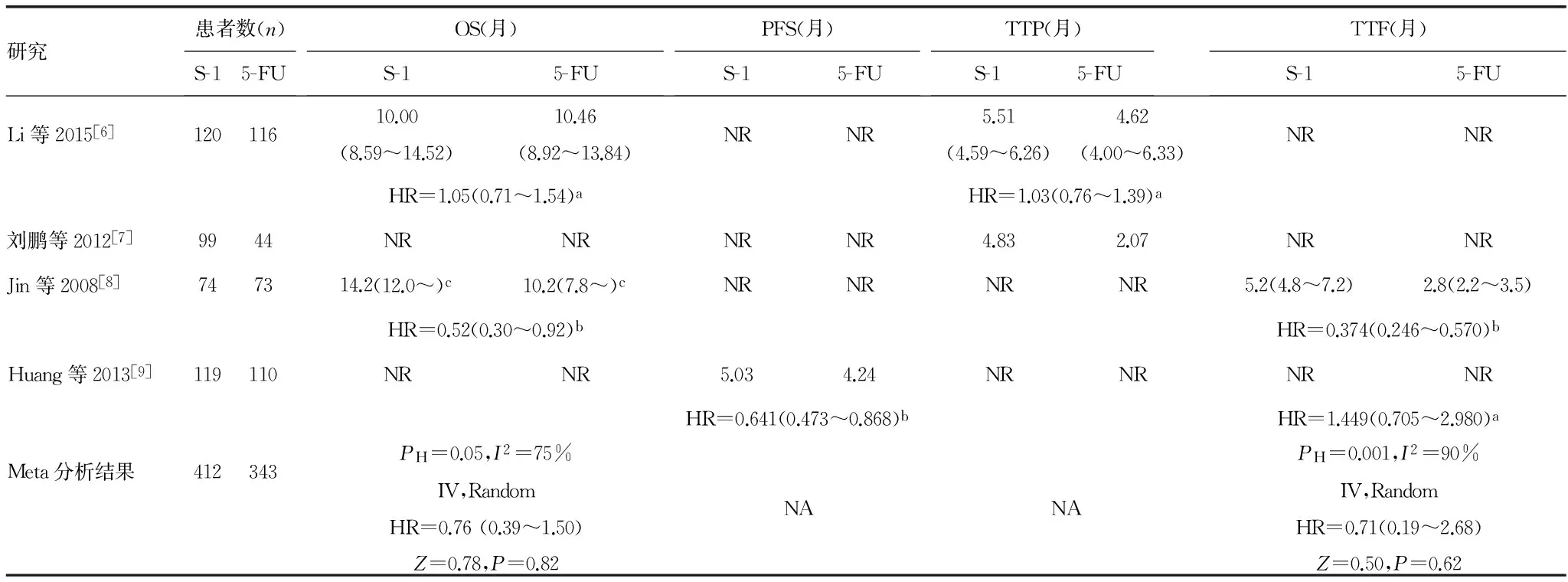
研究患者数(n)S-15-FUOS(月)S-15-FUPFS(月)S-15-FUTTP(月)S-15-FUTTF(月)S-15-FULi等2015[6]12011610.00(8.59~14.52)10.46(8.92~13.84)NRNR5.51(4.59~6.26)4.62(4.00~6.33)NRNRHR=1.05(0.71~1.54)aHR=1.03(0.76~1.39)a刘鹏等2012[7]9944NRNRNRNR4.832.07NRNRJin等2008[8]747314.2(12.0~)c10.2(7.8~)cNRNRNRNR5.2(4.8~7.2)2.8(2.2~3.5)HR=0.52(0.30~0.92)bHR=0.374(0.246~0.570)bHuang等2013[9]119110NRNR5.034.24NRNRNRNRHR=0.641(0.473~0.868)bHR=1.449(0.705~2.980)aMeta分析结果412343PH=0.05,I2=75%IV,RandomHR=0.76(0.39~1.50)Z=0.78,P=0.82NANAPH=0.001,I2=90%IV,RandomHR=0.71(0.19~2.68)Z=0.50,P=0.62
PH:异质性P值;IV:逆方差;NR:未报道;NA:不可合并;a:P>0.05;b:P<0.05,c:原文未提供范围最大值。
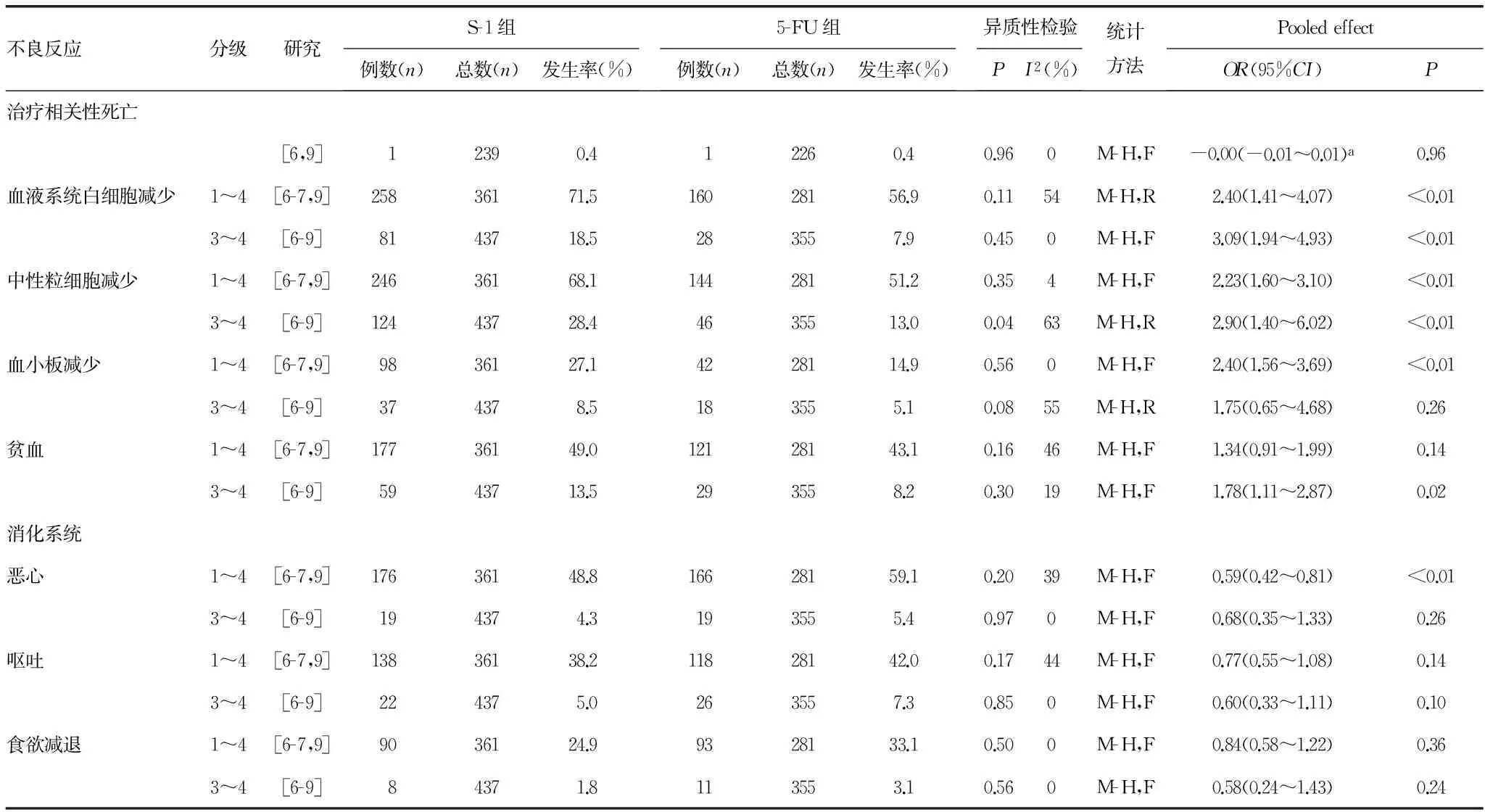
表4 S-1与5-FU在中国晚期胃癌患者中的治疗相关性死亡、血液及消化系统不良反应的meta分析
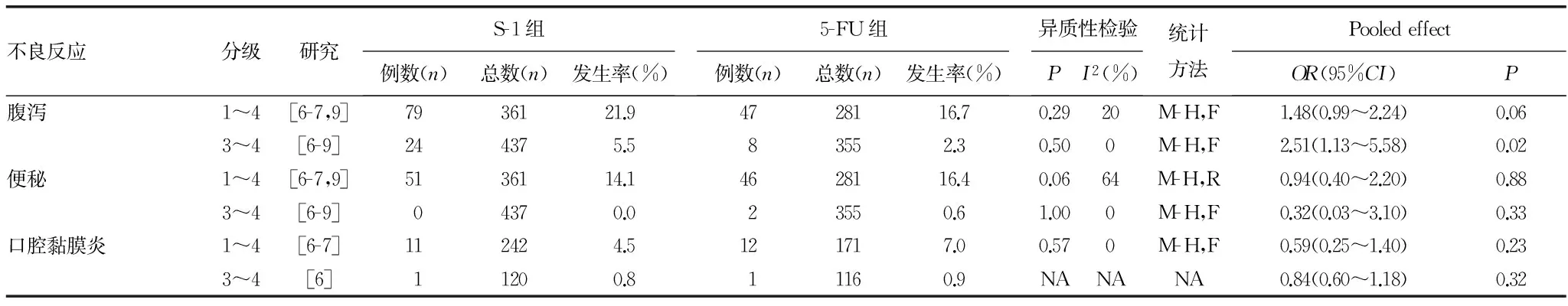
续表4 S-1与5-FU在中国晚期胃癌患者中的治疗相关性死亡、血液及消化系统不良反应的meta分析
M-H:Mantel-Haenszel法;F:固定效应模型;R:随机效应模型;NA:不可合并;a:危险差.
3 讨 论
尽管世界范围内胃癌的发病率及病死率均在逐渐下降,但是我国最新的肿瘤登记年报数据显示:2009年,胃癌发病率为36.21/10万人(男49.61/10万人,女22.50/10万人),居恶性肿瘤发病率第2位(构成比为12.67%);病死率为25.88/10万人(男34.64/10万人,女16.91/10万人),居恶性肿瘤第3位(构成比为14.33%)[1]。 由此可见,在我国胃癌仍然呈现高发病率及高病死率的特征,是严重威胁人民生命健康的主要恶性肿瘤之一。
更重要的是,由于没有开展广泛的人群筛查,我国早期胃癌的诊断率很低,多数患者发现晚,就诊时已是中晚期,甚至丧失最佳治疗时机。因此,如何治疗这些患者是临床工作中十分艰巨的任务[10]。系统评价及Meta分析显示:与最佳支持治疗相比,姑息化疗确实可以延长晚期胃癌患者的生存期并改善生活质量[11-12]。 然而,至今却无标准的一线化疗方案。
S-1是由日本Taiho药业研发的口服氟尿嘧啶类抗癌新药,小规模的Ⅱ期临床试验显示S-1单药治疗进展期胃癌可达到30%左右的客观有效率。因此1999年率先在日本被批准用来治疗晚期胃癌,随后在世界范围内开展了多项大规模的Ⅲ期临床试验。 在日本开展的JCOG 9912试验表明:S-1单独给药(1年及2年生存率:48%及21%)与5-FU持续静脉滴注(1年及2年生存率:44%及14%)相比,有明显的生存优势;而且S-1单独给药的不良事件较轻,而ORR、TTF、PFS及非住院生存时间均优于5-FU持续静脉滴注疗法;因此认为S-1单独给药可作为无法手术切除或复发胃癌患者的标准疗法之一[13]。另一项在日本开展的SPIRITS试验表明:与S-1单药治疗相比,S-1+顺铂联合化疗的OS明显延长(13.0个月和11.0个月),但3~4级不良事件发生率增加,提示可将SP作为晚期胃癌一线治疗的标准方案[14]。然而,在欧美国家进行的FLAGS试验则显示:SP与静脉FP相比,并没有延长晚期胃或胃食管结合部腺癌患者的OS(8.6个月和7.9个月),但治疗安全性有显著的提高[15-16]。由此可见,S-1在不同人群中的有效性及安全性存在差异,其在中国胃癌患者中的有效性及安全性有待证实。
近年来,S-1在中国晚期胃癌患者中逐渐广泛应用,学者们也开展了众多的临床研究,但大多为单中心、小样本的RCT,而对RCT 进行系统评价及Meta分析可以为临床提供更高级别的证据。有鉴于此,本研究对中国知网、万方数据及PubMed等国内外多个数据库进行检索,严格按纳入、排除标准进行筛选,最终有4篇文献符合标准,涉及789例患者,主要对ORR、DCR、生存数据及不良事件进行Meta分析。
尽管Meta分析显示S-1组的ORR及PCR显著增高,但是基于肿瘤测量的其他终点指标(如PFS、TTP、TTF)是否优于5-FU尚难做出肯定结论。分别有一项研究显示S-1组TTP(4.83个月和2.07个月)[7]、TTF(5.23个月和2.79个月)[8]、PFS(5.03个月和4.24个月)[9]均显著长于5-FU组,但另外两项研究显示两组TTP[6]、TTF[9]差异无统计学意义。 更为重要的是,OS是最可靠的癌症终点,常作为首选终点,但仅2项研究评价了OS。Jin等[8]报道S-1组OS显著延长[S-1 14.23个月和5-FU 10.16个月,HR=0.52,95%CI(0.30~0.92),P=0.038],但Li等[6]报道两组OS没有差异[S-1 10.00个月和5-FU 10.46个月,HR=1.05,95%CI(0.71~1.54),P=0.82],由于存在显著统计学异质性(PH=0.05,I2=75%),采用随机效应模型进行Meta分析显示两组OS差异无统计学意义[HR=0.76(0.39~1.50),P=0.82]。此外,所有研究均未对患者生存质量进行评估,也未进行成本-效益分析。因此,基于现有研究证据虽可以认为S-1的有效性不劣于5-FU,但其是否优于5-FU则尚待进一步探讨,尤其是是否能延长OS,改善生活质量,降低成本等问题。
另一方面,S-1的血液系统安全性亦应当给予高度关注。JCOG 9912试验[13]显示:S-1单药化疗所致的3~4级不良事件的发生率较低(白细胞减少1.0%、中性粒细胞减少6.0%、贫血13.0%),但中性粒细胞减少的发生率仍显著高于5-FU单药化疗(1.0%)。SPIRITS试验显示:S-1联合顺铂后3~4级不良事件发生率明显增加(白细胞减少11.0%、中性粒细胞减少40.0%、贫血26.0%)[14];而与之相比,FLAGS试验报道的3~4级不良事件发生率(白细胞减少7.3%、中性粒细胞减少18.6%、贫血15.7%)则明显低得多,也显著低于5-FU联合顺铂[15-16]。而本文纳入的我国研究显示S-1联合化疗组3-4级白细胞减少发生率为18.5%(7.4%~34.5%)、中性粒细胞减少为28.4%(12.3%~43.7%)、贫血为13.5%(0~25.8%),均显著高于5-FU联合化疗组,此结果与FLAGS试验结果相反。值得注意的是,先前一项针对国内所有的27个RCT进行的Meta分析显示,S-1组的3~4级白细胞减少发生率显著低于5-FU组[17]。此外,纳入的中国文献报告的治疗相关性病死率低于0.5%,但FLAGS试验报告的治疗相关性病死率达2.5%(13/521),其中与骨髓抑制相关的病死率为0.8%(4/521)[15-16]。导致这些差异的原因尚待进一步研究,可能是不同人群对S-1的耐受性存在差异,也不排除联合化疗药物(顺铂、紫杉醇)的干扰。总之,在服药过程中要求患者严密监测血液系统不良事件实属必要。
基于现有证据,对于我国晚期胃癌患者,S-1可以显著提高ORR及DCR,但增加血液系统不良事件发生率;而在OS、生活质量、降低成本等方面是否获益尚需更多高质量、大样本RCT 加以验证。
[1]赫捷,陈万青.2012中国癌症登记年报[M].北京:军事医学科学出版社,2012:27-31.
[2]Japanese Gastric Cancer Association.Japanese Gastric Cancer Treatment Guidelines 2010(ver.3)[J].Gastric Cancer,2011,14(2):113-123.
[3]Khalid Saeed Khan,NHS Centre for Reviews and Dissemination.Undertaking systemic reviews of research on effectiveness:CRD′s guidance for those carrying out or commissioning reviews.CRD Report 4[M].2nd ed.York:NHS Centre for Reviews and Dissemination,2001:160.
[4]黄鼎智,熊建萍,徐农,等.紫杉醇每周方案联合氟特嗪胶囊与氟尿嘧啶治疗晚期胃癌的Ⅱ期前瞻性随机对照研究[J].中华肿瘤杂志,2012,34(11):865-868.
[5]Deng T,Xu N,Xiong JP,et al.Safety analysis of weekly paclitaxel plus S-1 versus paclitaxel plus 5-fluorouracil/calcium folinate as first-line therapy in advanced gastric cancer:a multicenter open random phase Ⅱ trial[J].J Chemother,2013,25(1):56-59.
[6]Li YH,Qiu MZ,Xu JM,et al.S-1 plus cisplatin versus fluorouracil plus cisplatin in advanced gastric or gastro-esophageal junction adenocarcinoma patients:a pilot study[J].Oncotarget,2015(6):35107-35115.
[7]刘鹏,张弘纲,秦燕,等.抗代谢类新药替吉奥片联合顺铂一线治疗晚期胃癌的临床研究[J].中国慢性病预防与控制,2012,20(3):317-320.
[8]Jin M,Lu H,Li J,et al.Randomized 3-armed phase Ⅲ study of S-1 monotherapy versus S-1/CDDP(SP)versus 5-FU/CDDP(FP)in patients(pts)with advanced gastric cancer(AGC):SC-101 study[J].J Clin Oncol.2008,26(15 suppl 1):4533.
[9]Huang D,Ba Y,Xiong J,et al.A multicentre randomised trial comparing weekly paclitaxel + S-1 with weekly paclitaxel + 5-fluorouracil for patients with advanced gastric cancer[J].Eur J Cancer,2013,49(14):2995-3002.
[10]赖少清,鞠凤环,贺舜,等.902例胃癌临床流行病学特征分析[J].中国肿瘤,2011,20(7):506-508.
[11]Wöhrer SS,Raderer M,Hejna M.Palliative chemotherapy for advanced gastric cancer[J].Ann Oncol,2004,15(11):1585-1595.
[12]Wagner AD,Grothe W,Haerting J,et al.Chemotherapy in advanced gastric cancer:a systematic review and meta-analysis based on aggregate data[J].J Clin Oncol,2006,24(18):2903-2909.
[13]Boku N,Yamamoto S,Fukuda H,et al;Gastrointestinal oncology study group of the japan clinical oncology group.Fluorouracil versus combination of irinotecan plus cisplatin versus S-1 in metastatic gastric cancer:a randomized phase 3 study[J].Lancet Oncol,2009,10(11):1063-1069.
[14]Koizumi W,Narahara H,Hara T,et al.S-1 plus cisplatin versus S-1 alone for first-line treatment of advanced gastric cancer(SPIRITS trial):a phase Ⅲ trial[J].Lancet Oncol,2008,9(3):215-221.
[15]Ajani JA,Rodriguez W,Bodoky G,et al.Multicenter phase Ⅲ comparison of cisplatin/S-1 with cisplatin/infusional fluorouracil in advanced gastric or gastroesophageal adenocarcinoma study:the FLAGS trial[J].J Clin Oncol,2010,28(9):1547-1553.
[16]Ajani JA,Buyse M,Lichinitser M,et al.Combination of cisplatin/S-1 in the treatment of patients with advanced gastric or gastroesophageal adenocarcinoma:results of noninferiority and safety analyses compared with cisplatin/5-fluorouracil in the first-line advanced gastric cancer study[J].Eur J Cancer,2013,49(17):3616-3624.
[17]Chen XD,Tang LC,Tang XL,et al.A systematic review of S-1-based therapy versus 5-FU-based therapy in Chinese patients with advanced gastric cancer[J].Transl Gastrointest Cancer,2013,2(S1):61.
Meta-analysis of S-1 versus fluorouracil chemotherapy in Chinese patients with advanced gastric cancer*
ChenXiaodong1,2,HeFuqian3,ChenMi1
(1.DepartmentofGastrointestinalSurgery,SichuanCancerHospital·Institute/SichuanCancerControlandPreventionCenter,Chengdu,Sichuan610041,China;2.SchoolofMedicine,UniversityofElectronicScienceandTechnologyofChina,Chengdu,Sichuan610054,China;3.DepartmentofGeriatrics,theAffiliatedWestChinaHospitalSichuanUniversity,Chengdu,Sichuan610041,China)
Objective The aim of this study is to compare the efficacy and safety of S-1-based chemotherapy versus 5-fluorouracil- (5-FU-)based chemotherapy in Chinese patients with advanced gastric cancer (AGC).Methods Multicenter randomized controlled trials (mcRCTs),comparing S-1-based chemotherapy with 5-FU-based chemotherapy in Chinese patients with AGC,were searched in 3 online databases CNKI,Wanfang Data and PubMed.Two reviewers independently screened studies according to the inclusion and exclusion criteria,assessed quality of the included studies and extracted the data.Meta-analysis was performed using RevMan 5.2.Results Four mcRCTs were included in the analysis.Meta-analysis showed that S-1 could improve objective response rate [(OR=1.90,95%CI(1.36-2.65),P<0.01] and disease control rate [(OR=2.08,95%CI(1.43,3.03),P<0.01] compared with 5-FU,however,there was no significant difference in overall survival between the two groups [HR=0.76(0.39-1.50),P=0.82].With regard to safety,S-1 significantly increased the incidence of leukopenia[grade 1-4:OR=2.40(1.41,4.07),P<0.01;grade 3-4:OR=3.09(1.94,4.93),P<0.01],neutropenia[grade 1-4:OR=2.23(1.60-3.10),P<0.01;grade 3-4:OR=2.90(1.40-6.02),P<0.01],thrombocytopenia[grade 1-4:OR=2.40(1.56-3.69),P<0.01,anemia (grade 3-4:OR=1.78(1.11-2.87),P=0.02] and diarrhea[grade 3-4:OR=2.51(1.13-5.58),P=0.02];whereas,although the incidences of other gastrointestinal adverse events were relatively low in S-1 group,only the difference of grade 1-4 nausea was significant[OR=0.59(0.42-0.81),P<0.01].Conclusion For Chinese patients with AGC,S-1 can significantly improve the objective response rate and disease control rate,whereas increase the incidence of hematological toxicities.
stomach neoplasms;fluorouracil;Meta analysis;S-1;efficacy
2016年度重庆市出版专项资金资助项目
�证医学·
10.3969/j.issn.1671-8348.2017.05.021
四川省科技计划项目(2014FZ0089);四川省卫生厅科研课题(130226)。 作者简介:陈小东(1982-),副主任医师,副研究员,博士,主要从事胃癌的基础与临床研究。
R735.2
A
1671-8348(2017)05-0642-05
2016-09-24
2016-11-22)
