肺癌细胞系中KEAP1与NRF2相互作用区域基因突变的检测*
2017-03-01周建平李志芳梁笠轩
周建平,李志芳,梁笠轩,徐 德
(1.攀枝花学院医学院,四川攀枝花 617000;2.攀枝花学院附属医院,四川攀枝花 617000)
肺癌细胞系中KEAP1与NRF2相互作用区域基因突变的检测*
周建平1,2,李志芳1,梁笠轩1,徐 德2
(1.攀枝花学院医学院,四川攀枝花 617000;2.攀枝花学院附属医院,四川攀枝花 617000)
目的 检测非小细胞肺癌细胞系中KEAP1及NF-E2相关因子2(NRF2)相互作用结构域基因的突变情况。方法 以6个非小细胞肺癌细胞系为材料,检测KEAP1基因的第2至第6外显子及NRF2的DLG和ETGE基序编码序列的碱基序列突变情况,推测相应的氨基酸序列变异。同时检测供试细胞系的细胞内活性氧浓度,分析目标序列突变对肺癌细胞抗氧化系统的影响。结果 在KEAP1基因第4外显子区域发现4个所有癌细胞系共有的突变,部分细胞系的第3外显子区域还存在错义突变,所有NRF2-ETGE基序编码序列均存在多重遗传变异。活性氧检测发现供试细胞系活性氧浓度均高于肺胚细胞。结论 KEAP1和NRF2基因相互作用结构域的基因突变在供试细胞系内普遍存在,非小细胞肺癌细胞系对细胞内活性氧浓度失去调控能力是普遍现象。
NF-E2相关因子2;非小细胞肺癌;KEAP1
NF-E2相关因子2(NRF2)是细胞氧化应激反应中的关键转录因子,通过与抗氧化反应元件(antioxidant response element,ARE)相互作用,调控抗氧化蛋白和Ⅱ相解毒酶的表达[1]。NRF2的转录活性受胞浆蛋白(kelch-like ECH-associated protein-1,KEAP1)的负调控[1]。KEAP1通过其BTB区结合Cul3、Kelch区结合NRF2,将NRF2连接到E3复合体,使泛素从E3转移到NRF2的赖氨酸残基(位于ETGE基序、DLG基序之间),泛素化的NRF2被迅速降解[2-3]。发生氧化应激时,KEAP1特定的半胱氨酸残基被氧化修饰,导致DLG基序与KEAP1的亲和力减弱而分离,从而使NRF2免于泛素化降解。
研究发现,KEAP1和NRF2的体细胞突变常见于肺癌患者体内。KEAP1和NRF2的表达水平影响着非小细胞肺癌患者的化学治疗效果和无进展生存期[4-5]。约15%的肺癌患者携带KEAP1基因的体细胞突变[6],从而使得KEAP1失去了对NRF2活性的负调控能力。同时,约10%的肺癌患者携带NRF2基因的体细胞变异[1],使其能避免被KEAP1诱导降解,从而始终保持高度的NRF2转录因子活性。上述体细胞突变的存在,使得肺癌细胞能够持续大量表达抗氧化蛋白和解毒酶类,是导致癌细胞耐药的原因之一[7-8]。本研究以肺癌研究中常用的非小细胞肺癌细胞系为材料,对其核基因组中的KEAP1-Kelch区和NRF2-ETGE基序、NRF2-DLG基序的编码区段进行了PCR扩增和测序,以检测在这些常用肺癌研究材料中是否存在上述基因的突变,并结合细胞内活性氧水平的检测,分析了上述非小细胞肺癌细胞系在肺癌研究中的适用性。
1 材料与方法
1.1 肺癌细胞的准备 非小细胞肺癌细胞系PC9、HCC827、NCI-H1975、NCI-H1299、NCI-H460、NCI-H661和肺胚细胞系WI-38均购自中国科学院细胞库。冻存的细胞在37 ℃快速解冻后,1 000 r/min离心 5 min,用RPMI 1640基础培养基清洗1~2次,并重悬后再离心,获得的细胞加入含10%胎牛血清的RPMI 1640完全培养基,37 ℃,5% CO2培养箱内培养,每天换1次培养基,待细胞80%粘连时收获细胞。
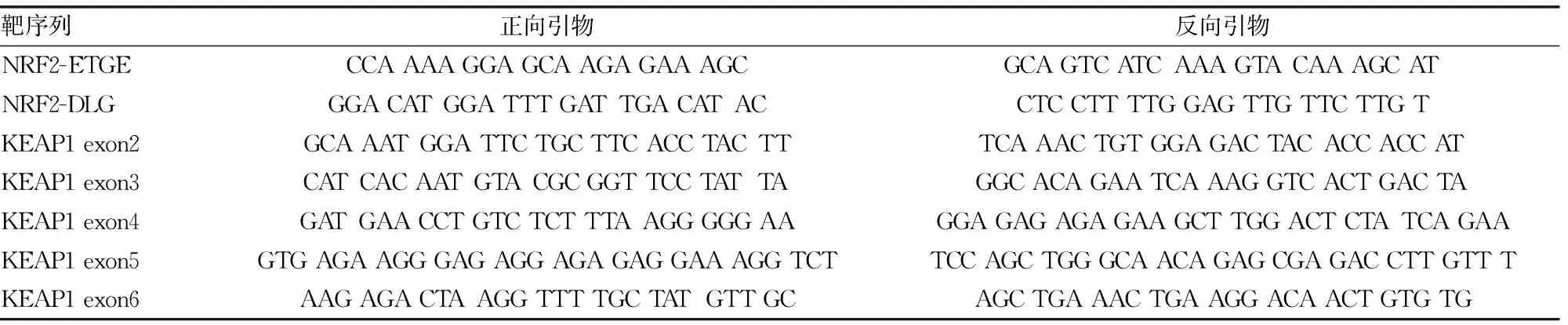
表1 PCR扩增采用的正反向引物序列
1.2 DNA提取 采用天根快速DNA提取检测试剂盒,(KG203)按说明书步骤进行DNA提取。首先取约5 mg细胞于1.5 mL Eppendorf管,加入100 μL缓冲液B1,用研磨杵(天根目录号:WL046)反复研磨30 s至样品与缓冲液B1混匀,再加入100 μL缓冲液B2,振荡混匀,12 000 r/min离心2 min,吸取其上清液直接用于PCR。
1.3 PCR扩增及产物测序 采用生工PCR扩增试剂盒(B532493),按说明书进行PCR扩增。PCR反应体系包括:模板、正反向引物、PCR Buffer (含Mg2+)、Pfu DNA聚合酶、dNTP。反应循环参数:95 ℃ 2 min进行DNA变性;95 ℃ 20 s,58 ℃ 30 s,72 ℃ 1 min,循环40次;最后于72 ℃延伸5 min。PCR产物经1%琼脂糖凝胶电泳20 min后,于Bio-Rad荧光成像系统检测,目标产物条带切胶回收,获得30~40 μL的纯化产物。PCR纯化产物送生工生物工程(上海)股份有限公司测序,得到测序图谱及序列。PCR扩增采用的正反向引物序列见表1。
1.4 基因突变的检测 核酸序列位置编码参考报道在美国国家生物技术信息中心网站(NCBI,http://www.ncbi.nlm.nih.gov)的人类基因参考序列:KEAP1 (NM_012289.3)、NRF2(NM_006164.4)。根据与参考序列比对结果,确定检测序列是否发生碱基突变,并用lasergene软件的MegAlign程序预测其对应的蛋白质氨基酸序列改变。
1.5 活性氧浓度检测 采用碧云天活性氧检测试剂盒(S0033),按照说明书步骤处理供试的肺癌细胞。细胞的准备如1.1所述,待细胞长满后调整细胞浓度为5×104/mL,按实验分组接种于48孔培养板,每孔300 μL,37 ℃,5% CO2培养箱内培养24 h。观察细胞80%粘连时,用磷酸盐缓冲液(PBS)清洗每孔细胞,加入DHE荧光染料,37 ℃下孵育30 min后,分别于荧光显微镜和荧光发光分析仪(Thermo Scientific)下拍照及检测。
2 结 果
2.1 KEAP1的Kelch结构域对应外显子基因突变分析 测序分析了KEAP1基因第2到第6外显子区域的DNA序列,发现第3和第4外显子区域存在错义突变和同义突变(表2)。从错义突变导致的氨基酸改变可以发现,所有供试细胞系在KEAP1第4外显子区域的4个相同位点存在相同突变,推测可能显著减弱KEAP1与NRF2的亲和力。其中3个位点的氨基酸残基电荷性质发生了显著改变:第446位由酸性谷氨酸(E)变为碱性赖氨酸(K),第459位碱性精氨酸(R)变为近中性的谷氨酰胺(Q),第493位酸性谷氨酸(E)变为碱性赖氨酸(K),上述氨基酸的变异可导致蛋白质构象的显著改变,从而减弱甚至丧失KEAP1结合NRF2的能力。第475位缬氨酸(V)变为甘氨酸则可能导致蛋白质折叠能力的显著改变。同时,部分细胞系的第3外显子区域也存在错义突变:第333位甘氨酸(G)变为半胱氨酸(C),第236位的酸性天冬氨酸(D)变为碱性组氨酸(H)。
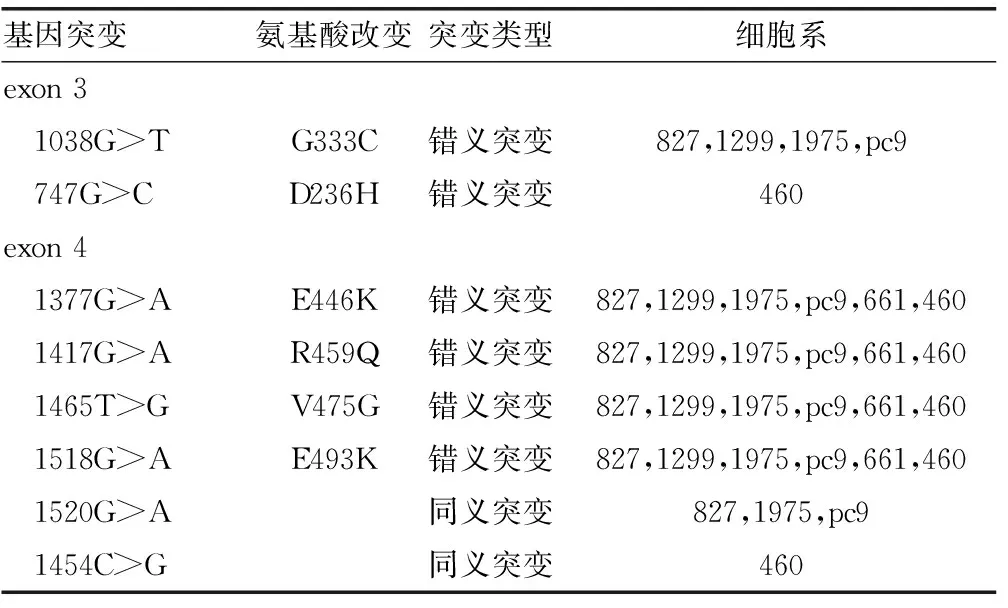
表2 KEAP1第2-6外显子基因突变分析
2.2 NRF2-DLG和NRF2-ETGE基因序列编码基因突变分析 对DLG及ETGE基因序列的基因突变检测结果显示,NRF2-DLG基因序列的碱基序列无突变,NRF2-ETGE基序对应碱基序列存在多重遗传变异(表3)。所有供试细胞系的ETGE基因序列对应碱基序列均存在大量的点突变,同时在347和352位点还存在缺失突变,推测其编码的氨基酸序列发生了极大改变,几乎所有位点的氨基酸均发生了改变,供试6个细胞系中不存在可供KEAP1蛋白结合的ETGE基因序列。

表3 NRF2-ETGE基因序列编码基因突变分析

续表3 NRF2-ETGE基因序列编码基因突变分析
a:NRF2-ETGE基因序列的氨基酸序列为:77DEETGE82。
2.3 肺癌细胞内活性氧浓度检测 采用2′,7′-二氧荧光黄双乙酸盐(DCFH-DA)法检测供试细胞系的相对活性氧浓度发现,供试肺癌细胞内活性氧水平均显著高于肺胚细胞WI-38,其中NCI-H1975细胞内活性氧浓度最高,其余细胞系的活性氧浓度相当。见图1。
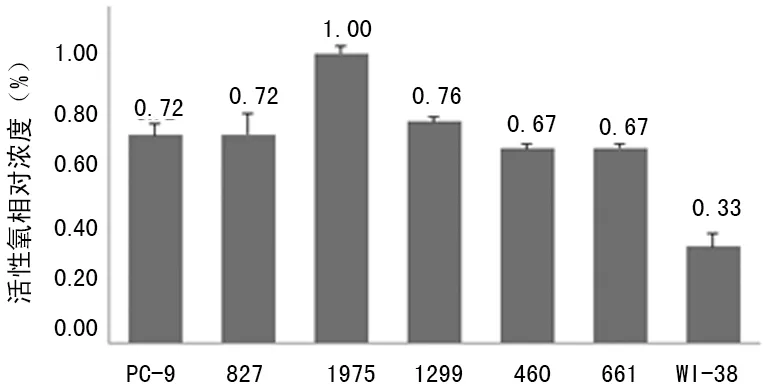
图1 细胞内活性氧相对浓度比较
3 讨 论
KEAP1/NRF2相互作用结构域基因突变在非小细胞肺癌细胞系内普遍存在,提示NRF2的转录因子活性的组成型表达是肺癌细胞增殖和存活的关键因素。KEAP1-NRF2调控系统在人类细胞的抗氧化和解毒调控中发挥着核心作用,非应激条件下,NRF2蛋白通过与KEAP1-泛素连接酶E3 复合体结合,不断被泛素化降解[9]。在氧化应激状态下,KEAP1蛋白中的活性半胱氨酸残基被氧化修饰,造成其与E3连接酶亲和力下降,使得NRF2能够在细胞内稳定存在,从而具有转录因子活性,能够进入细胞核内诱导一系列抗氧化和解毒基因的表达[10]。本次检测到肺癌细胞系内普遍存在着KEAP1-Kelch结构域和NRF2-DLG/ETGE基因序列基因的突变,且都可能导致蛋白质一级系列的变异,导致蛋白质功能的异常,KEAP1蛋白不能与NRF2蛋白进行正确识别和结合。这意味着在供试肺癌细胞内的KEAP1-E3复合体均对NRF2失去了抑制作用,NRF2因子可在癌细胞内稳定存在,使得癌细胞内抗氧化蛋白和解毒酶类变为组成型表达,使癌细胞的抗氧化能力最强化,以适应和拮抗癌细胞内高浓度的活性氧累积。
组成型表达的NRF2转录活性对肺癌细胞的存活是必需的[11],但是对于肿瘤治疗和肿瘤研究而言,这一变化意味着不好的结果:NRF2诱导大量解毒酶类的表达,极大地增强了癌细胞对抗癌药物的耐受性,有助于促进肺癌细胞耐药[12-14]。研究发现,通过破坏肺癌细胞NRF2蛋白的稳定性,可以有效提高肺癌细胞对抗癌药物的敏感性[13,15]。这意味着许多肺癌细胞对抗癌药物的耐药可能是NRF2或KEAP1基因突变导致的,使用具有不同遗传背景的癌细胞系进行药物测试可能得出不同的结论。因此,对于肿瘤药物研发而言,选择具有恰当遗传背景的细胞系是药物细胞测试能否成功的关键。
[1]Taguchi K,Motohashi H,Yamamoto M.Molecular mechanisms of the Keap1-NRF2 pathway in stress response and cancer evolution[J].Genes Cells,2011,16(2):123-140.
[2]Holland R,Hawkins AE,Eggler AL,et al.Prospective type 1 and type 2 disulfides of Keap1 protein[J].Chem Res Toxicol,2008,21(10):2051-2060.
[3]Satoh H,Moriguchi T,Taguchi K,et al.NRF2-deficiency creates a responsive microenvironment for metastasis to the lung[J].Carcinogenesis,2010,31(10):1833-1843.
[4]曹宝山,朱翔,陈森,等.Keap1在非小细胞肺癌中的表达及与化疗疗效相关性的研究[J].中国肺癌杂志,2012,15(10):591-596.
[5]倪静,秦丽娟,吴拥军,等.肺癌组织中NRF2、Keap1和NQO1蛋白的表达[J].郑州大学学报(医学版),2012,47(4):456-459.
[6]Singh A,Misra V,Thimmulappa RK,et al.Dysfunctional KEAP1-NRF2 interaction in non-small-cell lung cancer[J].PLoS Med,2006,3(10):1865-1876.
[7]Namani A,Li Y,Wang XJ,et al.Modulation of NRF2 signaling pathway by nuclear receptors:implications for cancer[J].Biochim Biophys Acta,2014,1843(9):1875-1885.
[8]Shibata T,Ohta T,Tong KI,et al.Cancer related mutations in NRF2 impair its recognition by Keap1-Cul3 E3 ligase and promote malignancy[J].Proc Natl Acad Sci U S A,2008,105(36):13568-13573.
[9]McMahon M,Thomas N,Itoh K,et al.Dimerization of substrate adaptors can facilitate cullin-mediated ubiquitylation of proteins by a “tethering” mechanism:a two-site interaction model for the NRF2-Keap1 complex[J].J Biol Chem,2006,281(34):24756-24768.
[10]刘晓平.癌症预防中的Keap1-NRF2-ARE通路[J].中国临床药理学与治疗学,2008,13(6):716-720.
[11]Ohta T,Iijima K,Miyamoto M,et al.Loss of Keap1 function activates NRF2 and provides advantages for lung cancer cell growth[J].Cancer Res,2008,68(5):1303-1309.
[12]Shibata T,Kokubu A,Gotoh M,et al.Genetic alteration of Keap1 confers constitutive NRF2 activation and resistance to chemotherapy in gallbladder cancer[J].Gastroenterology,2008,135(4):1358-1368.
[13]Homma S,Ishii Y,Morishima Y,et al.NRF2 enhances cell proliferation and resistance to anticancer drugs in human lung cancer[J].Clin Cancer Res,2009,15(10):3423-3432.
[14]莫享阳,乔洪源,欧阳学农,等.Keap1/NRF2/ARE 信号通路介导非小细胞肺癌耐药机制的研究进展[J].现代肿瘤医学,2015,23(9):1322-1324.
[15]Zhou S,Ye W,Shao Q,et al.NRF2 is a potential therapeutic target in radioresistance in human cancer[J].Crit Rev Oncol Hematol,2013,88(3):706-715.
Mutation detection in the interaction domains of NRF2 and KEAP1 in lung cancer cell lines*
ZhouJianping1,2,LiZhifang1,LiangLixuan1,XuDe2
(1.SchoolofMedicine,PanzhihuaUniversity,Panzhihua,Sichuan617000,China; 2.TheAffiliatedHospitalofPanzhihuaUniversity,Panzhihua,Sichuan617000,China)
Objective To detect the interaction domains′ gene mutations of KEAP1 and NRF2 in non-small-cell lung cancer cell lines,and to analyze the significance of these mutations on the study of lung cancer cell lines.Methods Six non-small-cell lung cancer cell lines were used as the research materials.The 2nd to 6th exons of KEAP1 and the coding sequences of DLG and ETGE motif were amplified by PCR,and the products were used for gene sequencing analysis.Obtained gene sequences were analyzed using NCBI databases to get the base locations of gene mutations,as well as the subsequent amino acid sequence changes.Meanwhile,the relative intracellular reactive oxygen species (ROS)concentrations in the tested cell lines were detected and used in the analysis of abnormal NRF2 transcriptional activity in lung cancer cell.Results Four mutations were detected in the 4th exon of KEAP1 gene from all the 6 cancer cell lines,several other missense mutations were also investigated in the 3rd exon of KEAP1 from some cancer cell lines.Multiple genetic variations were found in all the NRF2-ETGE motif-encoding sequences of the 6 cancer cell lines.All 6 cancer cell lines were found to have higher ROS concentration than the lung germ cell line.Conclusion Lung cancer cells generally contain high levels of ROS as well as gene mutations in KEAP1 and NRF2 genes which lead to abnormal transcriptional activity of NRF2 in lung cancer cell lines.
NF-E2 related factor 2;non-small-cell lung cancer;KEAP1
��·基础研究
10.3969/j.issn.1671-8348.2017.05.005
国家自然科学基金资助项目(81301893);四川省攀枝花市科技计划项目(2014TX-10-1); 攀枝花学院大学生创新创业训练计划项目(2014cxcy084)。 作者简介:周建平(1981-),讲师,博士,主要从事肿瘤相关细胞内信号转导网络研究。
R734.2
A
1671-8348(2017)05-0590-03
2016-06-30
2016-08-28)
