黄曲霉毒素的危害及其脱毒方法研究进展
2017-02-28乔宏兴姜亚乐王永芬史洪涛边传周
乔宏兴,姜亚乐,王永芬,史洪涛,边传周
(河南牧业经济学院,河南郑州 450046)
黄曲霉毒素的危害及其脱毒方法研究进展
乔宏兴,姜亚乐,王永芬,史洪涛,边传周*
(河南牧业经济学院,河南郑州 450046)
论文综述了黄曲霉毒素对动物免疫功能、生长发育、繁殖机能的危害及产生的致畸致癌作用,对人类健康的危害及对全球农业经济影响,并介绍了利用物理、化学和生物技术进行脱毒的方法和措施,旨在为降解黄曲霉毒素提供理论基础和研究思路。
黄曲霉毒素;危害;降解途径;动物
1960年,英国突然出现一种不明原因死亡的疾病造成10万只火鸡发病和死亡,被称为“火鸡X病”,后来当地鸭子也出现该病情,科学家经调查发现病原是来自于被一种真菌毒素污染的花生饼,这种毒素被命名为黄曲霉毒素(aflatoxin,AFT)。黄曲霉毒素为二氢呋喃香豆素的化学结构类似物,主要由黄曲霉和寄生曲霉等在适宜条件下分泌的代谢物质,具有强毒性和高致癌性,也是食源性的二级真菌毒素[1]。其遍布于土壤、动植物、各种坚果类中,易污染花生、玉米、小麦、棉子及其饼粕等。黄曲霉毒素B1((a5flatoxin B1,AFB1)给动物健康带来巨大威胁,畜禽轻则慢性中毒,导致免疫力下降、不孕、消化机制紊乱;严重者引发急性中毒症状,如肝病变、动物流产死胎甚至突然死亡。AFB1还可通过食源性动物传递到人,危害人类健康[2]。因此,采取安全并且有效的方法对黄曲霉毒素进行脱毒成为解决问题的关键点,本文对黄曲霉毒素的性质、危害和祛除方法等进行综述。
1 黄曲霉毒素的结构、理化性质及代谢
1.1 黄曲霉毒素种类
黄曲霉毒素为白色结晶物质,由二呋喃环和香豆素构成[3],分为三类,即在365 nm紫外光照射下呈蓝色荧光的为黄曲霉B类,发绿色荧光为G类,而M类是从牛奶中分离获得的,显示蓝紫色荧光[4]。AFB1是二氢呋喃氧杂萘邻酮的衍生物,二呋喃环是基本毒性单位,氧杂萘邻酮与其强毒性和癌变性相关。黄曲霉毒素B1在体内经过转化生成M1。
1.2 黄曲霉毒素理化性质
AFT分子质量为312~346 u,难溶于水,易溶于油脂、甲醇、乙腈、氯仿和丙酮等多种有机溶剂,不溶于己烷、石油醚、乙醚等[5]。对高温耐受性强,熔点200℃~300℃,在268℃条件下会部分分解,低浓度AFT经紫外线照射毒性稍有降低[6]。对光、热和酸稳定,在中性溶液中较稳定,在强酸性溶液中稍有分解,在pH 9~10强碱溶液中能迅速分解并生成几乎无毒的盐。因此,常用氨处理方法去除黄曲霉毒素,但反应可逆,遇到酸性条件毒性迅速恢复。对氧化剂也不稳定,氧化剂浓度越大,分解速度越快。因此在食品去毒时可利用这一化学反应。毒素在高浓度下稳定,低浓度毒素在紫外辐射下易分解。黄曲霉毒素的理化性质见表1。
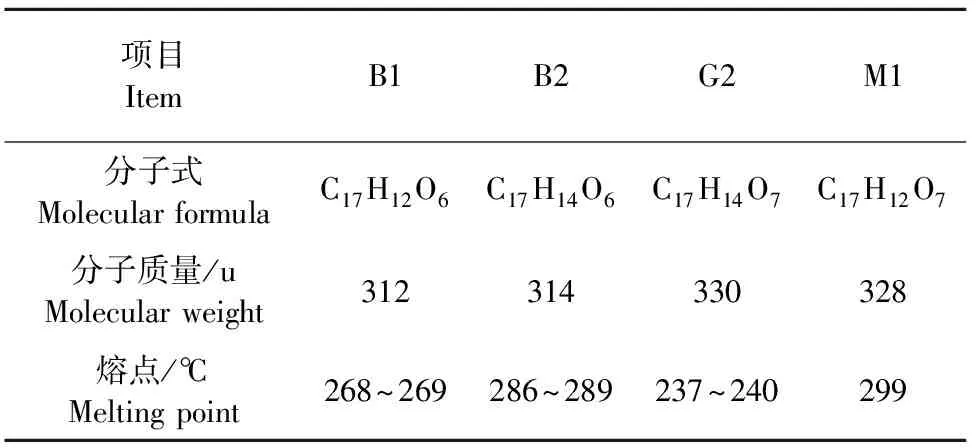
表1 黄曲霉毒素的性质
1.3 黄曲霉毒素合成及代谢
黄曲霉毒素以乙酰CoA为起始单位进行生物合成[7],延长单位是丙二醛单酰CoA。AFB1、AFG1合成过程为:乙酰CoA→己酰CoA→norsolorinic→acidaverantin→奥弗尼红素→versiconal hemiacetal acetate → versicona→杂色曲菌素B→杂色曲菌素A→杂色曲菌素→O-甲基杂色曲霉素→AFB1、AFG1;AFB2、AFG2合成过程:乙酰CoA→己酰CoA→norsolorinic→acidaverantin→奥弗尼红素→visional hemiacetal acetate→versiconal→杂色曲菌素B →二氢杂色曲霉素二氢→O-甲基杂色曲霉素→AFB2、AFG2。
畜禽饲喂了被AFB1和AFB2污染的饲料后,毒素经体内代谢后转化为AFM1(aflatoxin M1)和AFM2(aflatoxin M2),从乳汁和尿中排出体外,但仍有部分残留于动物肉中。检测自然条件下被霉菌毒素污染的饲料,发现AFB1的量最多且毒性最大,这也是中国在饲料质检中将AFB1霉菌毒素污染作为重要指标的原因[8]。
AFB1在生物体内代谢比较复杂,一般来说大部分在肝脏代谢,在肠道部位吸收。食物中的AFB1约50%在十二指肠被吸收,未被吸收的AFB1通过粪便排出体外且不会对机体造成特别大的损害。吸收的AFB1主要分布在肝脏,再者是肾脏,并且有少量以游离的AFB1及其水溶性代谢产物形式分布在肠系膜静脉[9]。
AFB1在体内的代谢过程如下:AFB1在肝脏内通过体内I相药物代谢酶(细胞色素P450氧化酶CYP450超家族成员,如CYP1A2、CYP3A4、CYP2A6等)发生羟化、脱甲基等代谢反应生成多种代谢产物,如黄曲霉毒素醇、AFP1、AFP1和 AFM1,后三者是无活性的,可直接通过尿液排出体外或以葡萄糖醛酸的形式通过粪便中排出体外,而黄曲霉毒素醇又可以被氧化为AFB1[10]。AFB1和AFM1可在细胞色素P450氧化酶系作用下发生环氧化反应生成能与细胞大分子(DNA或蛋白)结合的终致癌物,即AFB1-8,9-环氧化物、AFM1-8,9-环氧化物。其中AFB1-8,9-环氧化物的形成及其与DNA、RNA或蛋白质的共价结合,在急慢性中毒中起关键作用。高致癌活性的环氧化物可被机体Ⅱ相酶,如谷胱甘肽硫转移酶(glutathione S-transferases,GST)、尿苷二磷酸-葡糖醛酸基转移酶或磺基转移酶等部分代谢。其中经 GST作用,可使AFB1-8,9-环氧化物与谷胱甘肽结合,最终以AFB1-硫醇尿酸(AFB1-NAC)形式经尿排出体外;与此同时AFB1-8,9-环氧化物破坏DNA上的N7鸟嘌呤位置的G∶C碱基对,形成AFB1-N7-鸟嘌呤加合物,引起癌变,AFB1-8,9-环氧化物与白蛋白作用形成AFB1-白蛋白加合物,分布在血液中[11]。
2 黄曲霉毒素的危害
动物采食含黄曲霉毒素1 μg/kg的食物或饲料就会引发中毒,但不同种属动物对毒素敏感性和耐受力依次为雏鸭>雏火鸡>雏鸡>仔猪>犊牛>育肥猪>成年牛>绵羊,而同种动物的敏感性与其种类、性别、年龄、营养等相关。一般来说,幼龄畜禽比成年畜禽更敏感,种用畜禽比肉用畜禽敏感,雄性动物比雌性动物敏感,孕畜比未受孕母畜敏感,营养状况越差发病率越高。
黄曲霉毒素既有很强的急性毒性,导致肝脏坏死出血,使免疫系统受损,引起蛋白质营养不良症并导致儿童发育受阻,也有明显的慢性毒性,会引起肝癌,并具有致癌、致畸、致突变作用,对人、家畜、家禽的健康威胁极大[12]。黄曲霉毒素的毒性是氰化钾的10倍,砒霜的68倍,敌敌畏的100倍,致癌作用是二甲基亚硝胺的75倍,奶油黄的900倍,3,4-苯并芘的4 000倍[13]。AFB1对各种动物经口的LD50值分别为:雏鸭0.335 mg/kg,猪0.62 mg/kg,猫0.55 mg/kg ,狗0.5 mg/kg~1 mg/kg,山羊1.2 mg/kg,兔0.3 mg/kg~0.5 mg/kg,火鸡1.86 mg/kg~2 mg/kg,猴2.2 mg/kg,小鼠8.0 mg/kg。
2.1 对动物免疫功能的危害
AFT对动物造成免疫抑制主要为作用于细胞免疫,能与DNA或RNA结合,并抑制其合成;引起动物胸腺发育不良和萎缩,生成的淋巴细胞减少,抑制补体C4的产生,抑制T细胞产生白细胞介素和其他细胞因子。引起B淋巴细胞活性降低、抗原递呈细胞和吞噬细胞功能受到影响、抗体减少。AFB1对动物免疫造成的危害为降低血清中免疫球蛋白和抗体水平,减弱吞噬细胞能力,使机体抵抗力下降,产生免疫失败[14]。
2.2 对动物生长发育的危害
有研究表明在黄羽肉鸡的饲料中添加0.1 mg/kg的AFB1平均日增重下降5.09%,料肉比增加4.42 %,平均日采食量下降0.85%。猪对黄曲霉毒素的敏感性不及家禽,但其肝脏受损严重,采食量和日增重与饲料中AFT浓度呈负相关[15]。因此,饲料中污染AFT会降低和破坏营养成分,若毒素含量过大会导致动物采食量下降。进入体内的AFT能降低胰酶活性,影响酶及某些激素的合成,引起吸收和代谢障碍,造成动物消化不良、食欲减退、贫血、体重减轻和生长发育受阻等[16]。还可引起肝脏和血清中脂类水平上升,血液中总蛋白质、胆固醇和尿素氮减少。
2.3 对动物繁殖能力的危害
家禽生殖机能受AFT危害明显,可造成公禽睾丸生殖上皮发生明显病变[17],睾丸萎缩变轻,少精,引起繁殖能力和受精率下降等。母鸡日粮中AFB1含量为1 mg/kg时,蛋重小、受精率与蛋孵化率受到影响,生殖器官组织脂肪变性并伴随炎性细胞浸润。Meissonier G M等[18]研究了母鸡采食含1.5 mg/kg AFB1日粮,种蛋孵化率降低,胚胎后期死亡率增加,孵出小鸡体液和细胞免疫功能受到抑制,对疾病易感性增强。AFT对猪的繁殖性能危害也很明显,急性中毒表现母畜产仔数量减少,流产,产弱仔、死胎和畸形胎,导致卵巢畸形、萎缩,子宫黏膜受损。公猪无性欲、睾丸变小、趋向雌性化。AFT还可影响奶牛的生产力和身体状况,使其泌乳能力降低或丧失,导致妊娠母牛早产或流产。因此,AFT对种畜禽场的危害会造成繁殖力下降,直接影响经济效益。
2.4 对人类健康的危害
AFT一方面直接影响动物机体健康,同时会转移到畜禽产品(肉、奶、蛋)中,通过食物链威胁人类健康。人的黄曲霉毒素急性中毒往往发展为急性肝炎、胆管增生、肝细胞坏死、肝充血出血,通常与误食了被黄曲霉毒素污染的食品有关。一般还会出现典型变化如黄疸,发热,食欲减退、厌食和腹泻,严重者肝脾肿大,肝区疼痛,黏膜黄染,肝功能异常等中毒性症状,也可出现痉挛、昏迷等危险状况。
AFB1具有致畸、致癌作用,被国际权威组织归为人类1级致癌物。研究发现AFB1进入体内使癌细胞中的p53基因发生突变,证明该基因能发挥抑癌作用参与细胞调节,而P53基因突变会改变其蛋白空间结构,丧失辅助特异DNA片段的修复能力,严重情况下还会促进细胞发生癌变[19]。若少量多次摄入黄曲霉毒素,会造成生长受阻,食物利用率降低,肝损伤,肝衰,长期则会形成乙肝甚至肝癌、胃癌、肠癌等[20]。在人体内AFB1主要发生去甲基化和环氧化等代谢过程,代谢产物同样具有毒性、致癌和致突变作用。因此,黄曲霉毒素是人类原发性肝癌、胃癌和肺癌等癌症的诱因之一,例如乙型肝炎病毒携带者长期接触黄曲霉毒素后诱发肝癌的可能性是正常人的60倍,其主要原因在于其致畸、致癌的危害。
3 黄曲霉毒素对经济的影响
据联合国粮农组织(FAO)统计,全球每年有25%的谷物受真菌毒素的污染,而AFT的危害最严重。中国多种农产品及其制品受黄曲霉毒素污染严重,其中主要有花生和玉米及其加工制成的饲料。AFT对农业经济的影响是全人类共同面临的全球性问题。世界卫生组织(WHO)对食品中AFT的含量做出了相应的限定标准,其中黄曲霉毒素B1、G1、B2、G2这4种的总检出量不超过15 μg/kg[21]。世界主要农产品进口国纷纷出台了更为严格的限制标准,由于各国制定了自身相应的限量标准和法规,从而对各国贸易造成了很大的影响,如欧盟国家多次以花生中AFT超标为理由拒绝进口中国花生及其深加工产品。另外,中国自加入世贸组织后,粮食出口贸易经常发生AFT超标的现象,造成了巨大的经济损失。
4 黄曲霉毒素的预防和祛除措施
黄曲霉及其毒素污染给农业、养殖业、食品加工业和饲料工业造成了巨大损失,并且对人类健康造成巨大威胁,加上粮食资源短缺与人类需求增多的矛盾,黄曲霉毒素污染造成的粮食浪费问题急需采取安全有效的方法来解决。针对黄曲霉毒素的污染通常会采取一些基本措施:从根本上防止污染、对已经污染的作物进行脱毒、抑制霉菌毒素的吸收。当然,防止AFB1对食品的污染,最根本的措施就是预防其产生,而祛毒只是补救的措施。目前对霉菌毒素脱毒方法有物理脱毒法、化学脱毒法、生物脱毒法等。
4.1 物理脱毒法
物理脱毒法主要有高温灭活、辐射、吸附、有机溶剂萃取、臭氧处理等。吸附法最经典,常用吸附剂有酵母细胞壁、膨润土、水合硅铝酸盐、活性炭等。刘媛婷[22]以水合铝硅酸钠钙盐为主要成分的吸附剂和以水合铝硅酸钠钙盐和活性炭为主要成分的吸附剂D,作用90 min后对AFB1的吸附率分别为85.49%和91.71%,说明靠吸附方法可以去除大部分毒素。张芳[23]探讨了臭氧降解花生粕的条件,处理时间12 min,花生粕含水量15%,质量与反应容器体积比为5∶500 g/mL,对AFB1的降解率高达85.01%。此外,紫外照射、红外辐射、γ射线等辐射法在一定程度上均可以破坏黄曲霉毒素的化学结构,但目前这些方法由于使用受限,利用较少,在动物方面主要利用酵母细胞壁进行物理脱毒。
4.2 化学脱毒法
根据化学试剂不同分为酸处理法、碱处理法、氨处理法以及有机溶剂处理法等。强酸作用于黄曲霉毒素B1和G1使之转化为低毒的B2a和G2a。采用弱碱处理祛除花生粕中黄曲霉毒素,经121℃、pH10处理60 min,B族黄曲霉毒素的降解率超过84%。有研究报告利用氨气熏蒸处理祛除粮食中黄曲霉毒素后,饲喂雏鸡并对其组织病理学变化进行研究,证实氨气能部分祛除玉米中的AFT且无毒副产物产生。常用的有机溶剂950 mL/L乙醇、800 mL/L异丙酮、乙烷乙醇、乙烷乙酮水溶液等能够去除大部分的油脂中的AFT。理论上讲,化学脱毒法能降低AFT含量,但操作要求高,成本昂贵,仅限实验室操作,对畜禽来讲,化学处理营养成分可能被破坏,饲料营养价值和适口性下降。另一方面,该方法只能对某一种毒素有效,对其他毒素效果一般,并且可能有高残留问题,并不适用于大规模生产[24],因此,此方法不太现实。
4.3 生物脱毒法
随着人民对微生物的了解越来越深入,科学家们尝试通过微生物降解AFT这个世界性难题[25]。学者们从自然界分离筛选一些微生物,研究其生物转化机制,从而使霉菌毒素被破坏或转变为低毒、无毒物质。这种生物防治的方法效率高、无污染、成本低,有些还能使产品的营养价值得到提升,日益受到人们的重视。
殷传振[26]选择5株微生物对含有AFB1(aflatoxin B1)、DON(deoxynivalenol)和ZEN(zearalenone)的花生粕、麸皮、玉米副产物的混合物料进行固态发酵,对霉菌毒素的降解效果进行比较,结果表明,地衣芽胞杆菌和枯草芽胞杆菌对AFB1降解有一定的作用。张盼[27]筛选出9株芽胞杆菌,其发酵全菌液对AFB1降解率达80%以上,7株菌的发酵上清液对AFB1降解率达60%以上。其中一株来源于纳豆的菌株发酵上清液对AFB1的降解率达85.73%,其上清液经浓缩而成的粗酶液对AFB1降解率达91.4%。
4.3.1 微生物的吸附作用 有研究证实鼠李糖乳杆菌对AFB1的吸附率高达64.8%。Shahin A A M[28]从奶制品中分离12株乳酸菌,结果表明,Lactococcuslactic和Streptococcusthermophiles2株菌灭活后吸附效果分别达到86.1%和100%。
4.3.2 微生物的抑制作用 林峰[21]研究表明10株芽孢杆菌对寄生曲霉的菌丝体抑制率在80%以上,并且综合筛选出7个对寄生曲霉菌丝体和NA都有良好抑制效果的菌株。郭春兰[29]以玉米圆斑病菌为指示菌,经枯草芽胞杆菌21发酵液处理后,玉米圆斑病菌孢子萌发率降低,孢子和菌丝产生畸形,不能正常发育。
综合生物脱毒方法主要表现为三个方面,一是利用生物竞争原理,抑制霉菌生长从而降低霉菌毒素的产生和积累;二是利用微生物及其代谢产物进行脱毒,一些微生物菌体本身可以吸附黄曲霉毒素;三是另一些微生物在发酵过程中可以产生代谢产物(主要为胞外酶)降解黄曲霉毒素。这些微生物包括酵母菌、细菌、真菌和藻类等。相较其他方法用生物方法进行黄曲霉毒素解毒比较温和。
5 结论
综上所述,黄曲霉毒素不但对动物的生长和免疫等造成危害,给畜牧业生产带来了巨大影响,并且有可能危害人体健康,还对世界经济和贸易带来影响。因此,当务之急是采取有效的防治措施,降低污染风险,保证人类的健康。近年来,人们通过不断地研究和探索,研究出各种各样的防霉措施、脱毒方法。从当前降解黄曲霉毒素污染的方法来讲,利用微生物的生物转化作用降解黄曲霉毒素具有很好发展前景。
[1] Abrar M,Anjum F M,Butt M S,et al.Aflatoxins:biosynthesis,occurrence,toxicity,and remedies[J].Crit Rev Food Sci Nutrit,2013,53(8):862-874.
[2] Alberts J F,Engelbrecht Y,Steyn P S,et al.Biological degradation of aflatoxin B1 byRhodococcuserythropoliscultures[J].Int J Food Microbiol,2006(109):121-126.
[3] Cheraghali A M,Yazdanpanah H,Doraki N,et al.Incidence of aflatoxins in Iran pistachio nuts[J].Food Chem Toxicol,2007(45):812-816.
[4] Chen J,Hu L B,Zhou W,et al.Degradation of microcystin-LR and RR by aStenotrophomonassp.strain EMS isolated from lake Taihu,China[J].Int J Mol Sci,2010(11):896-911.
[5] Gratz S,Mykkanen H, El-Nezami H.Aflatoxin B1 binding by a mixture ofLactobacillusandPropionibacterium:invitroversusexvivo[J].J Food Protect,2005(68):2470-2474.
[6] 戴 军.黄曲霉毒素B1降解酶产生菌的筛选及发酵制备酶制剂的研究[D].湖北武汉:湖北工业大学,2015.
[7] 韩愈杰.黄曲霉拮抗菌株的分离筛选及对黄曲霉毒素的降解效果[D].河北保定;河北农业大学,2015.
[8] Khanafari A,Soudi H,Miraboulfathi M,et al.Aninvitroinvestigation of alfatoxin B1 biological cintrol byLactobacillusplantarum[J].Pakistan J Biol Sci,2007,4(3):163-168.
[9] 王清兰,陶艳艳,刘成海,等.黄曲霉毒素体内吸收与代谢的干预措施研究进展[J].肿瘤,2007,27(5):415-418.
[10] 罗自生,秦 雨,徐艳群.黄曲霉毒素的生物合成、代谢和毒性研究进展[J].食品科学,2015, 36(3):250-257.
[11] 孙玲玉.枯草芽孢杆菌泰山株的分离鉴定及其对黄曲霉毒素的降解作用[D].山东泰安:山东农业大学,2014.
[12] 张文敏,孙 超,郑晓春.饲料中黄曲霉毒素对动物的危害及防治措施[J].中国饲料添加剂,2015(4):5-7.
[13] 方振霞.黄曲霉毒素B1(AFB1)的分离、纯化及AFB1人工抗原的高效合成研究[D].福建福州:福建农林大学,2014.
[14] 谢 庆,常文环,刘国华,等.黄曲霉毒素对家禽的危害与脱毒技术[J].动物营养学报,2014,26(12):1-7.
[15] 周元军.饲料中黄曲霉毒素的危害与防治研究进展[J].安徽农业科学,2006,34(5):913-914.
[16] 黄 伟,谌先明.黄曲霉毒素的危害及预防措施[J].畜禽业,2014(10):38-41.
[17] Mohan K,Jay A K.Hepatotoxicity of acetaminophen in chickens[J].J Vet Pharmacol Toxicol,2008,7(1/2):48-49.
[18] Meissonnier G M,Marin D E,Galtier P,et al.Modulation of the commune response by a group of fungal food contaminant,the aflatoxins[J].Nutrit Immun,2006(1):147-166.
[19] Olempska-Beer Z S,Merker R I,Ditto M D,et al.Food-processing enazymes from recombinant microorganisms-a review[J].Regul Toxicol Pharmacol,2006,45:144-158.
[20] Laciakova A,Cicooova P,Mate D,et al.Alfatoxin and possibilities for their biological detoxification[J].Medycyna Weternaryjna,2008,64(3):276-279.
[21] 林 峰.生防芽孢杆菌物种与分子遗传多样性研究[D].黑龙江哈尔滨:哈尔滨工业大学,2011.
[22] 刘媛婷.霉菌毒素吸附剂对黄曲霉毒素B1吸附特性及效果研究[D].四川雅安;四川农业大学,2011.
[23] 张 芳.真菌毒素臭氧降解及其他脱毒方法研究[D].江苏无锡:江南大学,2014.
[24] 翁晓辉,王 敏,杜红方.霉菌毒素的危害及其降解方法简述[J].饲料广角,2015(20):31-33.
[25] 高 潮,郑云峰,王祖平,等.饲料中霉菌毒素脱毒剂的发展趋势[J].饲料研究,2014,5(4):7-10.
[26] 殷传振.4种霉菌毒素的吸附和降解效果研究[D].山东泰安:山东农业大学,2015.
[27] 张盼.生物法降解黄曲霉毒素B1的初步研究[D].北京:中国农业科学院,2015.
[28] Shahin A A M.Removal of aflatoxin B1 from contaminated liquid media by dairy lactic acid bacteria [J].Int J Agr Biol,2007,9 (1):71-75.
[29] 郭春兰.枯草芽孢杆菌21的分离及其抑菌能力研究[D].黑龙江大庆:黑龙江八一农垦大学,2014.
Progress on Harm and Detoxification Methods of Aflatoxin
QIAO Hong-xing,JIANG Ya-le,WANG Yong-fen,SHI Hong-tao,BIAN Chuan-zhou
(HenanUniversityofAnimalHusbandryandEconomy,Zhengzhou,Henan,450046,China)
In this paper, the effects of aflatoxins on animal immune function,growth and development, reproductive performance,teratogenesis,human health and global agricultural economy were summarized.The detoxification measures by physical,chemical and biological methods were also introduced for providing theoretical basis and research methods in degradation of aflatoxin.
aflatoxin; harm; degradation method; animal
2016-07-08
河南省科技攻关项目(142102310034);河南省高等学校青年骨干教师资助计划项目(2014GGJS-124);河南牧业经济学院科技创新团队项目(HUAHE2005001);河南省自然科学基金面上项目(162300410128)
乔宏兴(1976- ),男,河南长垣人,副教授,博士研究生,主要从事益生菌发酵中药研究。*通讯作者
S859.87
A
1007-5038(2017)01-0089-05
