Galectin-8蛋白对组织工程心脏瓣膜种子细胞的增殖、黏附功能的影响
2017-02-28冯德广
林 彬 冯德广
(河南省人民医院,河南 郑州 450003)
Galectin-8蛋白对组织工程心脏瓣膜种子细胞的增殖、黏附功能的影响
林 彬 冯德广
(河南省人民医院,河南 郑州 450003)
目的 体外研究Galectin-8在不同浓度或状态下对组织工程心脏瓣膜种子细胞增殖及黏附的影响。方法 以骨髓间充质干细胞分化而来的内皮细胞作为种子细胞,离体状态下常规培养。采用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)法测定不同浓度下Galectin-8作用12、24、48 h后对细胞增殖的影响;将细胞分为重组质粒pGFP-Galectin-8转染组、空质粒pGFP转染组、阴性对照组及蛋白预铺组,分别铺于96孔板中,观察相同时间段的细胞黏附数量。结果 Galectin-8 10、20、40 μg/ml剂量组的细胞增殖数目均显著高于空白对照组,其中20 μg/ml组表现尤为显著(P<0.05);pGFP-Galectin-8转染组的转染效率与空质粒pGFP转染组无显著差异(P>0.05),且Galectin-8的表达量显著高于空质粒pGFP转染组和阴性对照组(P<0.05);细胞种植到培养板上1、2、4 h后,蛋白预铺组相同时间的细胞黏附数量显著高于其他各组(P<0.05),pGFP-Galectin-8转染组的细胞黏附数量显著小于其他各组(P<0.05),空质粒pGFP转染组和阴性对照组的细胞黏附数量无显著差异(P>0.05)。结论 Galectin-8对内皮细胞的增殖具有促进作用,且在细胞种植前预铺蛋白固定后能够显著增加内皮细胞的黏附,而胞内Galectin-8过表达则抑制细胞黏附。
Galectin-8;组织工程心脏瓣膜;种子细胞;增殖;黏附
组织工程心脏瓣膜是一种理想的人造心脏瓣膜,在治疗心脏瓣膜性疾病过程中能够克服机械瓣膜和生物瓣膜的缺点,有望实现抗凝、耐受且对生长发育无副作用〔1〕。组织工程心脏瓣膜的研究重点分为种子细胞、支架材料及瓣膜构建三个方面,目前有关种子细胞和支架材料的研究已比较成熟,而关于瓣膜构建仍处于摸索阶段,尤其是如何将种子细胞最大效率地种植在支架上,提高其增殖速度和黏附性成为目前该项目的研究关键〔2〕。Galectin-8蛋白属于β-半乳糖凝集素家族,是一种分泌蛋白,主要通过与整合素结合,活化相关细胞通路,调控细胞黏连,在细胞黏附中发挥重要作用,但研究表明Galectin-8蛋白在细胞黏附中具有双重作用〔3,4〕。本研究通过不同浓度不同处理方式研究Galectin-8蛋白对种子细胞增殖及黏附的影响。
1 材料与方法
1.1 实验资料及主要试剂 种子细胞血管内皮细胞由骨髓间充质干细胞诱导分化并冻存;Galectin-8蛋白购自sino生物科技公司;pGFP-Galectin-8表达质粒由上海生工生物有限公司构建。3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)和胰蛋白酶购自Sigma公司,Dulbecco极限必需培养基达尔伯克汉良伊格尔培养基(DMEM)及胎牛血清均购自GIBCO公司,Lipofectamine®2000购自Invitrogen公司,兔抗人Galectin-8一抗及羊抗兔二抗均购自Abcam公司。
1.2 细胞复苏及培养 冻存的血管内细胞作为组织工程心脏瓣膜种子细胞,37℃水浴中快速融化,加含10%胎牛血清的DMEM培养基稀释,1 000 r/min,离心5 min,吸弃培养基,再用3 ml新鲜培养基重悬细胞并吸入培养瓶中,置于5% CO2、37℃培养箱中进行培养。
1.3 细胞增殖实验 内皮细胞传至3~4代后,待细胞生长至瓶底的90%时,0.25%胰蛋白酶消化处理,细胞计数后调细胞量至5×104/ml,接种于96孔细胞培养板中,每组6个复孔,每孔200 μl,置于CO2培养中培养24 h,吸弃培养基更换为含不同浓度Galectin-8(5、10、20、40 μg/ml)的细胞培养液,以不含蛋白的培养基作为空白对照,放于培养箱中培养,于培养12、24、48 h后测定细胞量,每孔加10 μl MTT(5 mg/ml)继续培养4 h,弃上清加150 μl二甲基亚砜(DMSO),震荡10 min,于酶标仪下测定OD490 nm的吸光值。
1.4 黏附实验
1.4.1 将细胞进行分组处理 ①将重组质粒pGFP-Galectin-8按照Lipofectamine®2000操作说明转染至提前铺于6孔板的细胞中,细胞初密度为1.5×105/孔,并于转染后24 h在显微镜下观察转染效率,收集细胞,提取蛋白,Western印迹法检测蛋白表达水平,使用Image J进行条带分析。②将不含Galectin-8基因的空质粒载体pGFP转染细胞,操作方法同上。③细胞不做任何处理,在相同时间收集细胞,作为阴性对照。④在细胞铺板前,将增殖实验中浓度最佳的Galectin-8蛋白预铺至96孔板中为蛋白预铺组,并于4℃风干16 h,磷酸缓冲液(PBS)冲洗。
1.4.2 黏附性测定 将处理或转染后的细胞按照5×104/孔的细胞密度铺于96孔板中,培养基不含血清,每组重复3次,放于CO2培养箱中培养,在培养1、2、4 h后分别取出培养板吸弃培养液,加100 μl甲醇,固定15 min,蒸馏水冲洗后晾干,采用100 μl吉姆萨进行15 min染色,并在室温风干,于显微镜下进行细胞计数,每孔取3个不同的视野进行计数最终取平均值作为黏附细胞数量。
1.5 统计学方法 采用SPSS19.0软件进行t检验。
2 结 果
2.1 Galectin-8对细胞增殖的影响 当Galectin-8处理细胞12 h时,各组细胞量无显著差异,作用24 h后,Galectin-8处理组的细胞数量高于对照组,其中Galectin-8 10、20、40 μg/ml浓度的细胞量与空白对照组差异显著(P<0.05),作用时间延长至48 h,细胞密度较24 h均有上升,其中Galectin-8 20 μg/ml组的细胞密度显著大于其他各组(P<0.05)。见表1。
2.2 各组内皮细胞转染情况 转染后24 h pGFP-Galectin-8转染组的转染效率为57.03%,空质粒pGFP转染组56.50%,两组无显著差异,阴性对照组未做任何处理,在同样曝光强度和曝光时间下,无荧光出现。见图1。
2.3 各组内皮细胞中Galectin-8蛋白表达情况 pGFP-Galectin-8转染组Galectin-8的表达(1.15±0.02)显著高于空质粒pGFP组(0.08±0.01)和阴性对照组(0.03±0.01)(P<0.05)。见图2。
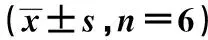
表1 Galectin-8对细胞增殖的影响
与空白对照组比较:1)P<0.05;与其他各组比较:2)P<0.05
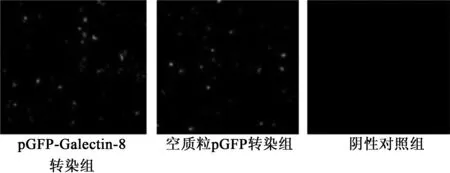
图1 各组转染效率比较(×200)
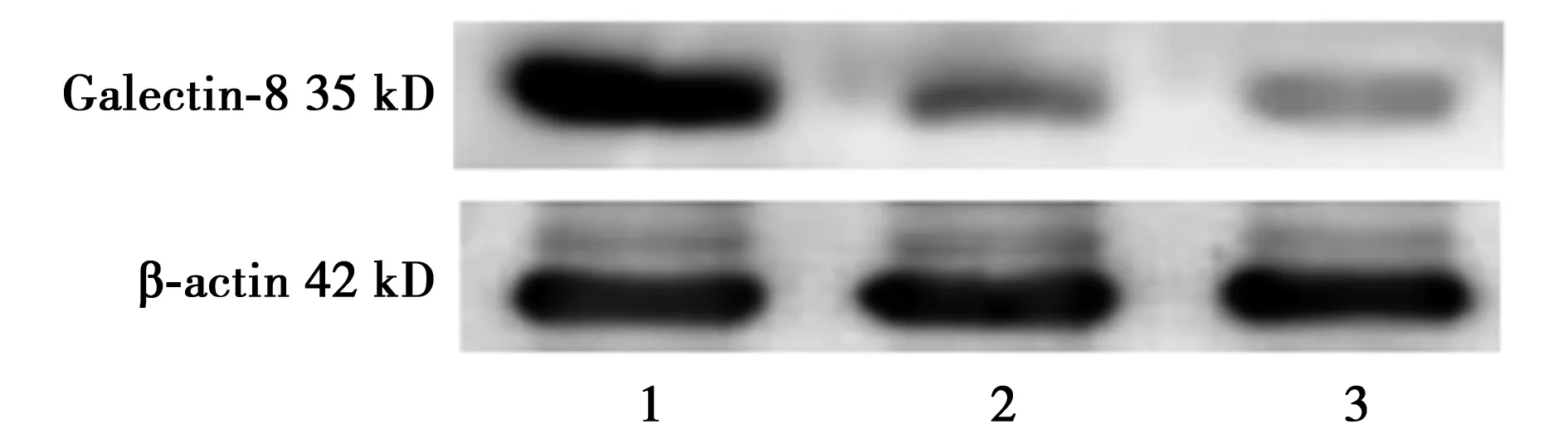
1.pGFP-Galectin-8转染组;2.空质粒pGFP转染组;3.阴性对照组图2 Galectin-8蛋白表达情况
2.4 Galectin-8对细胞黏附的影响 蛋白预铺组细胞黏附个数最多,在不同时间段均显著高于其他各组(P<0.05),且随着时间的增长不断增多,pGFP-Galectin-8转染组细胞黏附数目最少,显著低于其他3组,阴性对照组与空质粒pGFP转染组无统计学差异。见表2。
表2 Galectin-8对细胞黏附的影响,个,n=9)
与pGFP-Galectin-8转染组比较:1)P<0.05;与空质粒pGFP转染组比较:2)P<0.05;与阴性对照组比较:3)P<0.05
3 讨 论
心脏瓣膜病、先天性心脏病严重危害人类健康,其治疗是心外科领域的重点、难点。组织工程心脏瓣膜由于其优良的血流动力学性能,不需抗凝,不仅应用于主动脉瓣和肺动脉瓣的置换,同时还是复杂先天性心脏病纠治中带瓣管道良好的替代材料。获得种子细胞是组织工程的前提基础,目前筛选得到符合条件的种子细胞主要包括间质细胞、血管内皮细胞及干细胞等,但血管内皮细胞主要来源于用动脉或静脉,在取材时具有一定创伤性,间质细胞主要为肌纤维细胞,其功能与正常瓣膜细胞具有一定差距〔5,6〕。骨髓间充质干细胞是一种多能干细胞,获取方便,体外培养、纯化、扩增的技术也较为成熟,能够诱导转化为血管内皮细胞,已成为制备种子细胞的理想材料〔7〕。
在瓣膜构建过程中种子细胞与支架材料相互作用是一个极其复杂的过程,如何促进种子细胞在支架材料上的增殖、黏附及延长其在瓣膜表面的寿命成为目前研究的关键〔8〕。Galectin-8属于凝集素亚家族,包含两个碳水化合物识别区,主要分为原始型、串联重复型和嵌合体型三种类型。研究表明,Galectin-8可以促进脾细胞的增殖,低剂量的Galectin-8可以促进T细胞的增殖,在炎症反应中发挥重要作用〔9〕。另有研究发现,当Galectin-8浓度过高时会引起胞内钙离子和磷酯酰丝氨酸增多,刺激caspase-3的表达促进上皮细胞凋亡〔10〕。本研究在探讨Galectin-8对细胞增殖影响时,同样发现其在一定浓度范围内促进内皮细胞生长,当过高时反而导致细胞数量下降,与上述观点一致。种子细胞与支架材料之间的黏附主要是细胞与基质间的黏附,即在黏附因子介导下细胞表面受体与胞外配体结合,再与基质相互作用引起细胞与基质的黏附〔11〕。黏附因子主要包括整合素家族、钙黏素、免疫球蛋白超家族、选择素家族及透明质酸黏素五类。整合素是一种跨膜蛋白,在与配体结合活化后,可以通过α-肌动蛋白、裸蛋白及黏着斑蛋白等与细胞骨架连接,形成配体-整合素-细胞骨架系统,促进细胞黏附〔12〕。据报道,Galectin-8蛋白作为细胞内的活化因子,能够增加整合素与配体的结合,活化细胞内的信号通路,进而促进黏着斑激酶FAK磷酸化,小GTP酶的激活及结合蛋白的恢复等,最终增强细胞与基质蛋白的黏附〔13〕。但Galectin-8蛋白对整合素的调控具有双重作用,Troncoso等〔14〕研究显示当Galectin-8蛋白过量分泌时,导致其与细胞表面的整合素大量结合,负调节细胞与胞外基质间的黏附。熊辉强等〔15〕研究表明Galectin-8在组织分化差恶性程度高的喉鳞状上皮细胞癌中高表达,参与癌细胞的黏附侵袭。本研究表明过量的Galectin-8能够占据细胞表面的整合素结合位点,进而降低细胞黏附活性,而将Galectin-8预先包被在载体上,再种植细胞时能够显著增加细胞的黏附活性。
综上,Galectin-8蛋白在一定浓度范围内能够促进血管内皮细胞增殖,血管内皮细胞转染Galectin-8表达质粒时会导致溶解性蛋白过量进而抑制细胞与基质的黏附,而将Galectin-8蛋白在种植细胞前预铺于载体上能促进细胞黏附。
1 Cheung DY,Duan B,Butcher JT.Current progress in tissue engineering of heart valves:multiscale problems,multiscale solutions〔J〕.Expert Opin Biol Ther,2015;15(8):1-18.
2 苗 青,刘 鹏,丰 波.组织工程心脏瓣膜的研究进展〔J〕.包头医学院学报,2013;29(2):120-3.
3 刘 武.Galectin-8蛋白对组织工程心脏瓣膜种子细胞粘附性影响的研究〔D〕.南昌:南昌大学,2014.
4 Delgado VMC,Nugnes LG,Colombo LL,etal.Modulation of endothelial cell migration and angiogenesis:a novel function for the "tandem-repeat" lectin galectin-8〔J〕.FASEB J,2011;25(1):242-54.
5 郭海平.国内外骨髓间充质干细胞作为组织工程心脏瓣膜种子细胞的研究综述〔J〕.贵阳中医学院学报,2012;34(5):205-8.
6 祁 亮,宋 兵.国产人工机械瓣膜的历史与研究进展〔J〕.中国胸心血管外科临床杂志,2013;20(2):218-21.
7 林 彬,冯德广,王 锋.诱导多功能干细胞技术制备内皮细胞构建患者组织工程瓣膜的实验研究〔J〕.中华航海医学与高气压医学杂志,2015;22(5):352-5.
8 孙艳丽,韩宏光,黄带发,等.组织工程心脏瓣膜的构建:现状与前景〔J〕.中国组织工程研究,2013;17(50):8775-80.
9 Liu CH,Chien CT,Lin CH,etal.NMR assignments of the C-terminal domain of human galectin-8〔J〕.Biomol NMR Assign,2015;9(2):427-30.
10 Cárcamo C,Pardo E,Oyanadel C,etal.Galectin-8 binds specific β1 integrins and induces polarized spreading highlighted by asymmetric lamellipodia in Jurkat T cells〔J〕.Experim Cell Res,2006;312(4):374-86.
11 Hasan A,Ragaert K,Swieszkowski,etal.Biomechanical properties of native and tissue engineered heart valve constructs〔J〕.J Biomech,2014;47(9):1949-63.
12 朱 鹏,杨 谦.整合素与血管内皮细胞结构及功能的研究进展〔J〕.福建医药杂志,2015;37(1):121-3.
13 徐丽丹,罗运春.半乳糖凝集素-8与支气管哮喘〔J〕.中华哮喘杂志(电子版),2010;4(4):220-2.
14 Troncoso MF,Ferragut F,Bacigalupo ML,etal.Galectin-8:a matricellular lectin with key roles in angiogenesis〔J〕.Glycobiology,2014;24(10):907-14.
15 熊辉强,李 黎,张少容,等.Galectin-8在喉鳞状上皮细胞癌中的表达及临床意义〔J〕.中国现代医学杂志,2011;21(34):4278-81.
〔2015-03-19修回〕
(编辑 苑云杰)
林 彬(1982-),男,主治医师,硕士,主要从事心脏基础及临床研究。
R654.2
A
1005-9202(2017)03-0573-03;
10.3969/j.issn.1005-9202.2017.03.021
