Standford A型主动脉夹层术后ICU停留时间延长的危险因素分析
2017-02-27刘婷婷曾和松周晓阳李雪莹陈晓英
刘婷婷, 曾和松, 周晓阳, 李雪莹, 陈晓英
(1. 武汉大学人民医院东院 心内科, 湖北 武汉, 430000;2. 武汉亚洲心脏病医院, 湖北 武汉, 430000)
Standford A型主动脉夹层术后ICU停留时间延长的危险因素分析
刘婷婷1, 曾和松1, 周晓阳1, 李雪莹1, 陈晓英2
(1. 武汉大学人民医院东院 心内科, 湖北 武汉, 430000;2. 武汉亚洲心脏病医院, 湖北 武汉, 430000)
目的 分析A型主动脉夹层术后患者重症监护室(ICU)停留时间延长的危险因素。方法 选取A型主动脉夹层行手术治疗的361例患者。根据患者术后ICU停留时间分为ICU停留时间延长组和ICU停留时间未延长组。先进行单因素分析,将单因素分析有意义的变量纳入Logistic回归进行多因素分析。结果 Logistic分析发现,吸烟、入院时收缩压、白细胞计数、血肌酐、低密度脂蛋白胆固醇、术前假腔内血栓形成、载脂蛋白A-I、术后呼吸机使用时间与术后ICU停留时间延长相关。结论 吸烟、入院时收缩压、白细胞计数、血肌酐及术后呼吸机使用时间是术后ICU停留时间延长的独立危险因素,低密度脂蛋白胆固醇、载脂蛋白A-I、术前假腔内血栓形成是术后ICU停留时间延长的保护性因素。
主动脉夹层; ICU停留时间延长; 危险因素
A型主动脉夹层是临床心血管科急危重症之一,目前外科手术仍是主要治疗手段,与药物治疗相比可明显改善患者预后[1-2]。但外科手术治疗的风险性比较高,既往急性A型主动脉夹层手术死亡率约20%,近5年约10%[3]。慢性 Stanford A型夹层手术死亡率约5%[4-8]。国外研究[9-13]报道,心脏手术患者中2%~11%的患者术后ICU停留时间延长,这部分患者术后死亡率、并发症发生率高,远期预后改善较差[14-16]。本研究分析手术治疗的A型主动夹层术后ICU停留时间延长的危险因素,现报告如下。
1 资料与方法
1.1 临床资料
检索某三甲医院心外科2005-2013年所有出院时确诊为A型主动脉夹层的361例患者住院期间的临床资料。所有资料由固定医师收集并记录,采用一人记录、一人核对方式保证记录资料准确性。记录项目有:年龄、性别、体质量指数、既往病史、影像学检查、心电图、血液生化检查、手术情况、术后恢复情况及院外随访。一般情况包括患者的年龄、性别、发病时间。入院时情况主要为入院症状及生命体征情况。影像学检查包括心电图、彩色多普勒超声心动图、多层螺旋CT血管成像(MSCTA)。血液生化检查包括:白细胞计数、血小板计数、血肌酐、血尿酸、肝功能、血脂、血沉、C反应蛋白、BNP、肌钙蛋白等。手术情况包括手术方式、术中主动脉阻断时间、异体输血量及术后二次手术情况。术后情况包括ICU停留时间、组织病理学检查、术后并发症。所有患者均于2013年12月—2014年6月行门诊检查或电话随访,记录是否出现并发症。
1.2 方法
所有患者术前常规予以降压、控制心室率药物治疗,如无用药禁忌首选β-受体阻滞剂联合钙离子拮抗剂治疗,血压控制不理想时加用ACEI/ARB类药物,血压控制仍差者酌情加用利尿剂及α-受体阻滞剂。合并心功能不全者酌情选用硝普钠治疗。
全组患者手术采用统一的麻醉方案:以依托咪酯10~15 mg、芬太尼5~10 μg/kg和哌库溴铵0.1~0.15 mg/kg静脉诱导麻醉,机械通气FiO2为100%。术中以微量泵静脉输入芬太尼和/或吸入异氟醚维持麻醉,间断追加芬太尼和哌库溴铵。手术方式均采用孙氏手术方法进行。所有患者术后立即转入ICU进一步治疗。脱呼吸机指征为: ① 体温>35℃; ② 神志清醒; ③ 血流动力学状态稳定; ④ p(O2)>60 mmHg, p(CO2)<50 mmHg, pH>7.3。转出ICU指征为: ① 患者清醒,可完成简单指令动作; ② 自主呼吸频率16~25次/min, 不需机械辅助通气; ③ p(O2)>80 mmHg且p(CO2)<45 mmHg; ④ 体温>36℃; ⑤ 血流动力学稳定。
1.3 评价标准
术后并发症定义: ① 术后住院期间死亡; ② 术后住院期间无论任何原因再次手术; ③ 术后住院期间出现的脏器、肢体功能损害需专科进一步治疗的并发症,如大面积脑梗死需神经内科进一步治疗、脊髓缺血致瘫痪、严重心律失常需起搏器或电生理介入治疗、心肌梗死、心包填塞、脱呼吸机后再次气管插管或气管切开、脓毒血症、严重肝肾功能损害需长期血液净化治疗; ④ 术后随访期间出现的再发夹层、人工植入物感染、新发瓣膜反流、冠脉桥吻合口狭窄致心肌缺血、再发心功能不全。
术后并发症排除标准: ① 术后与大血管手术无关的病因致死者,如肿瘤、药物过敏、术后确诊的免疫疾病、外伤等; ② 院外出现的由其他病因导致的脏器功能损害; ③ 住院期间即出现但明确由非手术相关原因导致的脏器功能损害,如药物副反应、术前携带疾病术后复发等。
1.4 统计学处理
采用SPSS 22.0统计软件处理,所有计量资料符合正态分布的采用均数±标准差表示,组间均数比较采用独立样本t检验。非正态分布的计量资料采用中位数(25%~75%四分距)表示,组间比较采用Mann-Whitney U检验。计数资料采用χ2检验或fisher精确检验分析。从结果中筛选出无统计学意义的变量,为避免假阴性变量被淘汰,将P值放宽到P<0.1为差异有统计学意义。将单因素统计学分析有统计学意义的变量纳入Logistic回归分析,采用LR向前逐步法,得到独立预测因素,P<0.05为差异有统计学意义。
2 结 果
全组所有患者ICU停留时间为138.72±122.92 h, 时间分布符合正态分布,参考既往研究结果[17]将ICU停留时间定义为≥3 d, 统计发现ICU停留时间不足3 d和ICU停留时间≥3 d的患者在术后并发症方面有显著差异(P<0.05或P<0.01)。见表1、2。
与ICU停留时间延长组比较, *P<0.05, **P<0.01。
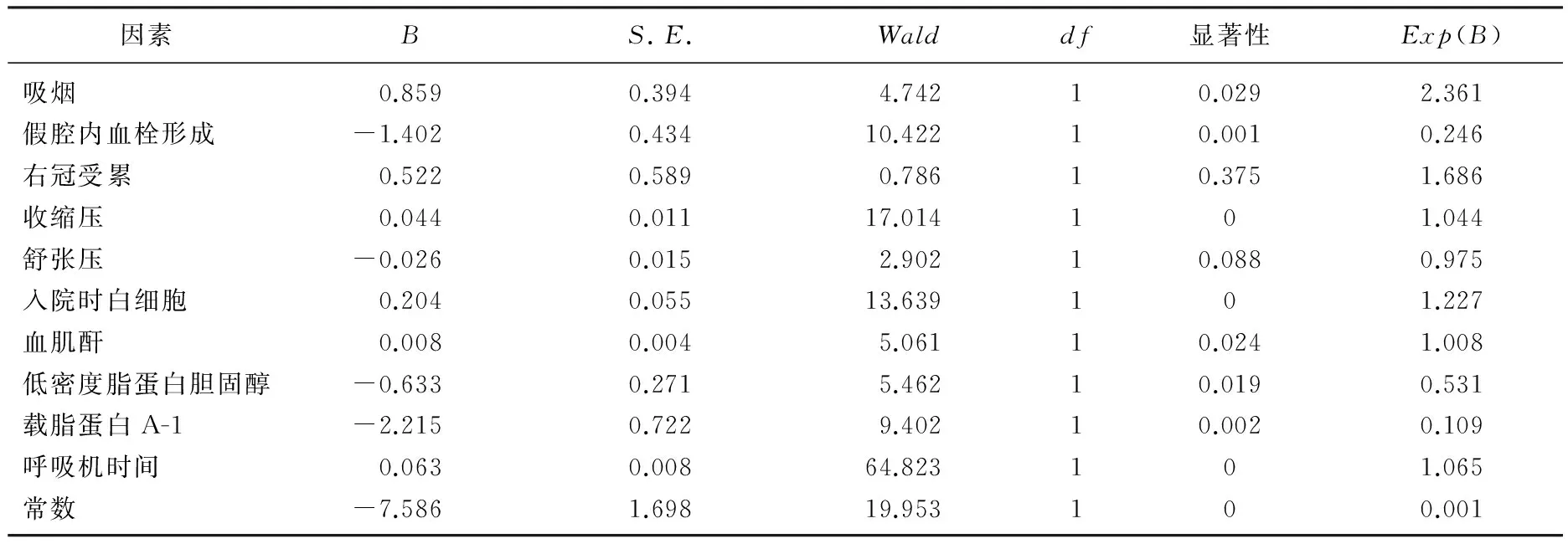
表2 Logistic分析结果
3 讨 论
近年来,主动脉夹层住院患者逐年增加。以中国报道的急性A型主动脉夹层患者为例,2007年广东省心血管病研究所报道该研究所收治的急性A型主动脉夹层患者在连续2个5年周期的比较中增加了270%[18], 2014年河南省报道的急性A型主动脉夹层患者在连续2个5年周期的比较中增加了294%[19]。这部分患者病情危重,术后并发症发生率高, ICU停留时间相应延长。中国目前医疗资源紧缺, ICU床位短缺,因此研究ICU停留时间延长危险因素,对评估手术风险、合理安排手术及分配各种医疗资源有重要意义[20]。国内研究[21-22]报道的心脏手术术后ICU停留时间延长相关危险因素,多选取瓣膜病或冠心病患者,尚无主动脉夹层患者外科术后ICU停留时间延长相关因素的报道。国外部分研究[23-24]探讨了心脏术后ICU停留时间延长危险因素,还有部分研究对Euroscore、Pasonnet评分系统对心脏术后ICU停留时间延长的预测作用进行了评估[25], 但这类研究的对象不仅包括主动脉手术,还囊括了所有其他的心脏手术。还有部分研究[26-28]只针对冠心病及瓣膜病患者,单独针对主动脉夹层患者的研究并不多见[29], 且尚缺乏针对中国A型主动脉夹层患者ICU停留时间延长的危险因素及预测模型的相关探讨。
本研究纳入361例A型主动脉夹层患者,以ICU停留时间≥3天作为ICU停留时间延长的标准, Logistic回归分析显示吸烟、入院时收缩压、白细胞计数、血肌酐、低密度脂蛋白胆固醇及术后呼吸机使用时间是术后ICU停留时间延长的危险因素,术前假腔内血栓形成、载脂蛋白A-1是术后ICU停留时间延长的保护性因素。
吸烟是主动脉夹层患者术后ICU停留时间延长的危险因素。吸烟对于机体功能的影响是多途径的: ① 吸烟能促使动脉粥样硬化的形成和发展,这是由于吸烟增加血液一氧化碳浓度,促进血管内膜内皮释放生长因子,中膜平滑肌细胞增生、迁移,形成动脉硬化。② 吸烟增加巨噬细胞的在血管内膜的黏附,加重内膜及粥样斑块中的炎症反应。③ 吸烟能增加血管壁基质金属蛋白酶表达,参与动脉血管壁的重塑。④ 吸烟者血液中凝血因子及纤维蛋白原含量增加,增加血小板聚集力,导致凝血功能紊乱。⑤ 吸烟是高血压病的独立危险因素[30], 而高血压是主动脉夹层形成和进展的高危因素。⑥ 吸烟直接导致肺组织病理性改变。病理学研究[31]发现,吸烟者无论呼吸功能是否正常,其肺小动脉均出现动脉肌化比例增加,内膜、中膜增厚,管腔变小; 肺腺泡内动脉血管内皮细胞变形,胞内细胞器减少。吸烟还可使肺组织纤毛运动能力减弱,支气管杯状细胞增生,黏膜分泌增加,气道净化能力减弱,支气管分泌物排除障碍,肺泡内吞噬细胞功能减退。有临床研究[32]证实吸烟是主动脉夹层患者手术后出现低氧血症的独立危险因素。吸烟导致的肺通气不足和换气障碍会增加手术后肺部感染和呼吸功能不全的发生率,延长术后ICU停留时间。
术后呼吸机使用时间也是ICU停留时间延长的危险因素,这类患者多由于血流动力学不稳定和/或呼吸功能不全导致。这2个因素也是心脏术后重返ICU的主要原因[33]。这类患者需要更长时间的机械辅助治疗, ICU停留时间相应延长,且预后不理想。炎症反应在主动脉夹层的发生、发展过程中占有重要作用。本研究在收集基础数据时纳入了包括白细胞、C反应蛋白、血沉等在内的大部分临床常用炎症指标。分析后显示主动脉夹层患者入院时白细胞计数升高是手术后ICU停留时间延长的独立危险因素。白细胞计数是反映炎症反应剧烈程度的最直接指标。主动脉疾病患者,尤其是急性期患者中,由于激活炎症反应瀑布,大量炎症介质释放,白细胞、巨噬细胞及多种细胞因子被激活,共同参与主动脉疾病的病理改变。主动脉夹层起病急剧,进展迅速,同时伴发机体的急性应激反应[34], 这一反应能加重炎症细胞激活和炎症因子释放,致使非感染特异性的炎症指标升高。在慢性期患者抑炎因子释放,使炎症反应控制在一定范围。其他炎症指标,如C反应蛋白也能反映炎症和组织损伤,已证实C反应蛋白是预测急性主动脉夹层近期死亡的独立危险因素[35]。本研究中, C反应蛋白对术后ICU停留时间延长的预测作用没有白细胞计数明显,这可能是由于C反应蛋白可能对低级水平的炎症反应不敏感导致的。高敏C反应蛋白被认为是一种能反映极低程度炎症反应的良好指标,高敏C反应蛋白是否更能预测主动脉夹层术后ICU停留时间延长需进一步探讨。
血肌酐水平是评价肾脏功能的重要指标。在主动脉夹层患者,术前肾功能损害多由肾前性及肾性因素引起。主动脉夹层患者多合并长期高血压史,引起肾小动脉硬化,造成肾脏自主调节功能和代谢功能障碍。主动脉夹层的撕裂可累及肾动脉,造成肾脏假腔供血,导致肾脏缺血性改变。这些基础性病变导致肾脏耐受深低温停循环手术的能力下降,增加术后出现肾功能衰竭的风险。手术过程中的体外循环和低灌注加重肾脏的损害。体外循环加重血液细胞破坏,破碎的血细胞可堵塞肾小球,加重肾损害; 体外循环可引发机体瀑布型炎症反应,加重内皮细胞损害; 体外循环及术中低温改变血小板聚集和粘附能力,造成血液高凝状态,形成微小血栓,造成微循环栓塞。术中低灌注及循环恢复后的缺血再灌注损伤加重对肾脏的损害。术前合并肾功能不全的患者在疾病和手术的多重打击下更容易出现肾脏功能衰竭,是术后出现肾功能衰竭的独立危险因素[36], 需要血液净化治疗的风险增加,延长ICU停留时间。
术前假腔内血栓形成是主动脉夹层术后ICU停留时间延长的保护性因素。假腔内血栓形成时,假腔血流减少,假腔内壁血管张力下降,使得主动脉撕裂的进展受到限制,减少重要脏器低灌注的发生和出现假腔供血的比例,降低术后重要脏器功能不全的发生率。同时,血栓形成使远端破口封闭,还能减少术后出现夹层逆向撕裂的比例。但由于主动脉夹层本身合并凝血功能异常和凝血因子的大量消耗,不推荐术前认为药物治疗促进假腔内血栓形成。
低密度脂蛋白胆固醇与载脂蛋白A-1是主动脉夹层术后ICU停留时间延长的保护性因素。既往认为低密度脂蛋白胆固醇可诱导和加剧炎症反应,而载脂蛋白A-1是高密度脂蛋白胆固醇的重要成分,主要发挥抑制炎症反应作用[37-38], 还可促进胆固醇由外周组织肝脏逆转运[39]。但在手术患者中,两者均为术后ICU停留时间延长的保护性因素,这主要与血脂在炎症反应及感染中的作用有关。血脂下降是发生严重感染的独立危险因素[40]。其原因可能为: ① 炎症因子抑制脂质合成,如炎症因子TNF-α、IL-1β、IL-6能抑制胆固醇在肝细胞的合成[41]; ② 感染时胆固醇消耗增加:胆固醇是细胞膜的重要结构,也是类固醇激素和部分维生素的主要来源,感染过程多合并白细胞等的破坏,使细胞合成增加,同时应激促进类固醇激素释放,这些过程均伴随胆固醇消耗; ③ 发生感染及应激使胆固醇吸收和利用下降[42]。术前合并血脂降低,是术后感染加重和死亡的危险因素[43]。因此,不推荐对拟手术治疗的主动脉夹层患者术前予以强化降脂药物治疗。
[1] Gummert J F, Funkat A K, Beckmann A, et al. Cardiac surgery in Germany during 2010: a report on behalf of the German Society for Thoracic and Cardiovascular Surgery[J]. ThoracCardiovascSurg, 2011, 59(5): 259-267.
[2] Ince H, Nienaber C A. Diagnosis and management of patients with aortic dissection[J]. Heart, 2007, 93: 266-269.
[3] Tan M E, Moeshuis W J, Dossche K M, et al. Long-term results after 27 years of surgical treatment of acute type A aortic dissection[J]. ANN Thorac Surg, 2005, 80: 523-529.
[4] Jault F, Rama A, Lievre L, et al. Chronic dissection of the ascending aorta: surgical during a 20-year period(previous surgery excluded)[J]. Eur J Cardiothorac Surg, 2006, 29: 1041-1045.
[5] 王亮, 常谦, 于存涛, 等. Standford A型主动脉夹层术后院内死亡危险因素分析[J]. 中华外科杂志, 2012, 5, 50(5): 442-425.
[6] 罗海燕, 胡克俭, 刘租赟, 等. A型主动脉夹层术后肾功能衰竭危险因素分析[J]. 中华外科杂志, 2008, 46(4): 1070-1072.
[7] 尚蔚, 刘楠, 闫晓蕾, 等. A型主动脉夹层手术后发生呼吸功能不全的危险因素分析[J]. 中华胸心血管外科杂志, 2011, 27(6): 349-352.
[8] 孙智山, 曾建平, 黄河, 等. 主动脉夹层5年死亡率相关因素的Logistic回归分析[J]. 中国医师杂志, 2012, 14(12): 1651-1653.
[9] Bapat V, Allen D, Young C, et al. Survival and quality of life after cardiac surgery complicated by prolonged intensive care[J]. J Card Surg, 2005, 20(3): 212-217.
[10] Gaudino M, Girola F, Piscitelli M, et al. Long-term survival and quality of life of patients with prolonged postoperative intensive care unit stay: unmasking an apparent success[J]. J Thorac Cardiovasc Surg, 2007, 134(2): 465-469.
[11] Mazzoni M, De Maria R, Bortone F, et al. Long-term outcome of survivors of prolonged intensive care treatment after cardiac surgery[J]. Ann Thorac Surg, 2006, 82(6): 2080-2087.
[12] Williams MR, Wellner RB, Hartnett EA, et al. Long-term survival and quality of life in cardiac surgical patients with prolonged intensive care unit length of stay[J]. Ann Thorac Surg, 2002, 73(5): 1472-1478.
[13] Gersbach P, Tevaearai H, Revelly J P, et al. Are there accurate predictors of long-term vital and functional outcomes in cardiac surgical patients requiring prolonged intensive care[J]. Eur J Cardiothorac Surg, 2006, 29(4): 466-472.
[14] ShuliSilberman, Daniel Bitran, Daniel Fink, et al. Very Prolonged Stay in the Intensive Care Unit After Cardiac Operations: Early Results and Late Survival[J]. Ann Thorac Surg, 2013, 31(2): 267-274.
[15] Dominik Joskowiak, Utz Kappert, Klaus Matschke, et al. Prolonged Intensive Care Unit Stay of Patients after Cardiac Surgery: Initial Clinical Results and Follow-UP[J]. Thorac Cardiovasc Surg, 2013, 61: 701-707.
[16] K. Miriam Elfstrom, Dustin Hatefi, Patrick D. Kilgo, et al. What Happens After Discharge An Analysis of Long-Term Survival in Cardiac Surgical Patients Requiring Prolonged Intensive Care[J]. J Card Surg, 2012, 27(1): 13-9.
[17] GopalSoppa, Claudia Woodford, Martin Yates, et al. Functional status and survival after prolonged intensive care unit stay following cardiac surgery[J]. Interactive Cardiovascular and Thoracic Surgery, 2013(16): 750-754.
[18] 薛凌, 罗建方, 麦劲壮, 等. 广州市主动脉夹层临床特征变化趋势十年回顾性分析[J]. 中华心血管病杂志, 2007, 35(1): 47-50.
[19] 宋先荣, 韩雪萍, 程兆云, 等. 河南省主动脉夹层病例临床特征变化趋势10年回顾性分析[J]. 中华心胸血管外科杂志, 2014, 30(3): 164-166.
[20] Balakrishnan Mahesh, Cliff K, Choong, Kimberley Goldsmith, et al. Prolonged Stay in Intensive Care Unit Is a Powerful Predictor of Adverse Outcomes After Cardiac Operations[J]. Ann Thorac Surg, 2012, 94: 109-16.
[21] 葛翼鹏, 许建屏, 史艺, 等. 心脏瓣膜手术后ICU时间延长的危险因素分析[J]. 中国胸心血管外科杂志, 2007, 14(2): 85-88.
[22] 赵强. 冠状动脉旁路移植术后ICU时间延长的影响因素[J]. 中国胸心血管外科杂志, 2011, 27(2): 101-7.
[23] Damien J LaPar, Jacob R Gillen, Ivan K Crosby, et al. Predictors of Operative Mortality in Cardiac Surgical Patients with Prolonged Intensive Care Unit Duration[J]. J Am Coll Surg, 2013, 216: 1116-1123.
[24] Fabio Barili, Nicoletta Barzaghi, Faisal H. Cheema, et al. An original model to predict Intensive Care Unit length-of stay after cardiac surgery in a competing risk framework[J]. Int J Cardiol, 2013, 168(1): 219-25.
[25] John Chalmers, Mark Pullan, Brian Fabri, et al. Validation of Euro SCORE Ⅱ in a modern cohort of patients undergoing cardiac surgery[J]. European Journal of Cardio-Thoracic Surgery, 2013(43): 688-694.
[26] Francesco Cacciatore, Clara Belluomo Anello, NicolettaFerrara, et al. Determinants of prolonged intensive care unit stay after cardiac surgery in the elderly[J]. Aging ClinExp Res, 2012, 24: 627-634.
[27] Ansar Hassan, Curtis Anderson, Alan Kypson, et al. Clinical Outcomes in Patients With Prolonged Intensive Care Unit Length of Stay After Cardiac Surgical Procedures[J]. Ann Thorac Surg, 2012, 93: 565-9.
[28] Jianping Xu, Yipeng Ge, Shengshou Hu, et al. A Simple Predictive Model of Prolonged Intensive Care Unit Stay after Surgery for Acquired Heart Valve Disease[J]. The Journal of Heart Valve Disease, 2007, 16: 109-115.
[29] Yipeng Ge, Lizhong Sun, Junming Zhu, et al. Can Euro SCORE Ⅱ Predict the Mortality and Length of Intensive Care Unit Stay after Total Aortic Arch Replacement with Stented Elephant Trunk Implantation for DeBakey Type I Aortic Dissection[J]. ThoracCardiovascSurg, 2013, 61: 564-568.
[30] 杨波, 邱泉, 栾玉明, 等. 海珠区4 062名男性常住居民吸烟指数对高血压影响分析[J]. 现代预防医学, 2010, 37(8): 1553-1555.
[31] 张建全, 陈珣珣, 梁毅, 等. 吸烟肺功能正常者及吸烟COPD患者肺小动脉超微结构的研究[J]. 中国呼吸与危重监护杂志, 2010, 9(5): 465-470.
[32] 刘子娜. 急性主动脉夹层术前低氧血症危险因素分析及肺复张治疗深低温停循环主动脉术后低氧血症的疗效观察[D]. 北京协和医学院, 中国医学科学院, 清华大学医学部, 2012
[33] D. Joskowiak, M, Wilbring, M, Szlapka, et al. Readmission to the intensive care unit sfter cardiac surgery: a single-center experience with 7105 patients[J]. J Cardiocasc Surg, 2012, 53: 671-6.
[34] Eggebrecht H, Naber C K, Batch C, et al. Value of plasma fibrin D-dimer for detection of acute aortic dissection[J]. J Am Coll Cardioi, 2004, 44(4): 804-809.
[35] Schillinger M, Ddmanovits H, Bayegan K, et al. C-reactive protein and mortality in patients with acute aortic disease [J]. Intensive Care Med, 2002, 28(6): 740-745.
[36] 曾嵘, 范瑞新, 范小平, 等. 急性A型主动脉夹层患者术后急性肾损伤的危险因素[J]. 中华胸心血管外科杂志, 2014, 30(1): 30-37.
[37] Gupta H, Dai L, DattaG, et al. Inhibition of lipopolysaccharide-induced inflamematory responses by an apolipoprotein A-I mimetic peptide[J]. Circ Res, 2005, 97: 236-243.
[38] Kim K D, Lim H Y, Lee H G, et al. Apolopoprotein A-I induces IL-10 and PGE2 production in human monocytes and inhibits dendritic cell differentiation and maturation[J]. BiochemBiophys Res Commun, 2005, 338: 1126-1136.
[39] Rocco A G, Sensi C, GianazzaE, et al. Structural and dynamic features of apolipoproteinA-I cysteine mutants, Milano and Paris, in synthetic HDL [J]. J Mol Graph Model, 2010, 29(3): 406-414.
[40] Grion C M, Cardoso L T, Perazolo T F, et al. Lipoproteins and CETP levels as risk factors for severe sepsis in hospitalized patients[J]. Eur J Clin Invest, 2010, 40(4): 330-338.
[41] Bonville D A, Parker T S, Levine D M, et al. The relationships of hypocholesterolemia to cytokine concentrations and mortality in critically ill patients with systemic inflammatory response syndrome[J]. Surg Infect (Larchmt), 2004, 5(1): 39-49.
[42] 安友仲, 谢启伟, 祝光学. 外科病人围术期血脂代谢的变化及其临床意义[J]. 中国临床营养杂志, 1998, 6(3): 103-106.
[43] 赵慧颖, 陈红, 刘丹, 等. 严重感染患者血脂的代谢特点及其对死亡的预测价值[J]. 中国医药, 2012, 7(12): 1503-1505.
Analysis in risk factors of prolonged residence time in ICU after surgery for Standford type A aortic dissection
LIU Tingting1, ZENG Hesong1, ZHOU Xiaoyang1,LI Xueying1, CHEN Xiaoying2
(1.DepartmentofCardiology,EastBranchofThePeople′sHospitalofWuhanUniversity,Wuhan,Hubei, 430000; 2.WuhanAsiaHeartHospital,Wuhan,Hubei, 430000)
Objective To analyze the risk factors of prolonged residence time in ICU after surgery for Standford type A aortic dissection. Methods A total of 361 patients with surgery for Standford type A aortic dissection were selected. They were divided into prolonged residence time in ICU group and normal residence time in ICU group. Single factor analysis was used at first, and the significant factors analyzed in single factor analysis were analyzed by Multi factor analysis. Results Logistic regression analysis showed that smoking history, systolic blood pressure, white blood cell count, serum creatinine, low density lipoprotein cholesterol, thrombosis in the false lumen, apolipoprotein A-I, ventilator time were associated with prolonged residence time in ICU. Conclusion Smoking history, systolic blood pressure, white blood cell count, serum creatinine and ventilator time are the independent risk factors for prolonged residence time in ICU, and low density lipoprotein cholesterol, apolipoprotein A-I, thrombosis in the false lumen are the protective factors for prolonged residence time in ICU.
aortic dissection; prolonged residence time in ICU; risk factors
2016-11-10
湖北省科技创新计划(121721822360)
陈晓英
R 543.1
A
1672-2353(2017)01-005-06
10.7619/jcmp.201701002
