飞蓬草内生真菌的分离及抑菌活性研究
2017-02-24倪佳俊赖童飞李学凤李宜聪柴家乐张慧雯白雪莲
倪佳俊, 周 婷, 赖童飞, 李学凤, 李宜聪, 柴家乐, 张慧雯, 白雪莲
(杭州师范大学生命与环境科学学院,浙江 杭州 310016)
飞蓬草内生真菌的分离及抑菌活性研究
倪佳俊, 周 婷, 赖童飞, 李学凤, 李宜聪, 柴家乐, 张慧雯, 白雪莲
(杭州师范大学生命与环境科学学院,浙江 杭州 310016)
以药用植物飞蓬草(ErigeronacerLinn.)为试验材料,利用平板分离法从飞蓬草各器官内共分离出34株内生真菌,其中根部12株、茎部6株、叶部16株,分离所得的菌株根据分子生物学鉴定方法及聚类分析来确定种属,其中曲霉属真菌及青霉属真菌为飞蓬草中的优势菌,并且青霉属为飞蓬草根、茎、叶中拥有的共有属.采用牛津杯法测定其发酵产物抑菌活性,考察34株内生真菌对金黄色葡萄球菌、白色念珠菌、烟草赤星病菌、恶臭假单胞菌、大肠埃希氏菌的抑制作用,结果显示,对指示病原菌抑制效果最强的G5、J2、J4菌株分别为产紫青霉、辐毛鬼伞、莱氏野村菌.研究表明飞蓬草内生真菌具有丰富的多样性,并且对病原菌有较强的抑菌活性,在生物农药和医药领域具有潜在开发应用价值.
飞蓬草;内生真菌;抑菌活性;分子鉴定
植物内生真菌是指在健康植物组织中,对植物没有引起明显病害症状的真菌,内生真菌与宿主植物之间存在和谐的关系,其主要分布在植物的叶鞘、花、茎、叶片、根等器官[1-2].各种植物中含有丰富的内生真菌资源,其中某些内生真菌可以产生与植物相同或相似的生物活性物质[3].而活性成分在植物中的含量较低,通过植物内生真菌来获得与植物有相同活性成分的方法,不受空间、季节的限制,优势明显,有很大的发展潜力[4].目前许多研究者已从具有药用功能的植物中,分离出内生真菌,并且其产生的代谢产物具有抑菌、抗肿瘤、杀虫等作用[5-7].此外,还可以从植物中分离获得新的菌种,对于丰富微生物资源具有重要的意义[8].因此,植物内生真菌无论在开发活性成分还是在发现新的菌种资源方面都有极高的研究价值.
飞蓬草(ErigeronacerLinn.)又名加拿大蓬、小飞蓬,为菊科越年生或一年生草本植物,原产于北美洲,现在我国广泛分布[9].飞蓬草作为一种药用植物,可以产生香草酸、丁香酸、柠檬烯等具有抑菌作用的代谢产物,并且有消炎止血、利尿、治疗痢疾等功效[10-11].目前对飞蓬草的研究主要集中在除草活性、抗氧化活性等方面[12-14],对其内生真菌及其对病原菌的抑菌活性研究较少,因此本实验通过对飞蓬草各器官的内生真菌进行分离、鉴定,开展内生真菌初步抑菌实验以及对内生真菌发酵液中代谢产物的抑菌活性进行研究,为挖掘飞蓬草内生真菌资源奠定基础.
1 材料与方法
1.1 材料
1.1.1 供试植株
飞蓬草新鲜健康植株采自于杭州师范大学药用植物园,全株采样后立即用保鲜袋包好,置于保温盒中带回实验室,24 h内进行内生真菌的分离.
1.1.2 培养基
PDA培养基(马铃薯葡萄糖琼脂培养基):去皮马铃薯200 g切成小块,加水煮沸20 min,待冷却后用8层纱布过滤,滤液加入葡萄糖20 g,琼脂粉20 g,搅拌均匀后再补充水分至1 000 mL,121 ℃高压蒸汽灭菌30 min.
PDB培养液(马铃薯葡萄糖培养液):去皮马铃薯200 g切成小块,加水煮沸20 min,待冷却后用8层纱布过滤,滤液加入葡萄糖20 g,搅拌均匀后再补充水分至1 000 mL,121 ℃高压蒸汽灭菌30 min.
WA培养基(水琼脂培养基):琼脂4 g,蒸馏水200 mL,121 ℃高压蒸汽灭菌30 min,冷却至50 ℃左右,加入0.4 g氨苄青霉素和0.4 g链霉素.
1.1.3 指示菌株
金黄色葡萄球菌(StaphylococcusaureusATCC29213)、白色念珠菌(CandidaalbicansATCC10231)、烟草赤星病菌(AlternariaalternateATCC11680)、恶臭假单胞菌(PseudomonasputidaATCC17485)、大肠埃希氏菌(EscherichiacoliATCC25922),5种病原菌购自中国微生物菌种保藏中心.
1.2 样品处理
分别取飞蓬草的叶、根、茎用自来水冲洗表面的污物,待自然晾干后,转移至超净工作台,无菌水冲洗3次,75%乙醇浸泡1 min,1%次氯酸钠消毒浸泡1 min,无菌水冲洗3次以上.吸取0.2 mL最后一次处理飞蓬草的冲洗液,涂布于PDA培养基上,28 ℃恒温箱中培养3 d,为确保飞蓬草表面消毒彻底.
1.3 飞蓬草内生真菌的分离
将消毒后的飞蓬草样品用灭菌的解剖刀将根、茎、叶分别截成1 cm左右的小段,呈45°角斜插入WA培养基表面,每个平皿放置3段,28 ℃恒温培养4~9 d.待菌丝从切口处长出后,挑取菌丝转接至PDA 培养基,进行内生真菌的划线分离,重复划线直至培养基中长出单一菌落为止.
1.4 内生真菌形态学鉴定
将分离得到的内生真菌接种于PDA培养基,在距离接种点3 cm处,用无菌镊子将灭菌后的盖玻片斜插入培养基中,平皿置于28 ℃恒温培养,直至菌丝长至盖玻片约1/2处,取出盖玻片,放在滴有无菌水的载玻片上,观察飞蓬草内生真菌的显微形态以及在培养基上生长的菌落特征形态,结合分子鉴定结果,参照《真菌鉴定手册》[15]确定菌株的分类学地位.
1.5 内生真菌分子生物学鉴定

表1 PCR扩增反应体系Tab. 1 PCR amplification reaction system
从平板中刮取各内生真菌样品,分别进行发酵,发酵液离心获得菌丝,按照CTAB 法[16]提取内生真菌基因组DNA,采用真菌ITS通用引物,ITS4:(5′-TCCTCCGCTTATTGATATGC-3′)和ITS5: (5′-GGAAGTAAAAGTCGTAACAAGG-3′),进行PCR扩增.按照表1所示反应体系,以ITS4和ITS5进行PCR反应:94 ℃变性5 min;94 ℃ 30 s、58 ℃ 1 min、72 ℃ 1 min,30个循环;72 ℃ 10 min.PCR产物进行琼脂糖(浓度为10 g/L)凝胶电泳(150 V恒电压,20 min),利用Gel Extraction Kit回收目的片段,以回收的目的片段作为模板,重复PCR扩增.PCR产物利用罗氏PCR产物纯化试剂盒纯化后,送至上海桑尼公司测序,利用BLAST搜索软件将序列测序结果与GenBank数据库中相关真菌菌株的序列进行比对,获得相似性序列,再用MEGA5.1进行邻接法(neighbor joining)聚类系统发育分析,从而获得菌种的分类地位.
1.6 内生真菌的抑菌活性
1.6.1 内生真菌发酵产物制备
将分离获得的内生真菌接种至PDB培养液中,28 ℃恒温摇床培养5 d,将发酵液以8 000 r·min-1离心10 min获取上清液.收集的上清液用等体积乙酸乙酯萃取3次,在50 ℃恒温水浴条件下减压浓缩至干,称重.用二甲基亚砜(DMSO)配制成浓度为100 mg/mL的溶液,备用.
1.6.2 抑菌活性测试
采用牛津杯法对内生真菌发酵产物进行抑菌活性测试.用接种环挑取经培养2 d的指示病原菌于1 mL无菌水中,摇匀,得病原菌悬菌液.吸取100 μL病原菌悬菌液加入灭菌后未凝固的PDA培养基中,混匀,将牛津杯放置在含有病原菌的平板上.取浓度为100 mg/mL各内生菌发酵产物70 μL加入牛津杯中,以等量DMSO溶剂作为阴性对照,28 ℃恒温培养,24~48 h后观察,采用十字交叉法测量抑菌圈直径,每个实验重复3次.
2 结果与分析
2.1 飞蓬草内生真菌的多样性分析
从飞蓬草植株的根、茎、叶中共分离获得内生真菌34株,不同组织中的内生真菌数量有明显差异.叶部数量多,达16株;根部仅次于叶部,为12株;茎中的内生真菌数量最少,为6株.
通过对各菌株进行菌落形态(表面形态、大小、质地、生长速度、边缘形态等)观察和显微形态(孢子形态、产孢结构、有无横膈等特征)观察,结合分子生物学鉴定结果.初步将飞蓬草内生真菌分为13个属:曲霉属(Aspergillus)、酵母属(Saccharomyces)、毛霉属(Mucor)、鬼伞属(Coprinus)、青霉属(Penicillium)、小菌核属(clerotium)、串珠霉属(Monilochaetes)、球座菌属(Guignardia)、丝核菌属(Rhizoctonia)、莱氏野村菌属(Nomuraearileyi)、木霉属(Trichoderma)、共头霉属(Syncephalastrum)、镰刀菌属(Fusarium).从表2可知,根部分离出内生真菌有7个属,茎部有4个属,叶中有9个属,由此表明飞蓬草不同器官拥有不同内生真菌种群,并且存在差异性.从表3可知,曲霉属真菌及青霉属真菌从飞蓬草中分离获得的频率最高,为优势菌群,其中青霉属为飞蓬草根、茎、叶拥有的共有属,两种属都有进一步研究的潜力.同时飞蓬草根、茎、叶3个不同组织部位,均分离出属于该组织的特有属,说明飞蓬草内生真菌具有一定的组织专化性.
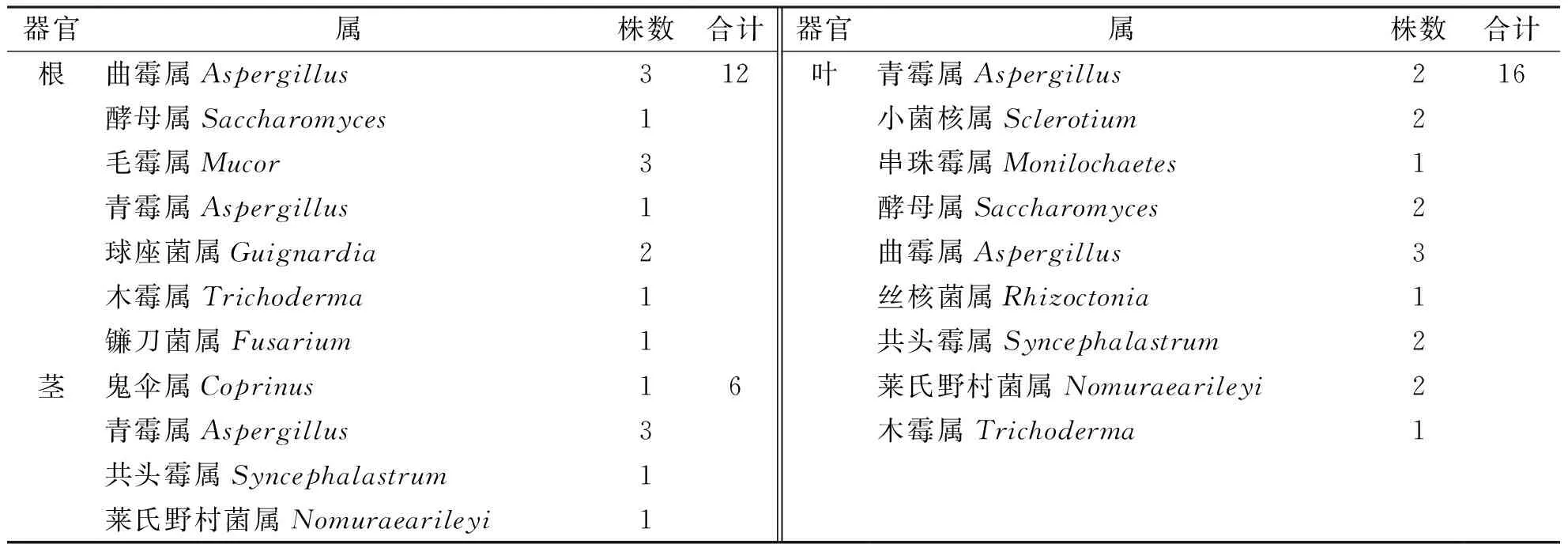
表2 飞蓬草不同部位中内生真菌分布Tab. 2 Distribution of the Endophytic fungi from different tissue of Erigeron acer L.
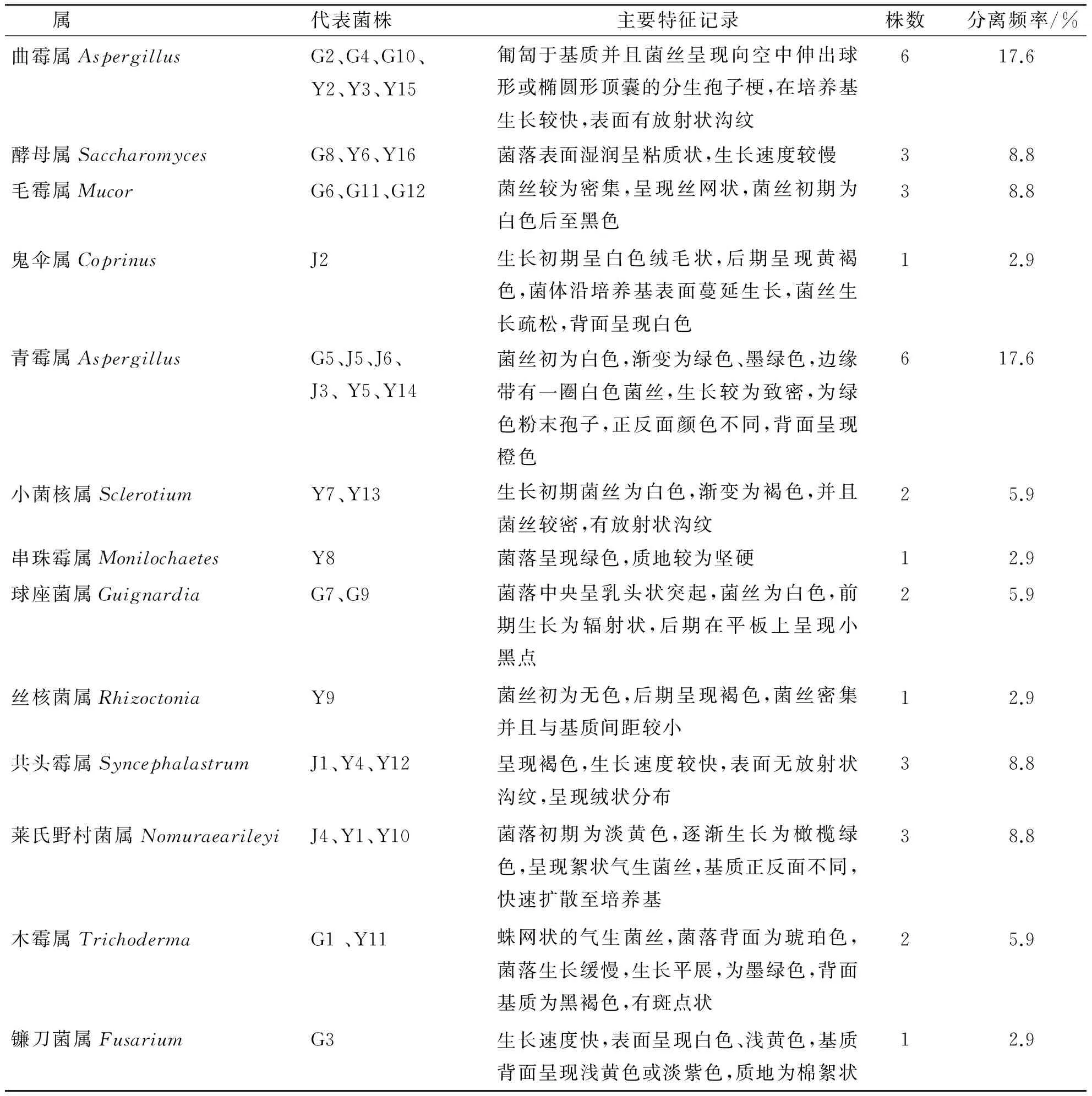
表3 飞蓬草内生真菌的形态特征Tab. 3 Morphological characteristicsof the plant endophytic fungi from Erigeron acer L.
2.2 飞蓬草内生真菌发酵产物的抑菌活性
将获得的34株内生真菌,通过牛津杯法进行内生真菌的发酵产物抑菌活性测定,其中对指示病原菌有抑菌作用的内生真菌共有14株,占分离获得内生真菌数目的41.2%(见表4).从茎中分离所得J1、J2、J4内生真菌的发酵产物,对3株指示病原菌有显著抑菌活性;而部分内生真菌的发酵产物只对单一指示病原菌有明显抑制作用,表现为抑菌专一性.根据抑菌活性实验,有9株飞蓬草内生真菌的发酵产物对大肠埃希氏菌有抑制作用;但仅有2株内生真菌的发酵产物对烟草赤星病菌有抑制作用.在所有内生真菌的发酵产物中,G5、J2、J4的发酵产物分别对烟草赤星病菌、大肠埃希氏菌、金黄色葡萄球菌的抑菌圈直径大于20 mm,有较强的抑菌活性,其组分分析、抑菌机理等有待进一步研究.
2.3 分子生物学鉴定及聚类分析
对指示病原菌有抑制作用的14株飞蓬草内生真菌序列,输入NCBI数据库中进行BLAST比对,并将有最高比对度的菌株及匹配编号列于表4中.最终,飞蓬草内生真菌序列与比对后获得相似度较高的菌株序列,录入MEGA 5.1软件进行聚类分析,并且采用邻接法构建系统发育树.
根据比对结果,对指示病原菌有抑制效果的飞蓬草内生真菌分别属于7个属:曲霉属、青霉属、木霉属、镰刀菌属、鬼伞属、共头霉属、莱氏野村菌属,NCBI匹配编号见表5.而根据比对结果及聚类分析结果,结合菌落形态特征,基本能够将所有菌株鉴定到种,但是仍有部分菌株只能鉴定到属.从根部分离获得的G2和G10,聚类分析结果与ITS序列分析结果并不完全一致,辨别程度低,因而仅仅能够鉴定为曲霉属;从茎部分离获得的J1,鉴定为共头霉属;从叶部分离获得的Y5和Y14,鉴定为青霉属真菌.其中对指示病原菌抑制效果最强的G5、J2、J4菌株分别为产紫青霉、辐毛鬼伞、莱氏野村菌.对指示病原菌有抑制效果的飞蓬草内生真菌系统发育树如图1-图3所示.
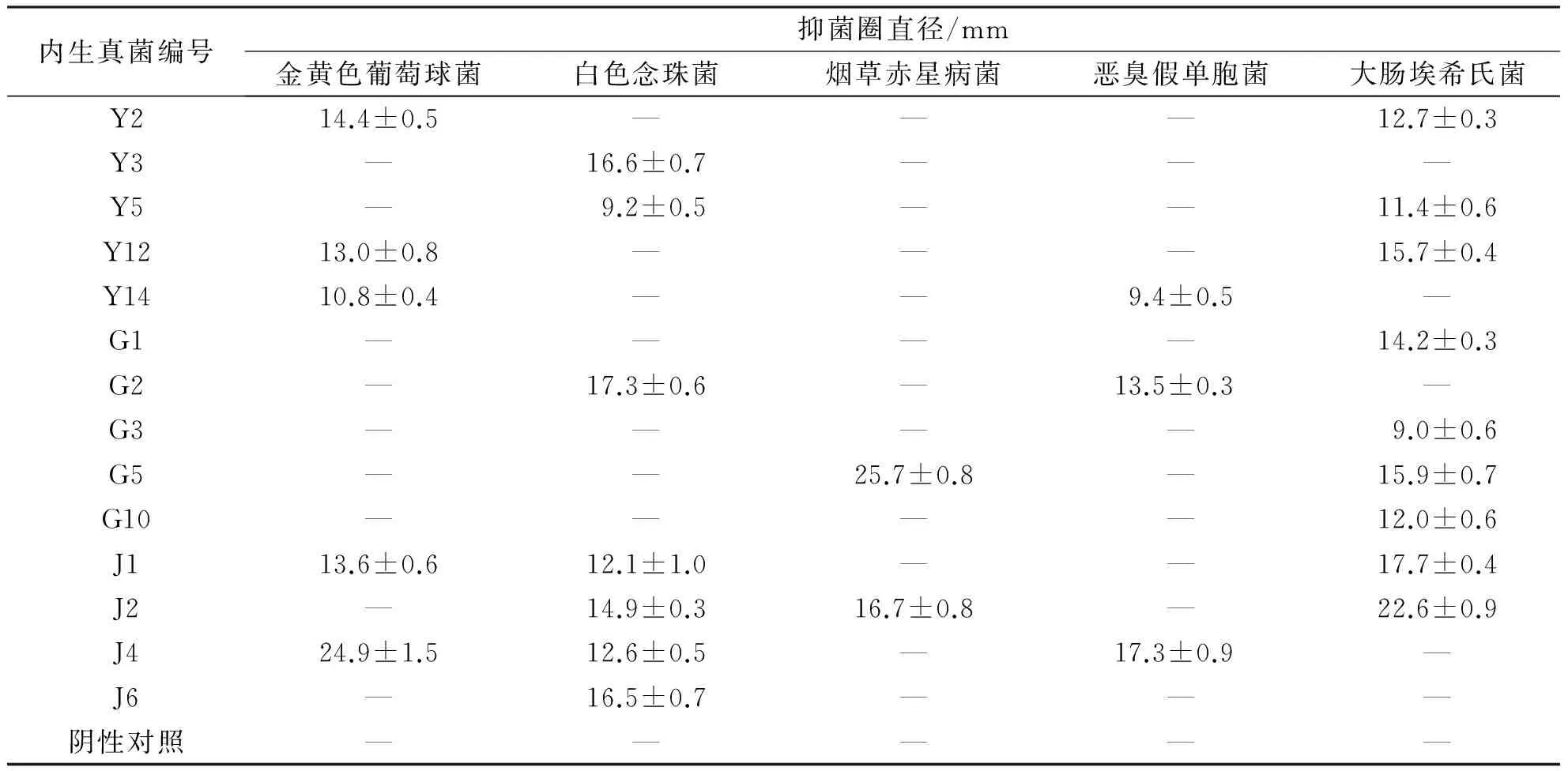
表4 飞蓬草内生真菌发酵产物的抑菌活性Tab. 4 Fermentation products antimicrobial activity of fungal endophytes isolated from Erigeron acer L.
注:—表示无抑菌作用.
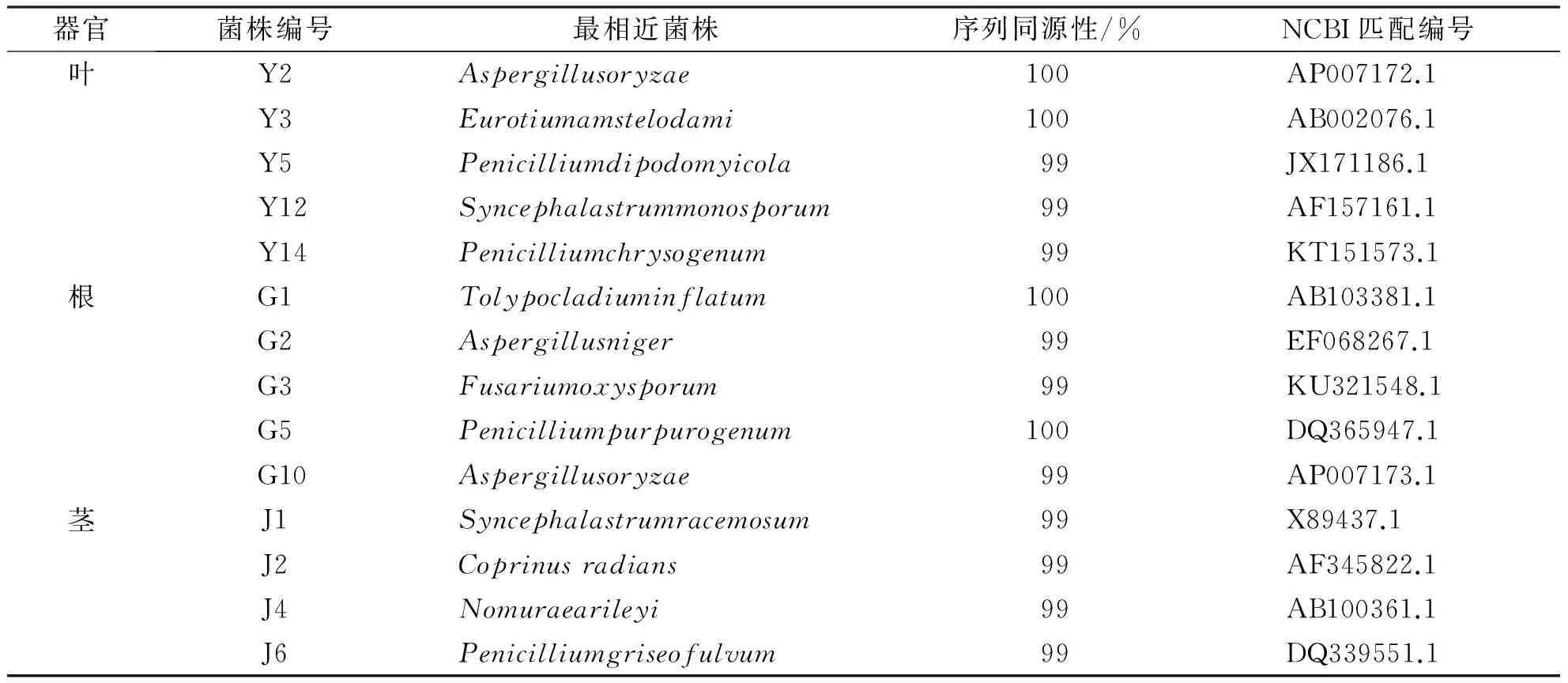
表5 NCBI数据库匹配结果Tab. 5 NCBI database matching results

图1 飞蓬草根部内生真菌聚类分析图(NJ法构建)Fig. 1 NJ Analysis of sequences offungal endophytesisolated from root of Erigeron acer L.

图2 飞蓬草茎部内生真菌聚类分析图(NJ法构建)Fig. 2 NJ Analysis of sequences offungal endophytesisolated fromstem of Erigeron acer L.

图3 飞蓬草叶部内生真菌聚类分析图(NJ法构建)Fig. 3 NJ Analysis of sequences offungal endophytes isolated from leaves of Erigeron acer L.
3 讨 论
飞蓬草是一种重要的药用植物,对其抑菌作用的研究还处在初级阶段.本研究从飞蓬草根、茎、叶中分离出34株内生真菌,表明飞蓬草的内生真菌具有生物多样性,是丰富的微生物资源库.本实验可以通过改进分离方式、处理条件来获取更多数量的内生真菌.另一方面,青霉菌属和曲霉菌属内生真菌为飞蓬草的优势菌,其中青霉菌属在根、茎、叶部均分离获得,但部分菌属只在特定组织中存在,由此可见在飞蓬草的不同部位存在一定的特异性.其中青霉菌属的繁殖能力快,菌丝初为白色,渐变为绿色、墨绿色,边缘带有一圈白色菌丝,生长较为致密,为绿色粉末孢子,正反面颜色不同,背面呈现橙色.曲霉菌属匍匐于基质并且菌丝呈现向空中伸出球形或椭圆形顶囊的分生孢子梗,在培养基生长较快,表面有放射状沟纹.
当前,对烟草赤星病菌的抑制研究主要集中在化学药剂防治[17].但由于化学药剂防治方法容易受环境等因素的干扰,易被冲刷而失效,并有化学农药残留等问题,且目前治疗大肠埃希氏菌、白色念珠菌、金黄色葡萄球菌、恶臭假单胞菌感染的药物因长期使用,其耐药性提高[18-20],因而通过生物防治方法,分离和筛选对病原菌有良好抑制效果的微生物及其发酵产物是一种重要的替代方法.
飞蓬草内生真菌抑菌实验表明,分离所获得菌株的发酵产物对不同指示病原菌的抑制效果差别较大,其中对烟草赤星病菌有抑制效果的菌株仅含2株,而大多数分离菌株的发酵产物对大肠埃希氏菌、白色念珠菌、金黄色葡萄球菌有较明显抑制效果.有研究表明,不同菌株的抑菌活性与其代谢产物,如生物碱、酚类及其有机酸类等有关[21-23].本实验仅仅考察内生真菌发酵所得次级代谢产物对指示病原菌的抑制作用,下一步可对其抑菌能力作进一步分析,并且代谢产物的组成及其化学结构还需进一步研究,从而挖掘出拥有较强抑菌能力的化学成分.
[1] 官珊,钟国华,孙之潭,等.植物内生真菌的研究进展[J].仲恺农业技术学院学报,2005,18(1):61-66.
[2] SUN J Q,GUO L D,ZANG W, et al. Diversity and ecological distribution of endophytic fungi associated with medicinal plants[J]. Science in China(Series C:Life Sciences),2008,51(8):751-759.
[3]孙剑秋,郭良栋,臧威,等.药用植物内生真菌及活性物质多样性研究进展[J].西北植物学报,2006,26(7):1505-1519.
[4] LI X F, JI P Z, XIAN H Y. Research advances in medicinal plant endophyte and its effects on geoherbs[J]. Medicinal Plant,2013,4(2):71-74.
[5] 朱继忠,臧皓,张辉.飞蓬属植物的化学成分及活性研究[J].长春中医药大学学报,2008,24(4):381-382.
[6] 杨明琰,田稼,马瑜,等.杜仲内生真菌的分离鉴定及抗菌活性研究[J].西北植物学报,2012,32(1):193-198.
[7] 杨润亚,冯培勇,李清.植物内生真菌农药活性的研究进展[J].农药,2006,45(7):440-444.
[8] 郭晓静,王俊鹏,宋晓平,等.南方红豆杉产紫杉醇内生真菌的分离鉴定[J].西北植物学报,2007,27(9):1874-1878.
[9] LI X,SONG K,YANG J , et al. Isolation and characterization of 11 new microsatellite loci in Erigeron breviscapus (Asteraceae), an important Chinese traditional herb[J]. International Journal of Molecular Sciences,2011,12(10):7265-7270.
[10] GRUENWALD J, BRENDLER T, JAENICKE C. PDR for herbal medicines[M]//MONTVALE N J. Thomson Medical Economics Co,2000:461-462.
[11] 田发军,赵欢欢,赵俊俊,等.小飞蓬化学成分及生物活性研究进展[J].河南科技学院学报(自然科学版),2013,41(6):12-17.
[12] 贤景春,赖金辉,刘玉明,等.小飞蓬多酚提取及其抗氧化性研究[J].南方农业学报,2012,43(11):1749-1753.
[13] 高兴祥,李美,于建垒,等.小飞蓬提取物除草活性的生物测定[J].植物资源与环境学报,2006,15(1):18-21.
[14] 刘姗姗.小蓬草(Conyzacanadensis)精油的除草活性组分研究[D].哈尔滨:东北林业大学,2011.
[15] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[16] 吴发红,黄东益,黄小龙,等.几种真菌DNA提取方法的比较[J].中国农学通报,2009,25(8):62-64.
[17] 曾超宁,车腾飞.不同化学药剂对烟草赤星病的防治效果[J].安徽农业科学,2015,43(24):99-100.
[18] 陈慧,罗育武,李季,等.白念珠菌耐药机制及治疗的研究进展[J].临床和实验医学杂志,2009,8(11):123-124.
[19] 杨杰,饶贤才.耐药机制指导下的抗金葡菌药物开发现状[J].微生物学杂志,2007,27(3):83-86.
[20] 白莉,郭云昌,董银萍.我国食品中大肠埃希菌0157耐药及PEGE分子分型特征分析[J].中国食品卫生杂志,2014,26(5):422-428.
[21] 苏经迁,黄彬,邱慧,等.产生物碱和石杉碱甲蛇足石杉内生真菌的初步研究[J].中国药学杂志,2011,46(19):1477-1481.
[22] 杨迎迎,熊智强,王勇.3种药用植物内生真菌的多样性分析及产生物碱菌株的筛选[J].中国抗生素杂志,2013,38(12):901-908.
[23] 高嘉卉,南志标.禾草内生真菌生物碱的研究进展[J].生态学报,2007,27(6):2531-2546.
Isolation of Endophytic Fungi fromErigeronAcerL. and
Antimicrobial Activities
NI Jiajun, ZHOU Ting, LAI Tongfei, LI Xuefeng, LI Yicong, CHAI Jiale,ZHANG Huiwen, BAI Xuelian
(College of Life and Environmental Sciences, Hangzhou Normal University, Hangzhou 310016, China)
Investigation on biodiversity of endophytic microbes associated withErigeronacerL. is carried out in this work. Using the method of plate separation, a total of 34 fungal strains are isolated from the organs ofE.acerL., which twelve endophytic strains are from root, six strains from stem, and sixteen strains from leaf.AspergillusandPenicilliumare the predominant fungi inErigeronacerL.,ErigeronacerL. roots, stems and leaves have common genera——Penicillium. Using Oxford cup method, its antibacterial activity is measured, and the inhibition of 34 strains of fungi onStaphylococcusaureus,Moniliaalbican,lternariaalternata,PseudomonasputidaandEscherichiacoliis investigated. The results show that the G5, J2, J4 strains with the strongest inhibition arePenicilliumpurpurogenum,Coprinusradians,Nomuraearileyi. This study shows thatErigeronacerL. endophytic fungi has abundant diversity, and has strong antibacterial activity against pathogenic bacteria.
ErigeronacerL.; endophytic fungi; antimicrobial activity; molecular identification
2016-09-17
浙江省自然科学基金项目(LQ14C200005;LY16H300007);杭州市科技发展计划项目(20140432B02);2016年国家级大学生创新创业训练计划(201610346024);2016-2017学年“本科生创新能力提升工程”重点项目(201610346024);2016-2017学年“本科生创新能力提升工程”一般项目(cx2016110);2016学年实验室开放项目;杭州师范大学第17届“挑战杯”大学生课外学术科技作品竞赛项目.
白雪莲(1978—),女,讲师,博士,主要从事天然产物研究与开发.E-mail:baixl2012@163.com
10.3969/j.issn.1674-232X.2017.01.015
Q939.5
A
1674-232X(2017)01-0057-07
