基于UPLC-Q-TOF MS技术的三七中皂苷类成分质谱裂解规律研究
2017-02-21秦振娴刘永刚
赵 静,秦振娴,彭 冰,刘永刚,刘 勇
(1.北京中医药大学,北京 100102;2.国家知识产权局专利局专利审查协作四川中心,四川 成都 610203;3.首都医科大学附属北京中医医院,北京市中医研究所,北京 100010)
基于UPLC-Q-TOF MS技术的三七中皂苷类成分质谱裂解规律研究
赵 静1,2,秦振娴1,彭 冰3,刘永刚1,刘 勇1
(1.北京中医药大学,北京 100102;2.国家知识产权局专利局专利审查协作四川中心,四川 成都 610203;3.首都医科大学附属北京中医医院,北京市中医研究所,北京 100010)
采用超高效液相色谱-串联四极杆飞行时间质谱(UPLC-Q-TOF MS)法快速分析三七中17种化合物,包括4对人参皂苷同分异构体,即三七皂苷R1、R2,人参皂苷Rg1,人参皂苷Rg3、Rb1、Rb2、Rb3、Re、Rf、Rc、Ro、Rd、Rk1、Rh1和拟人参皂苷F11。采用Waters Acquity UPLCTMBEH C18色谱柱(2.1 mm ×150 mm×1.7 μm),以乙腈(A)-0.1%甲酸水溶液(B)为流动相进行梯度洗脱,在电喷雾负离子模式下采集数据。结果表明,17种常见的三七皂苷和人参皂苷化合物对照品(包含多种同分异构体皂苷)可被液相色谱完全分离,通过归纳总结质谱全裂解信息,探讨了其裂解规律和特征离子。该方法可为快速鉴定和分析含有三七皂苷和人参皂苷类成分的化合物提供参考,并为全面表征三七指纹图谱提供依据。
超高效液相色谱-串联四极杆飞行时间质谱(UPLC-Q-TOF MS);人参皂苷;裂解途径;三七
三七为五加科植物(Araliaceae)三七Panaxnotoginseng的干燥根和根茎,是临床常用贵重中药材之一,具有散瘀止血、消肿定痛之功效。三七在血液系统、心血管系统、神经系统和免疫系统等方面具有生理活性,尤其对心、脑血管系统疾病具有明显疗效,可以降低心肌耗氧量、改善心肌缺血、抗心律失常、降血脂、降血压、抗休克等,同时还能改善脑血循环和保护实验性脑缺血[1-4]。达玛烷型三萜皂苷是三七的主要活性成分,分为原人参二醇型和原人参三醇型两大类[5-6]。在三七中未发现齐墩果烷型皂苷,而此类皂苷在人参、西洋参中可见,这是三七与人参的显著差异。目前,对三七植物的不同部位进行分离提取,已确定了70多种单体皂苷成分[7-9],且随着研究进展,不断有新单体化合物被鉴别。
传统的中药分析方法主要基于一种药材分离纯化,将得到的纯化合物进行四大光谱分析,耗时耗材,且常常因成分含量低不能纯化而难以鉴别。除了系统分离外,液相色谱-质谱法可鉴定出三七中可能存在的多种皂苷类成分,其中以原人参二醇型三萜皂苷和原人参三醇型三萜皂苷最多。然而,以往研究[12-14]使用的液相色谱-质谱仪多为低分辨率,所提供的裂解信息有限,而三七、人参中的皂苷存在大量的同分异构体,它们具有相同的相对分子质量,相似的特征峰,甚至相似的碎片信息,这给分析带来了困难。超高效液相色谱-串联四极杆飞行时间质谱(UPLC-Q-TOF MS)法集UPLC快速有效的色谱分离能力和Q-TOF高分辨质谱的高灵敏度于一体,在迅速识别和表征化合物方面得到广泛应用。如,孙靖辉等[15]采用ESI-Q-TOF-MS/MS法成功地区分了同分异构体人参皂苷Rh2和CK;郝颖等[16]采用RPLC-Q-TOF-MS/MS法分析了生晒参和大力参中的皂苷类成分。
本研究拟采用UPLC-Q-TOF MS法分析鉴定17种常见的三七皂苷、人参皂苷化合物的对照品,并探讨其裂解特征离子,希望为快速鉴定含有三七皂苷、人参皂苷类成分化合物提供参考,也为全面表征三七指纹图谱成分提供依据。
1 实验部分
1.1 仪器与试剂
Acquity超高效液相色谱分析系统、Q-TOF MS高分辨四极杆-飞行时间质谱仪:美国Waters公司产品,配有Masslynx4.1数据软件处理系统、Acquity UPLCTMBEH C18色谱柱(2.1 mm×150 mm×1.7 μm)、电喷雾离子源(ESI)。
三七皂苷R1、R2,人参皂苷Rg1、Rg2、Rg3、Rb1、Rb2、Rb3、Re、Rf、Rc、Ro、Rd、Rk1、Rh1、Rh2,拟人参皂苷F11(HPLC面积归一化法计算含量≥98%):均为成都曼斯特生物科技有限公司产品;乙腈(色谱纯):美国Fisher公司产品;甲酸(质谱纯):美国Fisher公司产品;超纯水:由南京权坤生物科技有限公司超纯水器制得。
1.2 对照品溶液的制备
分别精密称取2 mg三七皂苷R1、R2,人参皂苷Rg1、Rg2、Rg3、Rb1、Rb2、Rb3、Re、Rf、Rc、Ro、Rd、Rk1、Rh1、Rh2,拟人参皂苷F11对照品粉末于10 mL容量瓶中,用甲醇溶解至刻度,摇匀,过0.22 μm微孔滤膜。
1.3 实验条件
1.3.1 色谱条件 色谱柱:Acquity UPLCTMBEH C18柱(2.1 mm×50 mm×1.7 μm);柱温35 ℃;流动相:乙腈(A),含0.1%甲酸水溶液(B);梯度洗脱程序:0~3 min(19%A),3~10 min(19%~22%A),10~11 min(22%~24%A),11~41 min(24%A),41~43 min(24%~29%A),43~44 min(29%~30%A),44~50 min(30%~35%A),50~52 min(35%~50%A),52~60 min(50%~64%A),60~61 min(64%~100%A);进样量1 μL;流速0.45 mL/min。
1.3.2 质谱条件 电喷雾离子源(ESI)负离子模式,毛细管电压2 500 V,裂解电压60~70 V,离子源温度300 ℃,干燥气(N2)流速800 L/h。采用Lock Mass通路对采集的实验数据进行实时校正。
2 结果与分析
2.1 负离子模式下的总离子流图
三七皂苷中存在多种同分异构体,尤其此17种皂苷对照品中包含4组10个同分异构体。在ESI负离子模式下,17种对照品得到了完全分离,其总离子流图示于图1。17种对照品对应的5种皂苷类结构类型示于图2,各化合物的结构列于表1。

图1 17种对照品的总离子流图Fig.1 TIC of 17 saponins
2.2 各化合物的一、二级质谱
皂苷类成分因苷元四环结构稳定,在较大的裂解压力下也仅能产生糖碎片。本实验在1.3节条件下能够得到清晰的一、二级裂解峰,精确分子质量信息与理论分子质量值相吻合,质谱碎片信息全面稳定,且能观察到苷元的裂解信息,各成分的母离子及碎片离子数据信息列于表2。
2.3 糖链的断裂及裂解特征
多数皂苷至少含有1个糖链结构,由葡萄糖、鼠李糖、阿拉伯糖、木糖等构成单糖或多糖,因此需要对糖链结构进行研究以确定皂苷结构。在负离子模式下,这些糖苷键断裂分别失去162、146、132、132 u。17种皂苷的糖类裂解均发现了m/z101.02、113.02、119.03、161.04、179.05碎片离子,提示为葡萄糖的裂解碎片离子。通过比较苷元和糖链位置相同但数目不同的皂苷发现,皂苷所连接的糖越多,其糖的碎片离子丰度越大。人参皂苷Rb1、Rg3、Rh2的苷元结构一致,但含有的葡萄糖数量不同,分别为4、2、1个,其离子丰度依次降低,示于图3。
此外,不同的糖组成的糖链会出现不同的离子峰。如2个六碳醛糖(如葡萄糖)相连的糖链会出现m/z221.07碎片离子峰,在拟人参皂苷F11,人参皂苷Rb1、Rc、Rb2、Rb3、Rd、Rg3、Rk1中可看到;六碳醛糖与甲基五碳醛糖(如葡萄糖与鼠李糖)相连的糖链会出现m/z205.07碎片离子峰,在人参皂苷Re、Rg2,拟人参皂苷F11中可看到;六碳醛糖与五碳醛糖(如葡萄糖与阿拉伯糖或木糖)相连会出现m/z191.05碎片离子,在三七皂苷R1、R2,人参皂苷Rc、Rb2、Rb3中可看到,其裂解方式示于图4。

图2 皂苷类结构骨架类型Fig.2 Aglycone skeleton structures of five types
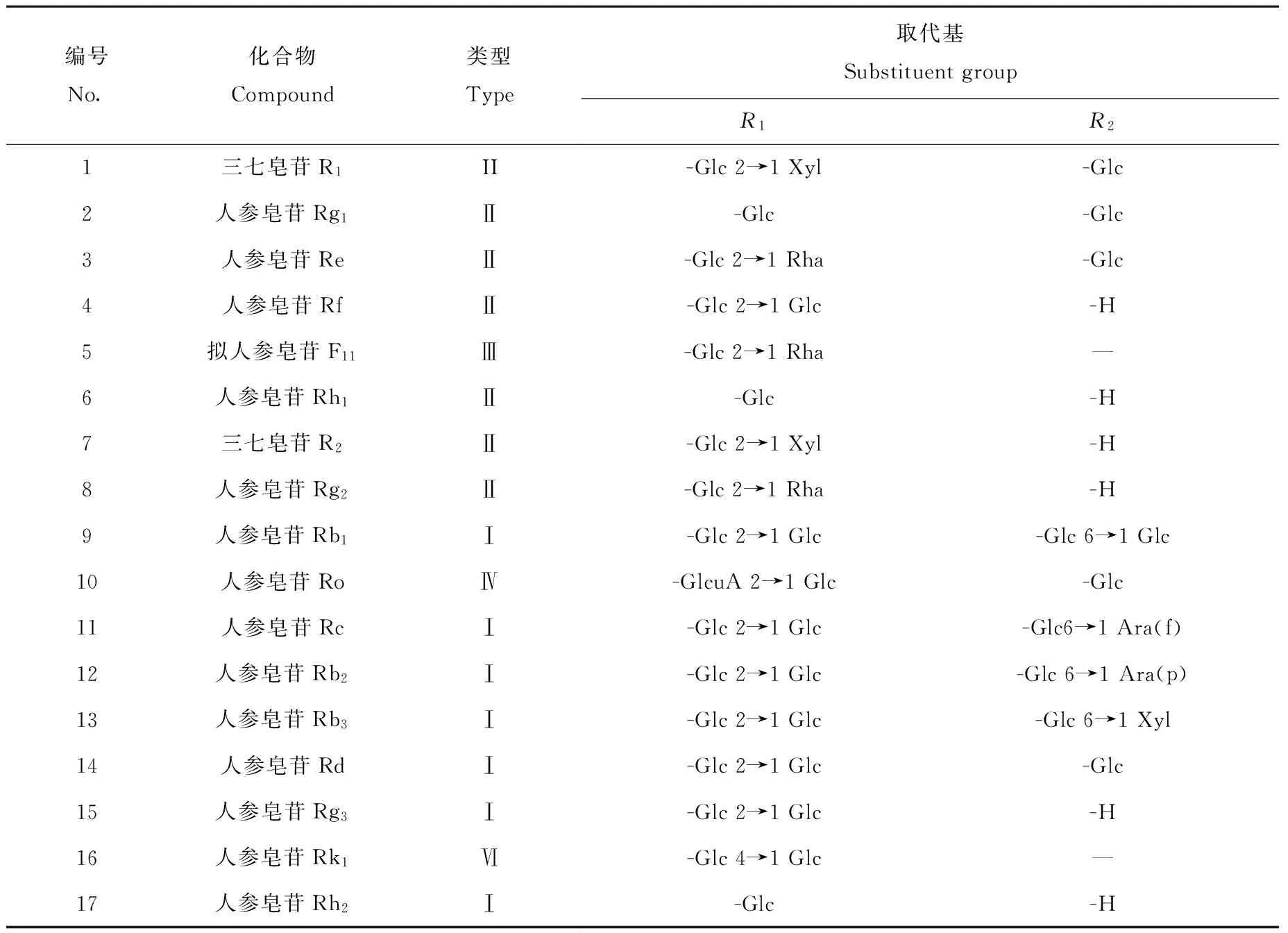
编号No.化合物Compound类型Type取代基SubstituentgroupR1R21三七皂苷R1II-Glc2→1Xyl-Glc2人参皂苷Rg1Ⅱ-Glc-Glc3人参皂苷ReⅡ-Glc2→1Rha-Glc4人参皂苷RfⅡ-Glc2→1Glc-H5拟人参皂苷F11Ⅲ-Glc2→1Rha—6人参皂苷Rh1Ⅱ-Glc-H7三七皂苷R2Ⅱ-Glc2→1Xyl-H8人参皂苷Rg2Ⅱ-Glc2→1Rha-H9人参皂苷Rb1Ⅰ-Glc2→1Glc-Glc6→1Glc10人参皂苷RoⅣ-GlcuA2→1Glc-Glc11人参皂苷RcⅠ-Glc2→1Glc-Glc6→1Ara(f)12人参皂苷Rb2Ⅰ-Glc2→1Glc-Glc6→1Ara(p)13人参皂苷Rb3Ⅰ-Glc2→1Glc-Glc6→1Xyl14人参皂苷RdⅠ-Glc2→1Glc-Glc15人参皂苷Rg3Ⅰ-Glc2→1Glc-H16人参皂苷Rk1Ⅵ-Glc4→1Glc—17人参皂苷Rh2Ⅰ-Glc-H
注:葡萄糖(Glc):β-D-葡萄糖;木糖(Xyl):β-D-木糖;鼠李糖(Rha):α-l-鼠李糖;阿拉伯糖(Ara(f)):α-l-阿拉伯糖(呋喃型);阿拉伯糖(Ara(p)):α-l-阿拉伯糖(吡喃型);葡萄糖醛酸(GlcuA):β-D-葡萄糖醛酸

表2 各成分的母离子及主要碎片离子Table 2 Parent ions and major fragment ions of components
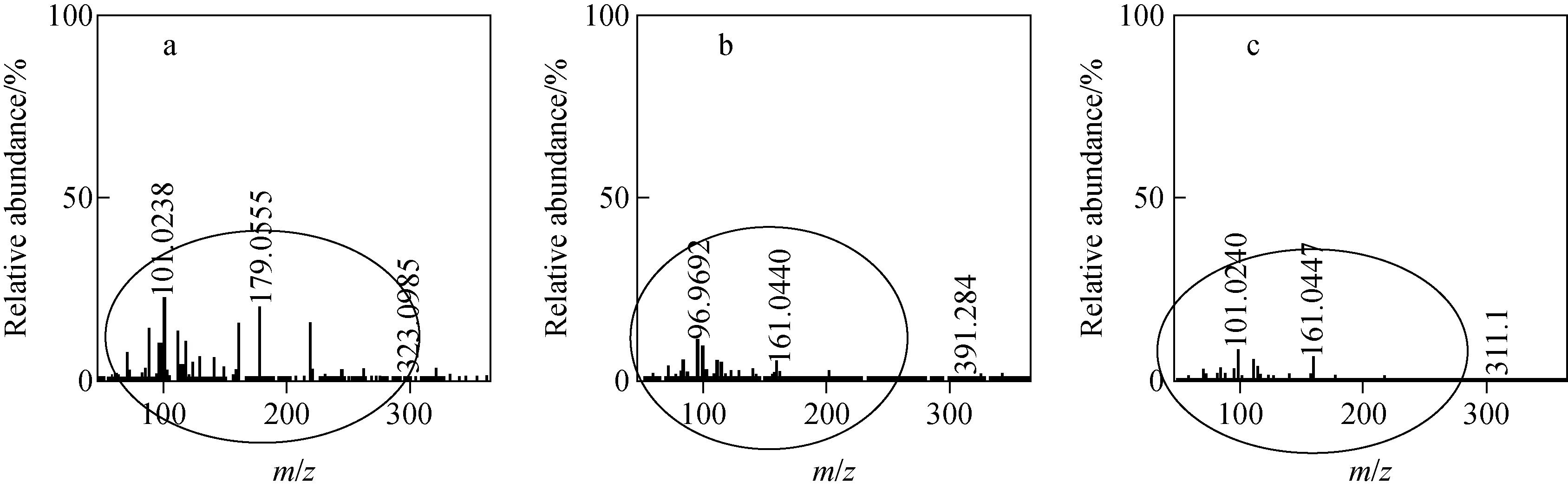
图3 人参皂苷Rb1(a),Rg3(b),Rh2(c)的离子丰度Fig.3 Ion abundance of ginsenoside Rb1 (a), Rg3 (b), Rh2 (c)
2.4 I型皂苷的裂解规律
人参皂苷Rb1、Rc、Rb2、Rb3、Rd、Rg3、Rh2均为I型皂苷,即原人参二醇型皂苷。I型皂苷最显著的特点是糖链部分通常取代苷元C-3位和C-20位,而C-6位无取代,在一级质谱中产生较强的[M+HCOO]-和[M—H]-离子。

图4 不同糖链的裂解方式Fig.4 Fragmentation pathway of different disaccharide sugars
Ⅰ型皂苷的特征碎片离子为丰度较大的苷元碎片离子m/z459.38和苷元失去C-17支链形成的碎片离子m/z375.29。据报道[17],在多数的人参皂苷裂解规律研究中仅发现皂苷上糖的断裂,而未发现负离子模式下苷元的进一步裂解,这是因为四环三萜皂苷具有较稳定的,难以破坏的皂苷元结构。本研究通过提高裂解电压等方法,几乎使得所有皂苷都能产生苷元裂解。在I型皂苷中,四环稳定结构上链有C-17支链,因此在强烈的裂解电压下能够失去烷基取代基,从而形成丰度较大的m/z375.29碎片离子。
以人参皂苷Rb1和人参皂苷Rd为例,人参皂苷Rb1二级质谱中出现m/z1 107.595 8,即[M—H]-,与标准精确分子质量1 107.595 1仅相差0.7×10-6,该分子离子峰相继失去四分子葡萄糖,得到m/z945.541 8、783.487 9、621.434 0、459.381 8主要碎片离子,m/z459.381 8为其苷元。人参皂苷Rd的一级质谱出现[M+HCOO]-m/z991.550 7和[M—H]-m/z945.543 3离子,与标准精确分子质量相差10-6,其主要碎片离子为脱去一分子葡萄糖产生的[M—H—glc]-m/z783.488 6,脱去二分子葡萄糖产生的[M—H—glc—glc]-m/z621.438 3,人参二醇型皂苷苷元碎片m/z459.383 1和苷元去掉C-20 链的碎片离子m/z375.290 5。
三七中存在多种同分异构体,当不同的异构体分属不同的皂苷类型时,可根据裂解碎片特征离子进行区分;当属于同种类型皂苷时,异构体很难得以区分。人参皂苷Rc、Rb2、Rb3均属于I型皂苷,且相对分子质量相同,区别在于C-20糖链末端糖异构;人参皂苷Rc为呋喃型阿拉伯糖,人参皂苷Rb2为吡喃型阿拉伯糖,人参皂苷Rb3为木糖。在一、二级质谱图中,二者所有裂解碎片均一致,将糖碎片部分裂解放大仍完全一致。但是,在一级质谱中,人参皂苷Rc的碎片离子m/z561与人参皂苷Rb2的碎片离子m/z538的丰度比不同;人参皂苷Rc中,m/z561与m/z538碎片离子丰度比大于1,而人参皂苷Rb2与Rb3中,其丰度比小于1,丰度比差异示于图5,其原因有待进一步研究,但仅凭质谱裂解难以有效区分人参皂苷Rb2和人参皂苷Rb3。
此外,人参皂苷Rc、Rb2、Rb3均产生m/z945.54和m/z783.49离子,即[M—H—Ara]-和[M—H—Ara—glc]-,或[M—H—xyl]-和[M—H—Ara—glc]-,表明C-20位糖链末端阿拉伯糖或木糖在裂解中比C-3位糖链更容易失去。这可能是C-20由于空间阻碍更容易脱去糖链而获得较为稳定的结构,由此可用于判断糖的位置。
2.5 Ⅱ型皂苷的裂解规律
三七皂苷R1,人参皂苷Rg1、Re、Rf、R2、Rh1和Rg2均为Ⅱ型人参皂苷,即原人参三醇型三萜皂苷。与Ⅰ型皂苷结构母核不同的是,Ⅱ型人参皂苷C-6位有羟基且由糖链取代,而C-3无取代。尽管二者结构上的差别不大,但在裂解碎片离子上的差别较大。Ⅱ型皂苷特征碎片离子为m/z475.37和m/z391.28。其中,苷元碎片离子m/z475.37同I型皂苷相同,四环上的烷基取代C-17支链容易失去,从而得到去掉C-17支链84 u的丰度较大的m/z391.28碎片离子。
以三七皂苷R1为例,三七皂苷R1的C-6位羟基和C-20位羟基分别有2个糖链,C-6位R1为二糖,由一分子葡萄糖与一分子木糖2→1位相连,C-20位为一分子葡萄糖。在一级质谱中,基峰为[M—H+HCOO]-m/z977.533 6和[M—H]-m/z931.527 1,其质谱图示于图6。在二级质谱中,m/z799.483 0,m/z637.433 6,m/z475.379 9以及m/z391.286 1分别为[M—H—xyl]-、[M—H—xyl—glc]-、[M—H—xyl—glc—glc]-苷元。其他碎片离子,如m/z101.023 9、113.023 7、161.045 3等为三七皂苷R1的葡萄糖糖链碎片。三七皂苷R1可能的裂解途径示于图7。

图5 一级质谱中,人参皂苷Rc(a)与人参皂苷Rb2(b)、Rb3(c)的丰度比差异Fig.5 Abundance ratios of ginsenosides Rc (a),ginsenosides Rb2 (b) and ginsenosides Rb3 (c) in MS
Ⅱ型皂苷人参皂苷Rg1与人参皂苷Rf为同分异构体,分子式均为C42H72O14。在一级质谱中均产生[M+HCOOH]-m/z845.490 7和[M—H]-m/z799.484 4碎片离子;在二级质谱中均产生[M—H—glc]-m/z637.43和[M—H—glc—glc]-m/z457.38,以及[M—H—glc—glc—84]-m/z391.28碎片离子。经研究发现,二者的质谱裂解存在两种差异。第一,二者的二级质谱中m/z637.43碎片离子,即[M—H—glc]-丰度差异很大。人参皂苷Rg1的[M—H—glc]-m/z637.43离子丰度明显高于其他碎片离子,而在人参皂苷Rf中,该离子丰度明显低于其他碎片离子。这是因为在人参皂苷Rg1中2个糖为2个单糖链,分别位于C-6和C-20位,在低能量下很容易失去1个糖,形成[M—H—glc]-m/z637.43离子,因此丰度较高;而C-20位糖苷键断裂所需的碰撞能较低,大约为0.4~0.6 V,此外,C-20位为季碳,断裂后更易形成较稳定的双键或环状结构,同时C-12位有羟基取代,距离C-20位较近,使得C-20位受到较大的空间位阻,因此C-20糖苷键较易断裂,离子丰度较高;而人参皂苷Rf的2个葡萄糖形成的糖链位于C-6位,在糖链中失去1个糖不如四环上失去二糖稳定,因此[M—H—glc]-m/z637.43离子丰度较低。第二,二者的质谱裂解信息在m/z50~400之间存在差异,人参皂苷Rf的2个葡萄糖相连的二糖形成了m/z221.07碎片离子,而人参皂苷Rg1中因无双糖链未发现该碎片。

图6 负离子模式下,三七皂苷R1的一级(a)和二级(b)质谱图Fig.6 MS (a) and MS/MS (b) spectrum of notoginsenoside R1 in negative ion mode
人参皂苷Re,三七皂苷R2和人参皂苷Rh1符合上述Ⅱ型皂苷裂解的普遍规律。人参皂苷Rg2与Ⅰ型皂苷Rg3互为同分异构体,但属于不同类型的皂苷,其裂解特征碎片离子明显不同,因此可以被有效区分,示于图8。
此外,I型皂苷与Ⅱ型皂苷在保留时间上有明显区别,在17种皂苷中,Ⅱ型皂苷的保留时间均少于I型皂苷,其原因可能为Ⅱ型皂苷比I型皂苷多1个羟基,极性更大,因而更容易在反相色谱柱C18柱中洗脱。
2.6 Ⅲ型、Ⅳ型与Ⅴ型皂苷裂解规律
Ⅲ型皂苷在Ⅱ型皂苷的结构基础上发生了少许变化,其C-20位与C-24位形成1个五元呋喃环。拟人参皂苷F11为Ⅲ型人参皂苷,是西洋参的特征成分,其与Ⅱ型皂苷人参皂苷Rf互为同分异构体,具有相同的相对分子质量和相似的结构和色谱行为,拟人参皂苷F11的质谱图示于图9。由于它们很难分离,因此有文献[18]报道称存在两种皂苷的分析混淆状况。
但拟人参皂苷F11与人参皂苷Rf不仅在液相色谱条件下能够完全分离,在质谱中也能得到完全区分。尽管二者的[M—H]-离子均为m/z799.485 0,但特征离子不同。Ⅲ型人参皂苷可以产生m/z491.373 6苷元及m/z415.36苷元碎片,推断该苷元碎片可能的裂解途径示于图10。
人参皂苷Ro为Ⅳ型人参皂苷,也称为齐墩果烷型皂苷,该型皂苷在植物中较为常见,尤其常见于人参和西洋参中,但在三七中未发现,是目前较为公认的区分三七与人参和西洋参的主要依据[19]。
人参皂苷Ro的一级质谱中存在[M—H]-m/z955.490 0离子峰,但不存在[M+HCOO—]-离子峰。在二级质谱中,主要的离子峰有m/z955.490 0、793.436 1、569.384 0,分别为皂苷依次脱去一分子葡萄糖、两分子葡萄糖、三分子葡萄糖,即皂苷元离子峰,裂解途径示于图11。此外,还可以观察到苷元进一步裂解的碎片离子m/z523.377 7,由于丰度较低,其结构尚未确定。Ⅳ型皂苷最特征的离子为m/z569.384 0苷元离子。

图7 负离子模式下,三七皂苷R1可能的裂解途径Fig.7 Proposed fragmentation pathways of notoginsenoside R1 in negative ion mode
Ⅴ型皂苷可以看作是I型皂苷的变形,二者的区别在于支链的少许变化,即C-20为双键。人参皂苷Rk1的一级质谱产生m/z811.485 0[M+HCOO]-和m/z765.479 6[M—H]-碎片离子;二级质谱主要产生m/z765.479 6[M—H]-、m/z603.426 0[M—H—glc]-、m/z439.358 1[M—H—glc—glc]-、m/z311.166 6等碎片离子。因此,Ⅴ型皂苷的特征离子为苷元m/z439.538 1及其碎片离子m/z311.166 6。
3 结论
本研究采用UPLC-Q-TOF MS法分析17种皂苷类成分,在1 h内完全分离了含有多种同分异构体的17种皂苷类成分,产生了较好的裂解碎片,并进一步研究了其可能的裂解途径。将17种皂苷类成分划分为5种类型,Ⅰ型皂苷(原人参二醇型)、Ⅱ型皂苷(原人参三醇型)、Ⅲ型皂苷(拟人参皂苷F11)、Ⅳ型皂苷(齐墩果烷型,人参皂苷Ro)和Ⅴ型皂苷(人参皂苷Rk1),并研究各种类型皂苷的特征离子,从而根据裂解碎片确定皂苷类型,同时对多种难以区分的同分异构体(如人参皂苷Rc、Rb2、Rg3、拟人参皂苷 F11等)进行有效区分。此外,研究了常见的糖及糖的裂解方式,确定了糖链位置和糖的类型,这可为皂苷样品的推断、鉴定提供较好的依据。

图8 同分异构体人参皂苷 Rg3(a)与 Rg2(b)的裂解特征离子Fig.8 Characteristic ions of isomers ginsenosides Rg3 (a) and Rg2 (b)
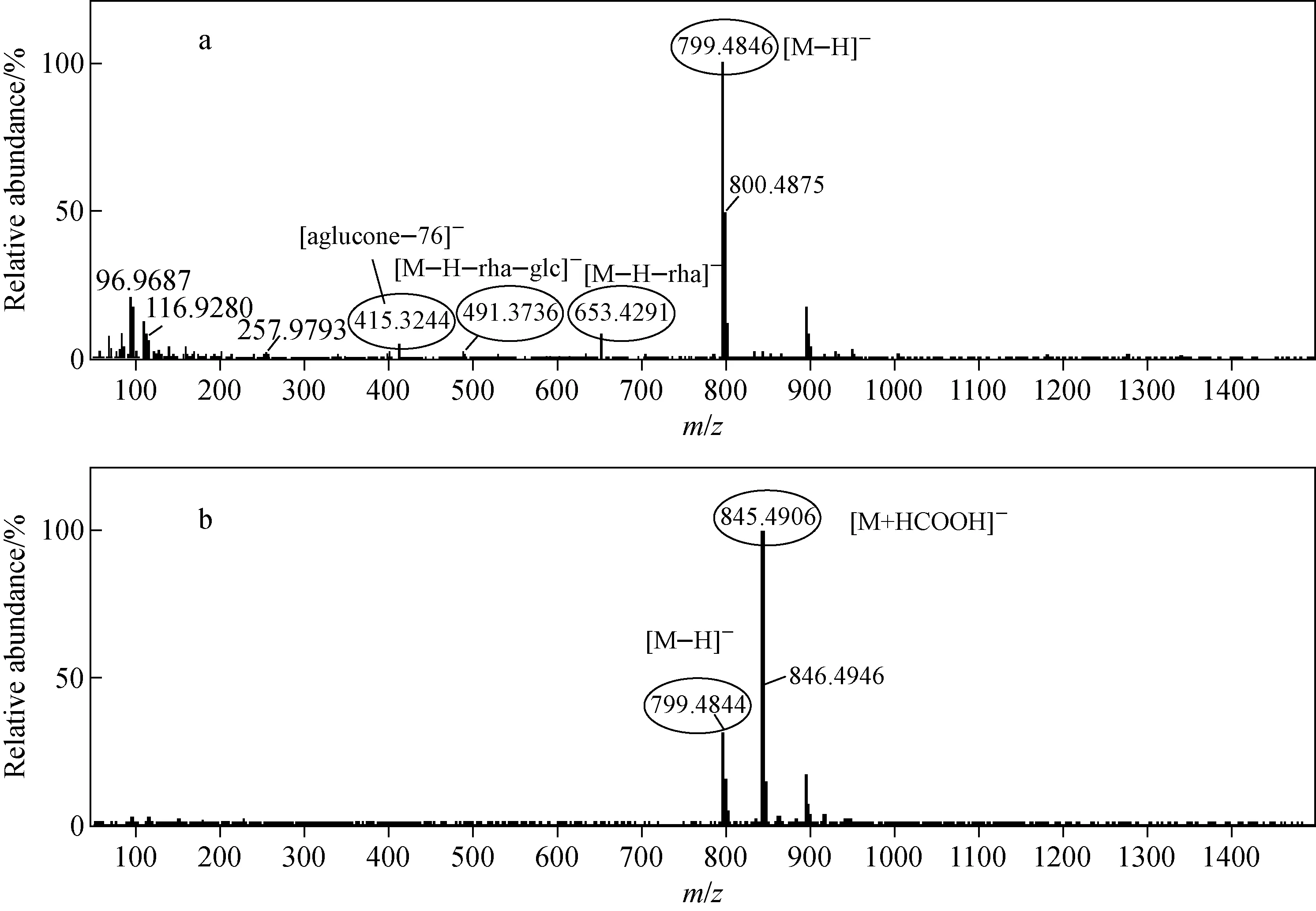
图9 负离子模式下,拟人参皂苷F11的一级(a)和二级(b)质谱图Fig.9 MS (a) and MS/MS (b) spectrums of pseudoginsenoside F11 in negative ion mode
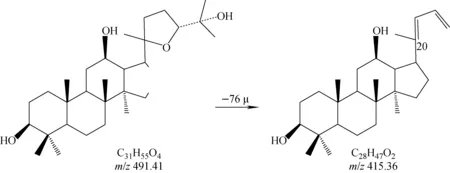
图10 负离子模式下,Ⅲ型皂苷可能的裂解途径Fig.10 Proposed fragmentation pathways of type Ⅲ in negative ion mode

图11 负离子模式下,人参皂苷Ro可能的裂解途径Fig.11 Proposed fragmentation pathways of ginsenoside Ro in negative ion mode
[1] LAM S K, NG T B. A xylanase from roots of sanchi ginseng (Panaxnotoginseng) with inhibitory effects on human immunodeficiency virus-1 reverse transcriptase[J]. Life Sciences, 2002, 70(25): 3 049-3 058 .
[2] CHEN S X, LIU J L, LIU X Y, et al.Panaxnotoginsengsaponins inhibit ischemia-induced apoptosis by activating PI3K/Akt pathway in cardiomyocytes[J]. Journal of Ethno-Pharmacology, 2011, 137(1): 263-270.
[3] LIU Y, XIE M X, KANG J, et al. Studies on the interaction of total saponins ofPanaxnotoginsengand human serum albumin by Fourier transform infrared spectroscopy[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2003, 59(12): 2 747-2 758.
[4] MAO Q, LI Y, LI S L, et al. Chemical profiles and anticancer effects of saponin fractions of different polarity from the leaves ofPanaxnotoginseng[J]. Chinese Journal of Natural Medicines, 2014, 12(1): 30-37.
[5] DU Q, JERZ G, WAIBEL R, et al. Isolation of dammaranesaponins fromPanaxnotoginsengby high-speed counter-current chromatography[J]. Journal of Chromatography A, 2003, 1 008(2): 173-180.
[6] LAU A J, WOO S O, KOH H L. Analysis of saponins in raw and steamedPanaxnotoginsengusing high-performance liquid chromatography with diode array detection[J]. Journal of Chromatography A, 2003, 1 011(1): 77-87.
[7] KIM D H. Chemical diversity ofPanaxginseng,Panaxquinquifolium, andPanaxnotoginseng[J]. J Ginseng Res, 2012, 36(1): 1-15.
[8] HAN L F, SAKAH K J, LIU L L, et al. Saponins from roots ofPanaxnotoginseng[J]. Chinese Herbal Medicines, 2014, 6(2): 159-163.
[9] SAKAH K J, WANG T, LIU L L, et al. Eight darmarane-type saponins isolated from the roots ofPanaxnotoginseng[J]. Journal of Functional Foods, 2013, 5(8): 1 159-1 169.
[10]ZHU X J, GUO S P, FU X L, et al. Characterization of steroidal saponins in crude extracts fromDioscoreazingiberensisC.H. Wright by ultra-performance liquid chromatography/electrospray ionization quadrupole time-of-flight tandem mass spectrometry[J]. J Pharm Biomed Anal, 2010, 53(3): 462-474.
[11]KANG L P, ZHAO Y, PANG X. Characterization and identification of steroidal saponins from the seeds of Trigonellafoenum-graecum by ultra high-performance liquid chromatography and hybrid time-of-flight mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis, 2013, 74 (74): 257-267.
[12]QI L W, WANG H Y, ZHANG H. Diagnostic ion filtering to characterize ginseng saponins by rapid liquid chromatography with time-of-flight mass spectrometry[J]. Journal of Chromatography A, 2012, 1 230(6): 93-99.
[13]LIU Y Y, LI J B, HE J M, et al. Identification of new trace triterpenoid saponins from the roots ofPanaxnotoginsengby high-performance liquidchromatography coupled with electrospray ionization tandem mass spectrometry[J]. Rapid Commun Mass Spectrom, 2009, 23(5): 667-679.
[14]TOH D F, NEW L S, KOH H L, et al. Ultra-high performance liquid chromatography/time-of-flight mass spectrometry (UHPLC/TOF MS) for time-dependent profiling of raw and steamedPanaxnotoginseng[J]. Journal of Pharmaceutical and Biomedical Analysis, 2010, 52(1): 43-50.
[15]孙靖辉,吴巍,郭迎迎,等. 利用ESI-Q-TOF-MS/MS区分人参皂苷Rh2和CK[J]. 质谱学报, 2014,35(2):158-162.
SUN Jinghui, WU Wei, GUO Yingying, et al. Differentiation of ginsenosideisomers Rh2and CK using ESI-Q-TOF-MS/MS[J]. Journal of Chinese Mass Spectrometry Society, 2014, 35(2): 158-162(in Chinese).
[16]郝颖,于珊珊,戴雨霖,等. RRLC-Q-TOF MS/MS法分析生晒参和大力参中的皂苷类成分[J]. 质谱学报,2014,35(4):311-316.
HAO Ying, YU Shanshan, DAI Yulin, et al. Study on ginsenosidesin white ginseng and Dali ginseng by RRLC-Q-TOF MS/MS[J]. Journal of Chinese Mass Spectrometry Society, 2014, 35(4): 311-316(in Chinese).
[17]CHANG-JIANG-SHENG L, TING T, SU-LING Z, et al. An integrated high resolution mass spectrometric data acquisition method for rapid screening of saponins inPanaxnotoginseng(Sanqi)[J]. Journal of Pharmaceutical and Biomedical Analysis, 2015, 109(10): 184-191.
[18]SONG F R, LIU Z Q, LIU S Y, et al. Differentiation and identification of ginsenoside isomers by electrospray ionization tandem mass spectroetry[J]. Analytica Chimica Acta, 2005, 531(1): 69-77.
[19]HAN L F, SAKAH K J, LIU L L. Saponins from roots ofPanaxnotoginseng[J]. Chinese Herbal Medicines, 2014, 6(2): 159-163.
Fragmentation Pathway of Ginsenosides inPanaxnotoginsengUsing Electrospray Ionization-Quadrupole/Time-of-Flight Mass Spectrometer
ZHAO Jing1,2, QIN Zhen-xian1, PENG Bing3, LIU Yong-gang1, LIU Yong1
(1.BeijingUniversityofChineseMedicine,Beijing100102,China;2.PatentExaminationCooperationCenterofPatentOffice,StateIntellectualPropertyOffice,Chengdu610213,China; 3.BeijingInstituteofTraditionalChineseMedicine,BeijingHospitalofTraditionalChineseMedicineAffiliatedtoCapitalUniversity,Beijing100010,China)
Panaxnotoginseng(Burk.) F.H. Chen or Sanqi in Chinese is a well-known Chinese medicinal herb, which has been used for thousands of years in China due to its good hemostatic effect. The major bioactive compounds ofPanaxnotoginsengare Dammarane triterpenesaponins, especially protopanaxadiol and protopanaxatriol glycosides. While, the normal method of compounds identification in plants mainly based on the NMR spectra of the pure compounds, which obtained by isolation and purification on a scale of crude drugs. Liquid chromatography coupled with mass spectrometry (LC/MS) can identify and characterize the compounds, and has been increasingly developed for the compounds research of crude drugs. In this study, 17 compounds (notoginsenoside R1, R2, ginsenoside Rg1, Rg2, Rg3, Rb1, Rb2, Rb3, Re, Rf, Rc, Ro, Rd, Rk1, Rh1and pseudoginsenoside F11) inPanaxnotoginsengincluding four pairs of ginsenoside isomers were detected using ultra perform liquid chromatogram-electrospray ionization-quadrupole/time-of-flight mass spectrometer (UPLC-Q-TOF MS). Compounds were analyzed on Acquity UPLCTMBEH C18 (2.1 mm×150 mm×1.7 μm) with acetonitrile (A)-0.1% formic acid aqueous solution (B) as mobile phase for gradient elution. The data were collected by negative electrospray ion mode using Q-TOF MS. The parameters of ion source were as follows: capillary voltage of 2 500 V, cracking voltage of 60-70 V, ion source temperature of 300 ℃, dry nitrogen flow rate of 800 L/h. Under this condition, all of 17 saponins were separated neatly within 1 h. The fragmentation behaviors especially the MS fragmentation rules of isomers were compared. According to the structure and the typical fragmentations, these saponins were divided into different typical types, and each type has its special fragments that can be easily identified. Meanwhile, the identification and structure of the 17 ginsenoside could provide essential and important data for the further studies on the multiple constitutions ofPanaxnotoginsengas well as ginseng which also has the same or some similar constitutions. These findings are valuable for the identification of ginsenosides in plants especiallyPanaxnotoginseng.
ultra perform liquid chromatogram-electrospray ionization-quadrupole/time-of-flight mass spectrometer (UPLC-Q-TOF MS); ginsenosides; fragmentation pathway;Panaxnotoginseng
2016-03-04;
2016-03-27
赵 静(1989—),女(汉族),河北人,硕士研究生,从事中药新药物质基础研究。E-mail: zhaojing.0301@163.com
刘 勇(1964—),男(汉族),浙江人,教授,从事药用植物亲缘学、中药质量与开发。E-mail: yliu0126@aliyun.com
O657.63
A
1004-2997(2017)01-0097-12
10.7538/zpxb.2017.38.01.0097
