视神经脊髓炎谱系疾病患者脑脊液蛋白水平与致残状况的相关性研究
2017-02-20仲星星汤可娜管阳太
于 鹭, 李 梅, 仲星星, 汤可娜, 管阳太
视神经脊髓炎谱系疾病患者脑脊液蛋白水平与致残状况的相关性研究
于 鹭, 李 梅, 仲星星, 汤可娜, 管阳太
目的 探讨视神经脊髓炎谱系疾病(Neuromyelitis optica disorders,NMOSDs)患者脑脊液蛋白与临床致残状况的关系及其临床意义。方法 回顾性分析2010年1月~2016年2月我院神经内科确诊的108例NMOSD患者临床与生化资料,根据临床扩展致残量表评分(Expanded disability status scale,EDSS)将患者分为独立行走受限与不受限组,并比较两组患者间的临床、生化特征;根据脑脊液蛋白值将患者分为脑脊液蛋白正常组与异常组,并比较两组间EDSS评分的变化;分析脑脊液蛋白与临床致残状况的相关性。结果 独立行走受限组与不受限组之间患者年龄、二便障碍、外周血白细胞(WBC)、中性粒细胞比(N%)、脑脊液蛋白、脑脊液IgG较有统计学差异(P<0.05);性别、病程、视力损害、AQP4抗体、24 h鞘内合成率、寡克隆带比较无统计学差异(P>0.05),两组不同脑脊液蛋白水平与患者EDSS值比较有统计学差异(T=3.13,P=0.002);脑脊液蛋白水平与独立行走受限呈正相关(r=0.286,P<0.01)。结论 NMOSD患者脑脊液蛋白值越高,患者致残发生的可能性越大,脑脊液蛋白有助于视神经脊髓炎谱系疾病患者致残状况的病情评估。
视神经脊髓炎谱系疾病; 脑脊液蛋白; EDSS评分; 病情评估
2015年Neurology杂志上更新了视神经脊髓炎谱系疾病(NMOSDs)国际共识及诊断标准[1],NMOSDs是包含视神经炎、急性脊髓炎、极后部综合征、有MRI表现的急性间脑综合征、大脑综合征等一大类疾病,临床上患者可出现视力损害、肢体瘫痪、尿便功能障碍等残障表现,其发病机制可能视神经和脊髓发生免疫炎性反应损伤有关[2]。研究显示脑脊液蛋白是评判中枢神经系统免疫反应的重要生化指标[3]。EDSS评分系统通用于评估多发性硬化(MS)残障状况,近年来在NMO及其谱系疾病中也逐渐应用。本研究通过检测NMOSDs患者脑脊液蛋白水平与评估EDSS来比较两者之间的关系,以期指导NMOSDs患者病情评估。
1 对象和方法
1.1 对象 病例108例,来源于2010年10月~2016年2月在长海医院神经内科住院确诊的NMOSDs患者。入组标准:(1)符合2015年国际共识-诊断标准[1],AQP4抗体阳性者:至少1项核心临床表现(视神经炎、急性脊髓炎、极后区综合征、其他脑干综合征、有MRI病灶的急性间脑综合征、大脑综合征);AQP4抗体阴性或未检测者:至少2项核心临床表现(视神经炎、急性脊髓炎或极后区综合征三者之一;支持空间多发的临床证据;MRI的表现);(2)接受血检验、腰椎穿刺术检查;(3)入院时行EDSS评估;(4)临床资料完整;(5)知情同意患者;排除标准:入院前已行激素、免疫球蛋白以及其他免疫抑制治疗患者。其中男性占35.2%(38/108),女性占64.8% (70/108);年龄13~85岁,平均(43.92±16.68)岁,病程0~315 m,平均(24.97±52.20) m。血检验、腰椎穿刺术等均经患者入院时签署知情同意书,本研究通过长海医院伦理委员会审批。
1.2 方法
1.2.1 临床资料 回顾性收集NMOSDs患者临床资料,包括:性别、年龄、扩展致残量表评分、视力损害、二便功能等临床资料,以及外周血白细胞数、中性粒细胞比例,脑脊液蛋白、免疫球蛋白G(IgG)、寡克隆带、24 h鞘内IgG合成率等生化指标。
1.2.2 检测方法 入院后次日早晨经肘静脉采取空腹血 4 ml并离心采集血清2 ml,入院后次日上午免疫药物治疗前行腰穿采集脑脊液 2 ml,均于-20 ℃冰箱保存;使用德国西门子公司全自动程序化分析仪(西门子BNⅡ),采用免疫散射比浊法测定脑脊液和血清IgG、白蛋白值,分析仪自动计算脑脊液蛋白、QALB和24 h鞘内IgG合成率等生化值;采用细胞测定法(Cell Based Assay,CBA)检测AQP4抗体:参照Matsuoka等[4]的方法检测血清中AQP4抗体。
1.2.3 评估标准 脑脊液蛋白正常值为≤0.45 g/L,脑脊液蛋白值>0.45 g/L为异常,根据以上标准,分为脑脊液蛋白正常值和异常组;患者残疾状况根据EDSS评分分组,EDSS≥ 5分为独立行走受限组,EDSS<5分为独立行走不受限组[5]。

2 结 果
2.1 独立行走分组患者资料比较 本研究NMOSDs患者独立行走受限组与不受限组人数百分比分别为49.1%(53/108)、50.9%(55/108),两组间年龄、肌力下降、二便障碍、外周血白细胞(WBC)、中性粒细胞比(N%)、脑脊液蛋白、脑脊液IgG比较有统计学差异(P<0.05)(见表1),两组间性别、病程、复发次数、视力损害、AQP4抗体、24 h鞘内合成率、寡克隆带比较无统计学差异(P>0.05)(见表2)。
2.2 脑脊液蛋白分组患者EDSS水平比较 本研究NMOSDs患者脑脊液蛋白正常组与异常组人数百分比分别为56.5%(61/108)、43.5%(47/108),EDSS水平分别为(4.28±2.10),(5.59±2.21),两组间比较有统计学差异(t=-3.13,P=0.002)(见图1)。
2.3 脑脊液蛋白与独立行走受限发生的相关性 脑脊液蛋白正常组与异常组独立行走受限发生率分别为37.7%与63.8%,经Spearman秩相关分析得出:脑脊液蛋白与独立行走受限发生呈正相关(r=0.286,P<0.01)。
表1 EDSS分组NMOSDs患者临床特征比较
表2 EDSS分组NMOSDs患者生化及脑脊液指标比较
注:WBC:外周血白细胞;CSF-pro:脑脊液蛋白;CSF-IgG:脑脊液免疫球蛋白IgG;OCB:寡克隆带
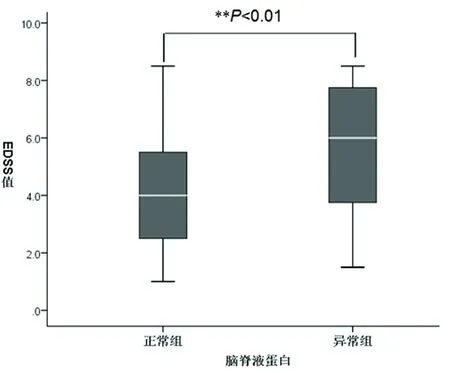
图1 脑脊液蛋白分组患者EDSS水平比较
3 讨 论
中枢神经系统脱髓鞘疾病病因多样,以炎症性损害为主要特点,发病机制与髓鞘的脱失以及最终导致轴索的损害密切相关,脑脊液是临床上重要的参考指标,对于这类疾病的鉴别和评估有着显著意义[6]。脑脊液的蛋白质来自血浆和自身合成,而前者主要来源于血脑屏障破坏。
NMOSDs的确切病因尚不明确,目前认为与异常免疫反应相关,导致严重的视神经炎和脊髓炎[7],而重度脊髓炎会使肢体残障的发生率升高。既往研究多报道NMOSDs患者严重病程与AQP4抗体水平相关[8],而对于NMOSDs患者脑脊液蛋白与致残状况之间关系的研究甚少。Schliep[9]认为CSF蛋白增高是血脑屏障破坏的结果。本研究发现NMOSDs患者脑脊液蛋白值越高,独立行走受限发生的可能性显著增加,且两者之间呈正相关关系,并且外周血白细胞数及中性粒细胞比例越高,EDSS评分也越高,考虑可能全身炎症反应引起的血脑屏障破坏,致使血清蛋白损伤性渗透入脑脊液,进而损害脊髓、脑部、视神经等部位,增加NMOSDs患者临床致残的风险。
NMOSDs患者致残状况与患者个体自身免疫反应有关,本研究为此观点提供了循证医学证据。国内外研究认为,脑脊液蛋白与脑脊液IgG是总体评估脑脊液循环系统免疫反应的生化指标,可反映中枢神经系统与神经免疫反应的程度[10];而脑脊液 IgG指数及24 h鞘内合成率则能够反映内源性免疫球蛋白的合成,是评价中枢神经系统内源性体液免疫应答状态的重要指标[11]。本研究结果显示NMOSDs患者在独立行走受限组与不受限组之间脑脊液蛋白、脑脊液IgG等生化指标有统计学差异,AQP4抗体、24 h鞘内合成率及寡克隆带无统计学差异;该结果表明:(1)NMOSDs患者脑脊液系统存在一定免疫反应,并且独立行走受限的NMOSDs患者免疫反应更加强烈;(2)NMOSDs患者致残的发生机制可能与血-脑脊液屏障损伤、血清蛋白以及免疫球蛋白等由血液循环进入脑脊液系统有关,脑脊液IgG水平在独立行走受限组显著升高,这与Kim等[12]认为CSF-IgG增加NMO发作时致残率的结论相一致。(3)AQP4抗体作为NMOSDs致病性抗体,对于患者独立行走受限的影响并无明显统计学差异,此前国内外尚无针对性报道。(4)NMOSDs患者脑脊液寡克隆带阴性比例高,与此前报道MS患者中90%有IgG寡克隆带阳性不同,支持Bergamaschi 等[13]的观点。此外,本研究显示NMOSDs患者独立行走受限发生率随着脑脊液蛋白水平升高显著增加,经统计分析显示脑脊液蛋白与独立行走受限发生呈正相关。因此,高水平的脑脊液蛋白可能是NMOSDs患者发生肢体瘫痪、行走受限的一个危险因素或预测因素,肯定结论尚需大样本、前瞻性队列研究证实。
综上所述,NMOSDs患者面独立行走受限发生率随着脑脊液蛋白水平的升高而增加。脑脊液蛋白与EDSS水平的正相关关系对于探讨NMOSDs患者致残状况的免疫机制方面有着重要的意义。
[1]Wingerchuk DM,Banwell B,Bennett JL,et al. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders [J]. Neurology,2015,85(2):177-189.
[2]Krumbholz M,Meinl E. B cells in MS and NMO:pathogenesis and therapy[J]. Semin Immunopathol,2014,36(3):339-350.
[3]Kowarik MC,Grummel V,Wemlinger S,et al. Immune cell subtyping in the cerebrospinal fluid of patients with neurological diseases [J]. J Neurol,2014,261(1):130-143.
[4]Matsuoka T,Matsushita T,Kawano Y,et al. Heterogeneity of aquaporin-4 autoimmunity and spinal cord lesions in multiple sclerosis in Japanese [J]. Brain,2007,130(Pt 5):1206-1223.
[5]John F. Kurtzke Rating Neurologic impairment in Multiple Sclerosis An Expanded disability status scale (EDSS) [J]. Neurology,1983,33:1444-1453.
[6]Matas SL,Glehn F,Fernandes GB,et al. Cerebrospinal fluid analysis in the context of CNS demyelinating diseases[J]. Arq Neuropsiquiatr,2013,71(9B):685-688.
[7]Wingerchuk DM,Hogancamp WF,O’Brien PC,et al. The clinical course of neuromyelitis optica(Devic’s syndrome)[J]. Neurology,1999,53:1107-1114.
[8]Akman-Demir G,Tüzün E,Waters P,et al. Prognostic implications of aquaporin-4 antibody status in neuromyelitis optica patients[J]. J Neurol,2011,258:464-470.
[9]Schliep G,Felgenhauer K. Serum-CSF protein gradients,the blood-CSF barrier and the local immune response[J]. J Neurol,1978,218(2):77-96.
[10]Seyfert S,Quill S,Faulstich A. Variation of barrier permeability for albumin and immunoglobulin G influx into cerebrospinal fluid[J]. Clin Chem Lab Med,2009,47(8):955-958.
[11]Conrad AJ,Chiang EY,Andeen LE,et al. Quantitation of intrathecal measles virus IgG antibody synthesis rate:subacute sclerosing panencephalitis and multiple sclerosis[J]. J Neuroimmunol,1994,54(1/2):99-108.
[12]Kim SM,Waters P,Vincent A,et al. Cerebrospinal fluid/serum gradient of IgG is associated with disability at acute attacks of neuromyelitis optica[J]. J Neurol,2011,258(12):2176-2180.
[13]Bergamaschi R,Tonietti S,Franciotta D,et al. Oligoclonal bands in Devic’s neuromyelitis optica and multiple sclerosis:differences in repeated cerebrospinal fluid examinations[J]. Mult Scler,2004,10(1):2-4.
The correlation between cerebrospinal fluid protein and disability status in patients with neuromyelitis optica spectrum disorders
YULu,ZHONGXingxing,TANGKena,etal.
(DepartmentofNeurology,SecondMilitaryMedicalUniversity,Shanghai200433,China)
Objective To explore the correlation between the cerebrospinal fluid protein and disability status in patients with neuromyelitis optica spectrum disorders (NMOSDs). Methods Clinical and biochemical data of 108 patients with NMOSDs in department of neurology from January 2010 to February 2016 were retrospectively analyzed. According to Expanded disability status scale (EDSS),patients were divided into independent walking normally and limitedly groups,and their clinical and biochemical characteristics were compared between the two groups. According to level of cerebrospinal fluid protein,NMOSDs patients were divided into cerebrospinal fluid protein normal and abnormal groups,EDSS were compared among the two groups. The correlation between the cerebrospinal fluid protein and disability status was analyzed. Results Between the independent walking normally and limitedly groups,there were statistically significant differences in age of onset,sphincter dysfunction,peripheral blood leucocyte,neutrophil-lymphocyte ratio,cerebrospinal fluid protein and cerebrospinal fluid immunoglobulin G(P<0.05),there was no significant difference in gender,vision impaired,Aquaporin-4 antibody and other clinical & biochemical characteristics (P>0.05),and between the two groups by different levels of cerebrospinal fluid protein,there were statistically significant differences in EDSS (T=-3.13,P=0.002). Cerebrospinal fluid protein was positively correlated with the independent walking limitedly (r=0.286,P<0.01). Conclusion The incidence of disability increased accompany with the level of cerebrospinal fluid protein,and cerebrospinal fluid protein may helpful in monitoring of NMOSDs patients in the aspect of disability status.
Neuromylitis optica disorders; Cerebrospinal fluid protein; EDSS; Disease assessment
1003-2754(2017)01-0031-03
2016-09-10;
2016-12-08
国家自然科学基金面上项目(No. 81471219)
(第二军医大学附属长海医院神经内科,上海 200433)
管阳太,E-mail:yangtaiguan@sina.com
R744.5+2
A
