结直肠腺瘤危险因素及幽门螺杆菌感染与腺瘤特征和血清胃泌素水平的相关性研究
2017-02-17陈志涛孙圣斌
陈志涛,王 萍,孙圣斌,张 姮,吴 杰
·论著·
结直肠腺瘤危险因素及幽门螺杆菌感染与腺瘤特征和血清胃泌素水平的相关性研究
陈志涛,王 萍,孙圣斌,张 姮,吴 杰*
背景 幽门螺杆菌(Hp)感染不仅是胃癌的主要致病因素,而且与结直肠腺瘤相关,但在不同种族间的结论不一致。目的 探讨结直肠腺瘤患者的危险因素,以及Hp感染与腺瘤特征和血清胃泌素水平的相关性。方法 回顾性收集2011—2015年华中科技大学同济医学院附属武汉市中心医院收治的结直肠腺瘤患者1 000例为结直肠腺瘤组,同时收集同时期本院通过结肠镜行结肠癌筛查未见肠道异常者1 500例为对照组。收集两组患者一般资料,采用14C尿素呼气试验检测Hp感染情况。酶联免疫吸附试验法测定血清细胞毒素相关基因A(CagA)蛋白和胃泌素水平。结直肠腺瘤组患者根据Hp感染情况分为Hp感染者(n=623)及非Hp感染者(n=377),Hp感染者根据是否表达CagA蛋白进一步分为CagA蛋白(+)(n=510)和CagA蛋白(-)(n=113)。结直肠腺瘤危险因素采用多因素Logistic回归分析。结果 结直肠腺瘤组患者Hp感染率较对照组升高〔62.30%(623/1 000)与54.33%(815/1 500),OR=1.39,95%CI(1.18,1.64),P<0.001〕。多因素Logistic回归分析结果显示:高脂血症、结肠癌家族史及Hp感染为结直肠腺瘤的独立危险因素(P<0.05)。结直肠腺瘤患者Hp感染者与非Hp感染者腺瘤数目、腺瘤蒂部分型、腺瘤病理类型比较,差异均无统计学意义(P>0.05);Hp感染者与非Hp感染者腺瘤大小及腺瘤伴高级别上皮内瘤变发生率比较,差异均有统计学意义(P<0.05)。结直肠腺瘤患者CagA蛋白(+)Hp感染者血清胃泌素水平〔(65.78±9.23)ng/L〕高于CagA蛋白(-)Hp感染者〔(55.04±8.05)ng/L〕和非Hp感染者〔(51.04±4.95)ng/L〕(P<0.05)。结论 高脂血症、结肠癌家族史及Hp感染为结直肠腺瘤的危险因素,结直肠腺瘤患者CagA蛋白(+)Hp感染者血清胃泌素水平升高。推测CagA蛋白所释放的促炎因子可能会促进结直肠上皮细胞的增殖,导致CagA蛋白(+)Hp感染人群结直肠上皮细胞增殖活跃、异常增生,从而增加结直肠腺瘤的发生。
结直肠肿瘤;幽门螺杆菌;细胞毒素相关基因A;胃泌素类
陈志涛,王萍,孙圣斌,等.结直肠腺瘤危险因素及幽门螺杆菌感染与腺瘤特征和血清胃泌素水平的相关性研究[J].中国全科医学,2017,20(2):154-158.[www.chinagp.net]
CHEN Z T,WANG P,SUN S B,et al.Risk factors for colorectal adenomas,association of helicobacter pylori infection with features of colorectal adenomas and serum gastrin levels[J].Chinese General Practice,2017,20(2):154-158.
幽门螺杆菌(Helicobacter pylori,Hp)被国际癌症研究机构列为胃癌的一类致癌原,是引起散发性胃癌的主要危险因素[1]。细胞毒素相关基因A(cytotoxin-associated gene A,CagA)存在于Hp高毒力菌株中,其表达产物为CagA蛋白,为可溶性蛋白,存在于血清中,是Hp产生致病作用的重要毒力因子之一[2]。并非所有的Hp菌株均表达CagA蛋白,与CagA蛋白(-)Hp菌株相比,CagA蛋白(+)Hp菌株可引起胃黏膜更严重的炎性反应,且更能增加胃癌的发病风险[3-4]。然而近年来,不断有证据表明Hp感染不仅是胃癌的主要致病因素,而且也与胃外的肿瘤有关,研究报道Hp感染亦与结直肠、肝胆及胰腺部位等肿瘤相关[5]。研究发现,Hp感染增加结直肠腺瘤的发病[6-7],亦有部分研究显示,Hp感染与结直肠腺瘤无明显相关性[8-9]。结果存在一定争议。研究发现,Hp感染可导致胃体黏膜萎缩,通过对胃窦G细胞负反馈调节致使血清胃泌素水平升高[10-11]。胃泌素通过刺激生长因子依赖的信号转导通路从而参与疾病的发生,因此,Hp感染所导致的高胃泌素血症可能成为导致结直肠肿瘤发病的始动因子。体外实验表明,高胃泌素水平与结直肠癌发病有关[12-14]。虽然,Hp感染与结直肠癌的相关性研究较多,但其可能的病理生理机制仍未阐明,尤其是结直肠腺瘤。因此,本研究探讨结直肠腺瘤的危险因素,以及Hp感染与腺瘤特征和血清胃泌素水平的相关性,旨在为预防结直肠腺瘤癌变及Hp的根除指征提供理论依据。
本研究背景和创新点:
越来越多的研究提示幽门螺杆菌(Hp)感染不仅是胃癌的主要致病因素,而且与结直肠腺瘤相关,但不同种族间的结论存在一定争议,且其可能的病理生理机制仍未阐述。因此,本研究探讨结直肠腺瘤的危险因素及Hp感染与腺瘤特征和血清胃泌素水平的相关性,旨在为结直肠腺瘤的治疗、预防及Hp的根除指征提供理论依据。
1 对象与方法
1.1 研究对象 回顾性收集2011—2015年华中科技大学同济医学院附属武汉市中心医院收治的结直肠腺瘤患者1 000例为结直肠腺瘤组,均经临床、实验室、放射学、内镜及组织病理学检查综合诊断[15]。每例结直肠腺瘤患者的临床资料均登记注册,有完整的结肠镜和病理学诊断资料。同时收集同时期本院通过结肠镜行结肠癌筛查未见肠道异常者1 500例为对照组。所有受试者于本院接受胃镜检查诊断为慢性胃炎,慢性胃炎诊断标准参考2004年中华医学会消化内镜学分会《慢性胃炎的内镜分型分级标准及治疗的试行意见》[16]。排除标准:(1)年龄<18岁者;(2)妊娠期妇女;(3)自身免疫性疾病者;(4)曾行Hp根除治疗者;(5)近4周服用过质子泵抑制剂、H2受体拮抗剂、抗生素及糖皮质激素者;(6)有其他部位恶性肿瘤病史者;(7)有胃肠道手术史者。受试者均签署知情同意书,该研究项目获华中科技大学同济医学院附属武汉市中心医院伦理委员会批准。
1.2 方法
1.2.1 一般资料 收集两组患者的一般资料,包括性别、年龄、吸烟、饮酒、体质指数、既往糖尿病、高血压、高脂血症病史、结肠癌家族史。吸烟定义为:每天至少吸烟1只,连续吸烟1年以上,长期吸烟但戒烟短于半年者;饮酒定义为:每天至少饮酒50 g,连续饮酒1年以上,或戒酒未超过半年者。
1.2.2 Hp检测 Hp感染参照我国2012年《第四次全国幽门螺杆菌感染处理共识报告》定义为:14C尿素呼气试验阳性定义为Hp感染阳性。14C尿素呼气试验检测数值≥100 dpm/mmol为阳性,<100 dpm/mmol为阴性[17]。
1.2.3 组织病理学评估 结直肠腺瘤经内镜下切除后样本常规处理、苏木素-伊红染色。参照世界卫生组织标准[15]评估所有切除样本发育不良的级别以及绒毛结构等情况。结直肠腺瘤蒂部分型分为有蒂和无蒂两种类型[18]。
1.2.4 血清采集 采集结直肠腺瘤组和对照组无抗凝外周静脉血5 ml,在3 h内,1 000×g离心10 min(室温),收集血清。于-80 ℃冰箱保存待检。
1.2.5 血清CagA蛋白检测 采用酶联免疫吸附试验(ELISA)试剂盒(CSB-E09170h, CUSABIO)检测结直肠腺瘤组和对照组血清CagA蛋白含量,具体步骤参照试剂盒说明书。采用酶标仪在波长450 nm处检测样本吸光度值(optical density,OD值)。OD值样本/OD值阴性对照≥2.1为CagA蛋白表达阳性,OD值样本/OD值阴性对照< 2.1为CagA蛋白表达阴性。
1.2.6 血清胃泌素水平检测 采用ELISA试剂盒(CSB-E09166h,CUSABIO)检测结直肠腺瘤组和对照组血清胃泌素水平(ng/L),具体步骤参照试剂盒说明书。
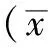
2 结果
2.1 对照组与结直肠腺瘤组患者一般资料比较 对照组与结直肠腺瘤组患者性别、年龄、吸烟率、饮酒率、体质指数、既往糖尿病、高血压病史比较,差异均无统计学意义(P>0.05);两组患者既往高脂血症病史、结肠癌家族史比较,差异均有统计学意义(P<0.05,见表1)。
2.2 对照组与结直肠腺瘤组患者Hp感染率比较 对照组患者Hp感染率为54.33%(815/1 500),结直肠腺瘤组患者Hp感染率为62.30%(623/1 000),结直肠腺瘤组患者Hp感染率较对照组升高,差异有统计学意义〔OR=1.39,95%CI(1.18,1.64),χ2=15.585,P<0.001〕。
2.3 结直肠腺瘤危险因素的多因素Logistic回归分析 以性别(赋值:男=1,女=0)、年龄(连续变量)、吸烟(赋值:有=1,无=0)、饮酒(赋值:有=1,无=0)、体质指数(连续变量)、糖尿病(赋值:有=1,无=0)、高血压(赋值:有=1,无=0)、高脂血症(赋值:有=1,无=0)、结肠癌家族史(赋值:有=1,无=0)、Hp感染(赋值:有=1,无=0)为自变量,以结直肠腺瘤(赋值:是=1,否=0)为因变量,采用逐步法进行多因素Logistic回归分析,结果显示:高脂血症、结肠癌家族史及Hp感染为结直肠腺瘤的独立危险因素(P<0.05,见表2)。
表2 结直肠腺瘤危险因素的多因素Logistic回归分析
Table2MultivariateLogisticregressionanalysisontheriskfactorsforcolorectaladenomas

变量βSEWaldχ2值P值OR值(95%CI)高脂血症0641034222370024138(118,503)结肠癌家族史0863102445420015153(121,325)Hp感染0574089735640032117(113,427)
注:Hp=幽门螺杆菌
2.4 结直肠腺瘤患者Hp感染者与非Hp感染者腺瘤特征比较 结直肠腺瘤患者Hp感染者623例,非Hp感染者377例,结直肠腺瘤患者Hp感染者与非Hp感染者腺瘤数目、腺瘤蒂部分型、腺瘤病理类型比较,差异均无统计学意义(P>0.05);Hp感染者与非Hp感染者腺瘤大小及腺瘤伴高级别上皮内瘤变发生率比较,差异均有统计学意义(P<0.05,见表3)。
2.5 CagA蛋白表达对血清胃泌素水平的影响 结直肠腺瘤患者Hp感染者根据是否表达CagA蛋白进一步分为CagA蛋白(+)(n=510)和CagA蛋白(-)(n=113)。结直肠腺瘤患者CagA蛋白(+)Hp感染者血清胃泌素水平〔(65.78±9.23)pg/ml〕高于CagA蛋白(-)Hp感染者〔(55.04±8.05) pg/ml〕和非Hp感染者〔(51.04±4.95) pg/ml〕,差异有统计学有意义(q=-11.234,P=0.013;q=-9.265,P=0.004);结直肠腺瘤患者CagA蛋白(-)Hp感染者血清胃泌素水平与非Hp感染者比较,差异无统计学意义(q=4.167,P=0.742)。

表1 对照组与结直肠腺瘤组患者一般资料比较
注:a为t值

表3 结直肠腺瘤患者Hp感染者与非Hp感染者腺瘤特征比较〔n(%)〕
3 讨论
随着生活方式的不断变化、饮食结构的调整以及各种微生物的感染,结直肠癌的发病率逐年上升,严重影响患者的身心健康[19-21]。腺瘤-癌序贯学说已被广泛关注,结直肠腺瘤是结直肠癌的主要癌前病变[22-23]。因此,调查结直肠腺瘤发生的危险因素对早期预防结直肠癌、降低结直肠癌的发生率有积极的临床意义。本研究结果表明,结直肠腺瘤组患者Hp感染率明显高于对照组,Hp感染是结直肠腺瘤的独立危险因素。且结直肠腺瘤患者Hp感染者与非Hp感染者腺瘤大小及腺瘤伴高级别上皮内瘤变发生率有差异。结直肠腺瘤患者Hp感染者发生>2 cm腺瘤及发生腺瘤伴高级别上皮内瘤变的概率明显高于非Hp感染者。这些发现均提示Hp感染阳性的人群罹患结直肠腺瘤的风险增高。BRIM等[6]发现,非裔美国人群中结直肠腺瘤患者Hp感染率明显高于健康对照者。SONNENBERG等[8]研究报道,Hp感染影响结直肠腺瘤的大小及数目。虽然PATEL等[24]研究发现,拉美裔人群中Hp感染与结直肠腺瘤无明显相关性,然而,最近一项东亚人群的Meta分析显示Hp感染增加结直肠腺瘤的发生[7]。出现这些分歧的可能原因与种族差异、遗传、环境因素及样本量大小不同有关。
Hp感染与结直肠腺瘤相关的病理生理机制不明,有研究报道高胃泌素血症与结直肠肿瘤相关[12,25-26]。Hp感染是否通过增加血清胃泌素的水平从而参与结直肠腺瘤的发病。因此,本研究进一步检测了结直肠腺瘤患者血清胃泌素水平,结果显示,结直肠腺瘤患者CagA蛋白(+)Hp感染者血清胃泌素水平高于CagA蛋白(-)Hp感染者和非Hp感染者,结直肠腺瘤患者CagA蛋白(-)Hp感染者血清胃泌素水平与非Hp感染者比较无差异。研究显示,与CagA蛋白(-)Hp菌株比较,CagA蛋白(+)Hp菌株所导致的炎性反应更强烈,且罹患胃癌的风险更高[4]。PEEK等[27]通过胃黏膜活检标本,采用流式细胞技术分析细胞凋亡,采用免疫组织化学技术检测胃黏膜上皮细胞增殖指数,发现CagA蛋白(+)Hp感染患者胃黏膜上皮细胞增殖指数明显高于CagA蛋白(-)Hp感染患者。
综上所述,Hp感染是结直肠腺瘤发生的独立危险因素,且Hp感染影响结直肠腺瘤的大小及腺瘤伴高级别上皮内瘤变的发生。CagA蛋白(+)Hp感染结直肠腺瘤患者血清胃泌素水平明显升高。推测CagA蛋白所释放的促炎因子可能会促进结直肠上皮细胞的增殖,导致CagA蛋白(+)Hp感染人群结直肠上皮细胞增殖活跃、异常增生,从而导致结直肠腺瘤的发生。但其具体的病理生理机制有待后续进一步研究。
至谢:感谢武汉市中心医院消化内科全体医护人员对本课题的支持!
作者贡献:陈志涛、吴杰进行文章的构思与设计、论文的修订,负责文章的质量控制及审校;陈志涛、张姮进行研究的实施与可行性分析、数据整理;王萍、孙圣斌进行数据收集、结果的分析与解释;陈志涛进行统计学处理、撰写论文;吴杰对文章整体负责,监督管理。
本文无利益冲突。
[1]IARC monographs on the evaluation of carcinogenic risks to humans.Vol.61.Schistosomes,liver flukes and Helicobacter pylori[M].Lyon:IARC,1994:177-240.
[2]WEN S,MOSS S F.Helicobacter pylori virulence factors in gastric carcinogenesis[J].Cancer Lett,2009,282(1):1-8.
[3]BACKERT S,TEGTMEYER N,SELBACH M.The versatility of Helicobacter pylori CagA effector protein functions:the master key hypothesis[J].Helicobacter,2010,15(3):163-176.
[4]PARSONNET J,FRIEDMAN G D,ORENTREICH N,et al.Risk for gastric cancer in people with CagA positive or CagA negative Helicobacter pylori infection[J].Gut,1997,40(3):297-301.
[5]VENERITO M,SELGRAD M,MALFERTHEINER P.Helicobacter pylori:gastric cancer and extragastric malignancies - clinical aspects[J].Helicobacter,2013,18(Suppl 1):39-43.
[6]BRIM H,ZAHAF M,LAIYEMO A O,et al.Gastric Helicobacter pylori infection associates with an increased risk of colorectal polyps in African Americans[J].BMC Cancer,2014,14:296.
[7]GUO Y,LI H Y.Association between Helicobacter pylori infection and colorectal neoplasm risk:a meta-analysis based on East Asian population[J].J Cancer Res Ther,2014,10(Suppl):263-266.
[8]SONNENBERG A,GENTA R M.Helicobacter pylori is a risk factor for colonic neoplasms[J].Am J Gastroenterol,2013,108(2):208-215.
[9]PAPASTERGIOU V,KARATAPANIS S,GEORGOPOULOS S D.Helicobacter pylori and colorectal neoplasia:is there a causal link? [J].World J Gastroenterol,2016,22(2):649-658.
[10]CHEN X Z,SCHÖTTKER B,CASTRO F A,et al.Association of helicobacter pylori infection and chronic atrophic gastritis with risk of colonic,pancreatic and gastric cancer:a ten-year follow-up of the ESTHER cohort study[J].Oncotarget,2016,7(13):17182-17193.
[11]WATSON S A,GRABOWSKA A M,EL-ZAATARI M,et al.Gastrin-active participant or bystander in gastric carcinogenesis? [J].Nat Rev Cancer,2006,6(12):936-946.
[12]WESTWOOD D A,PATEL O,BALDWIN G S.Gastrin mediates resistance to hypoxia-induced cell death in xenografts of the human colorectal cancer cell line LoVo[J].Biochim Biophys Acta,2014,1843(11):2471-2480.
[13]ROBERTSON D J,SANDLER R S,AHNEN D J,et al.Gastrin,Helicobacter pylori,and colorectal adenomas[J].Clin Gastroenterol Hepatol,2009,7(2):163-167.
[14]GEORGOPOULOS S D,POLYMEROS D,TRIANTAFYLLOU K,et al.Hypergastrinemia is associated with increased risk of distal colon adenomas[J].Digestion,2006,74(1):42-46.
[15]HAMILTON S R,VOGELSTEIN B,KUDO S.World Health Organization classification of tumours:pathology and genetics of tumours of the digestive system[M].Lyon:IARC,2000.
[16]中华医学会消化内镜学分会.慢性胃炎的内镜分型分级标准及治疗的试行意见[J].中华消化内镜杂志,2004,21(2):77-78. Chinese Society of Digestive Endoscopy.Trial on treatment and typing or grading chronic gastritis under endoscopies[J].Chinese Journal of Digestive Endoscopy,2004,21(2):77-78.
[17]中华医学会消化病学分会幽门螺杆菌学组/全国幽门螺杆菌研究协作组,刘文忠,谢勇,等.第四次全国幽门螺杆菌感染处理共识报告[J].中华消化杂志,2012,32(10):655-661. Chinese Society of Gastroenterology Helicobacter Pylori Group/China Research Group of Helicobacter Pylori,LIU W Z,XIE Y,et al.The 4th National Consensus on helicobacter pylori infection treatment[J].Chinese Journal of Digestion,2012,32(10):655-661.DOI:10.3760/cma.j.issn.0254-1432.2012.10.002.
[18]SCHACHSCHAL G,MAYR M,TRESZL A,et al.Endoscopic versus histological characterization of polyps during screening colonoscopy[J].Gut,2014,63(3):458-465.
[19]陈红,任淑华,庞红梅,等.埃克替尼与卡培他滨治疗老年结直肠癌疗效比较[J].中国全科医学,2013,16(33):3960-3962. CHEN H,REN S H,PANG H M,et al.Clinic research on icotinib and capecitabine in the treatment of senile advanced colorectal cancer[J].Chinese General Practice,2013,16(33):3960-3962.
[20]ZHENG Z X,ZHENG R S,ZHANG S W,et al.Colorectal cancer incidence and mortality in China,2010[J].Asian Pac J Cancer Prev,2014,15(19):8455-8860.
[21]SUNG J J,LAU J Y,GOH K L,et al.Increasing incidence of colorectal cancer in Asia:implications for screening[J].Lancet Oncol,2005,6(11):871-876.
[22]WONG M C,CHING J Y,CHIU H M,et al.Risk of colorectal neoplasia in individuals with self-reported family history:a prospective colonoscopy study from 16 Asia-Pacific Regions[J].Am J Gastroenterol,2016,111(11):1621-1629.
[23]陈冬妹,肖文,张满芬.叶酸对结直肠腺瘤复发干预作用的随访研究[J].中国全科医学, 2012,15(2):496-497. CHEN D M,XIAO W,ZHANG M F.Interventional effects of folic acid on recurrence of colorectal adenoma: follow-up study[J].Chinese General Practice,2012,15(2):496-497.
[24]PATEL S,LIPKA S,SHEN H,et al.The association of H.pylori and colorectal adenoma:does it exist in the US Hispanic population? [J].J Gastrointest Oncol,2014,5(6):463-468.
[25]PATERSON A C,MACRAE F A,PIZZEY C,et al.Circulating gastrin concentrations in patients at increased risk of developing colorectal carcinoma[J].J Gastroenterol Hepatol,2014,29(3):480-486.
[26]HAN Y M,PARK J M,PARK S H,et al.Gastrin promotes intestinal polyposis through cholecystokinin-B receptor-mediated proliferative signaling and fostering tumor microenvironment[J].J Physiol Pharmacol,2013,64(4):429-437.
[27]PEEK R M Jr,MOSS S F,THAM K T,et al.Helicobacter pylori cagA+ strains and dissociation of gastric epithelial cell proliferation from apoptosis[J].J Natl Cancer Inst,1997,89(12):863-868.
(本文编辑:陈素芳)
Risk Factors for Colorectal Adenomas,Association of Helicobacter Pylori Infection with Features of Colorectal Adenomas and Serum Gastrin Levels
CHENZhi-tao,WANGPing,SUNSheng-bin,ZHANGHeng,WUJie*
DepartmentofGastroenterology,theCentralHospitalofWuhan,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,KeyLaboratoryforMolecularDiagnosisofHubeiProvince,ClinicalResearchCenterforIntestinal&ColorectalDiseasesofHubeiProvince,Wuhan430014,China
*Correspondingauthor:WUJie,Professor;E-mail:wujie_20120803@163.com
Background Helicobacter pylori(Hp) infection is not only a major risk factor for gastric cancer but it is also related to colorectal adenomas(CAs),but there are still some contradictory data in different populations.Objective To investigate the risk factors for CAs,and the correlation of Hp infection with features of CAs and serum gastrin levels.Methods From 2011 to 2015,in the Central Hospital of Wuhan,Tongji Medical College,Huazhong University of Science and Technology,1 000 consecutive admitted CAs patients were selected as the CAs group,and other 1 500 physical examinees with normal manifestations showed by colonoscopy for colorectal cancer screening were selected as the control group.The general data of both groups were collected.Hp infection was determined by14C urea breath tests.Serum cytotoxin-associated gene A(CagA) protein and gastrin levels were measured by ELISA.The patients with CAs were divided into Hp-infected subgroup(n=623) and non-Hp-infected subgroup(n=377) based on whether they infected with Hp,then the Hp-infected subgroup was further assigned to CagA-positive patients(n=510) and CagA-negative patients(n=113) in accordance with whether the Hp strains expressed the CagA.The risk factors of CAs were estimated by multivariate Logistic regression.Results Hp infection was more frequently detected in patients with CAs compared to the controls〔62.30%(623/1 000)vs.54.33%(815/1 500),OR=1.39,95%CI(1.18,1.64),P<0.001〕.The results of multivariate Logistic regression showed that hyperlipidemia,family history of colorectal cancer and Hp infection were independent risk factors for the development of CAs(P<0.05).In CAs patients,there were no associations between Hp infection and adenoma number,presence of a pedicle and the pathological type(P>0.05).Hp infection was associated with the diameter of adenomas and adenomas presenting with high grade intraepithelial neoplasia in CAs patients(allP<0.05).In CAs patients,serum gastrin level was higher in that infected with Hp and positive CagA〔(65.78±9.23)ng/L〕 than in that infected with Hp and negative CagA〔(55.04±8.05)ng/L〕 and than in that without Hp infection〔(51.04±4.95)ng/L〕(P<0.05).Conclusion Hyperlipidemia,family history of colorectal cancer and Hp infection are the risk factors for the development of CAs.Hp-infected patients harboring CagA-positive strains have higher serum gastrin level and stronger ability of colorectal epithelial proliferation compared to CagA-negative strains in CAs patients.We speculate that the pro-inflammatory cytokines released by the CagA may promote colorectal epithelial cell proliferation,which would increase the occurrence of colorectal adenomas.
Colorectal neoplasms;Helicobacter pylori;Cytotoxin-associated gene A;Gastrins
国家自然科学基金青年基金资助项目(81400578);国家教育部博士点基金资助项目(20130142120096);武汉市卫生局项目(WX13A07,WX13B03)
R 735.37
A
10.3969/j.issn.1007-9572.2017.02.007
2016-05-16;
2016-11-11)
430014湖北省武汉市,华中科技大学同济医学院附属武汉市中心医院消化内科,分子诊断湖北省重点实验室,湖北省肠病医学临床研究中心
*通信作者:吴杰,教授;E-mail:wujie_20120803@163.com
