制备型高效液相色谱在天然产物分离中的应用*
2017-02-16吴希邓勤徐志勇岑举人徐静
吴希,邓勤,徐志勇,岑举人,徐静
(海南大学材料与化工学院,海口 570228)
制备型高效液相色谱在天然产物分离中的应用*
吴希,邓勤,徐志勇,岑举人,徐静
(海南大学材料与化工学院,海口 570228)
制备型高效液相色谱法在天然产物的分离纯化中得到广泛应用。从制备型高效液相色谱法的技术分类及其在天然产物研究中的实际应用方面对目前国内外制备型高效液相色谱技术研究现状进行了综述,对其发展动态进行了展望。
制备型高效液相色谱;天然产物;分离纯化
从植物、动物、微生物等天然材料中发现结构新颖且具有药理活性的天然产物并进一步开发成新药,是人类预防和治疗疾病的重要渠道,也是国际天然产物领域关注的研究方向[1]。采用高效、高分辨、多功能的分离技术是开展天然产物研究的关键环节之一[2]。近十几年来,制备型高效液相色谱(preparative high performance liquid hromatography,Prep-HPLC)是天然产物化学研究中应用最普遍、最有效和相关技术发展最快的分离纯化方法[3]。它是通过高负载、高分离度的制备柱来实现高纯度分离的色谱分离方法[4],其特点在于:(1)采用高柱效色谱柱,分离效率高;(2)应用范围广,对极性和非极性、离子型和非离子型、小分子和大分子、热稳定性和热不稳定性化合物均具有较好的分离效果,在药物研究领域具有不可替代的地位;(3)处理量大,能够满足不同的分离需求;(4)根据分离化合物的性质可配备不同类型的检测器,如紫外检测器(UV)、蒸发光散射检测器(ELSD)、二极管阵列检测器(DAD);(5)具有重现性好、毒性小、经济环保等优点[5–7]。笔者对近年来Prep-HPLC方法在各类天然产物分离纯化中的应用进行综述,为该方法的进一步推广应用提供参考。
1 制备型高效液相色谱技术的分类
制备型HPLC 是在分析型HPLC 的基础上发展起来的一种高效分离纯化技术。按照制备规模分有3种类型:(1)半制备色谱,其柱内径为5~20 mm,长度为15~50 mm,一般用10 µm或20~30 µm粒度的填料,通常在不超载的条件下操作,可以说是一种放大的分析分离。(2)克级制备色谱,当分离的样品量较大时,使用50 mm左右内径、20~70 cm长度的色谱柱,填料粒度40~60 µm,可装200~500 g固定相,在超载条件下操作。(3)工业用制备色谱,色谱柱尺寸及填料粒径更大[8]。表1列出了制备性高效液相色谱柱的级别和处理量。

表1 制备性高效液相色谱柱的级别和处理量
在天然产物分离纯化中,如果所得的纯化合物只是为了结构解析,使用半制备色谱即可很容易获得毫克级的单组分;如果所得的纯化合物是为了进行药理活性实验或进一步进行结构改造,则需要用到克级制备色谱。
2 制备型高效液相色谱的应用
2.1 生物碱类化合物
生物碱是生物体内一类除蛋白质、肽类、氨基酸及维生素B以外的含氮有机化合物,它们结构复杂且大多具有生理活性,如抗肿瘤活性[9–10]。在生物碱分离制备中,反相制备是制备型高效液相色谱应用最普遍的方法。根据样品的不同其流动相有很大差异。目前紫杉醇的制备是高效液相中比较成熟的应用[11],专用制备柱以D956树脂为填料(250 mm×200 mm),丙酮–水(40∶60~58∶42)为流动相,纯度可达到99%,回收率在80%以上。朱云霞[12]等利用Agilent 1100系列半制备型高效液相色谱对三尖杉总碱进行分离制备,色谱条件为Kromasil KR100–5 C18(10 mm×250 mm,5µm),流动相为0.02 mol/L乙酸铵溶液–甲醇(65∶35),用氨水调节pH为8.5左右,流速为5.0 mL/min,检测波长为284 nm,柱温为35℃,进样量为600 µL,可得到4种含量较高的三尖杉生物碱。王倩等[13]采用半制备高效液相色谱法对红毛七中的化学成分进行研究,对红毛七浸膏的6个洗脱部分进行制备,色谱条件为YMC–Actus Triart C18半制备色谱柱(20 mm×250 mm,5 µm),当流动相为甲醇–水(80∶20)、流速为8 mL/min时得到臭豆碱;当流动相为甲醇–水(50∶50)、流速为6 mL/min时得到穿叶赝靛碱。魏鼎华等[14]利用Waters系列高效液相从铁棒锤中得到3个二萜生物碱,色谱条件为YMC–Pack R&D ODS–A半制备色谱柱(20 mm×250 mm,5 µm),流动相为甲醇–水(70∶30)。陈艳等[15]采用Waters 600型半制备型高效液相色谱仪Kromasil–C18(250 mm×10 mm,5 µm),从小花清风藤茎叶的石油醚萃取部位分离纯化得到2种生物碱N-formyl-annonain(Z)和N-formyl-O-methylisopiline。尹元元等[16]利用日本Shimadzu LC–6A高效液相色谱仪,采用YMC C18色谱柱(20 mm×250 mm,5 µm),从吴茱萸得到11种生物碱类化合物,其中1-甲基-2-正十一烷基-4(1H)-喹诺酮、二氢吴茱萸卡品碱等具有抑制斑马鱼血管生物活性。制备型高效液相色谱法在生物碱纯化中的应用见表2。

表2 制备型高效液相色谱法在生物碱纯化中的应用
2.2 黄酮类化合物
黄酮类化合物是由两个苯环通过三碳链相互连接而成的,具有C6–C3–C615个碳原子基本骨架的一类物质,其广泛分布于各种药用植物中。目前已知的具有生物活性的黄酮类化合物有很多,其活性主要包括抗心血管疾病、抗肿瘤、抗氧化、抗病毒等[17]。万近福等[18]利用MCl gel柱层析,得到罗布麻花的总黄酮提取物,结合Varian Prostar制备型高效液相色谱进行纯化,色谱条件为反相C18柱(Merck,250 mm×25 mm,12 µm),流动相为0.1%甲酸的乙腈和水梯度洗脱,其中乙腈在180 min内从5%增加到50%。通过优化流速、样品进样量、洗脱梯度的变化,一次可从罗布麻花中制备分离得到9个黄酮类化合物,纯度均超过90%。此研究将高效液相色谱、紫外和蒸发光散色检测器联用分析罗布麻花总黄酮提取物的主要化学成分。该分离技术给天然产物黄酮类的分离、纯化提供了一种直接有效的方法。朱玲玲[19]利用高效液相色谱仪Shimadzu LC–20AT建立了对白鹃梅乙酸乙酯相快速分离纯化的方法,色谱条件为流动相甲醇–水(45∶55),流速为1.0 mL/min,进样量为40 µL,检测波长为267 nm,柱温为40℃,得到黄酮类化合物芦丁18 mg。易美玲[20]利用Agilent 1100型液相半制备色谱仪结合大孔吸附树脂、聚酰胺柱、正相硅胶柱、Sephadex LH–20柱色谱从翠云草75%乙醇提取物中得到9种黄酮类化合物,其中4’-甲氧基穗花杉双黄酮为首次从翠云草中分离得到。龚俊强等[21]采用硅胶、Sephadex LH–20柱色谱及半制备型高效液相色谱法,对黄杞叶中的黄酮类成分进行分离纯化,得到6种黄酮类化合物,其中(2R,3R)5,7,4’-三羟基二氢黄酮-3-氧-α-L-鼠李糖(3→1)-β-D-葡萄糖苷为首次从该植物中得到,为新化合物。应瑞峰等[22]对钱柳叶中化学成分进行研究,利用Waters-1525高效液相色谱仪从青钱柳叶中得到3个黄酮类化合物,其中丝桃甙和山柰酚-3-O-β-D-葡萄糖甙是首次从青钱柳叶中提取得到。青钱柳黄酮是青钱柳主要有效成分之一,但目前关于青钱柳黄酮单体的制备报道较少。制备型高效液相色谱法在黄酮类纯化中的应用见表3。
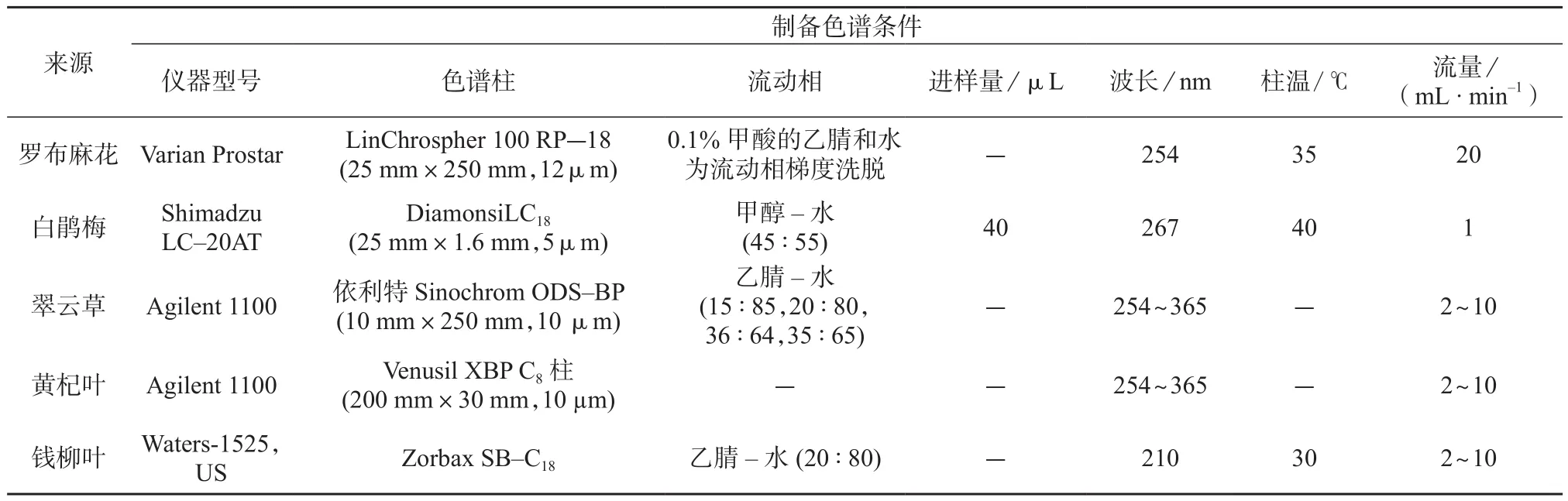
表3 制备型高效液相色谱法在黄酮类纯化中的应用
2.3 萜类化合物
萜类化合物是由异戊二烯或异戊烷以各种方式连接而成的天然化合物,具有祛痰、止咳、镇痛等生理活性[23–24]。此类化合物的制备通常采用以C18为填料的反相色谱柱、甲醇–水溶液为流动相,调节洗脱强度时加入异丙醇、正己烷溶液,流速控制在3~10 mL/min。朱玲娟等[25]利用Shimadzu LC–6A高效液相色谱和Phenomenex Gemini C18反相色谱柱(250 mm×10 mm,5 µm)从荚果蕨中分离出了9种高纯度的倍半萜类单体化合物,均为首次从荚果蕨属植物中分离得到。此项研究发展了分离纯化荚果蕨中倍半萜类的分离方法。石柳柳等[26]对黑老虎中的萜类成分进行了系统研究,采用丙酮提取,半制备高效液相JASCO PU–2089色谱等方法分离纯化,得到4种倍半萜类化合物。鞠爱华等[27]利用Prep-HPLC从蒙药大栀子中分离纯化其主要化学成分环烯醚萜苷类和西红花苷类,建立了纯化工艺。色谱条件Ⅰ为Shmadzu色谱柱(20 mm×50 mm,5 µm),选择220 nm为检测波长,以流动相甲醇–水进行线性梯度洗脱0~15 min,甲醇10%~40%;15~18 min,甲醇40%;18~45 min,甲醇40%~100%;流速为15 mL/min,进样量为1.5 mL。色谱条件Ⅱ为Shmadzu色谱柱(20 mm×50 mm,5 µm),选择440 nm为检测波长,以流动相甲醇–水进行线性梯度洗脱0~25 min,甲醇 40%~100%;流量为15 mL/min,进样量为0.5 mL。此项研究对分离这两类基本骨架完全相同、化学性质相似的化合物提供了可行方法。郎俊慧等[28]对豆荚软珊瑚中二萜类成分进行研究,利用Waters 1525/2998 高效液相色谱仪,色谱条件为YMC C18半制备柱(250 mm×10 mm,5 µm),流动相为乙腈–水(70∶30,65∶30,60∶40),分别制备得到6种半萜类化合物,其中豆荚内酯B为新化合物,其余均为首次从该属软珊瑚中分离得到,该研究丰富了软珊瑚的二萜类化学成分。表4列出了制备型高效液相色谱法在萜类纯化中的应用。

表4 制备型高效液相色谱法在萜类纯化中的应用
2.4 甾体化合物
甾体类化合物(steroids)是基本母核为环戊稠多氢化菲的一类天然化合物,其在维持生命、调节性功能、治疗皮肤疾病及控制生育等方面具有重要的生理、药理作用[29–30]。季改等[31]利用半制备高效液相色谱仪LC–20AT、硅胶柱色谱和Sephadex LH–20色谱柱,对绯红南五味子茎的化学成分进行研究,分离制备出10个甾体化合物。陈玉等[32]为研究灵芝的化学成分,利用多种柱层析和半制备高效液相色谱仪Ultimate 3000,VWD,DAD检测器,采用半制备型色谱柱5C18–MS–II(250 mm×10 mm,5 µm)对其进行了分离纯化,得到ganoderic acid B9等3个甾体化合物。徐瑞兰等[33]利用硅胶柱色谱、ODS反相柱色谱、Sephadex LH–20柱色谱和制备高效液相色谱仪对刘寄奴乙醇浸膏进行反复洗脱,得到schleicheol2等6个甾体化合物,其中一个为首次从菊科植物中分离得到。张甜甜等[34]对牛白藤的化学成分进行研究,利用高效液相色谱仪,YMC–Pack ODS–A半制备柱(20 mm×250 mm,5 µm),采用不同流动相,分离制备得到β–谷甾醇。Wang等[35]采用Dionex Ultimate 3000高效液相色谱仪,对消癌平化学成分研究,色谱条件为Agilent Technologies BDS C18column(50 mm×9.4 mm,5 µm)流动相甲醇–水(2∶1;3∶1;1∶1),从乌骨藤(消癌平)注射液中间体的氯仿提取物中分离得到11个甾体类化合物,其中3-O-β-D oleandropyranosyl 17β-tenacigenin B为新化合物。表5列出了制备型高效液相色谱法在甾体类纯化中的一些应用。
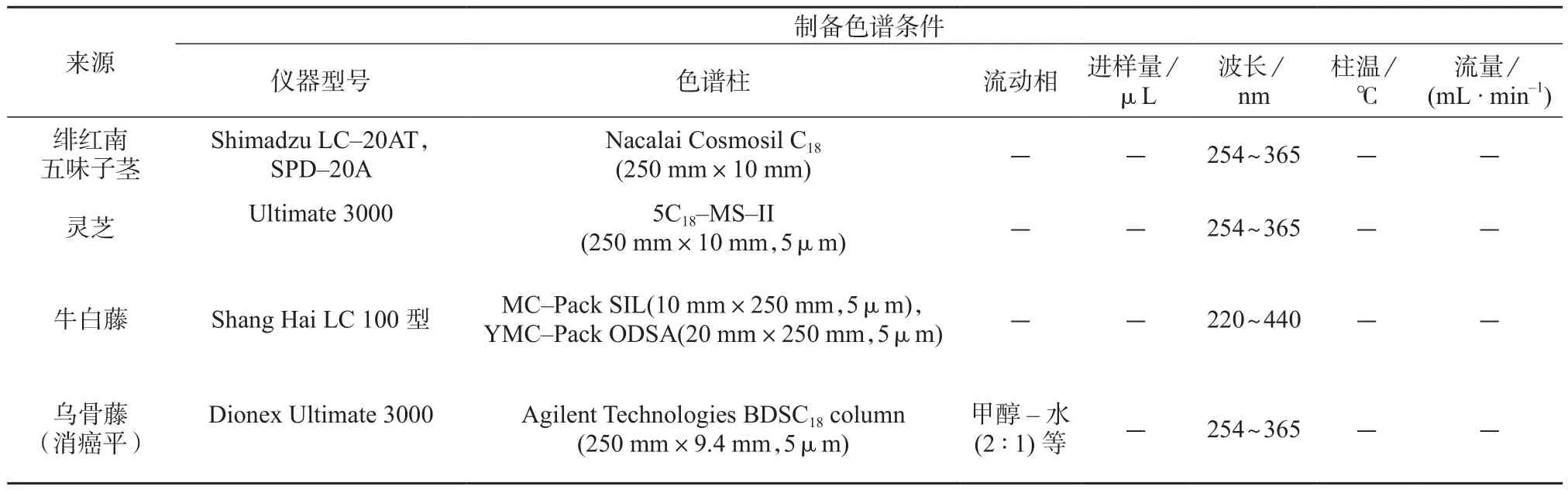
表5 制备型高效液相色谱法在甾体类纯化中的应用
2.5 其它类型天然产物
皂苷是苷元为三萜或螺旋甾烷类化合物的一类结构复杂的苷类化合物,一些皂苷类成分有明显的药理作用[36–37]。潘敏翔等[38]用硅胶柱色谱和示差检测器的半制备反相高效液相色谱仪从南海庞海星中制备得到一种新的多羟基甾醇皂苷。康俊霞等[39]采用半制备反相高效液相色谱仪Agilent 1100从银边海星中分离纯化得到皂苷,并建立纯化的色谱条件为Zorbax 300 SB–C18柱(250 mm×9.4 mm,5 µm),RID示差检测器,柱温30℃,流动相甲醇–水(47∶53),流速1.5 mL/min,进样量110µL,收集到白色粉末状皂苷化合物。香豆素是一类由顺式羟基桂皮酸分子内脱水环合而成的内酯化合物,实验研究发现香豆素类化合物具有抗HIV、抗癌、降压、抗心律失常、抗骨质疏松、镇痛、平喘及抗菌等多方面生物学活性[40]。李宝媛等[41]对蒙药沙蓬的化学成分进行研究,利用半制备高效液相色谱分离纯化得到2种香豆素类化合物。木脂素是一类由两分子苯丙素衍生物(即C6–C3单体)聚合而成的天然化合物,具有降压和防治绝经后骨质疏松等作用[42]。南泽东等[43]对新疆塔中栽培荒漠肉苁蓉Cistanche deserticola干燥肉质茎的化学成分进行研究,利用Dionex Ultimate 3000高效液相色谱仪,半制备色谱柱为Agilent Eclipse XDB–C18(10 mm×250 mm,5 µm),以不同比例的流动相制备纯化得到11种木脂素。蒽醌类化合物的基本母核为蒽醌,母核上常有羟基、羟甲基、甲基、甲氧基和羧基等取代基,具有抗菌消炎、抗病毒、抗癌等药理作用[44]。李钧等[45]利用Agilent 1200半制备液相色谱仪,色谱条件为ZORBAX EclipseXDB-C18(9.4×250 mm,5 µm),柱温为30℃,检测波长为250 nm,流动相为甲醇–水(55∶45),流速为4 mL/min,进样量为100 µL,从青龙衣中制备高纯度的醌类化合物。制备型高效液相色谱法在其它类纯化中的应用见表6。

表6 制备型高效液相色谱法在其它类纯化中的应用
3 结论与展望
目前在天然产物分离纯化过程中,一般先结合传统的分离方法如蒸馏、结晶、沉淀、萃取以及各种经典的色谱分离法(如大孔吸附树脂、聚酰胺柱色谱、硅胶柱色谱等)针对目标物质进行分离,然后采用制备型高效液相色谱法制备单体化合物。制备型高效液相色谱具有产率高、速度快等优点,未来很可能会成为天然产物分离的重要手段之一。由于天然产物分离纯化的核心目标是从天然生物资源中获取具有生物功能或活性的天然产物,因此建立高效液相色谱分离纯化天然产物的技术集成和样品库,是今后利用高效液相色谱分离纯化研究的发展趋势。
[1] 徐静.红树林微生物天然产物化学研究[M].北京:科学出版社,2015.
[2] 再帕尔·阿不力孜.天然产物研究方法和技术[M].北京:化学工业出版社,2010.
[3] Latif Z,Sarker S D. Isolation of natural products by preparative high performance liquid chromatography (prep-HPLC)[J]. Methods in Molecular Biology,2012,864: 255–274.
[4] Katti A,Guiochon G. Optimization of sample size and sample volume in preparative liquid chromatography[J]. Analytical Chemistry,1989,61(9): 982–990.
[5] 张祥民,张丽华,张玉奎.近年中国色谱研究进展[J].色谱,2012,30(3): 222–231.
[6] Cabanne C,Raedts M,Zavadzky E,et al. Evaluation of radial chromatography versus axial chromatography,practical approach[J]. Journal of Chromatography B,2007,845(2): 191–199.
[7] Jagschies G,Sofer G K,Hagel L. Handbook of Process Chromatography: Development,Manufacturing,Validation and Economics[M]. Pittsburgh: Academic Press,2007.
[8] 赵可星.高效液相色谱法分析并半制备党参化学成分的方法学探索[D].北京:北京中医药大学,2007.
[9] Laskar S. A brief resume on the genus Ailanthus:chemical and pharmacological aspects[J]. Phytochemistry Reviews,2010,9(3): 379–412.
[10] 胡苗芬,宋新波,张丽娟.臭椿吲哚生物碱成分及其生物活性研究进展[J].药物评价研究,2012,35(6): 469–472.
[11] 李洪彬,周建民,刘艳.制备型液相色谱法及其在制药和天然产物分离中的应用[J].现代制造,2013(5): 46–50.
[12] 朱云霞,侯卫,李明,等. 福建三尖杉中生物碱的高效液相分离与鉴定[J].复旦学报:自然科学版,2004,43(6): 1 124–1 128.
[13] 王倩,陆云阳,邱瑞桂,等.太白产红毛七生物碱成分的研究[J].中南药学,2016(2): 134–137.
[14] 魏鼎华,王菲,宋蓓,等. 铁棒锤中二萜生物碱成分及其生物活性[J].中国实验方剂学杂志,2015(19): 48–52.
[15] 陈艳, 黄滔, 苑春茂,等. 小花清风藤化学成分的研究[J]. 中草药, 2015, 30(21): 334-335.
[16] 尹元元,刘珊珊,韩利文,等. 吴茱萸生物碱类化学成分及其抗血管生成活性分析[J].中国实验方剂学杂志,2016(5): 45–53.
[17] Cheng X L,Wan J Y,Li P,et al. Ultrasonic/microwave assisted extraction and diagnostic ion filtering strategy by liquid chromatography–quadrupole time-of-fight mass spectrometry for rapid characterization of favonoids in Spatholobus suberectus[J]. Journal of Chromatography A,2011,1218(34): 5 774–5 786.
[18] 万近福,杨新洲,袁经权.制备型高效液相色谱快速分离罗布麻花的黄酮类成分[J].云南大学学报:自然科学版,2011,33(4): 463–468.
[19] 朱玲玲,张广文,郑树秀,等. 白鹃梅提取物的体外抗氧化活性及黄酮类化学成分的分离鉴定[J].食品与发酵工业,2016(2): 225–230.
[20] 易美玲,盛习锋,徐康平,等. 翠云草中黄酮类成分的研究[J].中国中药杂志,2015,40(15): 3 005–3 008.
[21] 龚俊强,蒋彩霞,陈仙,等. 黄杞叶黄酮类成分的研究[J].中国现代应用药学,2015(7): 813–817.
[22] 应瑞峰,季苏杰,李婷婷,等. 青钱柳叶黄酮的分离纯化与抗氧化性研究[J].食品科技,2015(12): 174–178.
[23] Shu Z,Pu J,Chen L,et al. Alisma orientale: Ethnopharmacology,Phytochemistry and Pharmacology of an Important Traditional Chinese Medicine[J]. American Journal of Chinese Medicine,2016,44(2): 227–251.
[24] Yi F,Zhao X,Peng Y,et al. Genus llex L: Phytochemistry,ethnopharmacology,and pharmacology[J]. Chinese Herbal Medicines,2016,8(3): 209–230.
[25] 朱玲娟,燕菲,陈金鹏,等. 荚果蕨地上部分萜类化学成分研究[J].中草药,2015,46(12): 1 737–1 741.
[26] 石柳柳,李贺然.黑老虎中倍半萜类化合物的分离鉴定及抑制NO生成作用研究[J].中国医药导报,2016,13(10): 27–29.
[27] 鞠爱华,张静,蔡丽娟,等. 蒙药大栀子中化学成分的制备高效液相色谱法分离纯化[J].时珍国医国药,2014(1): 27–29.
[28] 郎俊慧,杨帆,甘建红,等. 一种豆荚软珊瑚Lobophytum sp.中二萜类成分研究[J].中草药,2015,46(23): 3 455–3 459.
[29] Njar V,Brodie A,Gediya L K. Prodrugs of C–17-heteroaryl steroidal CYP17 inhibitors/antiandrogens:synthesis,in vitro biological activities,pharmacokinetics and antitumor activity:U.S, 9,018,198[ P].2015–4–28.
[30] Hirschmann R,Sprengeler P A,Kawasaki T,et al. The potential value of peptidomimetics in elucidating the bioactive conformation of peptide ligands[J]. Cheminform,2015,114(24): 254–259.
[31] 季改,余姝,胡文,等. 绯红南五味子茎的化学成分研究[J].中草药,2012,43(5): 873–876.
[32] 陈玉,刘流,牛艳芬.灵芝化学成分的研究[J].中南民族大学学报:自然科学版,2016,35(2): 10–14.
[33] 徐瑞兰,师彦平.刘寄奴的化学成分研究[J].中草药,2014,45(11): 1 521–1 525.
[34] 张甜甜,高莎莎,侯俊杰,等. 牛白藤的化学成分及其免疫抑制活性研究[J].中国中药杂志,2015,40(12): 2 357–2 362.
[35] Wang Y,Zhao M,Tang L,et al. Chemical constituents from Xiaoaiping injection[J]. Journal of Chinese Pharmaceutical Sciences,2014,23(4): 251–255.
[36] Danjuma N M,Chindo B A,Abduaguye I,et al. Psychopharmacological Psychopharmacological properties of saponins from Randia nlotica stem bark[J]. Pharmaceutical Biology,2014,52(1): 1–7.
[37] 马慧,宋少江,刘菲菲,等.高效液相色谱–串联质谱法同时测定辽东楤木不同部位中5种皂苷类成分的含量[J].色谱,2014(7): 762–766.
[38] 潘敏翔,吴久鸿,易杨华,等. 疣海星中一个新的多羟基甾醇皂苷[J].中国天然药物,2006,4(5): 344–346.
[39] 康俊霞,康永锋,韩华.半制备HPLC分离纯化海星皂苷novaeguinoside A[J].实验室研究与探索,2013,32(10): 17–20.
[40] Dighe N S,Patton S R,Dengale S S,et al. Synthetic and pharmacological profles of coumarins: A review[J]. Scholard Research Library,2010(2): 65–71.
[41] 李宝媛,战凯旋,周雨华,等. 沙蓬黄酮类和香豆素类化学成分的分离与鉴定[J].沈阳药科大学学报,2012,29(12):923–926.
[42] Kiyama R. Biological effects induced by estrogenic activity of lignans[J]. Trends in Food Science & Technology,2016,54: 186–196.
[43] 南泽东,赵明波,姜勇,等. 塔中栽培荒漠肉苁蓉中的木脂素类成分[J].中国中药杂志,2015,40(3): 463–468.
[44] Malik E M,Müller C E. Anthraquinones as pharmacological tools and drugs[J]. Medicinal Research Reviews,2016,36(4): 705–748.
[45] 李钧,曲中原,邹翔,等. 青龙衣中胡桃醌的分离与鉴定[J].哈尔滨商业大学学报:自然科学版,2011,27(5): 641–644.
Application of Preparative High Performance Liquid Chromatography in Separation of Natural Product
Wu Xi,Deng Qin,Xu Zhiyong,Cen Juren,Xu Jing
(Department of Materials Science and Engineering,Hainan University,Haikou 570228,China)
Preparation of high performance liquid chromatography (Prep-HPLC) was widely applied in the separation and purifcation of natural products. Research status of preparative high permormance liquid chromatography at home and abroad were summarized in respect of the classifcation and advances of prep-HPLC technique and practical application in natural products research. The development trend of it was put forward.
prep-high performance liquid chromatography; natural products; separation and purifcation
O657.7
:A
:1008–6145(2017)01–0113–05
10.3969/j.issn.1008–6145.2017.01.029
*教育部“新世纪优秀人才支持计划”项目(NCET-13-0760);自然科学基金地区基金项目(81660584);海南省科协青年科技人才学术创新计划项目(201509)
联系人:徐静;E-mail: happyjing3@163.com
2016–10–12
