棕榈花苞抗氧化成分提取及体外抗氧化活性研究
2017-02-15刘龙云吴彩娥李婷婷陈宗勇
刘龙云,吴彩娥,李婷婷,陈宗勇
(1.南京林业大学南方现代林业协同创新中心;2.南京林业大学林学院;3.南京林业大学轻工科学与工程学院,南京210037;4.贵州大自然科技有限公司,贵阳550000)
棕榈花苞抗氧化成分提取及体外抗氧化活性研究
刘龙云1,2,吴彩娥1,3*,李婷婷1,3,陈宗勇4
(1.南京林业大学南方现代林业协同创新中心;2.南京林业大学林学院;3.南京林业大学轻工科学与工程学院,南京210037;4.贵州大自然科技有限公司,贵阳550000)
为研究棕榈花苞中抗氧化成分的最佳提取工艺及体外抗氧化活性,在单因素试验的基础上,选取乙醇体积分数、液料比和提取时间为考察因素,以DPPH·自由基清除率和ABTS·+自由基阳离子清除率等抗氧化能力指标为衡量指标,采用Box-Behnken试验设计来优化提取工艺。在最佳提取工艺下得到提取物,测定其多酚和黄酮的含量,并以多项抗氧化指标综合评价其体外抗氧化能力。结果表明:当乙醇体积分数78%,液料比28∶1 (mL∶g),提取时间64 min,提取温度80℃时,棕榈花苞提取物DPPH·清除率为92.05%,ABTS·+清除率为63.82%,提取物中总酚含量4.72%,得率为15.08 mg/g;总黄酮含量3.63%,得率为11.67 mg/g。本试验条件下每100 g棕榈花苞(以干质量计)的体外抗氧化能力相当于2 990~6 262 mg Vc,棕榈花苞的体外抗氧化能力IC50为0.115~5.795 mg/mL,具备一定的抗氧化能力。
棕榈花苞;响应面;抗氧化;多酚;黄酮
棕榈(Trachycarpusfortunei(Hook.)H.Wendl.),棕榈科棕榈属,圆锥状花序叶腋生,花小,黄色[1],产于长江流域以南,是南方特有的经济树种和优美的观赏树种[2]。在南京地区的棕榈花期4—5月,而贵州的棕榈自10月起至第2年3月均有棕榈花序自棕榈树叶腋抽出。蓓蕾期的棕榈花序,基部具多数大型鞘状苞片,尚未开放的花苞淡黄色而细小,排列密集如鱼子状。幼嫩可食的棕榈花苞,是一种很好的菜果,营养丰富,并兼有降血压和清凉解暑作用[3]。现代药理研究表明,棕榈花蕾水提液、醇提液有兴奋子宫平滑肌、抑制肠平滑肌等作用[4-6]。
目前已有文献报道初出苞的棕榈花穗中黄酮类物质[7]和酚酸类物质[8]的提取工艺及其部分体外抗氧化活性。其中,花穗提取酚酸类物质的试验研究表明:其具有较强的体外抗氧化能力,清除DPPH·,·OH,以及络合Fe2+的IC50分别为 0.69,0.56和0.84 mg/mL[8]。但是,有关未出苞、适宜食用的幼嫩棕榈花苞中抗氧化成分的提取工艺以及抗氧化活性的研究均鲜见报道。因此,本试验采用响应面设计法优化棕榈花苞中抗氧化活性成分的提取工艺,并选用多项抗氧化指标评价其体外抗氧化活性,旨在为促进棕榈花苞的食用开发提供科学依据,为深入开发利用棕榈资源提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
试验材料:棕榈花苞,由贵州大自然科技有限公司提供,产自贵州贵阳生产基地,均为15 a左右树龄棕榈树,11月采摘,为适宜食用的淡黄色幼嫩花苞,去除苞片后经真空冷冻干燥、粉碎、过筛后密封保存(筛孔直径为0.180 mm)。
试验试剂:DPPH,日本东京化工工业;ABTS、菲洛嗪,阿拉丁工业有限公司;铁氰化钾、三氯乙酸,上海凌峰化学试剂有限公司;亚油酸,上海蓝季生物试剂有限公司;福林酚试剂、过硫酸钾、2-硫代巴比妥酸、菲啰啉,国药集团化学试剂有限公司;抗坏血酸、EDTA二钠,南京化学试剂有限公司。
1.2 仪器与设备
TU-1800PC型紫外可见分光光度计,美国优尼柯公司;ALPHA 1-2 LDplus真空冷冻干燥机,德国Christ公司;R-210旋转蒸发仪,瑞士Buchi公司;TG16-WS台式高速离心机,湖南湘仪实验室仪器开发有限公司;MDF-U32V立式超低温冰箱,日本三洋SANYO公司;DKS-12型电热恒温水浴锅,上海经济区海盐中新电器厂。
1.3 试验方法
1.3.1 响应面法优化提取工艺
以棕榈花苞干粉为试验材料,单因素试验采用热回流提取法进行提取,分析不同的提取条件对棕榈花苞抗氧化活性的影响。结果表明,温度对其影响并不显著,其他3项具有显著影响,得出最适提取条件分别为:乙醇体积分数75%;液料比(溶剂体积V∶样品质量m)25∶1(mL∶g);提取时间60 min;提取温度80℃。
在单因素试验基础上,选取乙醇体积分数(A)、液料比(B)和提取时间(C)为考察因素,提取温度选用80℃,以ABTS·+清除率和DPPH·清除率为衡量指标,采用Box-Behnken试验设计,得到表1所示的因素水平编码表。结合响应面分析法,进行回归方程拟合度检验和显著性检验,分析各试验因素对DPPH·清除率和ABTS·+清除率的影响及因素间的交互作用,优选出最佳提取工艺参数。

表1 响应面试验因素水平编码表
1.3.2 棕榈花苞体外抗氧化活性评价方法
将在最优工艺条件下提取得到的棕榈花苞提取物配制成不同浓度的溶液,采用多项抗氧化指标,进行抗氧化活性的研究及评价。以抗坏血酸或EDTA为对照,参考文献[9-15]的测定方法对棕榈花苞提取液分别进行清除DPPH·自由基能力、总抗氧化能力、总还原能力、羟基自由基清除能力、超氧阴离子自由基清除能力、抗脂质过氧化活性和Fe2+螯合能力的测定。
2 结果与分析
2.1 响应面优化提取工艺试验结果与分析
2.1.1 Box-Behnken试验设计方案及结果
根据单因素试验确定的试验因素及水平,将乙醇体积分数(A)、液料比(B)和提取时间(C)作为考察因素,以DPPH·自由基清除率和ABTS·+自由基清除率为响应值,采用Box-Behnken试验设计三因素三水平的响应面分析试验,试验设计及结果见表2。
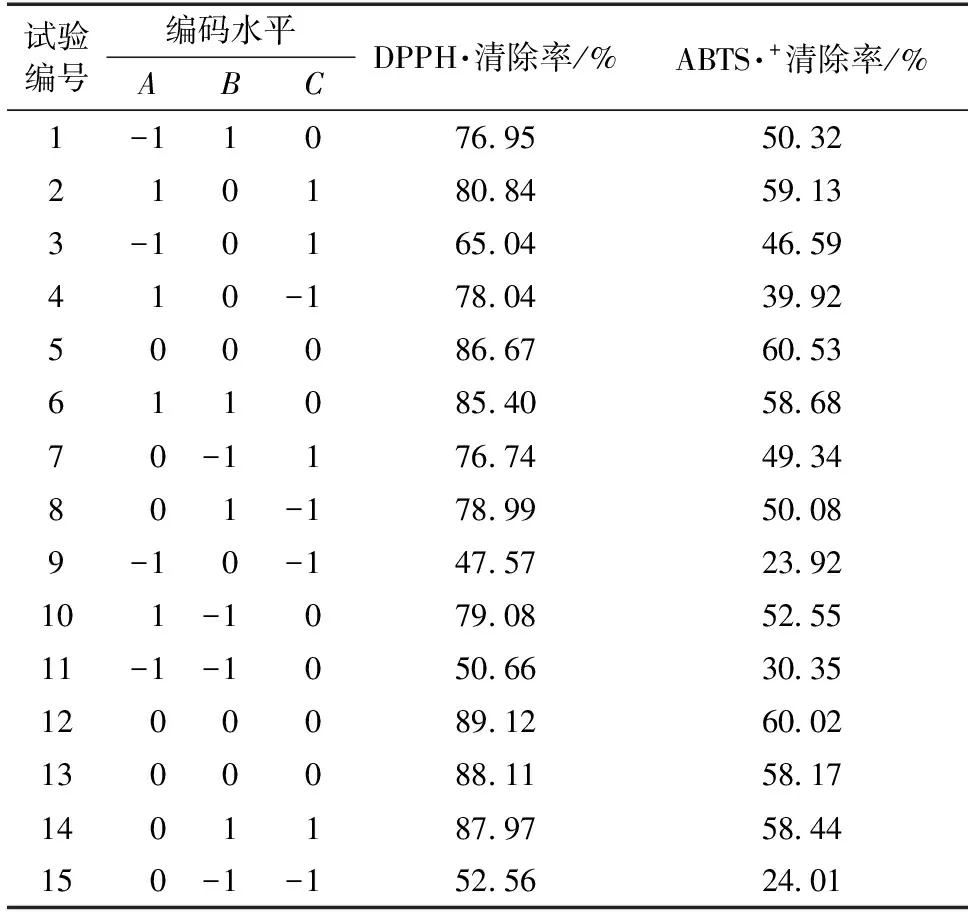
表2 响应面中心组合试验设计与结果
2.1.2 Box-Behnken试验结果方差分析
利用Design Expert 8.0软件,对表2试验设计方案多元回归拟合,得出响应值Y1(DPPH·清除率)对影响棕榈花苞抗氧化成分提取的关键因素(A、B、C)的二次多项回归模型,编码值的拟合方程为:
Y1=87.97+10.39A+8.78B+6.68C-4.99AB-3.67AC-3.80BC-10.57A2-4.38B2-9.53C2
由表3方差分析可知:模型的F=40.55,P=0.000 4,表明试验所采用的回归模型是极显著的。失拟项的F=7.70,P=0.117 2>0.05,无失拟因素存在。由分析结果来看,单一因素中,乙醇体积分数(A)对响应值Y1的影响最大,其P=0.000 1,影响极显著。液料比、提取时间均达到极显著水平。对响应值Y1的交互影响中,A和B、A和C、B和C的交互作用达到了显著水平,交互项按影响大小排列分为AB>BC>AC,说明各因素对棕榈花苞清除DPPH·自由基的能力并不是简单线性关系。
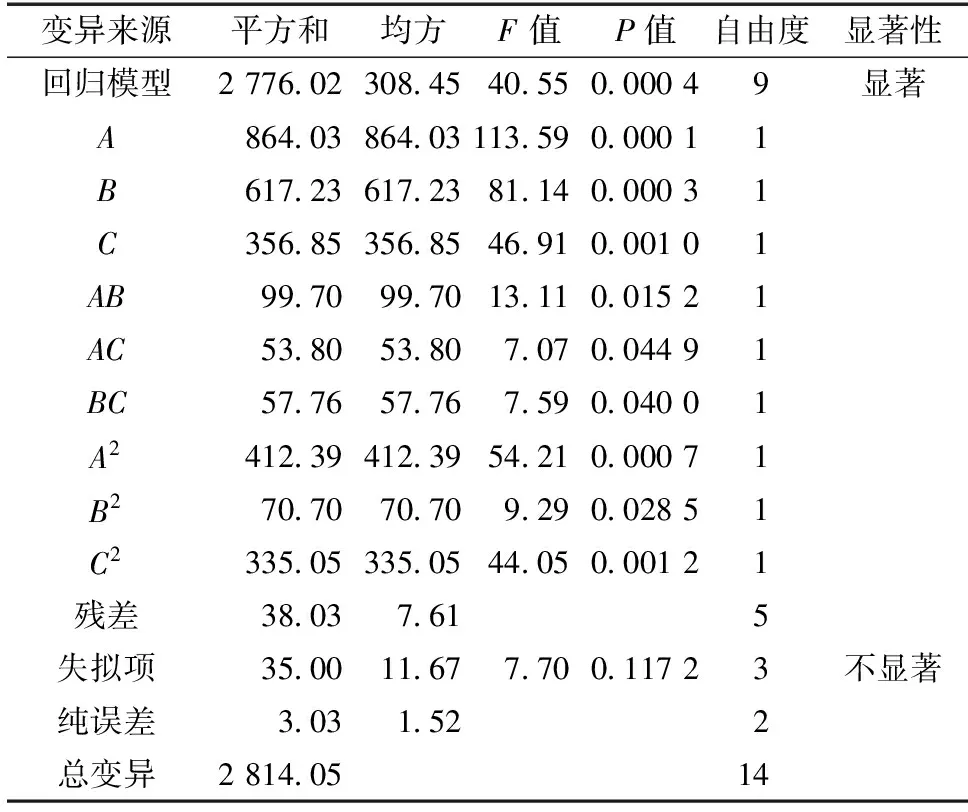
表3 DPPH·清除率回归模型方差分析
利用Design Expert 8.0软件,对表2试验设计方案多元回归拟合,得出响应值Y2(ABTS·+清除率)对影响棕榈花苞抗氧化成分提取的关键因素(A、B、C)的二次多项回归模型,编码值的拟合方程为:
Y2=59.57+7.39A+7.66B+9.45C-3.46AB-0.86AC-4.24BC-7.34A2-4.26B2-9.85C2
由表4方差分析可知:模型的F=57.29,P=0.000 2<0.001,表明试验所采用的回归模型是极显著的,可以用此模型进行统计分析。失拟项的F=4.15,P=0.200 4,说明使用该方程进行拟合的效果较好。由分析结果来看,单一因素中,提取时间(C)对响应值Y2的影响最大,P<0.000 1,影响极显著。乙醇体积分数、液料比均达到极显著水平。对响应值Y2的交互影响中,A和B、B和C的交互作用达到显著水平,而A和C的交互作用不显著,交互作用大小为BC>AB,说明各因素对棕榈花苞清除ABTS·+自由基的能力并不是简单线性关系。
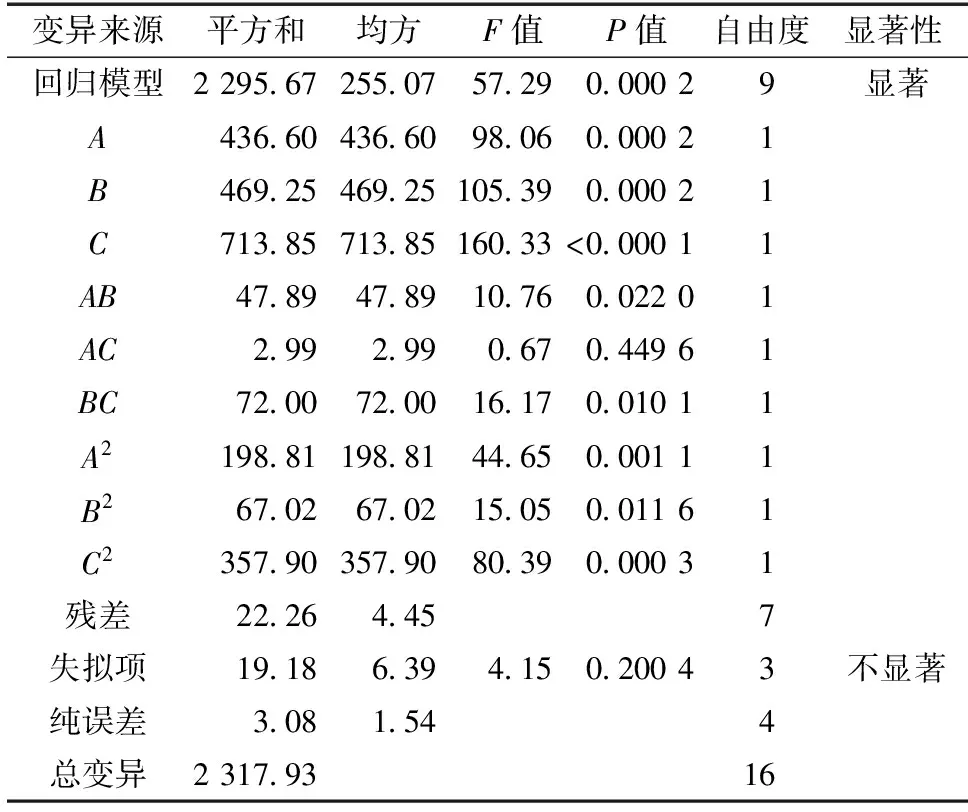
表4 ABTS·+清除率回归模型方差分析
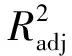
2.1.3 交互作用分析
由Design Expert 8.0软件分析交互作用得图1。从图1a可以看出,沿A因素(乙醇体积分数)向峰值移动,等高线密度大于沿B因素(液料比)移动的密度。这表明乙醇体积分数对DPPH·清除率影响的主效应大于液料比。从图1b可以看出,液料比对DPPH·清除率影响的主效应略大于提取时间。从图1c可以看出,乙醇体积分数对DPPH·清除率影响的主效应稍大于提取时间。由上可知,3个因素对DPPH·清除率的影响顺序为:乙醇体积分数>液料比>提取时间,这与方差分析结果一致。
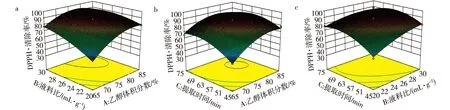
图1 各因素对DPPH·清除率影响的响应面图Fig. 1 The response surface map of the effects of various factors on DPPH· free radical clearance rate
由Design Expert 8.0软件分析交互作用得到图2。从图2a可以看出,乙醇体积分数对ABTS·+清除率影响的主效应与液料比近乎相同。从图2b可以看出,提取时间对ABTS·+清除率影响的主效应大于液料比。综上可知,3个因素对DPPH清除率的影响顺序为:提取时间>液料比>乙醇体积分数,这与方差分析的结果一致。
图2 各因素对ABTS·+清除率影响的响应面图Fig. 2 The response surface map of the effects of various factors on ABTS·+ free radical clearance rate
2.1.4 响应面优化及其抗氧化成分分析
运用Design Expert 8.0 软件,设置DPPH·和ABTS·+清除率达到极大值时,求解得到棕榈花苞抗氧化成分提取的理论最优条件为:乙醇浓度78.04%,液料比28.44∶1,提取时间63.63 min,在此条件下的DPPH·清除率的理论值为93.23%,ABTS·+清除率为64.61%。按照上述调整后的最佳提取工艺条件为:乙醇质量分数78%,液料比28∶1,提取时间64 min,提取温度为80℃。进行3次验证试验,得DPPH·清除率平均值为92.05%,ABTS·+清除率平均值为63.82%,与预测值的误差较小,且每组试验结果均处于表5可信度区间内。可见所得回归方程可以较好地拟合棕榈花苞中抗氧化成分的提取情况。
在最佳提取工艺下提取得到的棕榈花苞提取物,采用GB/T 8313—2008中的方法二测定其总酚含量为4.72%,得率为15.08 mg/g;采用NaNO2-Al(NO3)3-NaOH显色法[16-18]测定其总黄酮含量(质量分数)为3.63%,得率为11.67 mg/g。在此优化工艺下既得提取物的抗氧化能力高,抗氧化物质含量较高。

表5 可信度报告
2.2 棕榈花苞体外抗氧化能力综合评价
2.2.1 清除DPPH·自由基能力测定
经数据处理得到图3,棕榈花苞提取液在0~400 μg/mL范围内,清除DPPH·自由基的能力逐渐达到最高值93%左右,呈显著正相关关系。抗坏血酸对照组质量浓度高于25 μg/mL时,DPPH·清除率平稳在90%以上,明显高于相同浓度棕榈花苞提取液的清除率。当棕榈花苞提取液浓度增加至300 μg/mL时,对DPPH·自由基清除能力达到92.05%,与抗坏血酸对照组的清除能力达到同等水平。

图3 不同浓度棕榈花苞提取液对DPPH·清除率Fig. 3 DPPH· radical scavenging activities of palm bud extract at different concentrations
为了更准确地评价抗氧化活性,用IC50来表征抗氧化能力的大小,IC50值越低表明清除能力越高。另外抗氧化能力值(AEAC)代表棕榈花苞提取物清除DPPH·自由基的能力与对照Vc清除能力的比值。单位mg Vc/100g定义为每100 g样品相当于Vc的毫克数。
由回归方程可计算出AEAC当量值。IC50值分别由SPSS 22.0软件算出,结果见表6。每克棕榈花苞相当于30.85 mg的Vc(0.175 mmol Vc),IC50为114.5 μg/mL,虽然低于人工合成的常用抗氧化剂Vc,但与米书梅等[17]测定的常见水果、蔬菜(鲜重)的AEAC值17.41~85.29 mg相比,棕榈花苞仍然表现出较高的清除能力。

表6 棕榈花苞的DPPH·自由基清除能力
2.2.2 总抗氧化能力测定
通过Excel处理数据得到图4,棕榈花苞提取液质量浓度超过1 mg/mL后,对ABTS·+自由基阳离子的清除能力快速增加,逐渐达到最高99%左右,呈显著正相关关系。质量浓度高于6 mg/mL之后趋于稳定。抗坏血酸质量浓度在0~0.5 mg/mL范围内,清除率很快升高至95%以上,明显高于相同浓度的棕榈花苞提取物。质量浓度高于0.5 mg/mL之后,抗坏血酸的清除率稳定在98%左右。当棕榈花苞提取液质量浓度超过6 mg/mL时,与抗坏血酸的清除能力达到同等水平。
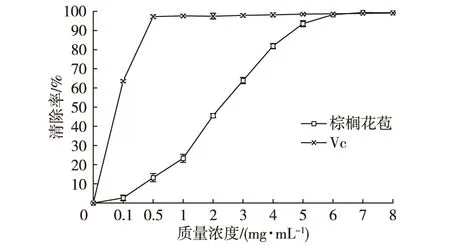
图4 不同浓度棕榈花苞提取液对ABTS·+清除率Fig. 4 ABTS·+ radical scavenging activities of palm bud extract at different concentrations
棕榈花苞提取液对ABTS·+自由基阳离子的清除能力测定结果见表7。由表7可以看出,每克棕榈花苞相当于29.901 mg 的Vc(或0.17 mmol的Vc),IC50值为1.747 mg/mL,这组数据仍然低于人工合成的常用抗氧化剂Vc,AEAC当量比DPPH·自由基清除能力略下降,但差异极小。与米淑梅等[19]测定的常见水果、蔬菜的总抗氧化能力AEAC值27.10~111.20 mg Vc/100g相比,棕榈花苞提取物对ABTS·+自由基阳离子的清除能力,即总抗氧化能力较强。
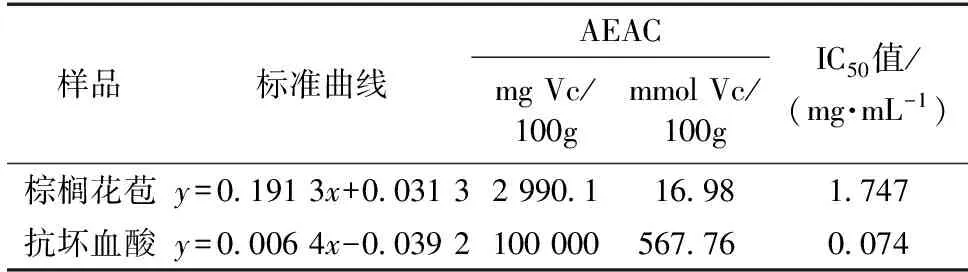
表7 棕榈花苞的ABTS·+自由基清除能力
2.2.3 羟基自由基清除能力测定
棕榈花苞提取液在0~3.5 mg/mL范围内,随着提取液浓度的增大,样品对·OH自由基的清除能力呈现一定的量效关系(图5)。棕榈花苞提取物对·OH自由基有一定的清除作用。在试验浓度范围内,棕榈花苞提取液对·OH自由基的清除能力均低于相同浓度的Vc。对照组抗坏血酸在0.5 mg/mL时,对·OH自由基的清除率已经接近80%。由于样品浓度过高时,吸光值反而超过未损伤管的吸光值。样品浓度过低,起不到清除作用。所以本试验要严格筛选合理的样品浓度来参与反应,才能测出清除能力强弱的变化规律。
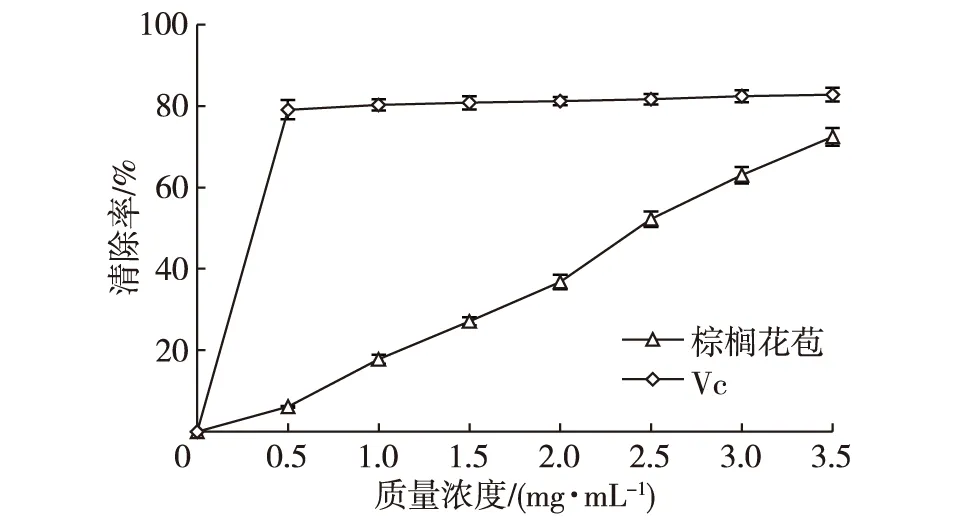
图5 不同浓度棕榈花苞提取液清除·OH自由基能力Fig. 5 Influence of palm bud extract concentration on ·OH scavenging activities
棕榈花苞提取液对·OH自由基的清除能力由表8可以看出,每克棕榈花苞相当于62.622 mg Vc(0.36 mmol Vc),IC50值为2.347 mg/mL,这组数据仍然低于人工合成的常用抗氧化剂Vc,但从AEAC当量来看抗氧化能力还是较高的。可见棕榈花苞提取物对·OH自由基的清除能力也很高。
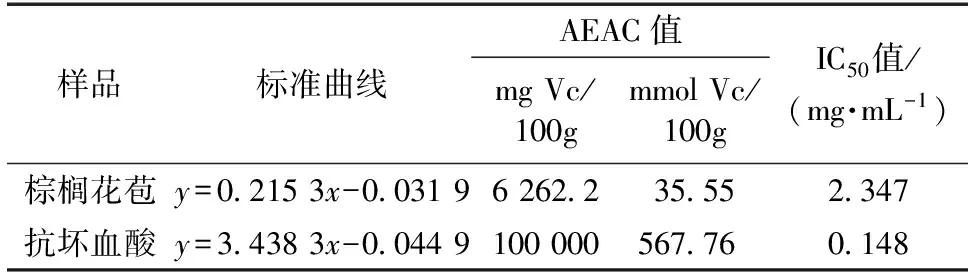
表8 棕榈花苞的·OH自由基清除能力
2.2.4 总还原能力测定(普鲁士蓝法)
棕榈花苞提取液在0~10 mg/mL范围内,样品管吸光值平缓的上升至1.8左右,普鲁士蓝生成量稳步增加,还原能力逐渐增强,呈显著正相关关系;达到15 mg/mL时,溶液吸光值接近2.5,已经接近分光光度计最大值(图6)。如果再增加棕榈花苞提取液浓度,虽然吸光值会变大,看似还原能力有所增强,实际上分光光度仪测量误差增大,而且可能所有的Fe3+早已被全部还原了,只是样品的吸光值在增加。这样就不能正确反映出真实的变化规律。所以试验中必须保证铁氰化钾足量,即Fe3+离子足量,又要控制样品浓度不能过高。
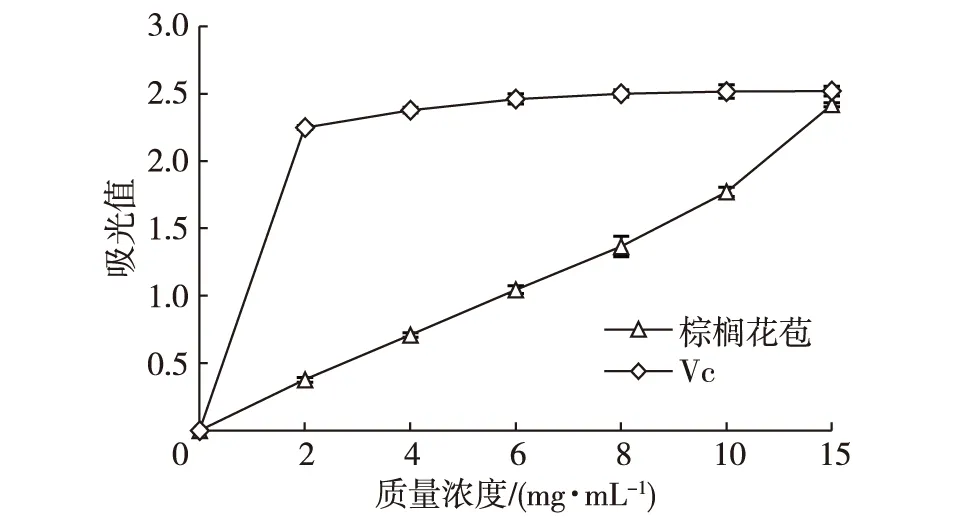
图6 不同浓度棕榈花苞提取液的还原能力Fig. 6 Reducing ability of palm bud extract at different concentrations
对照组抗坏血酸在2~15 mg/mL范围内,吸光值一直都维持在2.4左右。整体来看,棕榈花苞提取物的总还原能力弱于Vc。以吸光值1.0为参考量时,计算棕榈花苞的抗氧化能力AEAC为每克干质量的棕榈花苞相当于43.46 mg 抗坏血酸。由于普鲁士蓝法不是针对某一种自由基清除能力,而是样品总的还原能力,因此可用来反映样品总的抗氧化活性。
2.2.5 超氧阴离子自由基清除能力测定
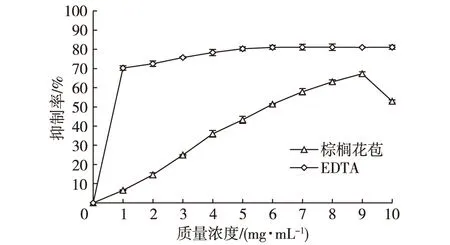
图7 不同浓度棕榈花苞提取液清除自由基能力Fig. 7 Influence of palm bud extract concentration on scavenging activities
2.2.6 抗脂质过氧化活性测定
棕榈花苞提取液质量浓度在0~9 mg/mL范围时,随着浓度的增加,脂质氧化抑制率几乎一直在升高,但是变化规律不一致。质量浓度在3~4 mg/mL之间时,抑制率显著增加,其他浓度时较为平缓。质量浓度超过9 mg/mL时,抑制能力反而减弱(图9)。可能是提取液浓度变高后,棕榈花苞中的某些物质与硫代巴比妥酸结合生成了其他化合物。而且并非所有的脂类氧化体系都有丙二醛产生。此外,此试验最好在pH=3.0左右的环境体系中反应。配制TBA溶液时,必须用NaOH溶液溶解,再由HCl溶液定容,那么既要保证溶解完全,又要控制TBA为酸性溶液,最终溶液的pH不好控制。试验过程中发现,pH对试验影响很大,pH高时,TBA溶液为淡粉色;pH低时,TBA溶液为淡黄色。pH过高,不能发生显色反应。pH低一点,显色反应变成橙黄色。控制合理的pH才能出现红色反应物。
在试验范围内,脂质氧化抑制率始终不高,可能与棕榈花苞中的抗氧化成分对脂质过氧化物的抑制能力较低有关。在质量浓度为9 mg/mL时达到的最高抑制率只有53%。
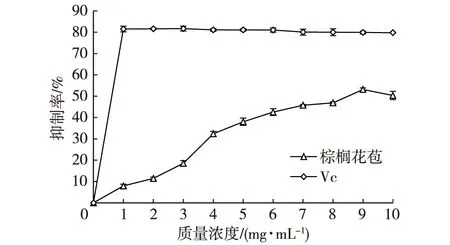
图8 不同浓度棕榈花苞提取液脂质氧化抑制率Fig. 8 Influence of palm bud extract concentrations on inhibition of lipid oxidation rate
2.2.7 Fe2+螯合能力测定
棕榈花苞提取液质量浓度在0~1.6 mg/mL范围时,随浓度的增加,对Fe2+的螯合能力不断增强,但是变化速率不太一致,线性规律稍差。当提取液质量浓度达到1.6 mg/mL以上,棕榈花苞对Fe2+的螯合能力几乎不再变化,螯合率达到80%以上(图9)。对照组抗坏血酸在此试验条件下,并无反应发生,故选用EDTA作为阳性对照组。当质量浓度0.5 mg/mL以上,EDTA对Fe2+的螯合率就已经达到90%左右,比棕榈花苞的螯合能力强。棕榈花苞对Fe2+的螯合率达到50%时的提取液浓度为0.147 mg/mL。
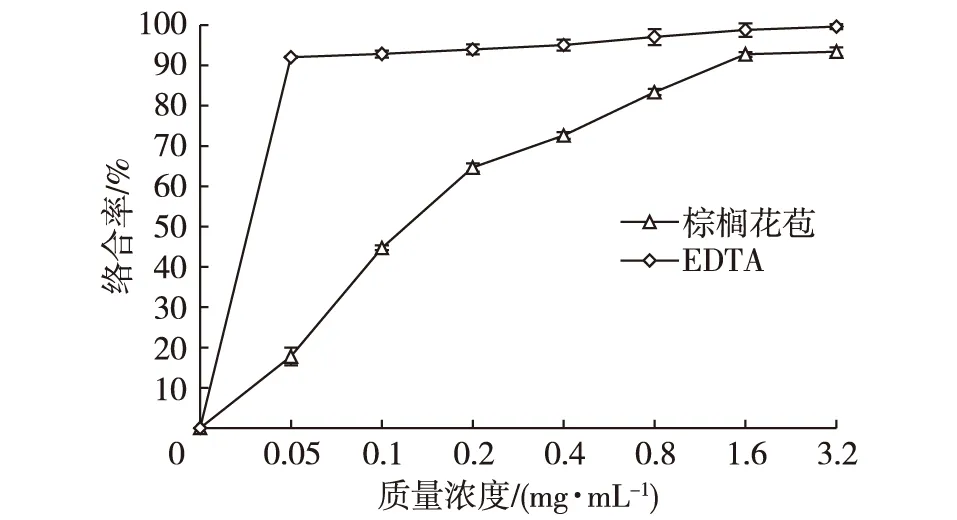
图9 不同浓度棕榈花苞提取液Fe2+螯合能力Fig. 9 Chelating ability of different concentrations of palm bud extract on Fe2+
3 结 论
本试验在单因素试验基础上,以液料比、提取时间及以乙醇体积分数为指标通过三因素三水平响应面设计对棕榈花苞的提取工艺条件进行优化,得到棕榈花苞抗氧化活性最高时的提取工艺参数:乙醇体积分数78%,液料比28∶1,提取时间64 min,提取温度80℃,此时总酚含量为4.72%,总黄酮含量为3.63%,均是其抗氧化功能的物质基础。
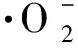
[1]中国科学院中国植物志编辑委员会. 中国植物志(十三卷第一分册)[M]. 北京: 北京科学出版社, 1991:12-13.
[2]何彦峰. 棕榈在甘肃天水的引种栽培[J]. 林业科技开发, 2001, 15(6):49-50. HE Y F. Introduction and cultivation of palm in Gansu[J]. China Forestry Science and Technology, 2001, 15(6):49-50.
[3]赵淑秋, 张延锋, 余小领. 棕苞、菠萝复合饮料的研制[J]. 饮料工业, 2012, 15(8):34-36. ZHAO S Q, ZHANG Y F, YU X L. The development of palm bud and pineapple compound beverage[J]. The Beverage Industry, 2012, 15(8):34-36.
[4]王清, 辛勤, 李军, 等. 棕榈花蕾提取液对大鼠回肠平滑肌收缩活动的影响[J]. 济宁医学院学报, 2005, 28(4):5-6. WANG Q, XIN Q, LI J, et al. Effects of palm bud extract on contractile activity of isolated ileum smooth muscle in rats[J]. Journal of Jining Medical College, 2005, 28(4):5-6.
[5]齐汝霞, 张鹏, 陈维刚, 等. 棕榈花蕾水醇提物对豚鼠离体心脏作用的试验研究[J]. 济宁医学院学报, 2010(4):235-237. QI R X, ZHANG P, CHEN W G, et al. A contrastive study on the effect of ethanol extract of kittul alabastrum on cavy isolated heart[J]. Journal of Jining Medical College, 2010(4):235-237.
[6]周晖, 陈小会, 章亮, 等. 棕榈子药效部位体内抗肿瘤研究[J]. 海峡药学, 2013, 25(4):269-271. ZHOU H, CHEN X H, ZHANG L, et al. Study on antitumor activity of effective fraction of fructus trachycarpiinvivo[J]. Strait Pharmaceutical Journal, 2013, 25(4):269-271.
[7]蔡定建, 徐晶, 梁晓鹏, 等. 棕笋中黄酮类物质的提取[J]. 贵州农业科学, 2009, 37(12):164-168. CAI D J, XU J, LIANG X P, et al. Extraction and determination of flavones fromTrachycarpusfortunei[J]. Guizhou Agricultural Sciences, 2009, 37(12):164-168.
[8]梁华伦, 江秀娟, 陈地灵, 等. 棕笋中酚酸类化合物的提取及抗氧化活性研究[J]. 食品研究与开发, 2014, 35(13):13-18. LIANG H L, JIANG X J, CHEN D L, et al. Extraction process and antioxidant capacity of phenolic acids from the buds ofTrachycarpusfortunei[J]. Food Research and Development, 2014, 35(13):13-18.
[9]张旋, 汤明礼, 张萍萍, 等. 黄连木叶的多酚提取和抗氧化研究[J]. 林业科技开发, 2012, 26(3):79-83. ZHANG X, TANG M L, ZHANG P P, et al. Extraction and antioxidant activity of polyphenols from the leaf ofPistaciachinensis[J]. China Forestry Science and Technology, 2012, 26(3):79-83.
[10]甘瑾. 玛咖(LepidiummeyeniiWalp.)抗氧化活性及活性物质基础的研究[D]. 北京:中国林业科学研究院, 2013. GAN J. Study on antioxidant activities and antioxidative substance basis of Maca (LepidiummeyeniiWalp.)[D]. Beijing: Chinese Academy of Forestry, 2013.
[11]TEDESEO I, RUSSO G L, NAZZARO F, et al. Antioxidant effect of red wine anthocyanins in normal and catalase-inactive human erythrocytes[J]. The Joumal of Nutritional Biochernistry, 2001, 12(9):505-511.
[12]金鸣, 蔡亚欣, 李金荣, 等. 邻二氮菲-Fe2+氧化法检测H2O2Fe2+产生的羟自由基[J]. 生物化学与生物物理进展, 1996, 1(6):24-27. JIN M, CAI Y X, LI J R, et al. 1, 10-phenanthroline-Fe2+oxidative assay of hydroxyl radical produced by H2O2/Fe2+[J]. Progress in Biochemistry and Biophysics, 1996, 1(6):24-27.
[13]许雅娟, 赵艳景, 胡虹. 邻苯三酚自氧化法测定超氧化物歧化酶活性的研究[J]. 西南民族大学学报(自然科学版), 2006, 32(6):1207-1210. XU Y J, ZHAO Y J, HU H. Study on the activity of superoxide dismutase by the method of self oxidation of three phenol[J]. Journal of Southwest University for Nationalities (Natural Science Edition), 2006, 32(6):1207-1210.
[14]GABRIELSKA J, OSZMIANSKI J. Antioxidant activity of anthocyanin glycoside derivatives evaluated by the inhibition of liposome oxidation[J]. Zeitschrift Fuer Naturforschung C, 2005, 60(5/6):399-400.
[15]贾韶千. 银杏抗氧化肽的制备、结构鉴定及活性研究[D]. 南京:南京林业大学, 2011. JIA S Q. Purification and activity identification of Ginkgo antioxidant peptide[D]. Nanjing:Nanjing Forestry University, 2011.
[16]张汇慧, 吴彩娥, 范龚健, 等. 刺梨黄酮的精制及其抗氧化活性比较[J]. 南京林业大学学报(自然科学版), 2015, 39(3):101-105. ZHANG H H, WU C E, FAN G J, et al. Refining and antioxidant activity of flavonoids fromRosaroxburghiiTratt.[J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2015, 39(3):101-105.
[17]牛鹏飞, 仇农学, 杜寅. 苹果渣中不同极性多酚的分离及体外抗氧化活性研究[J]. 农业工程学报, 2008,24(3):238-242. NIU P F, QIU N X, DU Y. The separation of different polarity polyphenols in apple residue and antioxidant activityinvitrostudies[J]. Transactions of the Chinese Society of Agricultural Engineering, 2008, 24(3): 238-242.
[18]张明. 几种体外抗氧化检测方法的评价研究[D]. 西安:陕西师范大学, 2010. ZHANG M. Study on the evaluation of severalinvitroantioxidant measuring methods[D]. Xi’an: Shaanxi Normal University, 2010.
[19]米书梅, 阮征, 温艳梅, 等. 几种常见果蔬抗氧化活性与多酚和维生素C的关系[J]. 食品工业科技, 2013, 34(1):133-136. MI S M, RUAN Z, WEN Y M, et al. Study on the antioxidant activity of several common vegetables and fruits and the correlation between the content of pdyphenols and VCand the antioxidant activity[J]. Science and Technology of Food Industry, 2013, 34(1):133-136.
Extraction of antioxidant components in palm bud and antioxidative activityinvitro
LIU Longyun1,2, WU Cai’e1,3*, LI Tingting1,3, CHEN Zongyong4
(1.Co-InnovationCenterforSustainableForestryinSouthernChina,NanjingForestryUniversity;2.CollegeofForestry,NanjingForestryUniversity;3.CollegeofLightIndustryScienceandEngineering,NanjingForestryUniversity,Nanjing210037,China;4.GuizhouNatureTechnologyCo.Ltd.,Guiyang550000,China)
In order to explore the optimal extraction process of antioxidant components in palm buds and the antioxidant activity of palm budsinvitro, the freeze-dried palm bud was used as test material, and the effects of extraction condition on the antioxidant activity of palm bud extracted by heat reflux was analyzed. Based on the results of single factor experiment, it was found that the effect of extraction temperature on the antioxidant activity of the extracts was not significant, and that the other three extraction conditions had significant effect on the extraction efficiency. The optimal extraction scheme of palm bud antioxidant components was designed by Box-Behnken test. The effects of the volume fraction of ethanol, liquid-to-solid ratio and extraction time on antioxidant activity of palm buds were studied, and the interaction between extraction conditions was considered, with DPPH·free radical scavenging rate and ABTS·+radical scavenging rate as the index, to optimize the extraction process. Under the optimum extraction condition, the contents of polyphenols and flavonoids in the extracts of palm buds were determined and antioxidant capacity of the extractsinvitrowas evaluated by a number of antioxidant indexes. The results showed that when the volume fraction of ethanol was 78%, solid-to-liquid ratio was 28∶1 (mL∶g), and the extraction was carried out at 80℃ for 64 min, the DPPH·clearance rate of palm bud extracts was 92.05%; the ABTS·+clearance rate was 63.82%; the total phenol content in the extract was 4.72%; with the yield of 15.08 mg/g; the total flavonoids content 3.63% with the yield of 11.67 mg/g. Under this experimental condition, antioxidant capacityinvitroof 100 g palm bud (in dry weight) was equivalent to 2 990-6 262 mg of Vc. The IC50of palm budinvitroantioxidant capacity was 0.115-5.795 mg/mL. Palm bud exhibits certain antioxidant capacity.
palm bud; response surface; antioxidation; polyphenols; flavonoids
2016-06-12
2016-11-05
江苏省科技支撑计划重点研发项目(BE2015315);江苏省自然科学基金项目(BK20150883)。
刘龙云,女,研究方向为森林资源加工与利用。通信作者:吴彩娥,女,教授。E-mail:wucaie@njfu.edu.cn
TQ35
A
2096-1359(2017)01-0070-08
