超高效液相色谱-四极杆飞行时间质谱分析不同加工何首乌中差异化学成分
2017-02-14罗益远刘娟秀刘训红王胜男华愉教兰才武邢清清
罗益远,刘娟秀,刘训红*,王胜男,华愉教,兰才武,邢清清
(1.南京中医药大学 药学院,江苏 南京 210023;2.贵州昌昊中药发展有限公司 研发部,贵州 凯里 556000)
超高效液相色谱-四极杆飞行时间质谱分析不同加工何首乌中差异化学成分
罗益远1,刘娟秀1,刘训红1*,王胜男1,华愉教1,兰才武2,邢清清1
(1.南京中医药大学 药学院,江苏 南京 210023;2.贵州昌昊中药发展有限公司 研发部,贵州 凯里 556000)
建立了超高效液相色谱-四极杆飞行时间质谱(UPLC-QTOF-MS)结合多元统计分析技术对不同加工何首乌中化学成分差异的分析方法。何首乌样品采用甲醇在室温下超声提取后,采用UPLC-QTOF-MS进行分析,对采集的图谱通过峰匹配、峰对齐、滤噪处理等进行特征峰提取,然后用主成分分析(PCA)和偏最小二乘法-判别分析(PLS-DA)对数据进行分析。结果显示,不同加工何首乌样品间的化学组成存在显著性差异;根据一级质谱精确质荷比和二级质谱碎片信息,结合软件数据库搜索及相关文献进行成分鉴定,初步筛选并鉴定出33种不同加工何首乌间差异显著的化学成分,其中15种为共有差异化学成分,并呈现出不同的变化规律。研究结果可为揭示不同加工方法对何首乌代谢产物差异性的影响规律提供依据。
何首乌;超高效液相色谱-串联四极杆飞行时间质谱(UPLC-QTOF-MS);加工方法;差异化学成分
何首乌为大宗常用中药材,系蓼科植物何首乌PolygonummultiflorumThunb.的干燥块根,具有消痈、解毒、截疟、润肠通便的功效,主要用于疮痈、瘰疬、风疹瘙痒、久疟体虚、肠燥便秘[1]。现代研究表明,何首乌具有抗衰老、增强免疫力、抗肿瘤、保肝、止痛抗菌等作用[2-3]。药材产地加工是药材生产与品质形成的重要环节,由于何首乌产地加工方法和条件不一,无规范化的技术指南,存在一定的随意性,造成何首乌有效成分的变化,药材质量参差不齐[4],难以实现商品药材标准化及保证其临床使用有效性。如何筛选适宜的加工方法已成为何首乌生产过程中的重要问题。目前对何首乌药材加工方法及其质量的评价研究,主要集中在二苯乙烯苷类、蒽醌类成分的分析,多以单一或单类成分的含量或动态变化为考察指标[5-7],尚少见对不同加工何首乌化学成分的整体变化或显著差异化学成分的研究报道。
植物代谢组学技术是对植物提取物中代谢物进行高通量、无偏差全面分析的技术,特别适合于中药中多组分复杂体系的分析[8-9],使中药研究更符合我国医学的整体观念。相对于传统的液相分离方法,超高效液相色谱(UPLC)对代谢物的检测更为简便、快速且效率更高, 除了对代谢物的分离检测外,未知代谢物的结构鉴定也是UPLC-MS 的又一特点[10-13]。本文在前期研究基础上[14-19],借鉴植物代谢组学的研究思路和方法,采用超高效液相色谱-四极杆飞行时间质谱(UPLC-QTOF-MS)技术分析了不同加工何首乌化学成分的差异性,并通过多元统计分析找出差异显著的化学成分及其变化规律,旨在为揭示不同加工方法对何首乌代谢产物的影响规律以及探讨何首乌药材的品质形成机制提供基础资料。
1 实验部分
1.1 仪器与试药
AquityTMUPLC超高效液相色谱仪(美国Waters公司);Triple TOFTM5600 System- MS/MS电喷雾飞行时间高分辩质谱仪、Peakview 1.2数据处理工作站(美国AB Sciex公司);SIMCA-P 13.0数据处理软件(瑞士Umetrics公司);Anke TGL-16B离心机(上海安亭科学仪器厂);BSA224S电子天平(德国赛多利斯公司);KQ-500B型超声波清洗器(昆山市超声仪器有限公司,超声功率500 W,40 kHz)。甲醇(色谱纯,德国Merck公司),用于色谱流动相配制;甲酸(色谱纯,德国Merck公司);甲醇(化学纯,南京化学试剂有限公司,批号:081110865),用于供试品溶液制备;实验用水为超纯水(由Millipore纯水器制备)。
何首乌样品为2013年10月采自贵州省赫章县平山乡中山村栽培基地(2年生植株),洗净,分别进行晒干和40~80 ℃烘干不同加工处理。所有样品均经南京中医药大学刘训红教授鉴定为何首乌PolygonummultiflorumThunb.的干燥块根。留样凭证保存于南京中医药大学中药鉴定实验室。
1.2 供试品溶液制备
取不同加工何首乌样品,粉碎,过80目筛。精密称取干燥恒重的样品粉末1.0 g,置于100 mL具塞锥形瓶中,加入25 mL甲醇,称重,室温下超声提取45 min后取出,放冷以甲醇补足失重,静置冷却,4 ℃保存,12 000 r/min离心10 min,取出上清液过0.22 μm的微孔滤膜,即得。
1.3 实验条件
1.3.1 色谱条件Agilent ZORBAX SB-C18色谱柱(250 mm×4.6 mm×5 μm);流动相:甲醇(A)- 0.1%甲酸的水(B);梯度洗脱程序:0~3 min,20%~35% A;3~10 min,35%~45% A;10~15 min,45%~60% A;15~20 min,60%~80% A;20~30 min,80%~100% A。流速1.0 mL/min;柱温30 ℃;进样量10 μL。
1.3.2 质谱条件电喷雾离子源(ESI)负离子模式;质量扫描范围m/z50~1 000;喷雾电压5.0 kV;气帘气30 L/min;雾化气55 L/min;辅助气55 L/min;离子源温度500 ℃;碰撞室射出电压(CXP)9 V;去簇电压(DP)100 V。
1.4 统计分析
将原始质谱数据和色谱图导入Peakview 1.2数据处理工作站进行峰匹配、峰对齐、滤噪处理等,结果保存导入SIMCA-P 13.0进行分析。采用主成分分析(PCA),初步观察各样品的聚集情况,直观地表达不同加工何首乌的化学组成差异;随后以偏最小二乘判别分析(PLS-DA)分别对各样品进行分类,其中R2X和R2Y越接近1,表示模型越稳定,Q2>0.5表示预测率高。根据PLS-DA模型得到的变量权重值(VIP>1)找到潜在的差异化学成分。采用t检验,验证多维统计中找到的差异化学成分是否在单维统计中具有显著性差异,其中P<0.05表示有显著性差异。

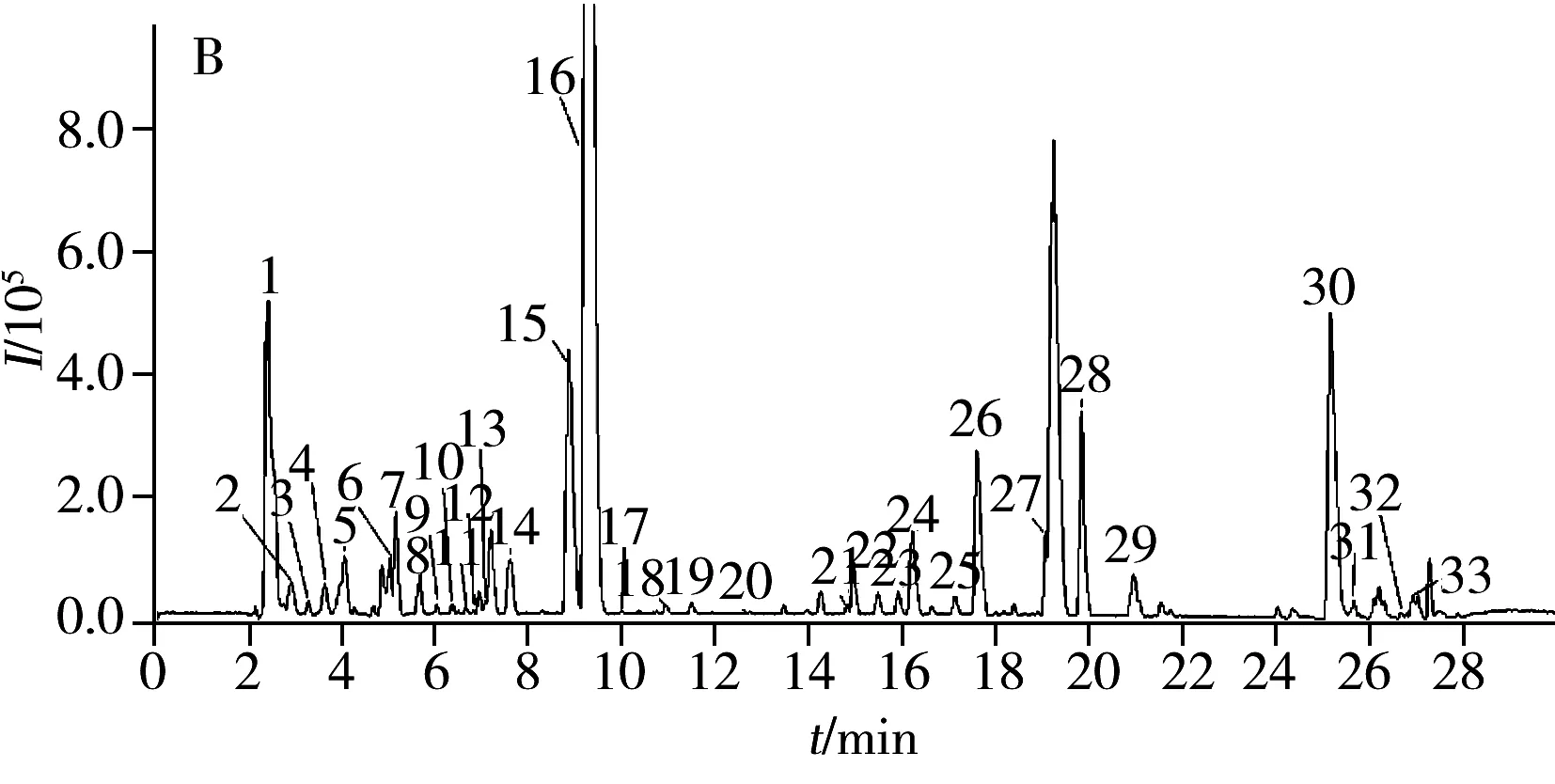

图1 不同加工何首乌样品的提取离子流(BPI)色谱图Fig.1 UPLC-QTOF-MS base peak intensity(BPI) chromatogram of Polygoni Multifori Radix processed by different methodsA.sun drying;B.40 ℃ drying;C.70 ℃ drying;the number denoted was the same as that in Table 1
1.5 差异化学成分的鉴定
通过一级质谱确定精确相对分子质量,二级质谱获得裂解信息,结合HMDB(http://www.hmdb.ca
/)和METLIN(http://metlin.Scripps.edu /)数据库搜索及已报道文献推测化合物的结构式信息。差异成分的量以各样品对应的峰面积表示,通过对不同加工何首乌样品间同一物质峰面积的平均值和标准差进行计算,得到差异化学成分在不同加工样品间的相对含量。
2 结果与讨论
2.1 色谱条件的优化
流动相的选择分别考察了甲醇-水、乙腈-水、甲醇-0.1%甲酸水、乙腈-0.1%甲酸水及梯度洗脱条件下对样品中各峰分离度的影响,结果发现,采用甲醇-0.1%甲酸水溶液梯度洗脱时,各峰的峰形较好且有良好的分离效果。根据设定的色谱-质谱条件,取不同加工何首乌样品(晒干品、 40 ℃烘干品、 50 ℃烘干品、60 ℃烘干品、70 ℃烘干品和80 ℃烘干品)供试品溶液进样分析。图1为不同加工(晒干,40 ℃烘干,70 ℃烘干)下何首乌样品在负离子模式下的UPLC-Triple TOF-MS/MS基峰强度离子流(BPI)色谱图。
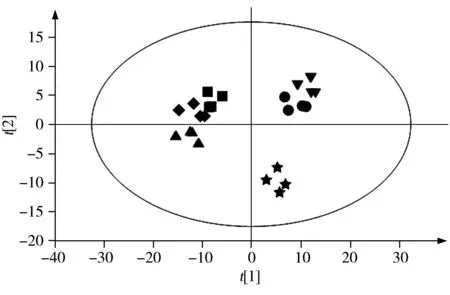
图2 不同加工何首乌在负离子模式下的PCA得分图Fig.2 PCA plot of Polygoni Multifori Radix processed by different methods in negative ion modesun drying;▼40 ℃ drying;●50 ℃ drying;■60 ℃ drying;◆70 ℃ drying;▲80 ℃ drying
2.2 样品处理方法的优化
供试品溶液制备中分别考察了甲醇、70%甲醇、50%甲醇3种溶剂,超声提取后发现以甲醇为溶剂的色谱峰峰形优于其它两种溶剂。并考察了超声提取时间(15,30,45,60 min)的影响,结果表明超声提取45 min时的相对峰面积明显较大,因此最终选择以甲醇溶液超声提取45 min。
2.3 PCA分析
采用PCA对6种加工何首乌样品进行降维分析。图2为6种不同加工何首乌PCA分析的散点图(t[1]:58.1%;t[2]:17.6%)。从图2中可以看出,不同加工何首乌的样品在PCA轴上呈逐步变化的趋势,不同加工何首乌样品的分类结果较为理想,说明6种不同加工的何首乌样品的化学成分存在明显差异。晒干品和烘干品何首乌的距离较远,说明晒干品和烘干品何首乌中的化学成分差异明显。40 ℃烘干和50 ℃烘干的何首乌样品距离较近,60 ℃烘干、70 ℃烘干和80 ℃烘干的何首乌样品相距也较近,说明40 ℃烘干与50 ℃烘干的何首乌样品化学成分差异不明显,60 ℃烘干、70 ℃烘干和80 ℃烘干的何首乌样品化学成分差异不明显,但与晒干品相比,化学成分均有显著差异。
2.4 PLS-DA分析
首先对晒干组何首乌样品与低温烘干组(40 ℃烘干、50 ℃烘干)何首乌样品进行了PLS-DA分析(图3A)。两组加工何首乌样品沿着PC1轴明显分开,模型验证结果(R2Y=0.996,Q2=0.985)显示模型可靠,与无监督模式的主成分分析(PCA)相比,两组加工何首乌样品得到更大程度的分离,且有助于寻找差异的化学成分。VIP的得分图(图3B)和有效对应的柱状载荷图(图3C)显示,对两组分类贡献较大的差异性成分(VIP>1)共有126个特征峰。

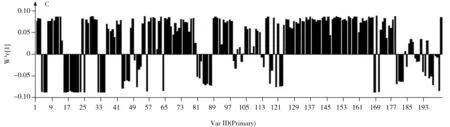
图3 晒干组(a)和低温烘干组(b)的何首乌样品的PLS-DA得分图(A)、VIP得分图(B)和柱状载荷图(C)
对晒干组和高温烘干组(60 ℃烘干、70 ℃烘干和80 ℃烘干)的何首乌样品进行PLS-DA分析,两组加工何首乌样品在其得分图中可以明显区分(图4A)。模型验证结果显示其有效可靠(R2Y=0.998,Q2=0.992)。两种加工何首乌样品的VIP得分图(图4B)和柱状载荷图(图4C)显示,VIP>1的共有118个特征峰。


图4 晒干组(a)和高温烘干组(c)的何首乌样品的PLS-DA得分图(A)、VIP得分图(B)和柱状载荷图(C)
最后对低温烘干组(40 ℃烘干、50 ℃烘干)和高温烘干组(60 ℃烘干、70 ℃烘干和80 ℃烘干)的何首乌样品进行PLS-DA分析,在得分图中两种加工的样品可以明显分开(图5A)。模型验证结果(R2Y=0.997,Q2=0.990)显示其有效可靠。同样对其VIP得分图(图5B)和柱状载荷图(图5C)进行考察,VIP>1的共有124个特征峰。

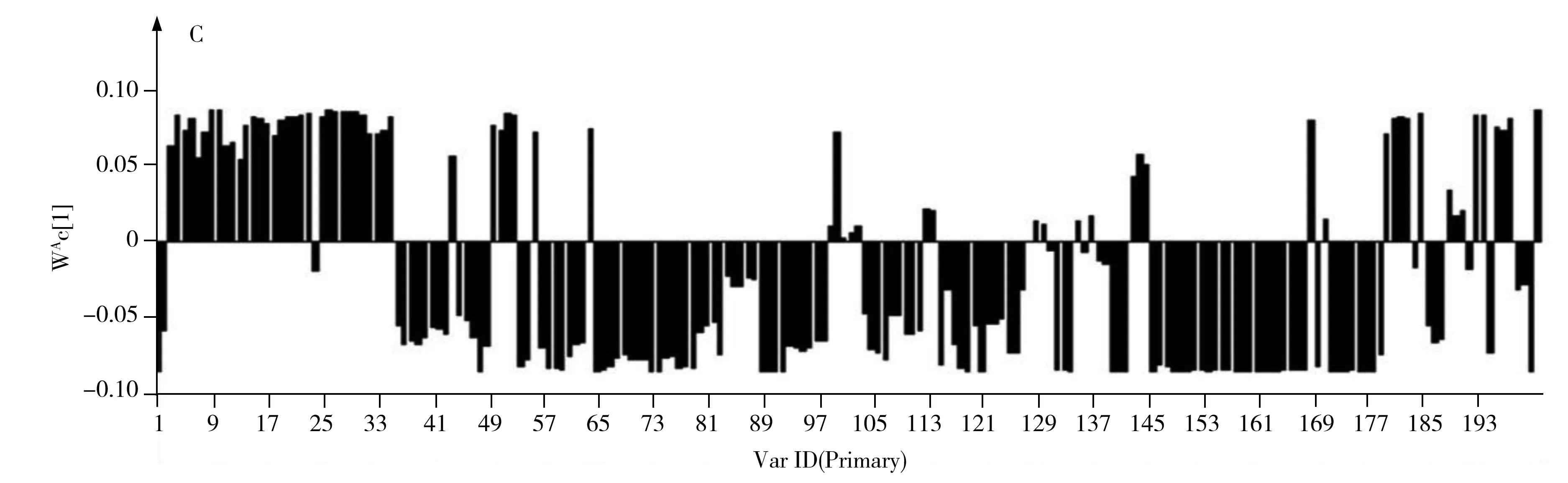
图5 低温烘干组(b)和高温烘干组(c)的何首乌样品的PLS-DA得分图(A)、VIP得分图(B)和柱状载荷图(C)
2.5 差异化学成分鉴定
通过HMDB和METLIN数据库及相关文献[20-27]搜索差异化学成分的精准质荷比,对VIP>1且P<0.05的差异化学成分进行结构分析(结果见表1),初步鉴定出33个化学成分。其中不同加工何首乌样品中共有15个差异化学成分,分别为:3,5-二羟苯基-1-O-β-D-(6″-O-没食子酰)-吡喃葡萄糖苷、没食子酸、原始车菊素B-7-3-O没食子酰、儿茶素、表没食子儿茶素没食子酸酯、表儿茶素没食子酸酯、2-甲基-5-羧甲基-7-羟基对氧萘酮、二苯乙烯苷、大黄素-1-O-β-D-葡萄糖苷、决明柯酮-O-β-D-葡萄糖苷、决明柯酮-O-乙酰基-葡萄糖苷、大黄素-8-O-(6′-O-丙二酰)-β-D-葡萄糖苷、大黄素甲醚-8-O-β-D-吡喃葡萄糖苷、大黄素和大黄素甲醚。

表1 不同加工何首乌中差异显著化学成分的鉴定

(续表1)
2.6 差异化学成分的相对含量变化
15个共有差异成分中,3,5-二羟苯基-1-O-β-D-(6″-O-没食子酰)-吡喃葡萄糖苷、决明柯酮-O-乙酰基-葡萄糖苷和大黄素-8-O-(6′-O-丙二酰)-β-D-葡萄糖苷的相对含量在80 ℃烘干何首乌样品中较高;没食子酸、儿茶素、表儿茶素没食子酸酯、2-甲基-5-羧甲基-7-羟基对氧萘酮、大黄素-1-O-β-D-葡萄糖苷、决明柯酮-O-β-D-葡萄糖苷和大黄素甲醚-8-O-β-D-吡喃葡萄糖苷的相对含量在晒干何首乌样品中较高;原始车菊素B-7-3-O-没食子酰和表没食子儿茶素没食子酸酯的相对含量在40 ℃烘干何首乌样品中较高;二苯乙烯苷的相对含量在50 ℃烘干何首乌样品中较高;大黄素和大黄素甲醚在60 ℃烘干何首乌样品中较高。
3 结 论
本文建立了UPLC-QTOF-MS结合多元统计分析技术的不同加工何首乌化学成分的分析方法,找出差异显著的化学成分及其变化规律。实验结果显示,不同加工何首乌样品间的化学组成存在显著差异;初步筛选并鉴定出33种差异显著的化学成分,其中共有差异化学成分15种,并呈现不同的变化规律。根据不同加工方法何首乌中的差异化学成分分析结果,结合当地的实际加工方法,建议何首乌产地初加工以晒干为宜。本研究结果为揭示加工对何首乌代谢产物的影响规律、优选其适宜加工方法及探讨何首乌药材的品质形成机制提供了依据。
[1] Pharmacopoeia Commission of People's Republic of China.Pharmacopoeia of People's Republic of China.Part 1.Beijing:China Medical Science Press(中国国家药典委员会.中华人民共和国药典.第一部.北京:中国医药科技出版社),2015:175-177.
[2] Lin L F,Ni Boran,Lin H M,Zhang M,Li X C,Yin X B,Qu C H,Ni J.J.Ethnopharmacology,2015,159(1):158-183.
[3] Yang H L,Ge Z Z,Sun Z X.J.Chin.Med.Mater.(杨红莉,葛珍珍,孙震晓.中药材),2013,36(10):1713-1717.[4] Chen H.J.Chin.Med.Mater.(陈虹.中药材),1990,13(9):27-28.
[5] Xu L Y,Dong Q,Hu F Z.J.Chin.Pharm.Sci.,2009,18(4):358-361.
[6] Zhu Z W,Li J,Gao X M.J.Pharm.Biomed.Anal.,2012,62:162-166.
[7] Li S G,Chen L L,Huang X J.J.AsianNat.Prod.Res.,2013,15(11):1145-1151.
[8] Li C Y,Wang Z,Wang P,Meng X L.Chin.Tradit.Herb.Drug.(李春雨,王张,王平,孟宪丽.中草药),2013,44(7):918-922.
[9] Hou Y,Ma Y,Zou L S,Liu X,Liu X H,Luo Y Y,Liu J X,Lan C W,Yuan J D.J.Chin.MassSpectrom.Soc.(侯娅,马阳,邹立思,刘晓,刘训红,罗益远,刘娟秀,兰才武,袁济端.质谱学报),2015,36(4):359-366.[10] Zhou Y Z,Lin Y,Liu X H,Ju W Z.J.Chromatogr.Sci.,2014,89:1-6.
[11] Ma X L,Meng L,Li X X,Li L L,Wang Y,Mao X M.J.Instrum.Anal.(马晓丽,孟磊,李新霞,李琳琳,王烨,毛新民.分析测试学报),2014,33(6):621-627.
[12] Chen Y H,Zhang R P,Song Y M,Dong L J,Zhan Q M,Abulizi Z.Chin.J.Anal.Chem.(陈艳华,张瑞萍,宋咏梅,董立佳,詹启敏,再帕尔·阿不力孜.分析化学),2011,39(2):173-177.
[13] Li F T,Duan J A,Qian A W,Guo S,Ding Y H,Liu X H,Qian Y F,Peng Y R,Ren Y J,Chen Y.J.Pharm.Biomed.Anal.,2013,83:10-18.
[14] Luo Y Y,Liu J X,Liu X H,Lan C W,Hou Y,Ma Y,Wang S N,Cai B C.Chin.Tradit.Herb.Drug(罗益远,刘娟秀,刘训红,兰才武,侯娅,马阳,王胜男,蔡宝昌.中草药),2016,47(2):318-323.
[15] Luo Y Y,Liu J X,Liu X H,Lan C W,Hou Y,Ma Y,Xu L.Chin.Pharm.Anal.(罗益远,刘娟秀,刘训红,兰才武,侯娅,马阳,徐力.药物分析杂志),2015,35(8):1474-1483.
[16] Luo Y Y,Liu J X,Liu X H,Lan C W,Wang S N,Hua Y J,Wang X.J.Chin.Med.Mater.(罗益远,刘娟秀,刘训红,兰才武,王胜男,华愉教,王肖.中药材),2015,38(10):2113-2116.
[17] Luo Y Y,Liu J X,Hou Y,Liu X H,Lan C W,Ma Y,Wang S N.Chin.Tradit.Herb.Drug(罗益远,刘娟秀,侯娅,刘训红,兰才武,马阳,王胜男.中草药),2015,46(7):1056-1064.
[18] Luo Y Y,Liu J X,Liu X H,Lan C W,Hou Y,Ma Y,Xu L.J.Instrum.Anal.(罗益远,刘娟秀,刘训红,兰才武,侯娅,马阳,徐力.分析测试学报),2015,34(5):519-524.
[19] Luo Y Y,Liu J X,Liu T,Liu X H,Lan C W,Wang S N,Hua Y J.J.Chin.MassSpectrom.Soc.(罗益远,刘娟秀,刘廷,刘训红,兰才武,王胜男,华愉教.质谱学报),2016,37(4):327-335.
[20] Pan Z R,Liang H L,Liang C H,Xu W.Chin.J.Chromatogr.(潘智然,梁海龙,梁朝辉,徐文.色谱),2015,33(1):22-28.
[21] Xu W,Zhang J,Huang Z H,Qiu X H.Anal.Methods,2012,4:1806-1812.
[22] Dong J,Wang H,Wan L R,Duan Y S,Chen S Z.Chin.J.Chromatogr.(董静,王弘,万乐人,端裕树,陈世忠.色谱),2009,27(4):425-430.
[23] Yan S L.StudiesonChemicalConstituentsofRadixPolygoniMultifloriPraeparata.Tianjin:Tianjin University(颜世伦.制何首乌的化学成分研究.天津:天津大学),2014.
[24] Sun J L.Huang X L,Wu H Q,Huang F.Nat.Prod.Res.Dev.(孙晋苓,黄晓兰,吴惠勤,黄芳.天然产物研究与开发),2009,21(5):806-812.
[25] Xu W.TheApplicationofLiqudChromatographyCoupledwithHighResolutionMassSpectrometryTechnologyonChemicalStudyofTwoChineseHerbs.Guangzhou:Guangzhou University of Chinese Medicine(徐文.液质联用技术在两种中药成分分析中的应用.广州:广州中医药大学),2015.
[26] Gao L L.StudiesontheChemicalConstituentsandBiologicalActivityofRheumTanguticumMaxim.exBalf.,RheumofficinaleBaill.andRheumPalmatumL.Beijing:Peking Union Medical College(高亮亮.唐古特大黄、药用大黄和掌叶大黄的化学成分和生物活性研究.北京:北京协和医学院研究生院),2012.
[27] Xu A L,Dong Y J,Chen Z,Jiang J Y,Li S M,Li Y X.J.Chin.Med.Mater.(胥爱丽,董玉娟,陈昭,江洁怡,李素梅,李养学.中药材),2015,38(6):1287-1289.
Analysis of Chemical Constituents in Polygoni Multifori Radix Processed by Different Methods Using UPLC-QTOF-MS
LUO Yi-yuan1,LIU Juan-xiu1,LIU Xun-hong1*,WANG Sheng-nan1,HUA Yu-jiao1,LAN Cai-wu2,XING Qing-qing1
(1.College of Pharmacy,Nanjing University of Chinese Medicine,Nanjing 210023,China;2.Research and Development, Guizhou Chang Hao Chinese Medicine Co.,Ltd.,Kaili 556000,China)
An ultra-performance liquid chromatography coupled with time-of-flight mass spectrometric(UPLC-QTOF-MS) method was developed for the analysis of the differences among chemical compositions in Polygoni Multifori Radix processed by different methods.The samples were extracted with methanol by ultrasonic at room temperature and centrifuged.The extracts were analyzed by UPLC-QTOF-MS.After peak matching,peak alignment and noise filtering of characteristic peak extraction,the obtained data were analyzed by principal component analysis(PCA) and partial least-squares discriminant analysis(PLS-DA).The results demonstrated that there were significant differences among the samples of Polygoni Multifori Radix with different processing methods.Accurate mass measurements and CID experiments as well as the software of database searching and literature component identification were applied to identify.The chemical compositions of Polygoni Multifori Radix by different processing methods were analyzed,and 33 constituents were identified.Among them,15 constituents were the common chemical composition presented in different changing laws.The research provided experimental data for revealing the laws of different processing methods on metabolites of Polygoni Multifori Radix.
Polygoni Multifori Radix;ultra-performance liquid chromatography coupled with time-of-flight mass spectrometry(UPLC-QTOF-MS);processing methods;the difference of chemical composition
10.3969/j.issn.1004-4957.2017.01.012
2016-07-23;
2016-08-29
国家科技支撑计划项目(2011BAI13B04);江苏高校优势学科建设工程资助项目(ysxk-2014)
*通讯作者:刘训红,教授,研究方向:中药鉴定与品质评价,Tel:025-85811511,E-mail:liuxunh1959@sohu.com
O657.63;TQ460.72
A
1004-4957(2017)01-0073-07
