山竹壳粉吸附亚甲基蓝性能研究
2017-02-14杨新周
杨新周
(德宏师范高等专科学校理工系,云南 德宏 678400)
山竹壳粉吸附亚甲基蓝性能研究
杨新周
(德宏师范高等专科学校理工系,云南 德宏 678400)
研究了山竹壳粉吸附亚甲基蓝的吸附性能,考察了亚甲基蓝溶液的pH、不同初始浓度、吸附时间、温度等条件对吸附效果的影响。应用准一级动力学方程、准二级动力学方程、颗粒扩散方程模拟了山竹壳粉吸附亚甲基蓝的动力学过程,结果表明准二级动力学方程适合描述整个吸附过程。用Langmuir和Freundlich模型模拟吸附等温线,Langmuir方程更适合描述此吸附过程,在298K下最大单层吸附量为88.49mg/g。计算了吉布斯自由能(ΔG0)、焓变(ΔH0)、熵变(ΔS0)、吸附势(E)等热力学参数,ΔG0、ΔH0、ΔS0均<0,说明此吸附过程是一个自发进行的、放热的、趋于有序的吸附过程。
山竹壳粉;亚甲基蓝;吸附;动力学;热力学
亚甲基蓝是一种广泛应用的染料。亚甲基蓝能使人心率加快,恶心、呕吐等,对人和动物存在威胁[1,2]。去除水体中亚甲基蓝是一项很有意义的工作。目前去除亚甲基蓝染料的方法主要有降解法[3]、混凝法[4]、氧化法[5]、吸附法[6]等,其中吸附法是去除亚甲基蓝最普遍的方法,且是一种可行、简便、高效的方法[7]。近年来,许多不同的吸附剂被用于研究吸附亚甲基蓝染料,如活性炭、农业废弃物、聚合物、固体废弃物等[8,9]。在这些吸附材料中,活性炭是一种应用最广的吸附剂。活性炭吸附容量大、吸附速率快,但造价昂贵、成本高。农业废弃物是一类新型的吸附材料,来源广,价格低廉,吸附效果良好,不会产生二次污染,是具有发展前景的吸附剂[8,9]。山竹壳是一种农业废弃物,是一种生物质材料,根据文献报道,山竹壳主要用于原花青素的提取、抗氧化作用的研究[10]、改性后进行金属离子的吸附[11]。本文选择山竹壳作为吸附剂,按照文献[10]将其原花青素提取出来,然后将剩余的部分烘干,用于吸附亚甲基蓝。
1 材料与方法
1.1 仪器和材料
1.1.1 仪器
722型分光光度计(上海美谱达仪器有限公司);WL-200高速中药粉碎机(瑞安市威力制药机械厂);酸度计(PHS-3c,上海雷磁仪器厂);超声波仪 (SK2200H,上海科导超声仪器有限公司);电子天平(AR224CN,奥豪斯上海仪器公司);电热真空干燥箱(ZK82J型,上海崇明实验仪器厂)。
1.1.2 实验材料
山竹,购于德宏芒市农贸市场;亚甲基蓝(天津市扬帆化学试剂公司,AR);乙醇(AR,国药集团化学试剂有限公司)。
1.2 实验方法
1.2.1 山竹壳粉的制备
山竹将其果实取出,山竹壳晾干,粉碎,过0.3mm筛,用无水乙醇浸泡,超声,将其色素及花青素提取[10]用于其它方面,抽滤洗涤数次,置于烘箱中将其烘干,得到山竹壳粉末。
1.2.2 标准曲线的制备
配制浓度为0、0.5、1、2、3、4mg/L的系列标准溶液,在λmax=664nm下测定其吸光度,绘制标准曲线为Y=0.2193X+0.0203,R2=0.9972。
1.2.3 吸附实验
取一定量的山竹壳粉,加入100mL一定浓度的亚甲基蓝溶液于250mL锥形瓶中,调节溶液pH值,加入一定量山竹壳粉, 振荡至吸附达到平衡后,0.45μm滤膜过滤,测定其吸光度。
1.2.3.1 吸附剂用量对吸附效果的影响
移取浓度为100mg/L的亚甲基蓝溶液100mL于250mL锥形瓶中,调节溶液pH为5左右,分别加入0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0g山竹壳粉末,置于温度为25℃的振荡器中振荡1h,用一次性针头过滤器(0.45μm)取样,测定其吸光度,按照式(1)计算其吸附率R(脱色率),按照式(2)计算其吸附剂吸附量qe(mg/L)。
R(%)=(C0-Ce)/C0
(1)
qe=(C0-Ce)V/m
(2)
式中:C0为亚甲基蓝初始浓度(mg/L);Ce为吸附后亚甲基蓝溶液浓度(mg/L);V为溶液体积(mL);m为吸附剂的用量(g)。
1.2.3.2 pH值对吸附效果的影响
移取浓度为100mg/L的亚甲基蓝溶液100mL于250mL锥形瓶中,利用0.1mol/L的NaOH和HCl溶液分别调节亚甲基蓝溶液pH值为2、3、4、5、6、7、8、9、10,加入0.3g山竹壳粉末,置于温度为25℃的振荡器中振荡1h,用一次性针头过滤器(0.45μm)取样,测定其吸光度,按照式(1)计算其吸附率R(脱色率),按照式(2)计算其吸附剂吸附量qe(mg/L)。
1.2.3.3 吸附时间及亚甲基蓝初始浓度对吸附效果的影响
移取质量浓度为50、100、150、200、250、300mg/L的亚甲基蓝溶液100mL于250mL锥形瓶中,调节亚甲基蓝溶液pH值,加入0.3g山竹壳粉末,25℃下振荡吸附,分别在不同时段取样,测定其吸光度。按照式(1)计算其吸附率R(脱色率),按照式(2)计算其吸附剂吸附量qe(mg/L)。
1.2.3.4 吸附温度及亚甲基蓝初始浓度对吸附效果的影响
移取质量浓度为50、100、150、200、250、300mg/L的亚甲基蓝溶液100mL于250mL锥形瓶中,调节亚甲基蓝溶液pH值,加入0.3g山竹壳粉末,在不同温度(25℃、40℃、55℃)条件下振荡60min,取样,测定其吸光度。按照式(1)计算其吸附率R(脱色率),按照式(2)计算其吸附剂吸附量qe(mg/L)。
2 结果与讨论
2.1 吸附剂用量的影响
山竹壳粉的加入量对吸附效果的影响如图1所示。山竹壳粉加入量为0.05~0.3g,山竹壳粉对亚甲基蓝的吸附率从56.5%递增到99.9%;当山竹壳粉投入量为0.3~1.0g,对亚甲基蓝的吸附率基本无变化。从图1中可以看出,随着山竹壳粉的质量增加,山竹壳粉对亚甲基蓝的吸附率增加,但是山竹壳粉对亚甲基蓝的单位吸附量逐渐减小。因为山竹壳粉投入量增加,山竹壳粉会聚集在一起,导致了山竹壳粉与亚甲基蓝接触的比表面积变小,减少了山竹壳粉的不饱和吸附位点。

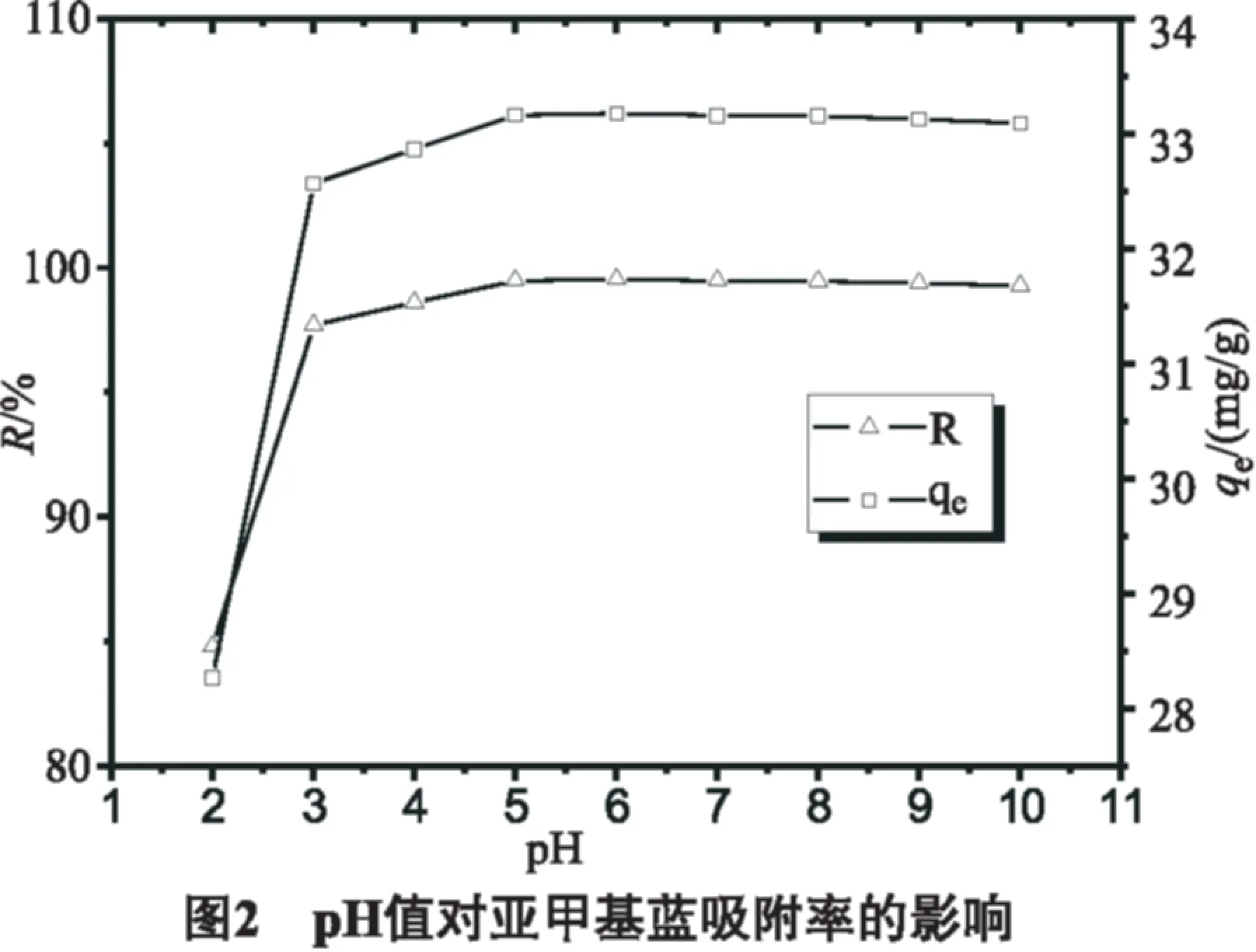
2.2 pH值的影响
pH值对吸附率的影响如图2所示。从图2中可以看出,当溶液pH值为2~5,亚甲基蓝吸附率逐渐增大;当溶液pH值>5,山竹壳粉对亚甲基蓝的吸附率趋于平稳。当溶液中pH值=2,山竹壳粉对亚甲基蓝的吸附率最小,此时溶液中存在大量的H+,亚甲基蓝染料阳离子与H+发生竞争吸附,山竹壳粉的吸附位点被H+占据,导致亚甲基蓝的去除率及吸附量降低。当溶液中pH为3~5,亚甲基蓝的吸附率缓慢递增,当溶液pH为5~10时,亚甲基蓝吸附率呈平稳趋势。本实验中选择吸附亚甲基蓝溶液的最佳pH为5。
2.3 吸附时间及初始浓度的影响
随着亚甲基蓝与山竹壳粉接触时间增大,山竹壳粉对亚甲基蓝的吸附量迅速增大,直到吸附量变化缓慢,并趋于平稳。从图3中可以看出,随着亚甲基蓝的初始浓度增大,山竹壳对亚甲基蓝的吸附量趋于饱和的时间逐渐增大,亚甲基蓝初始浓度为50~300mg/L,接触时间为30min左右,山竹壳粉对亚甲基蓝的吸附量均达到最大,趋于平稳。
2.4 温度及初始浓度对吸附效果的影响
三要能推进学术。中层管理干部,实际上就是学校工作的直接推进者。高校的管理,更多的是一种知识管理、创新管理。在这种情况下,我们更多的是要“理” 。“管”和“理”是不一样的,低水平者注重“管”,高水平者注重“理”[6]。“理”就是要建立好的制度环境,依此推进学术发展,推进核心竞争力的不断提升。我校党委和行政,近几年来特别重视制度环境的创新和对中层管理者能力水平的优化和提高,经常邀请高层次的专家、学者来校给中层以上干部讲管理、讲创新,以此开拓我们“理”的水平。
从图4中可以看出,不同初始浓度的亚甲基蓝随着反应温度的升高,山竹壳粉对亚甲基蓝的吸附量逐渐减小,所以本实验中选择山竹壳粉吸附亚甲基蓝的温度为298K,即25℃。


表1 一级和二级动力学方程拟合参数

C0/(mg/L) 一级动力学 二级动力学 qe,exp/(mg/g)k1/(1/min)qe,cal/(mg/g)R2qe,exp/(mg/g)K2/(1/min)qe,cal/(mg/g)R25016.650.11560.590.904616.650.618916.69110033.120.10241.740.95533.120.158933.22115049.010.11272.950.848849.010.0792549.26120064.480.13459.260.946764.480.0238965.360.999925077.260.115113.190.958377.260.0134478.74130086.360.091115.160.968886.360.0086988.491
2.5 吸附动力学分析
为了研究山竹壳粉对亚甲基蓝的动力学关系,采用准一级动力学方程式、准二级动力学反应方程和颗粒扩散方程3种动力学模型进行模拟研究[12]。
In(qe-qt)=Inqe-k1t
(3)
t/qt=1/k2qe2+t/qe
(4)
qt=kpt1/2+c
(5)
式(3)、4)、(5)中:qt为t时刻山竹壳粉对亚甲基蓝的吸附量;qe为吸附反应达到平衡时山竹壳粉对亚甲基蓝的吸附量;k1、k2分别为准一级动力学速率常数、准二级动力学速率常数;t为吸附时间;kp为颗粒内扩散速率常数。
图5(a)和(b)分别为准一级动力学模型和准二级动力学模型拟合曲线,相关系数R2、k1、k2、qe,exp、qe,cal分别列于表1中。从图5可以看出,准二级动力学模型拟合曲线线性优于准一级动力学模型。从表1中数据可以看出,不同初始浓度的亚甲基蓝吸附动力学方程,准二级动力学方程R2在0.9999~1,而准一级动力学方程R2在0.8488~0.9688,不同初始浓度的亚甲基蓝的准二级动力学模型拟合曲线R2值均优于准一级动力学方程R2值。从表1中可以看出,通过准一级动力学方程得到的qe,cal远远小于通过实验得到的qe,exp,而通过准二级动力学方程得到的qe,cal和实验值qe,exp非常吻合,结合相关系数R2和qe,cal值可以得出,准二级动力学模型能更准确地描述山竹壳粉吸附亚甲基蓝的过程。


表2 山竹壳粉吸附亚甲基蓝颗粒内扩散模型拟合参数
2.6 吸附等温线
在吸附过程中,吸附等温线可以判断山竹壳粉末和亚甲基蓝的相互作用形式。应用Langmuir和Freundlich这两种经典模型对3个不同温度下(298K,313K,328K)山竹壳粉吸附亚甲基蓝的实验数据进行分析[12]:
Ce/qe=ce/qmax+1/qmaxkL
(6)
lnqe=lnKF+1/nlnCe
(7)
式中:qmax为最大吸附量(mg/g);qe为平衡吸附量(mg/g);kL为Langmuir 方程吸附常数(L/mg);KF为与吸附能力有关的常数(L/mg);n为与温度有关的常数;Ce为吸附平衡时亚甲基蓝溶液浓度。
图7(a)和图7(b)分别为吸附等温线Langmuir和Freundlich方程的拟合图,拟合参数列于表3中。从图7中可以看出Langmuir方程的线性优于Freundlich方程。从表3中可以看出,Langmuir方程的R2值均>0.995,远远优于Freundlich方程的R2值。说明Langmuir模型能更好地描述山竹壳粉吸附亚甲基蓝的过程,而且可以看出山竹壳粉吸附亚甲基蓝的吸附为理想的单分子层吸附。从表3中数据可以看出KL和qmax随着温度的升高而降低,说明此吸附过程可能是一个放热吸附过程。

表3 热力学方程拟合参数

温度/K Langmuir Freundlich qmax/(mg/g)KL/(L/mg)R2RLKF/(L/mg)1/nR229888.490.60760.99530.00333819.780.26410.982931386.950.47330.99580.00333617.780.28850.969732885.470.37740.99750.00333016.080.30610.9608
RL值用来描述吸附质与吸附剂间的吸附亲和性,反应吸附过程好坏[12]。RL值可以通过式(8)计算:
RL=1/(1+kLC0)
(8)
式中:C0(mg/L)为最高初始浓度;kL为Langmuir 方程吸附常数(L/mg)。
RL的计算结果列于表3。从表3中可以看出山竹壳粉在3个不同温度下吸附亚甲基蓝的RL值均<1,通过查阅文献[15]可知:0﹤RL﹤1,表明有利于吸附;RL=0,不可逆;RL=1,呈线性吸附;RL﹥1,表明不利于吸附。山竹壳粉吸附亚甲基蓝过程中0﹤RL﹤1,所以表明山竹壳粉除去水溶液中的亚甲基蓝是可行的。
Freundlich模型中1/n代表偏离线性程度。1/n﹤1时,说明易于吸附;1/n﹥1时,说明难以吸附[16,17]。从表3中可以看出,山竹壳粉在3个不同温度下吸附亚甲基蓝1/n﹤1,说明此过程是容易进行的。
2.7 吸附热力学
吸附热力学参数能够反应吸附过程中本质能级的改变,吸附热力学参数主要包括:吉布斯自由能(ΔG0,KJ/mol),焓变(ΔH0,KJ/mol),熵变(ΔS0,KJ/mol),吸附势(E,KJ/mol)。这4个参数可以通过式(9)、(10)、(11)[13,14,17]算出:
ΔG0= -RTln(Kd)
(9)
ln(Kd)=ΔS0/R-H0/RT
(10)
E=-RTln(Ce/C0)
(11)式中:Kd为吸附分配系数,Kd=qe/Ce;R为气体摩尔常数,J·mol-1·K-1;T 为绝对温度。
以lnKd对1 /T作图,根据其拟合曲线的斜率和截距求出ΔH0和ΔS0。所计算出来的ΔG0、ΔH0、和ΔS0列于表4中。
从表4数据可以看出,ΔG0、ΔH0、ΔS0均<0,说明山竹壳粉吸附亚甲基蓝过程是一个有序的自发的放热过程。经过查阅文献[2],物理吸附ΔG0在-20~0 KJ/mol,化学吸附在-80~-400KJ/mol[2]。在本文中,ΔG0在-1.13024~-13.4997KJ/mol,说明此吸附过程是以物理吸附为主的物理化学吸附过程。从表4中数据还可以看出,随着温度的升高ΔG0的绝对值减小,表明温度越高吸附过程自发的趋势越小。
从表4中数据可以看出ΔH0<0,即山竹壳粉吸附亚甲基蓝过程为放热反应,和吸附等温线得到的结果一致。ΔH0<40KJ/mol,为物理吸附过程。本文中,ΔH0在-8.9849~-34.5380KJ/mol,均<40KJ/mol,所以此过程以物理吸附过程为主。
从表4中可以看出,ΔS0<0,说明亚甲基蓝被吸附到山竹壳粉上,使得吸附质分子失去一些自由度( 包括但不限于平动和转动) ,从而引发熵减小,表明此过程是一个趋于有序的吸附过程[17]。

表4 山竹壳粉吸附亚甲基蓝的热力学参数

山竹壳粉吸附亚甲基蓝的吸附势列于表5中。可以看出,在相同温度下,随着亚甲基蓝浓度的增加,吸附势在逐渐降低。发生此现象,推断是山竹壳粉表面吸附不均匀所导致。在吸附初期,亚甲基蓝分子首先占据表面吸附势较大的位点,但是亚甲基蓝分子的表面覆盖率和微孔的填充度随着吸附量的增大而增大,因此,山竹壳粉对亚甲基蓝分子的吸附作用下降,从而其吸附势相应下降[17]。

表5 山竹壳粉对亚甲基蓝的吸附势
3 结论
(1)当亚甲基蓝溶液浓度为100mg/L时,山竹壳粉吸附亚甲基蓝的最佳条件为山竹壳粉用量为3g/L,pH为5,温度为298K,吸附时间为30min,山竹壳粉对亚甲基蓝的吸附率可达到99%,吸附量可达到33.12mg/g。
(2)通过准一级动力学及准二级动力学模型的模拟计算,准二级动力学模型更能合适地描述山竹壳粉吸附亚甲基蓝的过程。通过Langmuir和Freundlich这两种经典模型的模拟计算,Langmuir模型能更好地描述山竹壳粉吸附亚甲基蓝的过程。通过Langmuir方程计算得到的RL值和Freundlich计算得到的1/n的值,说明山竹壳粉吸附亚甲基蓝是可行的,该过程是很容易进行的。
(3)通过计算,ΔG0、ΔH0、ΔS0均<0,说明山竹壳粉吸附亚甲基蓝过程是一个有序的自发的放热过程。
[1] 叶存玲,伍心妮,王治科.罗丹明B在碱化丝瓜络纤维上的吸附性能[J]. 环境污染与防治,2013,35(l):10-15.
[2] A.F. Hassan, A.M. Abdel-Mohsen, Moustafa M.G. Fouda. Comparative study of calcium alginate, activated carbon, and theircomposite beads on methylene blue adsorption[J]. Carbohydrate Polymers, 2014(102) : 192-198.
[3] El-Sheekh, M. M., Gharieb, M. M., Abou-El-Souod, G. W.. Biodegradationof dyes by some green algae and cyanobacteria[J]. International Biodeterioration &Biodegradation, 2009,63(6):699-704.
[4] Canizares, P., Martínez, F., Jiménez, C., Lobato, J., Rodrigo, M. A. Coagulationand electrocoagulation of wastes polluted with dyes[J]. Environmental Science &Technology, 2006,40(20): 6418-6424.
[5] Salem, I. A., El-Maazawi, M. S. Kinetics and mechanism of color removal ofmethylene blue with hydrogen peroxide catalyzed by some supported aluminasurfaces[J]. Chemosphere, 2000,41(8):1173-1180.
[6] Peifang Wang, Muhan Cao, Chao Wang,et al. Kinetics and thermodynamics of adsorption of methylene blue by amagnetic graphene-carbon nanotube composite[J]. Applied Surface Science, 2014(290) :116-124.
[7]Rafatullah, M., Sulaiman, O., Hashim, R., Ahmad, A. Adsorption of methy-lene blue on low-cost adsorbents: A review[J]. Journal of Hazardous Materials, 2010,177(1-3):70-80.
[8]Han, R., Wang, Y., Zhao, X., Wang, Y., Xie, F., Cheng, J., et al. Adsorption ofmethylene blue by phoenix tree leaf powder in a fixed-bed column: Experimentsand prediction of breakthrough curves[J]. Desalination, 2009,245(1-3):284-297.
[9]张佳,任秉雄,王鹏,等.山茶籽粉吸附亚甲基蓝的性能研究[J].环境化学,2013,32(8):1539-1545.
[10]杨青.山竹壳中原花青素的提取纯化与活性研究[D].厦门:集美大学,2013:12-15.
[11]黄晓东,刘明华,林春香.氨基硫脲改性山竹壳对Cd2+、Pb2+的吸附[J].环境科学与技术,2012,35(5):24-27.
[12]Zhonghui Chen, Jianan Zhang, Jianwei Fu,et al.Adsorption of methylene blue onto poly(cyclotriphosphazene-co-4,4-sulfonyldiphenol) nanotubes:Kinetics, isotherm and thermodynamics analysis[J]. Journal of Hazardous Materials , 2014(273 ):263-271.
[13]Khan A.A,Singh R.P.Adsorption thermodynamics of carbofuran on Sn(IV) arsenosilicate in H+,Na+and Ca2+forms [J].Colloid and Surfaces,1987,24(1):33-42.
[14] Zhu L Z,Ren X G,Yu S B.Use of cetyltrimethylammonium bromide-bentonite to remove organic contaminants of varying polar character from water[J].Environment Science and Technology,1998,32(21):3374-3378.
[15]Raom,Ramesh A,Rao G PC,et al. Removal of copper and cadmium from the aqueous solutios by activated carbon derived from Ceiba pentandra hulls[J].Journal of Hazardous Materials,2006,129(1/3):123-129.
[16]Sawatha MF,Jose R, Jaime R G. Thermodynamics and isotherm studies of biosorption of Cu,Pb and Zn by leave of saltbush[J].The Journal of Chemical Thermodynamics,2007,39(3):488-492.
[17]杨新周.王棕果壳粉吸附亚甲基蓝性能研究[J].生物质化学工程,2016,50(1):22-28.
Performance of Mangosteen Shell Powder Absorbing Methylene Blue
YANG Xin-zhou
(Science and Engineering Department, Dehong Normal College, Dehong Yunnan 6784000 ,China)
This paper mainly focused on the performance of mangosteen shell powder absorbing methylene blue in different pH, different initial concentration, different period, and different temperature. The quasi-order kinetic equation, quasi-second-order equation, the particle diffusion equation were applied separately to simulate the kinetics process of the absorption. The results showed that the pseudo-second kinetic equation was suitable for describing the whole desorption process. Langmuir equation and Freundlich equation were used to simulate the kinetics process of the absorption. It showed that Langmuir equation was more suitable for describing the whole desorption process. The maximum monolayer adsorption capacity was 88.49mg/g at 298K. TheΔG0,ΔH0,ΔS0were less than 0 by calculating the thermodynamic parameters of Gibbs free energy (ΔG0), enthalpy (ΔH0), entropy change (ΔS0), adsorption potential (E), which indicated that this adsorption process was a spontaneous, exothermic, nearly ordered adsorption process.
mangosteen shell powder, methylene blue; adsorption; kinetics; thermodynamics
2016-07-23
X13
A
1673-9655(2017)01-0011-07
