绿色荧光蛋白标记SOX9基因慢病毒载体的构建及在兔骨髓间充质干细胞中的表达
2017-02-13幸永明龚德军
刘 伟,王 杰,幸永明,赵 宏,龚德军
(1.解放军第113医院 骨科,浙江 宁波 315040; 2.第二军医大学附属长海医院 胸心外科实验室,上海 200433)
绿色荧光蛋白标记SOX9基因慢病毒载体的构建及在兔骨髓间充质干细胞中的表达
刘 伟1,王 杰1,幸永明1,赵 宏1,龚德军2
(1.解放军第113医院 骨科,浙江 宁波 315040; 2.第二军医大学附属长海医院 胸心外科实验室,上海 200433)
目的 构建绿色荧光蛋白标记的SOX9基因慢病毒载体,转染兔骨髓间充质干细胞,观察SOX9基因的表达情况。方法 双酶切从GeneArt提供的含SOX9基因序列的质粒13ABIV6C_1366933并克隆到pLenti6.3_MCS_IRES2-EGFP载体,获得含SOX9基因的质粒pLMIG-13GS0345-1,通过293T细胞包装后获得绿色荧光蛋白标记的SOX9基因慢病毒载体(Lenti-SOX9-GFP),将Lenti-SOX9-GFP转染兔骨髓间充质干细胞后观察SOX9基因的表达情况。结果 测序结果显示质粒pLMIG-13GS0345-1中的插入序列与基因库中SOX9(NM_000346)基因序列完全一致,成功构建Lenti-SOX9-GFP慢病毒载体。Lenti-SOX9-GFP转染兔骨髓间充质干细胞后可观察到绿色荧光蛋白的表达,RT-PCR与Western Blot检测结果证明Lenti-SOX9-GFP转染目的细胞后可在mRNA及蛋白水平成功表达SOX9。结论 本实验成功构建了绿色荧光蛋白标记的携带SOX9基因的Lenti-SOX9-GFP慢病毒载体,并在兔骨髓间充质干细胞中成功表达,为下一步研究提供前期实验基础。
慢病毒载体;骨髓间充质干细胞;椎间盘;SOX9基因;绿色荧光蛋白
(ChinJLabDiagn,2017,21:0140)
已有许多研究证实调节II型胶原合成的Sox-9基因 (sex determining region Y-Box9,Sox-9)在髓核退变中发挥重要的作用,SOX9基因可能参与了椎间盘从发育、成熟到退变的整个变化过程,增加SOX9可以明显增加II型胶原的合成,从而可能达到对退变椎间盘的修复作用[1,2]。目前采用基因转染技术加强或改造种子细胞是当今组织工程研究中热点[3],通过基因转染可以达到较为长期、高效、局部的效果,避免了直接应用生长因子时可能发生的过量反应和全身性毒副作用。慢病毒载体(Lentiviral vector)是组织工程基因改造最具潜力的载体之一,相对于腺病毒载体和逆转录病毒载体具有转移基因片段容量较大、目的基因表达时间长、免疫反应小、感染率高等优点。本研究即构建绿色荧光蛋白标记的携带SOX9基因的慢病毒载体,并观察其是否能成功转染兔骨髓间充质干细胞和是否可在mRNA及蛋白水平成功表达SOX9,为下一步实验奠定基础。
1 材料和方法
1.1 实验材料 13ABIV6C_1366933质粒(GeneArt);BamHI (MBI);AscI (MBI);感受态细胞DH5α (全式金);pLenti6.3_MCS_IRES2-EGFP(Invitrogen改造);T4 DNA ligase(NEB);氨苄抗生素溶液及平板(Invitrogen Shanghai制备);DNA凝胶回收试剂盒(Axygen);包装质粒pLP1,pLP2,pLP/VSVG(Life technologies);293T细胞 (Life technologies);DMEM + 10% FBS(Life technologies);lipofectamine 2000 (Life technologies);Opti-MEM 培养液(Life technologies),0.05% Trypsin (Life technologies)。引物由上海吉玛制药技术有限公司(Shanghai GenePharma Co.,Ltd)合成。鼠抗兔SOX9蛋白抗体 LifeSpan BioScience公司(美国)。鼠抗兔β-actin单克隆抗体购自Sigma公司(美国)。羊抗鼠IgG-HRP购自北京中山生物技术有限公司。
1.2 合成片段亚克隆至pLenti6.3_MCS_IRES2-EGFP载体及测序鉴定
从GeneArt提供的质粒13ABIV6C_1366933中按BamHI和AscI双酶切下目的片段并克隆到pLenti6.3_MCS_IRES2-EGFP载体中。用BamHI和AscI双酶切质粒,酶切体系如下:13ABIV6C_1366933_ZCY-Liu_Wei质粒 (约150 ng/μl)6 μl,BamHI 1 μl,AscI 2 μl,10× BamHI Buffer 5 μl,ddH2O 36 μl,37℃酶切2 h后电泳回收。用BamHI和AscI双酶切载体pLenti6.3_MCS_IRES2-EGFP,酶切体系如下:pLenti6.3_MCS_IRES2-EGFP (约150 ng/μl)6 μl,BamHI 1 μl,AscI 2 μl,10× BamHI Buffer 5 μl ,ddH2O 36 μl,37℃酶切2 h后电泳回收。连接目的片段和载体,连接体系如下:Ligation buffer 0.5 μl,13GS0345 DNA片段 (BamHI / AscI) 3 μl,pLenti6.3_MCS_IRES2-EGFP (BamHI / AscI) 1 μl,T4 DNA Ligase(10 U/μl)0.5 μl。16℃连接2 h后转化到感受态细胞DH5α。测序验证重组克隆插入片段的序列信息,含有目的序列的正确质粒编号为pLMIG-13GS0345-1。
1.3 慢病毒的包装、转染和病毒滴度的测定
慢病毒包装:取细胞状态良好,处于对数生长期的293T细胞,细胞计数后,按照每个10 cm的培养皿6×106个细胞数接种于培养皿中,37℃,5%CO2的培养箱中培养过夜;第二天转染前移去培养液,换5 ml Opti-MEM培养液;取9 μg Packaging Mix(Life)和 3 μg慢病毒表达质粒加入1.5 ml Opti-MEM(经37℃预热)中,轻轻混匀;取36 μl lipofectamine2000 加入1.5 ml Opti-MEM中,轻轻混匀,室温放置5 min;轻轻混合质粒溶液和lipofectamine 2000稀释液,置室温20 min;将3 ml质粒脂质体复合物小心地加入到细胞培养皿中,轻轻混匀,37℃,5% CO2的培养箱中孵育6 h后,更换完全培养液 DMEM +10% FBS;48 h后收集细胞培养上清,3 000 rpm 离心10 min,去除细胞和碎片,并用0.45 μm的滤器过滤;将病毒原液在50 000 g下超速离心2 h,去除上清,重悬于opti-MEM培养液中,滴度测定后分装成小管保存于-80度。构建的携带绿色荧光蛋白的SOX9基因慢病毒载体标记为Lenti-SOX9-GFP。
慢病毒活性滴度测定:慢病毒滴度测定前一天细胞铺板,HEK293细胞胰酶消化后轻轻吹打成单细胞悬液,细胞计数后铺96孔板,约8000个细胞每孔。慢病毒稀释用培养基的配制:DMEM中加入2%FBS,再添加8 μg/ml 的Polybrene,混合均匀后备用。对慢病毒液稀释,慢病毒原液或慢病毒浓缩液用慢病毒稀释用培养基10倍比稀释后,各取100 μl感染96孔板中的HEK293细胞。小心吸去96孔板中的培养基,轻轻混匀各管慢病毒稀释液,各取100 μl加入每孔细胞中,每个稀释度两个重复。放入37度的细胞培养箱中过夜培养。计算慢病毒滴度,96 h后,在荧光显微镜下观察各孔中荧光细胞数量,病毒滴度为各孔中表达荧光的细胞数平均数除以每孔中含有的慢病毒液体积。
1.4 兔骨髓间充质干细胞的培养
取健康新西兰大白兔(雄性,3-5周龄,体重1-2 kg)麻醉后,双侧股骨粗隆部位脱毛,碘酒消毒,在无菌操作下16号骨髓穿刺针在股骨粗隆处穿入股骨骨髓腔,穿刺针连接10 ml注射器,内含0.2 ml肝素(浓度3 000 U/ml),每只兔抽取约5 ml的骨髓液。1 000 rpm离心5 min,弃上清液,用含10%胎牛血清的DMEM/F12培养基(含有100 U/ml青霉素、100 mg/mL链霉素)反复吹打混匀后,将单细胞悬液接种于细胞培养瓶中,在37℃,5%CO2的细胞培养箱中培养。72小时后首次换液,后隔日换液。待细胞长满瓶底时(融合率达90%),通过倒置显微镜观察细胞并拍照。倒掉培养液,PBS 洗涤两遍,胰酶消化后,以1∶4比例将细胞传到培养瓶中,放入培养箱继续培养传代。
1.5 转染效率测定
取第三代生长状态良好的BMSCs细胞进行消化,以5×104/孔铺12孔板,待细胞达至70%-80%融合时,分别转染空白慢病毒载体或Lenti-SOX9-GFP慢病毒载体。感染复数(Muhiplicities of infection,MOI)分别为50、100、150、200,轻轻混匀。置于37℃、5%CO2的培养箱培养,置于37℃、5%CO2的培养箱中继续培养72 h后,弃去培养基,PBS清洗2次,加入4%多聚甲醛固定15 min;PBS再次漂洗5 min后,加入DAPI工作液室温染色20 min,PBS漂洗后通过倒置荧光显微镜观察转染后细胞中细胞核与胞质中的荧光发光情况,倒置荧光显微镜下取6个视野细胞计数,计算各MOI值转染情况下病毒的转染效率,公式为:转染率 = 红(或绿)荧光细胞数 / 镜下DAPI标记的细胞数×100%。
1.6 MTT法检测转染对BMSCs增殖的影响
取第三代生长状态良好的BMSCs细胞进行消化,以1×104/孔铺96孔板,待细胞达至70%-80%融合时,将高转染复数的Lenti-SOX9-GFP慢病毒载体转染BMSCs细胞(MOI 200),每组设3个平行孔,未处理组作为阴性对照。分别从转染后第1-5天采用MTT法检测细胞生长情况,每天取出一块培养板,向每孔加入20 μl新鲜配制的MTT液(5 mg/ml),继续培养4 h,小心吸去孔内培养上清液,每孔加入二甲基亚砜150 μl,振荡10 min,使结晶物充分溶解后在酶标仪上读取570 nm波长的光密度OA值。
1.7 慢病毒载体介导的SOX9基因在兔骨髓间充质干细胞内的表达
将Lenti-SOX9-GFP以优化的MOI值转染BMSCs,方法同上,以正常BMSCs细胞作为对照组。
RT-PCR检测慢病毒转染BMSCs后SOX9 mRNA的表达:将BMSCs以5×104/孔铺12孔板,待细胞达至70%-80%融合时,Lenti-SOX9-GFP转染培养72 h后,PBS溶液清洗2次,加入Trizol试剂裂解各组细胞,按照参照Qiagen公司逆转录试剂盒说明书提取总RNA。进一步对各组细胞RT-PCR检测(RT-PCR引物如下):正向引物:5’-TCTCAGGCTTTGCG ATTT-3’,反向引物:5’-TGCTCGGGCACTTATTGG-3’,反应条件:94℃ 40sec;94℃ 40 sec,58℃ 40 sec,72℃ 2 min,35 cycles;72℃ 5 min。反应结束后取5 μl产物在1.5%琼脂糖凝胶中电泳,预期产物长度304 bp。
Western-Blot检测慢病毒转染BMSCs后SOX9蛋白的表达:转染方法同上,继续培养72小时后,提取各孔总蛋白质:吸取培养液,PBS清洗3次,向各组BMSC细胞孔加入1 ml预冷的细胞裂解液,冰上裂解20 min,4℃转速12 000 rpm离心10 min,收集上清液至EP管中,BCA试剂盒蛋白定量后,80℃保存备用。凝胶电泳和转膜后进行免疫杂交反应,PVDF置于反应盒,加入5% TBSTM液,4℃封闭过夜,弃封闭液后,加入1∶500鼠抗兔SOX9蛋白抗体和1∶1 000的β-actin单克隆抗体溶液,室温振荡孵育2小时,TBST漂洗3次。再加入1∶2 000辣根过氧化物酶标记的山羊抗鼠抗体溶液,室温振荡孵育30 min,TBST漂洗3次。在PVDF膜上滴加2 ml化学发光试剂ECL作用5 min,暗室内用底片曝光,形成蛋白条带以评价SOX9蛋白的表达。
1.8 统计学分析
利用SPSS12.0统计软件包分析数据,数据以均数±标准差表示,组间比较采用方差分析,P值<0.05为有统计学意义。
2 实验结果
2.1 质粒及对应的测序结果
测序结果显示质粒pLMIG-13GS0345-1中的插入序列与SRY-related high mobility group-box gene 9,SOX9(NM_000346,共1 550 bp)完全一致(测序图略),未见碱基突变。序列插入位点位于pLenti6.3_MCS_IRES2-EGFP载体的BamHI/AscI(图1)。

图1 pLenti6.3_MCS_IRES2-EGFP载体图谱
2.2 慢病毒的包装和滴度的测定 将构建的病毒原液转染293T细胞24小时后,在荧光显微镜下同一视野的荧光和可见光照片如下(图2)。慢病毒滴度测定结果为2.5*107TU/ml。

图2A Lenti-SOX9-GFP转染293T细胞后荧光显微镜下可见绿色荧光的表达;B,同一视野下的可见光照片
2.3 兔BMSCs细胞的体外培养
刚提取的BMSCs细胞为圆形,悬浮于培养液中,可见有圆盘状血细胞混杂其中。培养7天左右BMSCs细胞已贴壁,细胞呈多角形生长。培养14天后BMSCs细胞贴壁,呈多种形态,如梭形,胞体膨大,有长短不一的胞质突起,呈集落生长(图3A)。已传第三代的BMSCs细胞,细胞纯度较高,生长速度较快,细胞密度较高,已达95%融合(图3B)。
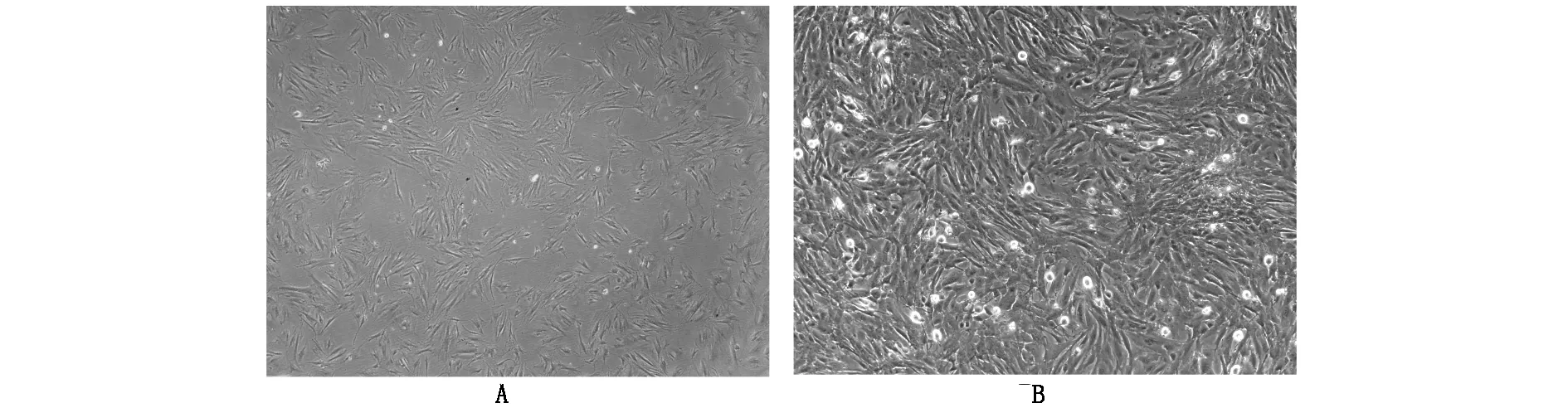
图3 兔BMSCs细胞的体外生长形态(A.BMSCs体外培养14天 B.体外培养第三代BMSCs)
2.4 Lenti-SOX9-GFP慢病毒载体对BMSCs转染MOI的确定
慢病毒转染后BMSCs细胞在倒置显微镜下呈梭形、多角形,胞质呈伪足伸展,相互交错;在荧光显微镜下细胞呈多角形,胞体增大、胞质伸展相互交错,胞质内充满绿(或蓝)色荧光物质(图4),DAPI标记的细胞核清晰可见,计算不同MOI值(50、100、150、200)条件下的转染率如表1,测定结果显示Lenti-SOX9-GFP的最佳转染复数(MOI)为100,其转染率约为85%。该结果证实SOX9慢病毒载体可成功转染BMSCs细胞。

表1 Lenti-SOX9-GFP慢病毒转染BMSCs后72小时,不同MOI值的转染效率(n=6)
2.5 MTT法检测转染对MSCs增殖的影响
经MTT细胞增殖试剂盒检测Lenti-SOX9-GFP以高转染复数转染(MOI 200)BMSCs后5天内的生长情况(表2),实验结果显示慢病毒转染的细胞生长曲线与未处理的细胞基本一致,统计分析表明,各种处理细胞的生长特性差异无统计学意义P>0.05)。表明慢病毒转染对MSCs的生长增殖没有明显的影响,为进一步研究奠定基础。

表2 MTT法检测Lenti-SOX9-GFP慢病毒转染BMSCs后的OA值
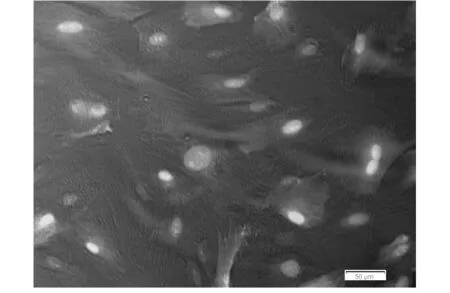
图4 Lenti-SOX9-GFP慢病毒载体转染MSCs细胞(MOI 100)72小时后荧光显微镜下可见绿色荧光蛋白的表达
2.6 Lenti-SOX9-GFP转染兔BMSCs后目的基因的表达
SOX9 mRNA表达:骨髓间充质干细胞被重组慢病毒Lenti-SOX9-GFP以MOI值100转染后48小时,抽提细胞总RNA进行RT-PCR分析。结果显示转染组出现位置大小为320 bp的条带,这与SOX9预期结果相符合,而对照组没有发现SOX9的基因表达(图5)。
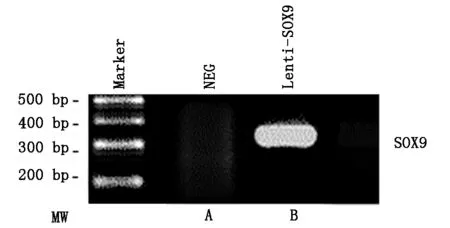
A对照组(NEG);B,Lenti-SOX9转染组
SOX9蛋白的表达:经Western-Blot检测各组处理后BMSCs细胞中目的蛋白表达,结果如图6所示,Lenti-SOX9-GFP转染组中观察到80-85 KDa处有条特征带,其分子量大小与SOX9 融合蛋白(55 kDa+27 kDa=82 kDa)相吻合,条带较强,对照组未见SOX9蛋白表达。
3 讨论
Ⅱ型胶原在健康成人髓核基质中占极大比例,而随着年龄的增长,其合成减少,降解增加。SOX9基因属于SOX基因家族成员之一,是Ⅱ型胶原合成以及软骨形成过程中的一个必需的转录因子,也是维持软骨表型的主要调控基因。SOX9基因定位于染色体17q24.3-q25.1区段内,已有学者通过在退变的人椎间盘细胞中转染腺病毒介导的SOX9基因,证实其可以使椎间盘细胞增殖、Ⅱ型胶原及蛋白聚糖的合成得到增加,表明SOX9基因参与了椎间盘从发育、成熟到退变的整个变化过程,增加SOX9可以明显增加II型胶原的合成,从而可能达到对退变椎间盘的修复作用[2]。目前的研究发现,通过SOX9转染兔骨髓间充质细胞后,可上调SOX9基因的表达,使细胞内软骨特异性的分子如II型胶原等的因子表达,增加椎间盘内II型胶原的合成,有望恢复椎间盘的生理活性,促进其修复[4]。
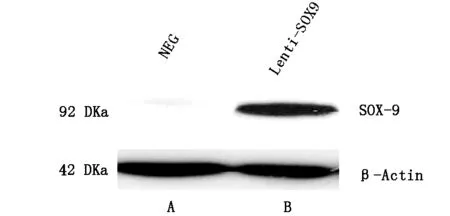
A:对照组;B:Lenti-SOX9转染组
骨髓间充质干细胞(BMSCs)是目前髓核组织工程中应用最广泛的种子细胞之一,与髓核细胞和软骨细胞等其他髓核组织工程种子细胞相比,具有取材方便、对机体损伤少、与生物支架材料的粘附性能好、在体外培养具有较强的增殖传代能力等优点[5,6]。在对种子细胞的改造或促其向类髓核细胞方向转化方面,目前则具有各种不同的方法,但主要集中在体外或体内应用细胞生长因子或将其通过基因转染的方法导入细胞内表达促BMSCs向类髓核细胞转化。利用细胞生长因子诱导BMSCs向类髓核细胞方向转化的方法主要有体外诱导、体内诱导和基因转染3种方法。体外诱导过程中,细胞生长因子的浓度很难控制,而体内应用则具有常不能耐受37℃体内环境、半衰期短、局部应用易于流失、诱导时间短等诸多缺点,通过基因转染则可以达到较为长期、高效、局部的效果,避免了直接应用生长因子时可能发生的过量反应和全身性毒副作用。慢病毒载体(Lentiviral vector,LVs)属于一种新型的逆转录病毒载体,它既可感染分裂细胞,也可感染非分裂细胞,还具有整合到宿主细胞基因组、稳定长效转染、感染效率高等优点,能高效将目的基因(或RNAi)导入动物和人的原代细胞或细胞系[7]。本实验选用的Invitrogen ViraPowerTM系列慢病毒系统为四质粒包装系统,属于第三代慢病毒载体系统[8],可以高效感染宿主细胞,是实现基因治疗较为理想的载体,在安全性上最大限度的降低了其产生复制型慢病毒(RCL)的可能性。
本实验通过绿色荧光标记的慢病毒载体介导SOX9基因体外成功高效转染兔BMSCs细胞,转染后的BMSCs在荧光显微镜下细胞呈多角形,胞体增大、胞质伸展相互交错,胞质内充满绿色荧光物质,确定了慢病毒的最佳感染复数MOI为100,转染效率约为90.3±5.2%。同时,通过MTT法检测转染后5天的细胞增殖能力,发现构建的慢病毒转染BMSCs后不影响其增殖能力。我们进一步将Lenti-SOX9-GFP在最佳MOI条件下转染BMSCs,72小时后采用荧光显微镜观察,RT-PCR与Western Blot检测,结果证明Lenti-SOX9-GFP可成功高效转染目的细胞并可在mRNA及蛋白水平成功表达SOX9,显著高于对照组。本部分研究结果证实SOX9可在BMSCs稳定表达,为下一步实验奠定基础。
[1]Vadala G,Studer RK,Sowa G,et al.Coculture of bone marrow mesenchymal stem cells and nucleus pulposus cells modulate gene expression profile without cell fusion[J].Spine(Phila Pa 1976),2008,33(8):870.
[2]Wuertz K,Godbum K,latridis JC,et al.MSC response to pH levels found in degenerating intervertebral discs[J].Biochem Biophys Res Commun,2009,379(4):824.
[3]Vadala G,Sowa GA,Kang JD.Gene therapy for disc degeneration[J].Expert Opin Biol Ther,2007,7(2):185.
[4]Sun W,Zhang K,Liu G,et al.Sox9 gene transfer enhanced regenerative effect of bone marrow mesenchymal stem cells on the degenerated intervertebral disc in a rabbit model[J].PLoS One,2014,9(4):e93570.
[5]Turgeman G,Pittman DD,Muller R,et al.Engineered human mesenchymal stem cells:a novel platform for skeletal cell mediated gene therapy[J].J Gene Med,2001,3:240.
[6]刘 伟,陈 剑,宋 佳,宋滇文.兔骨髓间充质干细胞的分离、培养及鉴定[J].中国实验诊断学杂志,2013,17(8):1366.
[7]Wang S,Zeng X,Liu Y,et al.Construction and characterization of a PDCD5 recombinant lentivirus vector and its expression in tumor cells[J].Oncol Rep.2012,Jul;28(1):91.
[8]Dull T,Zufferey R,Kelly M,et al.A third-generation lentivirus vector with a conditional packaging system[J].J Virol,1998,72(11):8463.
Construction of a SOX9 gene recombinant lentivirus vector marked by green fluorescent protein and it’s expression in rabbit bone marrow derived mesenchymal stem cells
LIUWei1,WANGJie1,XINGYong-ming1,etal.
(1.DepartmentofOrthopaedics,PLA113Hospital,Ningbo,315040,China;2.DepartmentofChestcardiaclaboratory,ChanghaiHospitalAffiliatedtoTheSecondMilitaryMedicalUniversity,Shanghai200433,China)
Objective To build a recombinant lentivirus vector which express SOX9 gene and marked by green fluorescent protein,transfect the rabbit bone marrow mesenchymal stem cells,and observe the expression of SOX9 gene.Methods Double enzymed plasmid 13 abiv6c_1366933 containing SOX9 gene sequences provided by GeneArt,and cloned into pLenti6.3 _MCS_IRES2 - EGFP carrier,got the plasmid pLMIG- 13 gs0345-1 including SOX9 gene,packed by 293T cells and then we got the lentivirus vectors recombined with SOX9 gene and green fluorescent protein markers (Lenti-SOX9-GFP).We transfected the Lenti-SOX9-GFP into rabbit bone marrow mesenchymal stem cells and observed the expression of SOX9 gene.Results Sequencing results showed that the insert sequence of plasmid gs0345 pLMIG - 13-1 was completely consistent with the SOX9 gene sequences (NM_000346) in the Genbank.We Successfully built the lentivirus vector recombined with SOX9 and green fluorescent protein gene.The expression of green fluorescent protein can be observed after the rabbit bone marrow mesenchymal stem cells transfected by Lenti-SOX9-GFP.The RT-PCR and Western Blot test results also proved that the mRNA and protein expression of SOX9 gene could successfully observed after the rabbit BMSCs cells transfected by Lenti-SOX9-GFP.Conclusion A recombinant lentivirus vector containing SOX9 and green fluorescent protein gene was successfully constructed and successfully expressed in the rabbit BMSCs cells,provided preliminary experimental basis for further research.
Lentiviral vector;Bone marrow derived mesenchymal stem cells;SOX9 gene;Green fluorescent protein
1007-4287(2017)01-0140-06
南京军区重点课题 (12Z06)
Q813
A
刘伟(1982-),男,主治医师,医学博士。研究方向:脊柱外科和组织工程。
2016-05-10)
