生漆中漆酚单体分离、化学结构修饰及生物活性研究进展
2017-02-11王成章涛1陈虹霞1冉1
周 昊,王成章∗,邓 涛1,陈虹霞1,陶 冉1
(1.中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局 林产化学工程重点开放性实验室;江苏省 生物质能源与材料重点实验室,江苏 南京 210042;2.中国林业科学研究院 林业新技术研究所,北京 100091)
·综述评论——生物质天然活性成分·
生漆中漆酚单体分离、化学结构修饰及生物活性研究进展
周 昊1,2,王成章1,2∗,邓 涛1,陈虹霞1,陶 冉1
(1.中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局 林产化学工程重点开放性实验室;江苏省 生物质能源与材料重点实验室,江苏 南京 210042;2.中国林业科学研究院 林业新技术研究所,北京 100091)
漆酚化合物是具有C15或C17烃基侧链的邻苯二酚结构,侧链不饱和度为0~3。漆酚良好的抗肿瘤、抑菌和抗氧化活性使其受到越来越多的关注。对不同不饱和度烃基漆酚单体的分离方法进行了叙述,介绍了通过对漆酚的苯环或侧链烃基进行化学结构修饰这2种途径以获得结构相对稳定的漆酚衍生物,并阐述了漆酚单体及其衍生物的抗肿瘤、抗氧化、抑菌和抗病毒等生物活性。
生漆;漆酚;单体分离;结构修饰;生物活性
生漆是漆树(Toxicodendron verniciflum(Stokes)F.A.Barkl.)韧皮部位分泌的一种乳白色液体,是我国重要的林木资源,世界上85%的生漆产自中国[1]。生漆传统用作涂料,是人类所使用的最早的天然涂料,在我国已有几千年的历史,生漆漆膜色泽光亮,耐久性、抗腐蚀、耐溶剂和绝缘性能极佳,素有“涂料之王”的美誉[2]。然而由于生漆具有致敏性、干燥时间长、成膜慢、耐碱性差、色彩深和成本高等弊端,生漆大多为合成漆所代替,从而导致我国生漆产量逐年减少,传统生漆产业衰退[2]。生漆的主要化学成分是漆酚(60%~70%)、漆多糖(5%~7%)、漆酶(<1%)和水分(20%~30%),其中漆酚是一种邻苯二酚结构的烃基酚类化合物,其侧链为不同饱和度的直链C15或C17的烃基,研究表明漆酚具有很好的抗氧化、抗肿瘤、抑菌、抗病毒等生物活性,极具药物开发价值[3]。然而,漆酚结构不稳定,容易氧化聚合,此外漆酚中不同不饱和度烃基酚极性相似,使得漆酚单体分离困难,从而限制了漆酚作为临床药物的开发与应用。近年来针对漆酚的结构特征进行化学修饰,以期得到结构稳定、生物活性更强的化合物已成为国内外漆酚研究的热点。现将近年来生漆中漆酚单体分离、结构修饰及其抗肿瘤、抗氧化、抑菌和抗病毒等活性的研究进展综述如下,以期为漆酚药物开发与应用提供理论指导。
1 生漆中漆酚的化学结构
漆酚是邻苯二酚衍生物的混合物,其侧链为C15或C17的烃基,侧链烃基的不饱和度为0~3。图1以毛坝生漆为例给出了所得漆酚的化学组成与结构。Honda等[4]研究发现不同产地生漆中漆酚的侧链烃基碳原子数和不饱和度存在明显差异,如中国和日本漆树属于Rhus vernicifera,生漆中漆酚以侧链为C15的三烯烃基漆酚为主,越南和中国台湾漆树属于Rhus succedanea,生漆中漆酚以侧链为C17的三烯烃基漆酚为主,缅甸和柬埔寨漆树属于Melanorrhoea usitata,生漆中漆酚以侧链为C17的二烯烃基漆酚为主。何源峰等[5]采用HPLC-MS等手段对中国毛坝生漆(Rhusvernicifera Maoba lacquer)中漆酚的化学组成和结构进行了研究,结果表明中国毛坝漆中漆酚主要是由侧链为C15的饱和、单烯、双烯和三烯烃基漆酚组成,其中三烯烃基漆酚的量最高,达到65%,而饱和、单烯、双烯烃基漆酚的量分别为4.5%、15%和15.5%。

图1 中国毛坝生漆中漆酚的化学结构Fig.1 The chem ical structure of urushiol in M aoba lacquer of China
2 生漆中漆酚单体的分离
漆酚的化学组成复杂,饱和、单烯、双烯和三烯烃基漆酚的结构相近,极性差异小,且漆酚容易氧化聚合,因此漆酚单体的分离极为困难。早期由于分离技术水平低且设备条件差,无法对生漆中漆酚单体进行直接分离,通常是将漆酚衍生化后再进行单体分离和结构表征。国外对生漆单体分离研究很早,1954年,美国Sunthankar等[6]先将漆酚进行二甲醚衍生化,然后以三氧化二铝为吸附材料、石油醚为洗脱剂,采用柱层析方法从日本生漆(Rhus vernicifera lacquer)中分离出4种漆酚同系物,其中侧链为C15的三烯烃基漆酚1个、饱和烃基漆酚1个、双烯烃基漆酚2个。1980年,日本 Yamauchi等[7]利用漆酚的不饱和双键与银离子能形成可逆的络合物这一原理,使用含硝酸银的硅胶层析柱对乙酰化的漆酚进行分离,以苯-氯仿溶剂为洗脱液,从日本生漆中分离鉴定了7种漆酚单体,其中侧链为C15的三烯烃基漆酚2个、饱和烃基漆酚1个、双烯烃基漆酚2个、单烯烃基漆酚2个。随着填料技术及色谱应用的发展,逐渐出现了对漆酚直接分离的研究。Hatada等[8]以中国生漆为原料,采用HPLC法,以乙腈/水/醋酸(体积比90∶10∶2)为流动相,从中分离得到侧链为C15的三烯烃基漆酚单体,并通过1H NMR、13C NMR 和1H COSY等手段对其进行结构鉴定。Lu等[9]采用 GPC法,以三氯甲烷为洗脱液,从缅甸漆酚(Melanorrhoea usitata lacquer)中分离出5种漆酚单体,经气相色谱-质谱联用技术(GC-MS)鉴定为侧链为C17的单烯烃基漆酚2个、饱和烃基漆酚1个、双烯烃基漆酚2个。Kim等[10]采用液质联用技术(LC/APCI-ITMS)不经衍生化直接从韩国生漆(Rhus succedanea lacquer)中分离了13个漆酚类化合物,经NMR鉴定为C15及C17的三烯烃基漆酚7个、C15及C17的二烯烃基漆酚3个、C15的单烯烃基漆酚2个、C15的饱和烃基漆酚1个。
国内在生漆的分离方面也开展了大量研究工作。早在1984年,Du等[11]第一次实现了HPLC法对生漆中未经衍生化漆酚的分离,利用十八烷基硅烷键合硅胶(ODS)柱,以乙腈/水/醋酸(体积比80∶20∶2)为流动相,从中国生漆中成功分离鉴定出13种漆酚单体。先对漆酚进行衍生化处理再分离的研究更早,1983年,林乔源等[12]以中国生漆为原料,先将其中的漆酚进行二甲醚衍生化,然后采用薄层色谱法分离鉴定了6种漆酚单体,其中C15侧链的三烯烃基漆酚2个、二烯烃基漆酚2个、单烯烃基漆酚1个、饱和烃基漆酚1个。随后,邱峰等[13]通过先将漆酚乙酰化,然后采用涂渍AgNO3的离心旋转薄层层析法,从中国生漆中分离出5种漆酚单体,并通过1D和2D-NMR技术鉴定为C15侧链的三烯烃基漆酚2个、二烯烃基漆酚1个、单烯烃基漆酚1个、饱和烃基漆酚1个。吴采樱等[14]采用气相色谱自制强极性二乙二醇丁二酸聚酯(DEGS)毛细管柱从中国生漆中分离出硅醚化漆酚13个,经GC-MS鉴定出C15侧链的饱和漆酚1个、C15及C17侧链的单烯烃基漆酚3个、二烯烃基漆酚4个、三烯烃基漆酚5个,显示出气相色谱分析比液相色谱更好的分离效果。李林等[15]采用高效液相色谱-电喷雾-质谱(HPLC-ESI-MS)技术,以甲醇/水(体积比88∶12)为流动相,从中国生漆中分离鉴定了9种漆酚单体,其中C15侧链的三烯烃基漆酚2个、二烯烃基漆酚2个、单烯烃基漆酚1个以及C17侧链的三烯烃基漆酚2个、单烯烃基漆酚2个。
3 漆酚的化学结构修饰
3.1 漆酚中苯环的化学结构修饰
漆酚中苯环的化学结构修饰目前主要是将苯环上的2个邻位的酚羟基进行醚化、酯化、氨基化、磺酰胺化等改性,生成系列漆酚衍生物。对苯环进行化学修饰不仅可阻止漆酚氧化聚合,还可增强漆酚的抑菌、抗肿瘤、抗氧化等生物活性。图2是漆酚苯环结构修饰后得到的漆酚衍生物的化学结构。

图2 漆酚中苯环化学修饰后的漆酚衍生物Fig.2 Urushiol derivatives of chem icalmodification of benzene ring
黄载福等[16]通过将漆酚先进行催化加氢反应,再与冠醚反应,合成了饱和漆酚冠醚,与原漆酚相比,其脂溶性和成膜性能明显改善。Wang等[17]将漆酚与二氯甲烷进行反应,以NaOH为催化剂,合成了亚甲基醚漆酚,其对肿瘤细胞的毒性明显增强。Kim等[18]将漆酚与甲基丙烯酰氧基三甲氧基硅烷(MPS)反应,合成了甲基丙烯酰氧基二甲氧基硅醚化漆酚(YPUOH),其不仅具有很好的抑菌、抗氧化生物活性,且热稳定性明显增强。Eisohly等[19]将漆酚苯环上的一个酚羟基甲基醚化后,再通过另一个酚羟基与4-氯-2-苯基喹唑啉反应,合成了2-苯基喹唑啉醚基漆酚;另外通过将漆酚苯环上的一个酚羟基改性,合成了氨基漆酚和甲基磺酰胺漆酚等衍生物,结果表明其致敏性明显降低。近年来出现直接在漆酚苯环上引入活性基团的报道,王冬晖等[20]以漆酚和N-羟甲基丙烯酰胺为原料,通过Fridel-Crafts烷基化反应,合成了丙烯酰胺甲基漆酚,其具有优异的抗菌性能。由此可见,对漆酚苯环进行结构修饰,不仅可提高其结构稳定性、降低其致敏性,而且可增强其生物活性,但是目前的研究主要是针对苯环的邻二酚羟基进行修饰,针对苯环其他部分结构修饰较少,对漆酚衍生物的构效关系研究也还很缺乏。
3.2 漆酚侧链烃基的化学结构修饰
国内外有关漆酚侧链烃基结构修饰的研究报道较少。漆酚侧链具有双键,可进行氧化、环加成等反应,引入羧基、酮基、羟基等基团。图3是漆酚侧链烃基结构修饰得到的衍生物的化学结构。Roberts 等[21]通过在漆酚侧链尾部引入α-亚甲基-γ-丁内酯基团,合成了α-亚甲基-γ-丁内酯漆酚衍生物,结果表明其对皮肤致敏性明显降低。Jefferson等[22]以甲基醚漆酚为原料,分别通过侧链烷基的氧化反应、缩醛反应等,合成了甲基醚漆酚乙二醇、甲基醚漆酚乙酸酯和甲基醚漆酚缩丙酮衍生物,其具有很好的抑菌性能。何源峰[23]以亚甲基醚漆酚为原料,与马来酸酐进行Diels-Alder反应,再通过水解反应,在漆酚侧链尾部引入邻二甲酸环己烯结构,合成了侧链二羧基漆酚衍生物,与原漆酚相比,其抑菌活性有所降低。
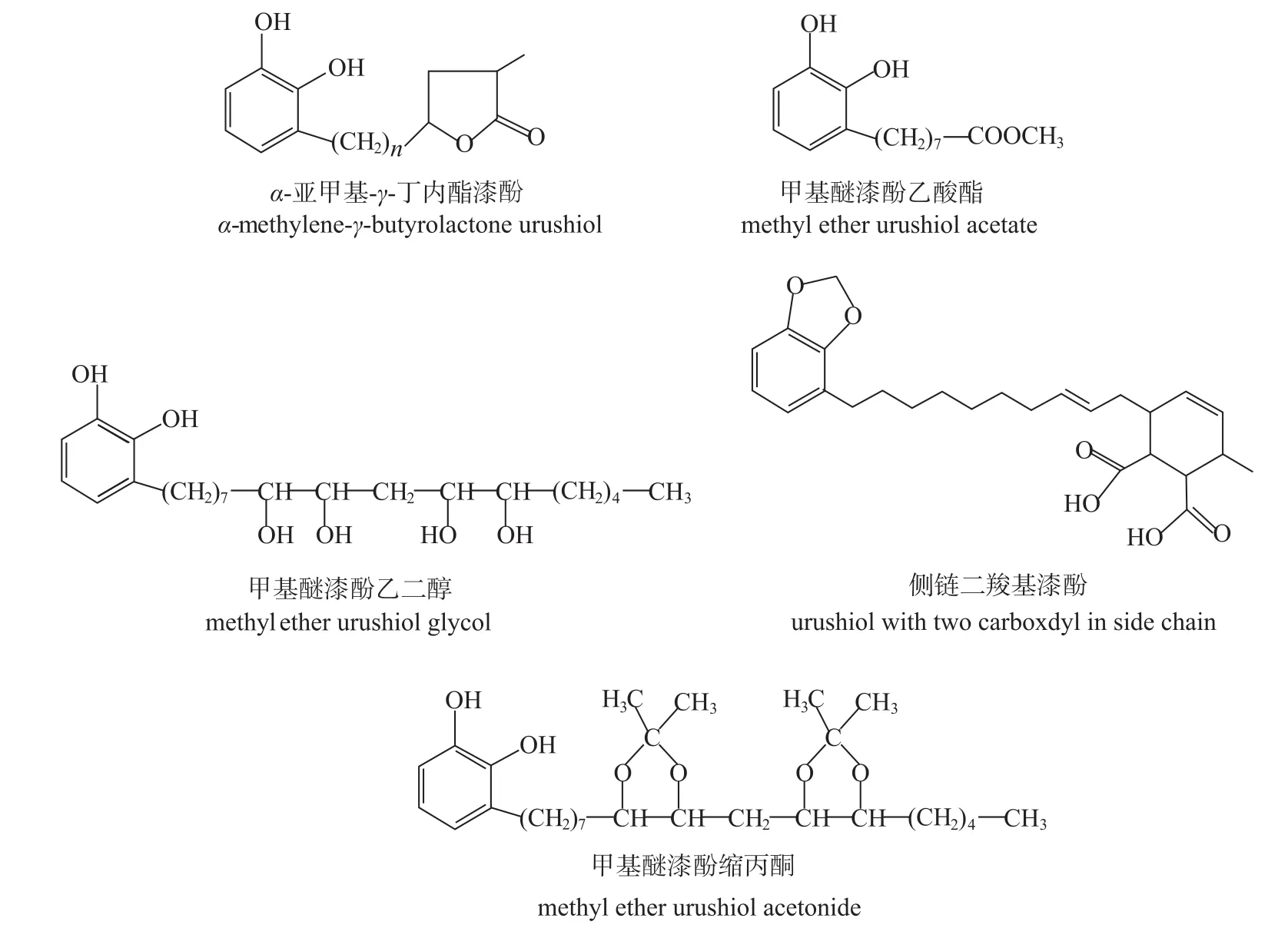
图3 侧链烃基化学修饰后的漆酚衍生物Fig.3 Urushiol derivatives of chem icalm odification of alkyl side chain of urushiol
4 漆酚的生物活性
4.1 抗肿瘤活性
漆酚具有很好的抗肿瘤活性,对多种肿瘤如卵巢癌、肝癌、乳腺癌、前列腺癌、食道癌、骨髓癌、结肠癌、肺癌及白血病等均具有良好的疗效[24]。研究表明,漆酚可通过诱导肿瘤细胞凋亡、抑制肿瘤细胞增殖、抑制肿瘤血管生成、抑制核转录因子活性、毒杀肿瘤细胞等途径来有效发挥抗肿瘤作用[25-32]。Lee等[25]发现漆酚可抑制淋巴癌细胞DNA合成,并能通过细胞毒性效应促进肿瘤细胞凋亡,对淋巴癌具有很好的治疗效果。Luo等[26]研究发现漆酚对肝癌细胞具有显著的毒杀作用,其作用机制是促进细胞内活性氧生成从而破坏肿瘤细胞的DNA。Kim等[27]从韩国漆树中分离漆酚,并对其抗肿瘤活性进行研究,发现其对胃癌细胞具有很好的毒杀作用,能够通过DNA片段化、聚腺苷二磷酸(ADP)核糖聚合酶断裂、p53基因依赖途径的蛋白激酶抑制因子调节等机制促进肿瘤细胞凋亡。Ryckewaert等[28]的研究发现漆酚的肿瘤细胞毒性与其对肿瘤细胞中组蛋白去乙酰化(SIRT)酶的抑制作用有关,体外试验测定C15侧链的单烯、双烯和三烯烃基漆酚分别对SIRT酶抑制活性和对人胚肾、宫颈癌细胞的毒性,发现,随着漆酚侧链双键数目的增加,其SIRT酶抑制活性和肿瘤细胞毒性明显增强。杨梅等[29]研究发现C15不饱和侧链的漆酚可显著抑制人脐静脉内皮细胞的增殖、迁移与成管,达到抑制肿瘤新生血管形成的功效,此外研究还发现其对多种肿瘤细胞株具有较强的细胞毒性(IC50值为0.7~40μmol/L)。Chen 等[30]从中国台湾漆树中分离出C17侧链的单烯烃基漆酚,发现其可通过抑制酪氨酸酶的活性抑制黑色素瘤的产生。Kim等[31]和Choi等[32]的研究表明漆酚对宫颈癌和卵巢癌细胞具有很好的细胞毒作用,且该作用与破坏肿瘤细胞DNA合成和促进细胞凋亡等机制有关。
4.2 抗氧化活性
漆酚是一种酚类化合物,苯环上的羟基能起到抗氧化作用,因此漆酚具有很好的抗氧化和清除自由基等功效。Kim等[33]研究发现漆酚具有很好的清除自由基和抑制脂质过氧化的功效,但是其衍生物甲基醚漆酚却不能清除自由基和抑制脂质过氧化,说明漆酚中酚羟基是抗氧化作用的功能基团。Lee 等[25]从韩国漆树中分离漆酚,发现其对羟基自由基及超氧阴离子均具有很好的清除作用。Chakraborty 等[34]研究发现漆酚可阻止人体内自由基引起的氧化性DNA损伤,还可减少氧化嘌呤和嘧啶的生成,对多种疾病具有预防作用。Lee等[35]以小鼠胸腺细胞为模型,研究了漆酚的抗氧化作用,表明其对氧自由基尤其是羟基自由基具有极强的清除作用。Hong等[36]以小鼠肝脏为模型,研究了漆酚的抗氧化作用,结果表明其可通过增加谷胱甘肽过氧化酶的含量来增强机体的抗氧化能力。Liu等[37]研究发现漆酚类化合物可减少人皮肤中基质金属蛋白酶-1的表达,抵抗由过量自由基引起的氧化应激,具有很好的防止皮肤老化的效果。何源峰[23]分别研究了C15侧链的单烯、双烯和三烯烃基漆酚的自由基清除能力,结果显示三烯烃基漆酚的自由基清除能力最强,其次是双烯烃基漆酚,单烯烃基漆酚的自由基清除能力最弱,推测漆酚的抗氧化能力还可能与双键提供的电子数目有关。
4.3 抑菌活性
近年来研究显示,漆酚及其衍生物对多种细菌和真菌均具有较好的抑制作用[38-41]。何源峰[23]研究了中国生漆中C15侧链漆酚的抑菌活性,结果表明其对肺炎克雷伯氏菌、产气肠杆菌、大肠埃希菌、金黄色葡萄球菌和表皮葡萄球菌均具有很好的抑制效果,同时随着漆酚侧链不饱和度的增加,抑菌能力呈增高趋势;此外还对亚甲基醚漆酚和侧链二羧基亚甲基醚漆酚的抑菌活性进行了研究,结果显示这些漆酚衍生物具有明显的抑菌性能,但抑菌活性均低于原漆酚,可能是由于漆酚结构中的邻二酚羟基对抑菌活性影响较大,另外侧链二羧基亚甲基醚漆酚的抑菌活性强于亚甲基醚漆酚。Jeong等[38]研究了硅醚化漆酚衍生物(YPUOH)的抑菌活性,表明其对革兰氏阳性、阴性菌及酵母菌(如大肠杆菌、金黄色葡萄球菌、酿酒酵母)均具有很好的抑制效果,抑菌率达99.9%。Suk等[39]研究表明C15侧链漆酚对幽门螺旋杆菌具有很强的抑制作用,其最小抑菌质量浓度(MIC)为0.064~0.256 g/L。Song等[40]研究发现漆酚对炭疽病真菌具有很好的抑菌效果,当其质量浓度为1 g/L时,抑菌率达到75%以上。Cho等[41]研究表明漆酚对金黄色酿脓葡萄球菌、表皮葡萄球菌、绿脓杆菌、大肠杆菌、枯草芽孢杆菌、沙门氏菌、变异链球菌、弧菌、白色念珠菌、幽门螺旋杆菌等均具有很强的抑菌效果,其最小抑菌浓度(MIC)为0.03~0.75mmoL/L。王冬晖等[20]研究了丙烯酰胺甲基漆酚的抑菌活性,结果表明其在抗菌涂料中质量分数为10%时,对于金黄色葡萄球菌和大肠杆菌的抑菌率都达到100%。
4.4 其他生物活性
漆酚除具有抗肿瘤、抗氧化、抑菌等生物活性外,还具有抗病毒、抗脂肪肝等功效。Kadokura等[42]从漆树叶中分离得到漆酚,研究表明其对艾滋病病毒I型反转录酶具有很好的抑制功效,其IC50值为12.6mmoL/L。Kim等[43]分别研究了C15侧链的单烯、双烯和三烯烃基漆酚对艾滋病病毒反转录酶的抑制活性,结果表明三烯烃基漆酚的抑制活性最强,其IC50值为10.87mg/L。Hong等[36]研究发现漆酚可通过提高自然杀伤(NK)细胞活性,抑制甘油三酯的产生,提高高密度脂蛋白胆固醇的含量,从而达到抑制非酒精性脂肪肝疾病的发生。Bang等[44]研究表明漆酚对酒精性肝病具有很好的治疗效果,可通过抑制Toll样受体(TLR)-4、白介素1β及肿瘤坏死因子-α等细胞因子的表达,抑制酒精引起的脂肪肝的产生。
5 展望
我国拥有丰富的生漆资源,生漆中漆酚具有很好的抗肿瘤、抗氧化、抑菌等功效,具有巨大的医药开发潜力。漆酚是由C15或C17烃基邻苯二酚衍生物组成的混合物,漆酚单体的获得是实现其药物开发的首要关键,目前通过硅胶柱层析、高效液相色谱、薄层色谱等方法,可以分离得到不同饱和度烃基侧链的漆酚单体,但是目前漆酚单体分离还处于实验室少量分离阶段,未能实现大批量生产,因此需要引进新的分离技术,以实现逐渐从微量的实验室制备向大规模的工业化分离制备的深入发展,从而为漆酚药物开发提供原料。尽管漆酚具有很好的生物活性,但是漆酚的结构非常不稳定,容易氧化聚合,限制了其应用,这也是漆酚尚未开发成新药的重要原因。近年来,通过对漆酚化学结构的修饰得到结构稳定、生物活性更强、实用价值更大的化合物,成为漆酚研究与利用的一个重要方向。目前漆酚的结构修饰主要是针对邻二酚羟基进行保护,防止其氧化聚合,已合成的漆酚衍生物种类较少,针对漆酚侧链及苯环的结构修饰很少,此外对漆酚衍生物的构效关系研究还很缺乏。因此对于漆酚的结构修饰还有待深入系统研究。相信随着对漆酚类化合物研究不断深入,此类化合物有望成为药物应用于临床。
[1]张飞龙,李钢.生漆的组成结构与其性能的关系研究[J].中国生漆,2000,19(3):31-37.
[2]孙祥玲,吴国民,孔振武.生漆改性及其应用进展[J].生物质化学工程,2014,48(2):41-47.
[3]赵喜萍,魏朔南.中国生漆化学成分研究[J].中国野生植物资源,2007,26(6):1-4.
[4]HONDA T,LU R,SAKAI R,et al.Characterization and comparison of asian lacquer saps[J].Progress in Organic Coatings,2008,61 (1):68-75.
[5]何源峰,王成章,陆榕.HPLC-MS法表征坝漆酚类化合物的结构[J].林产化学与工业,2012,32(6):47-51.
[6]SUNTHANKAR S V,DAWSON C R.The structural identification of the olefinic components of Japanese lac urushiol[J].Journal of the American Chemical Society,1954,76(20):5070-5074.
[7]YAMAUCHIY,OSHIMA R,KUMANOTANIJ.Separation of Japanese lac urushiol diacetate on silver nitrate-coated silica gel columns by highperformance liquid chromatography[J].Journal of Chromatography A,1980,198(1):49-56.
[8]HATADA K,KITAYAMA T,NISHIURA T,et al.Structural analysisof the components of Chinese lacquer“Kuro-urushi”[J].Macromolecular Chemistry and Physics,1994,195(5):1865-1870.
[9]LUR,YUKIOK,TETSUOM.Characterization of lipid componentsof Melanorrhoea usitata lacquer sap[J].Talanta,2007,71(4):1536-1540. [10]KIM D H,CHOIJO,YANG JS,etal.Analysis of urushiols by liquid chromatography/atmospheric pressure chemical ionization-ion trap mass spectrometry[J].Journal of Liquid Chromatography&Related Technologies,2003,26(1):17-28.
[11]DU Y M,OSHIMA R,KUMANOTANIJ.Reversed-phase liquid chromatographic separation and identification of constituents of uroshiol in the sap of the lac tree,Rhus vernicifera[J].Journal of Chromatography A,1984,284:463-473.
[12]林乔源,许奎钫,胡邦豪,等.中国漆漆酚的核磁共振研究[J].科学通报,1983,28(5):274-276.
[13]邱峰,李丽云,黄照庚,等.中国生漆漆酚组分的分离及NMR研究[J].波谱学杂志,1987,4(4):337-343.
[14]吴采樱,曾昭睿.用毛细管柱分离鉴定中国生漆中漆酚的组成结构[J].中国生漆,1992,11(4):3-5.
[15]李林,魏朔南,胡正海.生漆中漆酚类化合物的HPLC-ESI-MS分析[J].西北大学学报:自然科学版,2010,40(6):1017-1019.
[16]黄载福,喻宗源,束家有.饱和漆酚冠醚的研究进展[J].有机化学,1985,5(6):497-502.
[17]WANG C Z,HE Y F,ZHOU H,et al.Preparation and characterization of urushiol methylene acetal derivatives with various degrees of unsaturation in alkyl side chain[J].International Journal of Polymer Science,2015,3:1-6.
[18]KIM D,JEON S L,SEO J.The preparation and characterization of urushiol powders(YPUOH)based on urushiol[J].Progress in Organic Coatings,2013,76(10):1465-1470.
[19]EISOHLY M A,ADAWADKAR P D,BENIGNID A,et al.Analogues of poison ivy urushiol.Synthesis and biological activity of disubstituted n-alkybenzenes[J].Journal of Medicinal Chemistry,1986,29(5):606-611.
[20]王冬晖,张萌,白卫斌,等.具类辣素漆酚衍生物的制备及其抑菌性能[J].中国生漆,2015,34(3):47-51.
[21]ROBERTSDW,BENEZRA C.Quantitative structure-activity relationships for skin sensitization potential of urushiol analogues[J].Contact Dermatitis,1993,29(2):78-83.
[22]JEFFERSON A,WANGCHAREONTRAKUL S.Long-chain phenols:Urushiol,laccol,thitsiol and phenylalkyl catechol compounds in burmese lac from melanorrhoea usitata[J].Journal of Chromatography A,1986,367:145-154.
[23]何源峰.生漆漆酚的结构修饰及生物活性的研究[D].北京:中国林业科学研究院硕士学位论文,2013.
[24]HONG D H,HAN SB,LEE CW,et al.Cytotoxicity of urushiols isolated from sap of korean lacquer tree(Rhus vernicifera Stokes)[J]. Archives of Pharmacal Research,1999,22(6):638-641.
[25]LEE JC,KIM J,JANG Y S.Ethanol-eluted extract of Rhus verniciflua stokes inhibits cell growth and induces apoptosis in human lymphoma cells[J].Journal of Biochemistry and Molecular Biology,2003,36(4):337-343.
[26]LUO L H,JIANG L P,GENG C Y,et al.Hydroquinone-induced genotoxicity and oxidative DNA damage in HepG2 cells[J].Chemico-Biological Interactions,2008,173(1):1-8.
[27]KIM S,KIM D H,LEE SH,et al.Urushiol induces apoptosis via a p53-dependent pathway in human gastric cancer cells[J].Journal of Cancer Prevention,2013,18(2):169-176.
[28]RYCKEWAERT L,SACCONNAY L,CARRUPT PA,etal.Non-specific SIRT inhibition asamechanism for the cytotoxicity of ginkgolic acids and urushiols[J].Toxicology Letters,2014,229(2):374-380.
[29]杨梅,何江波,程永现,等.3-[(Z)-十五碳-8-烯基]儿茶酚的全合成及其抗肿瘤血管生成活性研究[J].有机化学,2013,33 (6):1319-1325.
[30]CHEN Y R,CHIOU R Y Y,LIN T Y,et al.Identification of an alkylhydroquinone from Rhus succedanea as an inhibitor of tyrosinase and melanogenesis[J].Journal of Agricultural and Food Chemistry,2009,57(6):2200-2205.
[31]KIM JW,RYU K E,JANG H S,et al.Cytotoxic effect of urushiol-ethanolmicro-particles on human cervical carcinoma cells[J].Journal of Pharmaceutical Investigation,2004,34(1):23-27.
[32]CHOI J Y,PARK C S,CHOI J,et al.Cytotoxic effect of urushiol on human ovarian cancer cells[J].Journal of Microbiology and Biotechnology,2001,11(3):399-405.
[33]KIM JY,CHO JY,MA Y K,etal.Nonallergenic urushiolderivatives inhibit the oxidation of unilamellar vesiclesand of ratplasma induced by various radical generators[J].Free Radical Biology and Medicine,2014,71:379-389.
[34]CHAKRABORTY A,FERK F,SIMIC T,et al.DNA-protective effects of sumach(Rhus coriaria L.),a common spice:Results of human and animal studies[J].Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis,2009,661(1):10-17.
[35]LEE JC,KIM J,LIM K T,et al.Ethanol eluted extract of Rhus verniciflua Stokes showed both antioxidant and cytotoxic effects on mouse thymocytes depending on the dose and time of the treatment[J].BMB Reports,2001,34(3):250-258.
[36]HONG SH,SUK K T,CHOISH,et al.Anti-oxidant and natural killer cell activity of Korean red ginseng(Panax ginseng)and urushiol (Rhus vernicifera Stokes)on non-alcoholic fatty liver disease of rat[J].Food and Chemical Toxicology,2013,55:586-591.
[37]LIU C S,NAM T G,HAN M W,et al.Protective effect of detoxified Rhus verniciflua stokes on human keratinocytes and dermal fibroblasts against oxidative stress and identification of the bioactive phenolics[J].Bioscience,Biotechnology,and Biochemistry,2013,77 (8):1682-1688.
[38]JEONG S,KIM D,SEO J.Preparation and the antioxidantand antibacterial activities of urushiol powders(YPUOH)[J].Progress in Organic Coatings,2014,77(5):981-987.
[39]SUK K T,KIM H S,KIM M Y,etal.In vitro antibacterial andmorphological effects of the urushiol componentof the sap of the Korean lacquer tree(Rhus vernicifera Stokes)on Helicobacter pylori[J].Journal of Korean Medical Science,2010,25(3):399-404.
[40]SONG C H,CHUNG JB,JEONG B R,et al.Antifungal activity of crude extract compound from Rhus verniciflua against anthracnose fungi (Collectotrichum spp.)of red-pepper[J].Korean Journal of Environmental Agriculture,2012,31(1):60-67.
[41]CHO J Y,PARK K Y,KIM S J,et al.Antimicrobial activity of the synthesized non-allergenic urushiol derivatives[J].Bioscience,Biotechnology,and Biochemistry,2015,79(11):1915-1918.
[42]KADOKURA K,SURUGA K,TOMITA T,et al.Novel urushiols with human immunodeficiency virus type 1 reverse transcriptase inhibitory activity from the leaves of Rhus verniciflua[J].Journal of Natural Medicines,2015,69(1):148-153.
[43]KIM M J,CHOIW C,BARSHINIKOV A M,et al.Inhibitory effects of the extract of Rhus verniciflua Stokes on the reverse transcriptase of AIDS[J].Korean Journal of Medicinal Crop Science,2002,10(4):284-287.
[44]BANG C S,HONG SH,SUK K T,et al.Effects of Korean red ginseng(Panax ginseng),urushiol(Rhus vernicifera Stokes),and probiotics (Lactobacillus rhamnosus R0011 and lactobacillus acidophilus R0052)on the gut-liver axis of alcoholic liver disease[J].Journal of Ginseng Research,2014,38(3):167-172.
Progress on the Monomer Separation,Chemical Structural Modification and Biological Activity of Urushiol from Raw Lacquer
ZHOU Hao1,2,WANG Chengzhang1,2,DENG Tao1,CHEN Hongxia1,TAO Ran1
(1.Institute of Chemical Industry of Forest Products,CAF;National Engineering Lab.for Biomass Chemical Utilization;Key and Open Lab.of Forest Chemical Engineering,SFA;Key Lab.of Biomass Energy and Material,Jiangsu Province,Nanjing 210042,China;2.Research Institute of Forestry New Technology,CAF,Beijing 100091,China)
Urushiol possesses catechol structure with C15or C17alkyl side chain.They consist of different alkyl phenols with the degree of unsaturation from 0 to 3.The potent antitumor,antimicrobial and antioxidant activities of urushiol have been greatly concerned.In this paper,the research progresses on separation method of different urushiol monomer are described.And the chemical structuremodification of benzene ring and alkyl side chain urushiol to obtain stable urushiol derivatives are introduced. And then,the anti-tumor,antioxidant,antibacterial,antiviral activities of urushiolmonomers and their derivatives are discussed.
raw lacquer;urushiol;monomer separation;structuralmodification;biological activity
TQ35
:A
:1673-5854(2017)01-0044-07
10.3969/j.issn.1673-5854.2017.01.008
2016-04-25
江苏省生物质能源与材料重点实验室基本科研业务费项目(JSBEM-S-201509)
周昊(1982—),女,江苏盐城人,助理研究员,硕士,主要从事天然产物化学与利用研究
∗通讯作者:王成章(1966—),男,研究员,博士生导师,主要从事植物提取物化学加工与利用研究;E-mail:wangczlhs@sina.com。
