两种重编程系统诱导人牙源性多潜能干细胞的对比研究*
2017-02-10谭小兵徐静舒孙贵虎宋俊呈戴青原
谭小兵,徐静舒,孙贵虎,宋俊呈,戴青原△
(1.云南省第一人民医院/昆明理工大学附属医院口腔内科,昆明 650032;2.昆明医科大学第一附属医院心内科,昆明 650032)
两种重编程系统诱导人牙源性多潜能干细胞的对比研究*
谭小兵1,徐静舒1,孙贵虎2,宋俊呈2,戴青原2△
(1.云南省第一人民医院/昆明理工大学附属医院口腔内科,昆明 650032;2.昆明医科大学第一附属医院心内科,昆明 650032)
目的 对比研究两种人牙源性多潜能干细胞重编程体系的特点。方法 分别利用STEMCCA慢病毒/饲养层和仙台病毒/基质胶两种重编程系统,将人根尖乳头干细胞重编程为iPS细胞,比较两种方法的诱导效率、诱导工作量、iPS细胞非整倍体核型比例、外源性基因消除难易程度等情况。结果 STEMCCA重编程体系需要制备饲养层细胞MEF,重编程效率约为0.1%,后期经Cre-Loxp酶切技术可得到无外源性转录基因的iPS细胞。仙台病毒重编程体系为无饲养层培养,基质胶制备方便、标准统一,重编程效率约为0.7%,明显高于STEMCCA系统(P<0.05),外源性病毒和转录基因经自然传代后逐渐消除。结论 与STEMCCA系统相比,仙台病毒/基质胶体系更适于人牙源性iPS细胞的诱导。
多潜能干细胞;乳头;干细胞;慢病毒属;人诱导性多潜能干细胞;根尖乳头干细胞;重编程;仙台病毒
自从2007年首次报道人多潜能干细胞(induced pluripotent stem cells,iPS细胞)以来,人们已成功将多种终末分化体细胞重编程为iPS细胞[1-5]。iPS细胞能分化为所有三胚层细胞,在组织再生、疾病模型、个性化治疗等方面具有巨大的应用前景。由于诱导iPS细胞时会利用外源性转录因子和载体,有可能在宿主体内形成肿瘤,成为制约iPS细胞应用于组织再生的一个瓶颈。目前有多种方法可以用来诱导体细胞重编程为iPS细胞,也有学者使用非染色体结合性诱导方法以降低外源性转录基因插入宿主染色体而致瘤的风险,包括质粒、cre-loxp酶切除、蛋白转运技术等[6-9]。饲养层的选择也是iPS细胞必须考虑的一个安全性问题。本研究采用两种重编程体系,即STEMCCA慢病毒+小鼠胚胎成纤维细胞(mouse embryonic firbroblasts,MEF)和仙台病毒+基质胶,将人根尖乳头干细胞(stem cells from apical papilla,SCAP)诱导为iPS细胞,从多方面比较两种方法,为建立安全有效的iPS细胞及进一步研究提供实验数据和指导。
1 材料与方法
1.1 材料 α-MEM培养基,DMEM培养基,DMEM-F12培养基,血清替代品,2.5 g/L胰蛋白酶,0.25 mmol/L 二乙胺四乙酸(EDTA),碱性成纤维细胞生长因子(bFGF)均购自美国Gibco公司;胎牛血清购自美国Hyclone公司;70 μm细胞过滤网、基质胶(生长因子减少型)购自美国BD公司;总RNA提取试剂盒购自德国QIAGEN公司;c-DNA合成试剂盒、iTaq DNA聚合酶、dNTP混合物购自美国BIO-RAD公司;STEMCCA Lentivirus Reprogramming Kits试剂盒购自美国Millipore公司;Hela Monster transfection reagent试剂盒购自美国Mirus公司;CytoTune®-iPS 2.0 Sendai Reprogramming Kit试剂盒购自美国Life公司,重编程培养基、PSC-easy培养基购自北京赛贝生物科技公司。
1.2 方法
1.2.1 人SCAP原代分离 收集云南省第一人民医院口腔颌面外科因阻生需要拔除的下颌第三磨牙(<20岁),按照Sonoyama等[10]方法进行细胞培养。
1.2.2 MEF的制备 按照本课题组之前研究方法进行制备[11]。
1.2.3 主要培养基组成 (1)MEF培养基:DMEM+10%胎牛血清+1%L-谷氨酰胺+1%青/链霉素+1%非必需氨基酸;(2)SCAP培养基:α-MEM+10%胎牛血清+1%L-谷氨酰胺+1%青/链霉素;(3)iPS培养基(用于H9和iPS细胞的培养):DMEM-F12+20%血清替代品+1%非必需氨基酸+1%L-谷氨酰胺+0.1 mmol/L β-巯基乙醇+4 ng/mL bFGF。
1.2.4 两种重编程体系
1.2.4.1 方法1 STEMCCA慢病毒体系参照本课题组方法进行[12]:转染前一天人SCAP细胞铺板,当天细胞50%融合,加入适量STEMCCA慢病毒和聚凝胺(5 μg/mL)混合物进行转染,24 h后换为MEF培养液。第4天收集已转染细胞,转移到MEF覆盖的培养板上。第2天换为iPS 培养基,隔日换液,两周内可观察到小克隆出现。克隆成熟时,“十字法”分离克隆,转移到新培养板内(MEF覆盖)继续培养,每日换液。切除转录基因:挑选第2代克隆,转移到抗嘌呤霉素MEF上培养。细胞60%融合时,将培养液换为加有2.5 μg pHAGE2-Cre-IRES-PuroR质粒DNA,7.5 μL Trans IT Hela试剂,5.0 μL MONSTER试剂的iPS培养基,24 h后换为iPS培养基再处理6 h,接着用含有嘌呤霉素(1.2 μg/mL)iPS培养基处理细胞,48 h后再换为iPS培养基。所有克隆开始会慢慢死去,2~4 d后克隆重新出现,逐渐长大后“十字法”分离挑选,转移到新的培养板内(MEF覆盖)正常培养。提取细胞克隆的基因组DNA,PCR扩增目的片段、凝胶电泳,明确外源性hSTEMCCA是否已无表达。STEMCCA慢病毒重编程及切除过程见图1。
1.2.4.2 方法2 仙台病毒诱导体系:转染前两天,将第3代人SCAP铺到6孔板内(1×105/孔),常规培养。转染当天(第0天),将适量SeV溶解到70 μL SCAP培养基内开始转染,1天后(第1天)再加入130 μL SCAP培养基,第2天换新鲜含SeV培养液继续转染。第3天将已转染细胞转移到基质胶覆盖6孔板内,重编程培养基继续培养,3周左右可观察到克隆出现。克隆成熟时,“十字法”分割克隆,转移到新培养板内(基质胶覆盖),PSC-easy培养基(含10 μmol/L Y27632)继续培养。提取第0、10及14代iPS克隆总RNA,逆转录为cDNA,PCR扩增目的片段、凝胶电泳,明确外源性病毒序列和转录基因是否已消除。仙台病毒重编程过程见图2。
图2 仙台病毒重编程过程简图
1.2.5 两种重编程系统的比较
1.2.5.1 iPS细胞克隆形态 观察iPS克隆在不同体系底物上的生长情况(人胚胎干细胞H9为标准对照)。
1.2.5.2 重编程效率 确定精确的重编程效率非常复杂,出现克隆数占重编程体细胞数量的比例是一个重要参数。计算公式:重编程效率=克隆数/体细胞数量×100%,重复3次,取平均值。
1.2.5.3 重编程时间 包括准备时间(培养基、饲养层细胞的制备),从目标细胞铺板到iPS克隆可以挑取所需时间。重复3次,取平均值。
1.2.5.4 外源性基因消除 比较两种方法得到的iPS细胞外源性重编程基因消除的时间和复杂程度。

2 结 果
2.1 两种系统得到的重编程iPS克隆形态 两种方法得到的iPS克隆在不同底物上状态良好,具有典型的胚胎干细胞样形态:圆形克隆,有清晰边界线,克隆内部细胞核大,有一个或几个核仁,胞质少,结构简单、排列致密整齐,见图3。
A:hSCAP-iPS(P15,×100);B:H9(P54,×100)生长于MEF;C:hSCAP-iPS(P15,×100);D:H9(P54,×100)生长于基质胶。
图3 不同底物人SCAP-iPS细胞生长情况
2.2 两种系统的重编程效率比较 人SCAP重编程前细胞数量大约为1×104,重编程后方法1得到10个克隆,重编程效率为0.1%;方法2共得到约70个克隆,重编程效率为0.7%,明显高于方法1(P<0.05),见图4。
2.3 两种系统的重编程时间比较 方法1准备时间3.0h,MEF铺板过夜12.0h,丝裂霉素处理时间2.0h,总计17.0h,重编程第28天克隆长大可以挑选扩增,同时后期酶切除、嘌呤霉素筛选等也增加了处理时间。方法2准备时间3.5h,重编程第26天时克隆长大可以挑选扩增(P<0.05),见图5。
图4 两种方法重编程效率比较
图5 两种方法重编程时间比较
2.4 两种系统的重编程效果比较 方法1得到的iPS克隆先用嘌呤霉素处理48h,此间所有克隆会慢慢消失,2~3d后重新出现的克隆为外源性基因可能已被切除的iPS克隆[4]。方法2得到的iPS克隆体外正常扩增培养数代后外源性基因及病毒序列即消除,RT-PCR结果也证实无外源性基因及病毒序列的表达,见图6。
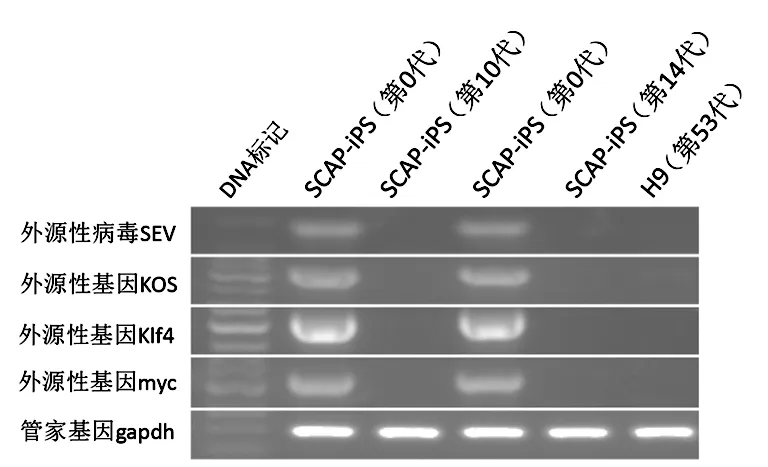
图6 无病毒、无转录基因人SCAP-iPS细胞
3 讨 论
提高重编程效率,减少外源性因素的影响,提高临床安全性是目前iPS细胞领域的研究热点,主要包括饲养层的选择和诱导方法的改进。自从iPS细胞产生以来,为了支持其能理想生长并长期维持未分化状态,同时获得安全性能高的iPS细胞,其培养条件经历了从饲养层细胞到无饲养层的演变,重编程方法也由结合性逐渐进展到非结合性诱导[13-14]。
作为最早的饲养层细胞,MEF可分泌多种必需生长因子和胞外基质等以支持iPS细胞的生长,但其分泌成分不明,MEF及其产物对iPS细胞可能是病原菌的来源[15],影响iPS细胞的生长及安全性。STEMCCA重编程系统与目标细胞DNA的结合最小化,可减少DNA插入突变和病毒再激活,后期利用Cre/LoxP将外源性转录基因切除,得到安全性更高的iPS细胞。本课题组[12]、Sommer等[16]成功利用STEMCCA重编程系统得到iPS细胞,但外源性转录基因切除后宿主DNA仍有部分残留,临床安全性能不足。基质胶主要由层粘连蛋白、Ⅳ型胶原、生长因子等组成,可以为iPS细胞生长提供理想支持,是目前最为常用的培养底物[13]。Seki等[17]、Soares等[18]的研究证实仙台病毒重编程系统为RNA病毒,不会结合到宿主细胞基因组内,转录基因表达效率高,病毒及转录基因随着iPS细胞的传代扩增,易于从目标细胞中消除,临床安全性能高。
尽管已有多项研究证实STEMCCA/MEF系统与仙台病毒/基质胶系统均可诱导人皮肤成纤维细胞得到iPS细胞,但这两种系统对人牙源性细胞的重编程效果未见报道。本研究利用这两种重编程体系将人SCAP诱导为iPS细胞,得到的iPS克隆均具有典型胚胎干细胞形态。STEMCCA重编程体系诱导时间较长,重编程效率低,后期还要切除外源性基因,操作繁琐,不可控因素较多,难以统一标准。仙台病毒重编程体系重编程效率高、时间短,外源性转录基因和病毒也易于去除,同时基质胶制备方便、标准统一,易于操控。
综上所述,与STEMCCA/MEF体系相比,仙台病毒/基质胶系统更适于诱导人SCAP重编程为iPS细胞,为后期iPS细胞用于牙髓再生和干细胞移植治疗等提供可靠的重编程方法。
[1]TakahashiK,TanabeK,OhnukiM,etal.Inductionofpluripotentstemcellsfromadulthumanfibroblastsbydefinedfactors[J].Cell,2007,131(5):861-872.
[2]YuJY,VodyanikMA,Smuga-OttoKA,etal.Inducedpluripotentstemcelllinesderivedfromhumansomaticcells[J].Science,2007,318(5858):1917-1920.
[3]TakahashiK,OkitaK,NakagawaMA.Inductionofpluripotentstemcellsfromfibroblastcultures[J].NatProtoc,2007,2(12):3081-3089.
[4]MontesR,RomeroT,CabreraS,etal.GenerationandcharacterizationofthehumaniPSClinePBMC1-iPS4F1fromadultperipheralbloodmononuclearcells[J].StemCellRes,2015,15(3):614-617.
[5]AasenT,RayaA,BarreroMJ,etal.EfficientandrapidGenerationofinducedpluripotentstemcellsfromhumankeratinocytes[J].NatBiotechnol,2008,26(11):1276-1284.
[6]YamanakaS.Inducedpluripotentstemcells:past,present,andfuture[J].CellStemCell,2012,10(6):678-684.
[7]DoweySN,HuangX,ChouBK,etal.Generationofintegration-freehumaninducedpluripotentstemcellsfrompostnatalbloodmononuclearcellsbyplasmidvectorexpression[J].NatProtoc,2012,7(11):2013-2021.
[8]MerlingRK,SweeneyCL,ChoiU,etal.Transgene-freeiPSCsgeneratedfromsmallvolumeperipheralbloodnonmobilizedCD34+cells[J].Blood,2013,121(14):e98-107.
[9]ZhouHY,WuSL,JooJY,etal.Generationofinducedpluripotentstemcellsusingrecombinantproteins[J].CellStemCell,2009,4(5):381-384.
[10]SonoyamaW,LiuY,YamazaT,etal.Characterizationoftheapicalpapillaanditsresidingstemcellsfromhumanimmaturepermanentteeth:apilotstudy[J].JEndod,2008,34(2):166-171.
[11]谭小兵,GeorgeTH.人胚胎干细胞和诱导性多功能干细胞饲养层细胞的制备方法[J].国际口腔医学杂志,2014,41(3):268-271.
[12]ZouXY,YangHY,YuZ,etal.Establishmentoftransgene-freeinducedpluripotentstemcellsreprogrammedfromhumanstemcellsofapicalpapillaforneuraldifferentiation[J].StemCellResTher,2012,3(5):43.
[13]Villa-DiazLG,RossAM,LahannJ,etal.Concisereview:theevolutionofhumanpluripotentstemcellculture:fromfeedercellstosyntheticcoatings[J].StemCells,2013,31(1):1-7.
[14]JiP,ManupipatpongS,XieN,etal.Inducedpluripotentstemcells:generationstrategyandepigeneticmysterybehindreprogramming[J].StemCellsInt,2016:8415010.
[15]Ghasemi-DehkordiP,Allahbakhshian-FarsaniM,AbdianN,etal.Comparisonbetweentheculturesofhumaninducedpluripotentstemcells(hiPSCs)onfeeder-andserum-freesystem(Matrigelmatrix),MEFandHDFfeedercelllines[J].JCellCommunSignal,2015,9(3):233-246.
[16]SommerAG,RozelleSS,SullivanS,etal.GenerationofhumaninducedpluripotentstemcellsfromperipheralbloodusingtheSTEMCCAlentiviralvector[J].JVisExp,2012(68):4327.
[17]SekiT,YuasaS,FukudaK.GenerationofinducedpluripotentstemcellsfromasmallamountofhumanperipheralbloodusingacombinationofactivatedTcellsandSendaivirus[J].NatProtoc,2012,7(4):718-728.
[18]SoaresFA,PedersenRA,VallierL.Generationofhumaninducedpluripotentstemcellsfromperipheralbloodmononuclearcellsusingsendaivirus[J].MethodsMolBiol,2015(1357):23-31.
A comparative study of two reprogramming systems for inducing pluripotent stem cells from human dental origin*
TanXiaobing1,XuJingshu1,SunGuihu2,SongJuncheng2,DaiQingyuan2△
(1.DepartmentofCariologyandEndodontics,YunnanProvincialFirstPeople′sHospital/AffiliatedHospitalofKunmingUniversityofScienceandTechnology,Kunming,Yunnan650032,China;2.DepartmentofCardiology,FirstAffiliatedHospitalofKunmingMedicalUniversity,Kunming,Yunan650032,China)
Objective To comparatively study the features of two reprogramming systems of induced pluripotent stem cells(iPSCs) from human dental origin.Methods Two kinds of reprogramming system,i.e.STEMCCA lentivirus /feed layer and Sendai virus /matrigel were used to induce human stem cells from apical papilla(SCAP) into iPSCs,respectively.The induction efficiencies,workload of generating iPSCs,aneuploidy karyotype ratio,complexities of eliminating exogenous transcription factors and specific markers expression were compared between these two systems.Results The STEMCCA reprogramming system required to prepare the feeder cell MEF.The reprogramming efficiency was 0.1%.Transcription gene-free iPSCs cells were obtained by the Cre-loxp enzyme digestion technique at the later stage.Sendai virus reprogramming system was feeder-free and the preparation of matrigel was quite simple with unified standard.The reprogramming efficiency was 0.7%,which was much higher than that of STEMCCA system(P<0.05).The exogenous virus and transgenes could be gradually eliminated after several passages of natural subclone.Conclusion The Sendai virus/matrigle reprogramming system is much more applicable for the induction of iPSCs from dental origin than the STEMCCA system.
pluripotent stem cells;nipples;stem cells;lentivirus;human induced pluripotent stem cells;stem cells from apical papilla;reprogramming;sendai virus
�术与方法·
10.3969/j.issn.1671-8348.2017.01.021
国家自然科学基金资助项目(81360161);云南省教育厅基金资助项目(2015Y153)。
谭小兵(1974-),副主任医师,硕士,主要从事干细胞在牙髓再生方面研究。△
R781
A
1671-8348(2017)01-0091-03
2016-07-26
2016-09-27)
