人参皂苷Rh2调控PI3K/AKT/GSK-3β信号通路诱导人结肠癌细胞凋亡
2017-02-08石雪萍冉建华李海星陈地龙
石雪萍,李 静,冉建华,熊 伟,李海星,郭 珮,陈地龙
(重庆医科大学基础医学院干细胞与组织工程研究室,重庆 400016)
人参皂苷Rh2调控PI3K/AKT/GSK-3β信号通路诱导人结肠癌细胞凋亡
石雪萍,李 静,冉建华,熊 伟,李海星,郭 珮,陈地龙
(重庆医科大学基础医学院干细胞与组织工程研究室,重庆 400016)
目的 探究人参皂苷Rh2(ginsenoside Rh2, Rh2)诱导人结肠癌细胞SW480凋亡作用机制。 方法 CCK-8法检测Rh2对SW480细胞增殖的影响;流式细胞术(Flow cytoMetry, FCM)检测Rh2对SW480细胞凋亡的影响;Hoechst33258染色观察Rh2对SW480细胞凋亡形态学的影响;Western blot检测经Rh2诱导SW480细胞中凋亡相关蛋白Bcl-2、Bax、p53、cleaved caspase-3,PI3K/AKT/GSK-3β信号通路相关蛋白PI3K、AKT、P-AKT、GSK-3β、P-GSK-3β表达量变化;LY294002、Rh2单独及联合诱导SW480细胞后,蛋白PI3K、AKT、P-AKT、GSK-3β、P-GSK-3β表达量变化。结果 CCK-8结果显示Rh2呈时间浓度依赖抑制SW480细胞增殖。FCM结果显示细胞早期凋亡率由正常对照组的(0.70±0.09)%增至(11.06±1.04)% (P<0.05)。Hoechst33258结果显示,Rh2诱导SW480细胞48h后呈现典型的凋亡形态学改变。Western blot结果显示,经Rh2诱导的SW480细胞,凋亡相关蛋白 Bcl-2表达降低,Bax、p53、激活型胱天蛋白酶3(cleaved caspase-3)蛋白表达增加;PI3K/AKT/GSK-3β信号通路蛋白PI3K、P-AKT、P-GSK-3β表达量与对照组比较明显减少,AKT、GSK-3β表达量无明显变化;LY294002、Rh2和LY294002与Rh2联合诱导SW480细胞后,总AKT蛋白和总GSK-3β蛋白表达量基本一致,LY294002与Rh2联合用药对SW480细胞中PI3K、P-AKT和P-GSK-3β的表达抑制作用较单独用药更加明显。结论 Rh2可能是通过抑制PI3K/AKT/GSK-3β通路,激活p53信号通路,激活caspase-3,破坏Bcl-2/Bax比例,诱导结肠癌细胞SW480凋亡。
人参皂苷Rh2;人结肠癌SW480细胞;PI3K/AKT/GSK-3β;p53;Bcl-2;Bax;cleaved caspase-3;凋亡
人参作为历史悠久的传统名贵中药材,近年来,应用于许多肿瘤的辅助性治疗。人参皂苷Rh2 (ginsenoside Rh2, Rh2) 作为人参的主要有效成分之一,具有较高的抗肿瘤活性,研究表明其对多种肿瘤细胞具有抑制增殖,诱导凋亡的作用[1-5]。目前关于Rh2对结肠癌作用的研究包括Rh2能够通过阻滞细胞处于S期抑制结肠癌细胞增殖[6],诱导结肠癌细胞凋亡[7],以上研究肯定了Rh2抑制结肠癌细胞增殖,诱导凋亡的作用,但对其具体机制研究甚少。PI3K/AKT/GSK-3β信号通路在多种细胞凋亡的过程中扮演了重要的角色,那么Rh2诱导结肠癌SW480细胞凋亡能否通过经典的PI3K/AKT/GSK-3β通路发挥作用,目前尚未见报道。
本研究拟观察Rh2作用结肠癌细胞后,对其增殖和凋亡的影响,凋亡相关蛋白及PI3K/AKT/GSK-3β信号通路蛋白表达量变化;PI3K抑制剂LY294002、Rh2单独及联合诱导SW480细胞后,PI3K/AKT/GSK-3β信号通路蛋白表达量变化。旨在探讨Rh2对结肠癌细胞凋亡的影响及其可能作用机制。
1 材料与方法
1.1 细胞与试剂 人结肠癌细胞系SW480细胞由重庆医科大学附属医院肿瘤分子研究中心惠赠[来源于美国模式培养物集存库(american type culture collection, ATCC)];Rh2购自成都曼斯特生物科技有限公司(20 mg/支),相对分子质量为622.87, HPLC检测纯度≥98%;DMEM培养基、胎牛血清均购自 HyClone 公司;0.25% 胰酶购自Gibco公司;Cell Counting Kit-8 (CCK-8) 试剂盒购自日本株式会社同仁化学研究所;LY294002、Hoechst 33258染液、 BCA蛋白浓度测定试剂盒(增强型)、 RIPA裂解液(强)、 PMSF(100 nmol·L-1)、SDS-PAGE凝胶配制试剂盒购自碧云天生物技术有限公司;6孔板和96孔板购自 NEST 公司;抗体 β-actin、兔抗人 IgG 购自巴傲得生物科技有限公司;抗体 p53 、 Bcl-2 、 Bax 、 cleaved caspase-3、 PI3K 和 AKT 购自沈阳万类科技有限公司;抗体 p-AKT 、 GSK-3β 、p-GSK-3β 购自美国 Cell Signaling Technology; PVDF 膜和 ECL 显色剂购自 Miliproe 公司。
1.2 方法
1.2.1 细胞培养及药品储存液配制 人结肠癌 SW480 细胞用含 10% 胎牛血清DMEM 完全培养基,于 37℃ , 5% CO2饱和湿度下常规培养,每 2~3 d传代1次。
人参皂苷 Rh2(20 mg/支)溶于 200 μL DMSO 配制成 160 mmol·L-1储存液, -20℃ 保存,实验时用10%胎牛血清的高糖 DMEM 培养基稀释成相应浓度( DMSO 终体积分数不能超过 0.1% )。
1.2.2 CCK-8 法检测 SW480 细胞增殖抑制率 取处于对数生长期的 SW480 细胞,调整细胞密度为 1×108·L-1, 以每孔 100 μL 的细胞悬液接种于96孔板,培养5~6 h 贴壁后弃去培养上清液。配制终浓度为10、30、50、70 μmol·L-1的 Rh2 ,每孔 200 μL ,每个浓度设置3个复孔,各药物诱导组作为实验组。空白组为含10%胎牛血清的200 μL完全培养基,对照组为含与实验组等量细胞的200 μL细胞悬液。细胞培养24、48、72 h后,每孔加入20 μL 的 CCK-8试剂并放孵箱孵育2.5 h ,酶标仪于450 nm波长处测定各孔的吸光度(A值),并计算药物诱导组细胞生存抑制率和各个时间点的半数抑制浓度(IC50),以IC50为标准确定药物最适作用浓度和时间。细胞生存抑制率由下面公式计算:抑制率/%=(AControl 组-ARh2)/AControl组-A空白对照组)×100%1.2.3 FCM检测结肠癌 SW480 细胞凋亡 取对数生长期的SW480细胞,以5 × 108·L-1的密度接种于直径为6 cm 的培养皿,设置对照组和药物组,培养24 h后 药物组分别加入终浓度为10、30和50 μmol·L-1的 Rh2处理48 h,收集上清液并用PBS洗涤2次,收集全细胞,每组样本测定3×104个细胞,流式细胞仪检测采用Cell Quest 软件分析得出细胞凋亡率。实验重复3次。
1.2.4 Hoechst 33258染色检测SW480细胞核形态变化 将无菌的防脱盖玻片置于6孔板内,以2×108·L-1的密度接种在6孔板内。培养24 h,分别设置对照组(0 μmol·L-1)和药物组(10、30、50 μmol·L-1)处理48 h,吸尽培养基,PBS洗涤2遍,每孔加入1 mL固定液,固定30 min 。弃去固定液,用 PBS洗涤3次,每次2 min。避光加入1 mL Hoechst 33258 染色液,染色5 min。去除染色液,用 PBS 洗3遍,每次5 min 。用抗荧光淬灭封片液将盖玻片封片于载玻片上,使用荧光显微镜观察,采图。实验重复3次。
1.2.5 蛋白质免疫印迹法( Western blot )检测相关蛋白 取对数生长期的 SW480 细胞,调整细胞数为 6×108·L-1,接种于直径10 cm 培养皿,每皿6 mL。①分别设置对照组和药物组,培养24 h后药物组加入终浓度为10、30、50 μmol·L-1的 Rh2诱导 48 h;②分别设置对照组、 Rh2(50 μmol·L-1) 、 LY294002(20 μmol·L-1)、 LY294002(20 μmol·L-1)+Rh2(50 μmol·L-1)组,培养24 h后,分别加入对应的药物组诱导48 h。用细胞裂解液在冰上同时裂解细胞组20 min ,12 000×g,离心15 min,提取各组总蛋白,BCA法测定蛋白含量。酶标仪测定各组蛋白质含量并配平,使各组蛋白终浓度为 5 g·L-1。每个加样孔加样 50 μg,采用 SDS-PAGE 胶分离蛋白,70~110 V电泳;4℃、250 mA恒流条件下转膜。封闭液 37℃ 封闭2 h,采用兔抗人p53(1 ∶1 000) 、 Bcl-2(1 ∶1 000)、 Bax(1 ∶500)、 cleaved caspase-3(1 ∶500) 、 PI3K(1 ∶1 000) 、 AKT(1 ∶1 000)、p-AKT(1 ∶1 000)、GSK-3β(1 ∶1 000)、p-GSK-3β(1 ∶1 000)、β-actin(1 ∶10 000) , 4℃ 孵育过夜, TBST 漂洗, 37℃ 孵育山羊抗兔IgG(1 ∶10 000) 二抗20 min, TBST 漂洗, ECL 试剂发光, Bio-Rad 发光系统呈像。采用 Bio-Rad-Image-Lab-Software 分析测定条带,检测分析条带灰度值,用各组目的条带的灰度值和内参的灰度值比值表示蛋白质相对表达水平。
1.3 统计学方法分析 采用SPSS 22.0软件进行统计学分析,进行独立样本t检验。
2 结果
2.1 人参皂苷 Rh2 能有效抑制人结肠癌 SW480 细胞增殖 运用 CCK-8 法检测 Rh2对SW480细胞增殖抑制率。结果显示, Rh2 10、30、50和70 μmol·L-1作用于SW480细胞 24、48、72 h,SW480 细胞的增殖受到明显抑制(Fig 1),与对照组比较,差异有统计学意义(P<0.01)。 Rh2作用于 SW480 细胞 24、 48、72 h的半数致死浓度(IC50)分别为 61.74 μmol·L-1、52.26 μmol·L-1、39.57 μmol·L-1。由Fig 1可见, Rh2 对 SW480 细胞的抑制作用呈时间浓度依赖性。
2.2 Rh2 对人结肠癌 SW480 细胞凋亡的影响
2.2.1 FCM 检测 Rh2 诱导人结肠癌 SW480 细胞凋亡 Rh2 10、 30、 50 μmol·L-1作用于 SW480 细胞48 h后, SW480 细胞的早期凋亡率分别为(5.37±0.54)% 、(8.71±1.29)% 和 (11.06±1.04)%,随着药物浓度升高, SW480 细胞的凋亡率逐渐增加,与正常对照组的 (0.70±0.09)% 相较,差异有统计学意义(P<0.01)(Fig 2,Tab 1)。

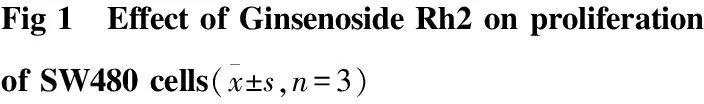
**P<0.01vscontrol group(24h);▽▽P<0.01vscontrol group(48h);##P<0.01 compared with control group(72 h)

Fig 2 Effect of Ginsenoside Rh2 on apoptosis of SW480 cells detected by FCM

Rh2/μmol·L-1Apoptoticrate/%Control0.710±0.09105.37±0.54∗∗308.71±1.29∗∗5011.06±1.04∗∗
**P<0.01vscontrol group
2.2.2 Hoechst 33258 染色观察人结肠癌细胞 SW480 凋亡形态学改变 Hoechst 3328 检测结果(Fig 3)显示, Rh2 处理对照组 SW480 细胞48 h后,对照组发出均匀的淡蓝色荧光,细胞核无明显凋亡形态学特征; Rh2 10、30、50 μmol·L-1分别诱导48 h后,随着药物浓度增加,各组出现核染色质浓缩聚集、核碎裂、核边集及发出蓝白色荧光等典型的凋亡改变,且呈明显浓度依赖性。

Fig 3 Effect of Ginsenoside Rh2 on morphology of SW480 cells detected by Hoechst33258
A:control; B:10 μmol·L-1; C: 30 μmol·L-1; D:50 μmol·L-1. Arrows show pathologic changes in apoptosis
2.3 Rh2诱导人结肠癌SW480细胞调控相关蛋白表达
2.3.1 Rh2 对 SW480 细胞凋亡相关蛋白调控 SW480 细胞经10、30、50 μmol·L-1Rh2诱导48 h后收集细胞提取总蛋白, Western blot 进行凋亡相关蛋白表达量变化分析。结果显示(Fig 4),与对照组相较,抑凋亡蛋白 Bcl-2 表达水平逐渐下降;促凋亡蛋白 Bax、抑癌蛋白p53和激活型caspase-3表达水平升高逐渐升高,与对照组比较差异均有统计学意义(P<0.05)。此结果提示, Rh2诱导SW480细胞凋亡过程,可能通过p53信号通路破坏Bcl-2/Bax比例和caspase-3激活共同参与。
2.3.2 Rh2 对 SW480 细胞 PI3K/AKT/GSK-3β 信号通路相关蛋白调控 SW480 细胞经10、30、50 μmol·L-1Rh2诱导48 h后收集细胞提取总蛋白,Western blot 进行PI3K/AKT/GSK-3β信号通路相关蛋白表达量变化分析。结果显示(Fig 5),与对照组相比较,各实验组总 AKT 蛋白和总 GSK-3β 蛋白表达量基本无变化,与对照组相比较差异无统计学意义(P>0.05 ); PI3K、P-AKT和P-GSK-3β蛋白表达量呈逐渐减少趋势,与对照组比较差异有统计学意义(P<0.05)。结果提示,在 Rh2诱导SW480细胞凋亡过程中,PI3K/AKT/GSK-3β信号通路可能发挥了重要作用。

Fig 4 Effect of Ginsenoside Rh2 on apoptosis protein expression of SW480 cells detected by Western blot
A:control; B:10 μmol·L-1; C: 30 μmol·L-1; D:50 μmol·L-1.*P<0.05,**P<0.01vscontrol group.
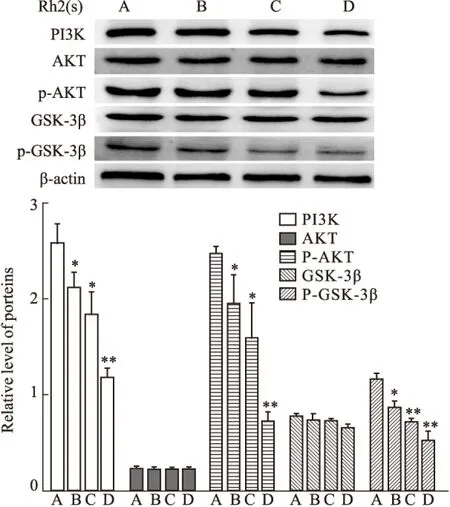
Fig 5 Effect of Ginsenoside Rh2 on proteins of PI3K/AKT/GSK-3β expression of SW480 cells detected by Western blot
A:control; B:10 μmol·L-1; C:30 μmol·L-1; D:50 μmol·L-1.*P<0.05,**P<0.01vscontrol group.
2.3.3 Rh2和LY294002诱导SW480细胞,PI3K/AKT/GSK-3β信号通路相关蛋白表达量变化 SW480 细胞经 Rh2(50 μmol·L-1) 、 LY294002(20 μmol·L-1) 、 LY294002+Rh2 组诱导48 h后收集,提取总蛋白, Western blot 进行 PI3K/AKT/GSK-3β信号通路相关蛋白表达量变化分析。结果显示(Fig 6),与对照组比较,各实验组总 AKT 蛋白和总 GSK-3β 蛋白表达量基本一致,与对照组比较差异无统计学意义(P>0.05);与对照组比较, LY294002 诱导组较 Rh2诱导组对 PI3K、P-AKT和P-GSK-3β蛋白的下调作用更明显;且两药联合诱导后,表现出协同作用,对 SW480 细胞中PI3K、P-AKT和P-GSK-3β的表达抑制作用较单独用药更加明显(P<0.05)。结果提示 Rh2 诱导细胞凋亡可能是通过抑制 PI3K/AKT/GSK-3β 信号通路,下调 P-AKT 和 P-GSK-3β 来实现的。
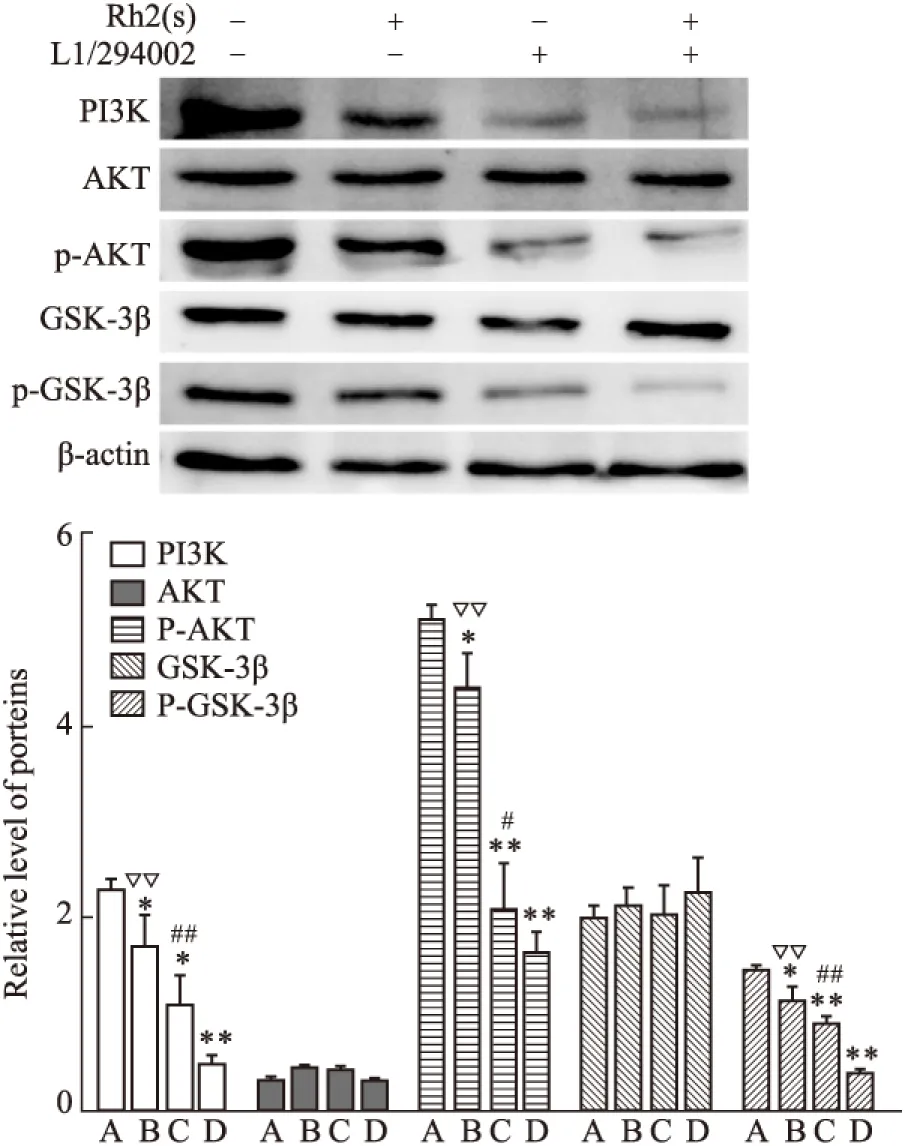
Fig 6 Effect of Ginsenoside Rh2 and LY294002 on proteins of PI3K/AKT/GSK-3β expression of SW480 cells detected by Western blot
A:control; B:Rh2(50 μmol·L-1); C:LY294002(20 μmol·L-1); D:Rh2+LY294002.*P<0.05,**P<0.01vscontrol group;▽▽P<0.01,Rh2vsRh2+LY294002;#P<0.05,##P<0.01,LY294002vsRh2+LY294002
3 讨论
结肠癌作为胃肠道常见的恶性肿瘤,近年来,其发病率和致死率呈逐年上升趋势。人参皂苷 Rh2 作为一种中国传统中药人参的主要成分之一,大量研究表明,其不仅对正常细胞脂溶性毒性很低,还具有很高的抗肿瘤活性,能够有效阻滞肿瘤细胞的细胞周期、诱导凋亡和分化[8-10],提高荷瘤机体免疫功能,抑制肿瘤转移[11]等多种作用。有关人参皂苷 Rh2 对结肠癌的增殖抑制和诱导凋亡已有相关文献报道[12],但对其调节机制在分子水平层面的报道甚少,且其调节机制在分子水平也没有彻底阐明。
PI3K/AKT 通路是机体内重要信号通路,通过调节细胞增殖、凋亡作用而参与多种肿瘤发生发展的过程。磷酸化 AKT 通过促进丝氨酸/苏氨酸残基底物磷酸化二而发挥抗凋亡的作用,糖原合成酶激酶-3β( glycogen synthase kinase 3β, GSK-3β )作为细胞内主要的丝氨酸/苏氨酸家族激酶,是 AKT的重要底物。在多种肿瘤中,肿瘤抑制因子 p53 可直接与 GSK-3β 结合,激活的 GSK-3β 能够增加激活型 caspase-3 的表达水平[13],这可能会促进凋亡。在结直肠癌细胞系和结直肠肿瘤中, GSK-3β 的表达水平和活化形式均高于正常, PI3K/AKT 信号通路也处于异常活化水平,磷酸化 GSK-3β 可以抑制促凋亡蛋白Bax蛋白线粒体转位和抗凋亡分子Bcl-2的降解,维持线粒体稳定而抑制凋亡。
本实验用人参皂苷Rh2诱导人结肠癌SW480细胞,通过CCK-8、FCM和Hoechst33258检测其增殖、凋亡指标,确定人参皂苷Rh2对结肠癌SW480细胞具有抑制增殖、促进凋亡的作用;研究结果表明,人参皂苷Rh2能明显抑制人结肠癌SW480细胞增殖,并且呈一定的时间浓度依赖性。Hoechst33258染色结果显示,SW480细胞经过人参皂苷Rh2诱导48 h后,SW480细胞出现了典型的细胞核染色质浓缩聚集,核碎裂,并发出较强蓝白色荧光等细胞凋亡特征。FCM检测结果也证实了Rh2能诱导结肠癌SW480细胞的早期凋亡,随着人参皂苷Rh2浓度增加,SW40细胞凋亡率逐渐升高。综上,人参皂苷Rh2可以诱导SW480细胞凋亡,阻止结肠癌的进一步恶化。本实验运用了多个实验方法从多方面验证文献报道Rh2对结肠癌细胞抑制增殖,诱导凋亡的作用,并且根据实验结果选择出对人结肠癌细胞SW480细胞最适Rh2药物浓度为52.26 μmol·L-1。
运用 Western blot 检测凋亡和 PI3K/AKT/GSK-3β 信号通路相关蛋白的表达,探究人参皂苷 Rh2诱导结肠癌SW480细胞凋亡可能机制。LY294002 作为 PI3K/AKT/GSK-3β 信号通路特异性抑制剂,可以阻断该信号通路的激活。Western blot 结果显示,经Rh2诱导后的SW480细胞抗凋亡蛋白Bcl-2表达量下降,促凋亡蛋白 Bax、抑癌蛋白p53和激活型caspase-3表达水平升高;PI3K/AKT/GSK-3β信号通路相关蛋白总AKT和总GSK-3β与对照组比较基本保持一致,PI3K、P-AKT、P-GSK-3β蛋白表达量降低,并且呈浓度依赖性。经LY294002处理的SW480细胞中,PI3K/AKT/GSK-3β信号通路的激活被阻断。另LY294002、Rh2联合用药组与LY294002单独诱导组、Rh2单独诱导组比较,可进一步抑制PI3K/AKT/GSK-3β信号通路中P13K、p-AKT、p-GSK-3β蛋白表达。提示P13K/AKT/GSK-3β可能不是Rh2诱导SW480细胞凋亡的唯一通路。
综上所述, Rh2 对人结肠癌 SW480 细胞有明显抗肿瘤活性,其作用机制可能是 Rh2 能够抑制 SW480 细胞中的 P13K/AKT/GSK-3β 的激活,激活 p53 信号通路,激活 caspase-3,破坏 Bcl-2/Bax 比例,诱导结肠癌细胞 SW480 凋亡。
(致谢:本实验在重庆医科大学干细胞与组织工程研究室完成。衷心感谢组胚平台的所有老师及同学对我的支持与帮助!)
[1] Chen Y, Liu Z H, Xia J, et al. 20(S)-ginsenoside Rh2 inhibits the proliferation and induces the apoptosis of KG-1a cells through the Wnt/beta-catenin signaling pathway[J].OncolRep, 2016,36(1):137-46.
[2] Qian J, Li J, Jia J G, et al. Ginsenoside-Rh2 inhibits proliferation and induces apoptosis of human gastric cancer SGC-7901 side population cells[J].AsianPacJCancerPrev,2016,17(4):1817-21.
[3] Yang Z, Zhao T, Liu H, et al. Ginsenoside Rh2 inhibits hepatocellular carcinoma through beta-catenin and autophagy[J].SciRep, 2016,6: 19383.
[4] 张春晶, 于海涛, 侯金才. S型与R型人参皂苷Rh2对人肺癌A549细胞增殖和凋亡的影响[J].中国中药杂志,2011,36(12):1670-4.
[4] Zhang C J, Yu H T, Hou J C. Effect of 20(s)-ginsenoside Rh2 and 20(R)-ginsenoside Rh2 on proliferation and apoptosis of human lung adenocainoma A549 cells[J].ChinJChinMeterMed,2011,36(12):1670-4.
[5] 盛 磊, 郝树芳, 周洁芸, 等.人参皂苷Rh2抑制实验性大鼠子宫异位内膜增殖及其作用机制探讨[J].中国药理学通报,2013,29(5):718-23.
[5] Sheng L, Hao S F, Zhou J Y, et al. Ginsenoside Rh2 inhibits growth of ectopic endometrium in rat model and mechanism of action[J].ChinPharmecolBull,2013,29(5):718-23.
[6] 李秋影, 颜璐璐, 马晓慧, 等.20(S)-人参皂苷Rh2对人结肠癌细胞增殖和周期的影响[J].中成药,2011,33(11):1874-8.
[6] Li Q Y, Yan L L, Ma X H, et al.Effect of 20(s)-ginsenoside Rh2 on cell proloferation and cycle of human colon cancer cells[J].ChinTraditPatMed,2011,33(11):1874-8.
[7] Zhu C L, Liu F, Qian W B, et al. Combined effect of sodium selenite and ginsenoside Rh2 on HCT-116 human colorectal carcinoma cells[J].ArchIranMed,2016,19(1):23-9.
[8] Choi S, Kim T W, Singh S V. Ginsenoside Rh2-mediated G1 phase cell cycle arrest in human breast cancer cells is caused by p15 Ink4B and p27 Kip1-dependent inhibition of cyclin-dependent kinases[J].PharmRes,2009,26(10): 2280-8.
[9] Kim Y S, Jin S H, Lee Y H, et al. Differential expression of protein kinase C subtypes during ginsenoside Rh2-lnduced apoptosis in SK-N-BE(2) and C6Bu-1 cells[J].ArchPharmRes,2000,23(5): 518-24.
[10]Zeng X L,Tu Z G. Induction of differentiation by ginsenoside Rh2 in hepatocarcinoma cell SMMC-7721 [J].AiZheng,2004,23(8): 879-84.
[11]Tatsuka M, Maeda M, ota T. Anticarcinogenic effect and enhancement of metastatic potential of BALB/c 3T3 cells by ginsenoside Rh(2)[J].JpnJCancerRes,2001, 92(11): 1184-9.
[12]Li B, Zhao J, Wang C Z, et al. Ginsenoside Rh2 induces apoptosis and paraptosis-like cell death in colorectal cancer cells through activation of p53[J].CancerLett,2011,301(2): 185-92.
[13]Watcharasit P, Bijur G N, Zmijewski J W, et al. Direct, activating interaction between glycogen synthase kinase-3beta and p53 after DNA damage[J].ProcNatlAcadSciUSA,2002, 99(12): 7951-5.
Ginsenoside Rh2 induced human colorectal cancer cell apoptosis through PI3K/AKT/GSK-3β pathway
SHI Xue-ping, LI Jing, RAN Jian-hua, XIONG Wei, LI Hai-xing, GUO Pei,CHEN Di-long
(ChongqingMedicalUniversity,LaboratoryofStemCellsandTissueEngineering,CollegeofBasicMedicine,Chongqing400016,China)
Aim To investigate the effect of Ginsenoside Rh2 on apoptosis in human colorectal cancer cell SW480, and to explore the possible mechanism of it. Methods The proliferation activity of SW480 treated with Ginsenoside Rh2 was measured CCK-8 assay. Apoptosis rates were evaluated by FCM. Hoechst 33258 staining was used to observe cell nucleus morphological; change SW480 cells were treated with Ginsenoside Rh2, and the protein expressions of Bcl-2, Bax, p53, cleaved caspase-3, PI3K, AKT, P-AKT, GSK-3β, P-GSK-3β were detected by Western blot; SW480 cells were treated with LY294002, Rh2, LY294002+Rh2, the expressions of PI3K, AKT, P-AKT, GSK-3β, P-GSK-3β were detected by Western blot. Results The proliferation of SW480 cells was significantly inhibited by Ginsenoside Rh2 in dose-dependent and time-dependent manner. FCM showed the inducing apoptosis effect of Ginsenoside Rh2 was significantly different from that of control group. Hoechst 33258 staining indicated clearly cell apoptosis in Ginsenoside Rh2 treatment groups. Western blot showed Ginsenoside Rh2 decreased expression of Bcl-2, increased expression of Bax, p53 and cleaved caspase-3, PI3K/AKT/GSK-3β pathway proteins PI3K, P-AKT, P-GSK-3β decreased obviously, AKT and GSK-3β were not changed significantly in SW480. SW480 cells were separately treated with LY294002, Rh2, LY294002+Rh2, there were no significant difference in AKT and GSK-3β protein among all groups, and the expression of PI3K, P-AKT, P-GSK-3β decreased more obviously in LY294002+Rh2 group compared with LY294002 and Rh2 alone. Conclusion Rh2 induces colorectal cancer cell apoptosis through PI3K/AKT/GSK-3β pathway, which activates p53 and cleaved caspase-3, and destroys the balance of Bcl-2/Bax.
Ginsenoside Rh2; human colorectal cancer cell SW480; PI3K/AKT/GSK-3β; p53;Bcl-2;Bax; cleaved caspase-3; apoptosis
时间:2016-12-27 16:13
http://www.cnki.net/kcms/detail/34.1086.R.20161227.1613.040.html
2016-08-15,
2016-11-12
国家自然科学基金资助项目(No 31271368)
石雪萍(1989-),女,硕士生,研究方向:药物抗肿瘤作用及机制,E-mail:18983006530@163.com; 陈地龙(1971-),男,博士,研究员,研究方向:中药药理学,通讯作者,E-mail:xinmengyuandlc@163.com
10.3969/j.issn.1001-1978.2017.01.020
A
1001-1978(2017)01-0114-06
R284.1;R329.25;R329.24;R735.35;R977.6
