杨桃根总提取物对糖尿病小鼠肾功能及其抗氧化应激作用的研究
2017-02-08徐小惠范氏泰和韦晓洁黄仁彬
徐小惠,范氏泰和,韦晓洁,覃 妮,黄仁彬
(广西医科大学药学院,广西 南宁 530021)
杨桃根总提取物对糖尿病小鼠肾功能及其抗氧化应激作用的研究
徐小惠,范氏泰和,韦晓洁,覃 妮,黄仁彬
(广西医科大学药学院,广西 南宁 530021)
目的 探讨杨桃根总提取物(EACR)对糖尿病小鼠肾损伤及其抗氧化应激的作用。方法 小鼠尾静脉注射120 mg·g-1链脲佐菌素(STZ)建立糖尿病模型小鼠,随机分为5组:模型对照组、缬沙坦组(20 mg·kg-1)、EACR低、中、高剂量组(300、600、1 200 mg·kg-1),再设正常对照组,每组10只小鼠。分别于药前、药后测各组小鼠空腹血糖(FBG)。末次给药后,收集血清和尿液,检测小鼠血清中肌酐(Cr)和尿素氮(BUN)的含量以及24 h尿量及尿蛋白水平;试剂盒检测小鼠肾脏组织中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)的活性和丙二醛(MDA)含量;HE染色观察肾脏组织的病理学变化;ELISA法检测肾组织中氧化氢酶(CAT)、活性氧簇(ROS)的含量;蛋白免疫印迹法检测肾组织中Cyto-C、AIF、caspase-3的蛋白表达。结果 与模型组比较,缬沙坦组以及EACR中、高剂量组的血清生化指标和24 h尿蛋白水平明显降低,差异具有统计学意义(P<0.05)。糖尿病小鼠给药后,EACR能明显降低MDA含量,提高SOD、GSH-Px、CAT活性;下调ROS、Cyto-C、AIF、caspase-3的表达(P<0.05)。HE结果显示EACR还能改善糖尿病小鼠肾小球病理变化。结论 杨桃根总提取物可减轻糖尿病小鼠血清中Cr和BUN的水平,降低肾脏组织中MDA、ROS含量,以及提高组织中抗氧化因子SOD、GSH-Px活性及CAT的含量,下调肾组织中Cyto-C、AIF、caspase-3的蛋白表达,缓解氧化应激对肾组织所造成的损伤,从而起到改善糖尿病小鼠肾损伤的作用。
杨桃根总提取物;糖尿病;肾损伤;氧化应激;ROS;促凋亡因子
糖尿病是一种由多种病因引起的以慢性高血糖为特征的代谢紊乱疾病,与此同时还被广泛认为是一种慢性炎症性疾病。在长期高血糖的环境下会产生大量的ROS,大量的ROS产生可激活引起糖尿病肾病晚期糖基化终末产物(AGEs)途径[1]。由于糖尿病患者代谢紊乱影响了清除自由基的各种抗氧化酶的活性和表达,引起自由基增多,进而损伤肾脏组织[2]。所以降低或改善糖尿病患者的氧化应激状态,能有效缓解糖尿病患者病程进展,对其并发症的防治也起到很大的作用。
杨桃根(AverrhoacarambolaL. root, ACLR)为酢浆草科属植物的新鲜或干燥根,其药理作用广泛,民间多用于改善消化功能、治疗咳嗽以及糖尿病[3-4]。在我们的前期研究中已发现,杨桃根醇提物对糖尿病小鼠具有降血糖作用,杨桃根多糖有明显的体外抗氧化作用[5-6]。此外,杨桃根总提取物还可以降低糖尿病小鼠血清中游离脂肪酸(FFAs)水平,改善胰岛细胞凋亡[7]。故本研究将探讨杨桃根总提取物基于肾脏组织的氧化应激功能,对糖尿病小鼠血糖和肾脏损伤的影响。
1 材料与方法
1.1 实验动物与主要试剂 SPF级♂ KM小鼠,体质量(20±2) g,由广西医科大学实验动物中心提供。动物饲养环境通风良好,室温18 ℃~25 ℃,相对湿度40%~70%,12 h光照昼夜循环。试验动物使用许可证SCXK(桂)2009-0002。缬沙坦片(北京京丰制药有限公司,批号:151019);链脲佐菌素(streptozotocin,STZ美国Sigma公司);考马斯亮蓝蛋白测定试剂盒(南京建成生物工程研究所,批号20150927);SOD试剂盒(南京建成生物工程研究所,批号20150925);丙二醛(MDA)测试盒(南京建成生物工程研究所,批号20150925);谷胱甘肽过氧化物酶(GSH-Px)试剂盒(南京建成生物工程研究所,批号20150918);ROS试剂盒(上海杰美基因医药科技有限公司,批号 20151017);氧化氢酶(CAT)试剂盒(上海杰美基因医药科技有限公司,批号 20151009);预染蛋白Marker(西安润德生物技术有限公司,批号QE15104);Cyto-C、AIF、caspase-3蛋白抗体(武汉博士德有限公司,批号2691107);HRP 标记的兔抗羊IgG抗体(Santa Cruz Biotechnology,批号CV20151028);多克隆抗体(Santa Cruz Biotechnology,批号SC-1507)。
1.2 仪器 罗氏卓越型血糖仪(ACCU-CHEK Performa,注册证号:国食药监械(进)字2008第2403661号);卓越金锐血糖试纸(注册证号:国食药监械(进)字2010第2400386号);垂直电泳仪(BIO-RAD公司);转膜及显影设备(BIO-RAD公司);全自动生化分析仪(日立公司,7100)
1.3 糖尿病模型建立及分组给药 取90只♂昆明小鼠,SPF级,体质量(20±2)g,造模前禁食12 h,随机选取10只作为正常对照组,其余小鼠分别尾静脉注射STZ(120 mg·kg-1)。72 h后尾巴取血测FBG,选取FBG 11.1 mmol·L-1以上的小鼠作为造模成功的糖尿病小鼠。将造模成功的小鼠随机分配成5个组,每组10只,分别为模型对照组,缬沙坦对照组(20 mg·kg-1),EACR低、中、高剂量组(300、600、1 200 mg·kg-1)。成模后缬沙坦组对照组、EACR各给药组每天上午空腹灌胃给药1次,正常对照组和模型对照组组灌胃生理盐水,各组连续给药42 d。
1.4 标本采集 采用代谢鼠笼收集小鼠24 h尿;小鼠尾巴取血检测药前、药后的FBG;末次给药后小鼠拔眼球取血,以3500 r·min-1离心10 min,取血清待测。取小鼠肾脏组织用4%甲醛固定,常规石蜡包埋,进行HE染色。
1.5 指标检测
1.5.1 FBG测定 小鼠尾静脉取血,用血糖仪和试纸测定。
1.5.2 血清Cr 、BUN和24 h尿蛋白检测 采用全自动生化分析仪进行测定。
1.5.3 肾脏组织SOD、GSH-Px活性和MDA、CAT、ROS水平测定 小鼠取材时摘取新鲜肾脏组织,取部分组织用生理盐水制成10%匀浆,取上清液试剂盒法测定SOD、MDA和GSH-Px;ELISA法检测CAT、ROS的含量。
1.5.4 蛋白免疫印迹法检测 检测肾皮质中Cyto-C、AIF、caspase-3的蛋白表达。
1.5.5 肾脏组织的病理学检测 常规石蜡包埋,进行HE染色。

2 结果
2.1 小鼠一般状态的观察 与正常对照组相比,小鼠尾静脉注射120 mg·kg-1STZ的72 h内,逐渐出现多饮、多尿、毛发松散、精神较萎靡;42 d后,模型组小鼠体质量较正常组小鼠有所下降,其一般状态未有明显改善。与模型组比较,缬沙坦组和杨桃根各给药组的小鼠一般状态均有所改善。
2.2 EACR对糖尿病小鼠FBG的影响 由Tab 1可知,与正常组比较,模型组FBG明显升高(P<0.01)。与模型组比较, EACR中、高剂量组的FBG均有所下降,其中EACR各剂量组的FBG下降呈剂量依赖性。
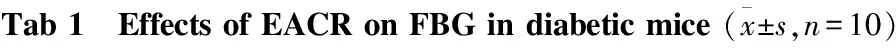

GroupDose/g·kg-1FBG/mmol·L-1Pre⁃treatment42dposttreatmentNormalcontrol6.45±2.137.41±1.48Modelcontrol20.35±2.74∗28.27±2.54∗Valsartan0.0221.34±4.41∗29.48±5.21∗EACR0.320.58±6.21∗27.19±4.02∗0.619.54±6.22∗21.64±4.00∗Δ1.219.95±5.54∗16.28±5.38∗Δ
*P<0.05vsnormal control;ΔP<0.05vsmodel control
2.3 EACR对糖尿病小鼠血清Cr 、BUN和24 h尿量及尿蛋白的影响 由结果可知,与正常组比较,模型组小鼠的BUN、Cr和尿蛋白值明显升高(P<0.05)。与模型组比较,缬沙坦组以及EACR中、高剂量组肾功能指标的水平明显降低,差异具有统计学意义(P<0.05)。见Tab 2。


GroupDose/g·kg-1BUN/mg·dL-1Cr/mg·dL-124hurinevolume/mLUrinaryprotein/mg·d-1Normalcontrol-17.21±1.70.42±0.0640.68±0.032.63±0.18Modelcontrol-27.13±2.3∗0.56±0.063∗2.74±0.37∗6.97±0.47∗Valsartan0.0220.11±2.6∗Δ0.45±0.040Δ1.41±0.19∗Δ4.83±0.33∗ΔEACR0.327.59±2.3∗0.51±0.058∗2.53±0.52∗5.68±0.23∗Δ0.625.95±3.4∗0.47±0.075∗Δ2.29±0.35∗Δ5.71±0.42∗1.224.00±3.7∗Δ0.47±0.051∗Δ1.87±0.21∗Δ4.10±0.26∗Δ
*P<0.05vsnormal control;ΔP<0.05vsmodel control


GroupDose/g·kg-1SOD/kU·g-1MDA/mmol·g-1GSH⁃Px/kU·g-1Normalcontrol-316.02±24.406.84±1.19672.36±119.26Modelcontrol-196.38±13.27∗15.77±3.18∗486.24±100.28∗Valsartan0.02276.05±33.05∗Δ8.46±3.36Δ625.10±140.30∗ΔEACR0.3206.24±30.24∗16.04±4.14∗509.11±79.54∗0.6216.86±21.54∗14.13±2.37∗549.24±164.32∗Δ1.2245.01±18.97∗Δ10.24±2.21∗Δ61005±128.06∗Δ
*P<0.05vsnormal control;ΔP<0.05vsmodel control


GroupDose/g·kg-1CAT/MU·g-1ProROS/kU·L-1Normalcontrol-11.38±1.57209.08±31.73Modelcontrol-6.51±1.34∗396.27±34.51∗Valsartan0.0213.59±3.06∗Δ251.13±33.98∗ΔEACR0.37.14±1.88∗Δ391.25±21.71∗Δ0.610.52±1.65Δ337.67±35.26∗Δ1.212.63±2.41∗Δ286.45±29.68∗Δ
*P<0.05vsnormal control;ΔP<0.05vsmodel control
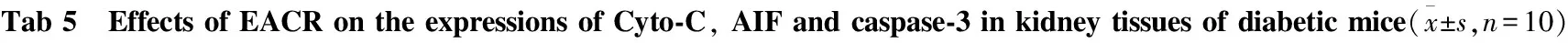

GroupDose/g·kg-1Cyto⁃CAIFcaspase⁃3Normalcontrol-0.07±0.020.27±0.070.12±0.05Modelcontrol-0.46±0.07∗0.62±0.12∗0.85±0.17∗Valsartan0.020.18±0。05∗Δ0.43±0.11∗Δ0.38±0.08∗ΔEACR0.300.41±0.13∗0.59±0.08∗0.76±0.13∗Δ0.600.35±0.09∗Δ0.55±0.07∗Δ0.62±0.12∗Δ1.200.22±0.06∗Δ0.46±0.13∗Δ0.45±0.09∗Δ
*P<0.05vsnormal control;ΔP<0.05vsmodel control
2.4 EACR对糖尿病小鼠肾脏组织中SOD、GSH-Px活性和MDA水平的影响 与正常组比较,模型组小鼠肾脏组织中SOD和GSH-Px活性明显下降,MDA含量升高(P<0.05)。与模型组比较,缬沙坦组以及EACR中、高剂量组的SOD和GSH-Px活性升高,MDA水平明显降低,但EACR低剂量组无明显改变。见Tab 3。
2.5 EACR对糖尿病小鼠肾脏组织中CAT、ROS的影响 与正常组比较,模型组小鼠肾脏组织ROS的含量明显上升,CAT的含量明显下降(P<0.05)。与模型组比较,EACR中、高剂量组ROS的含量明显降低,CAT的含量明显升高。见Tab 4。
2.6 EACR对糖尿病小鼠肾脏组织中Cyto-C、AIF、caspase-3表达的影响 与正常组比较,模型组小鼠肾脏组织中Cyto-C、AIF、caspase-3的蛋白表达明显上升(P<0.05)。与模型组比较,缬沙坦组、EACR中、高剂量组Cyto-C、AIF、caspase-3的蛋白表达明显降低。见Tab 5、Fig 1。

Fig 1 Effects of EACR on expressions of Cyto-C,AIF and caspase-3 in kidney tissues of diabetic mice
A: Normal control group; B: Model control group; C: Valsartan control group; D: Low dose of EACR group; E: Moderate dose of EACR group; F: High dose of EACR group
2.7 EACR对糖尿病小鼠肾脏组织病理学变化的影响 肾脏组织HE染色可见,正常对照组小鼠肾脏组织中细胞结构紧密、完整,肾小球结构饱满。模型对照组中肾小球萎缩,肾小管空泡变性;给药组小鼠的肾脏组织形态较模型组有一定的改善。见Fig 2。
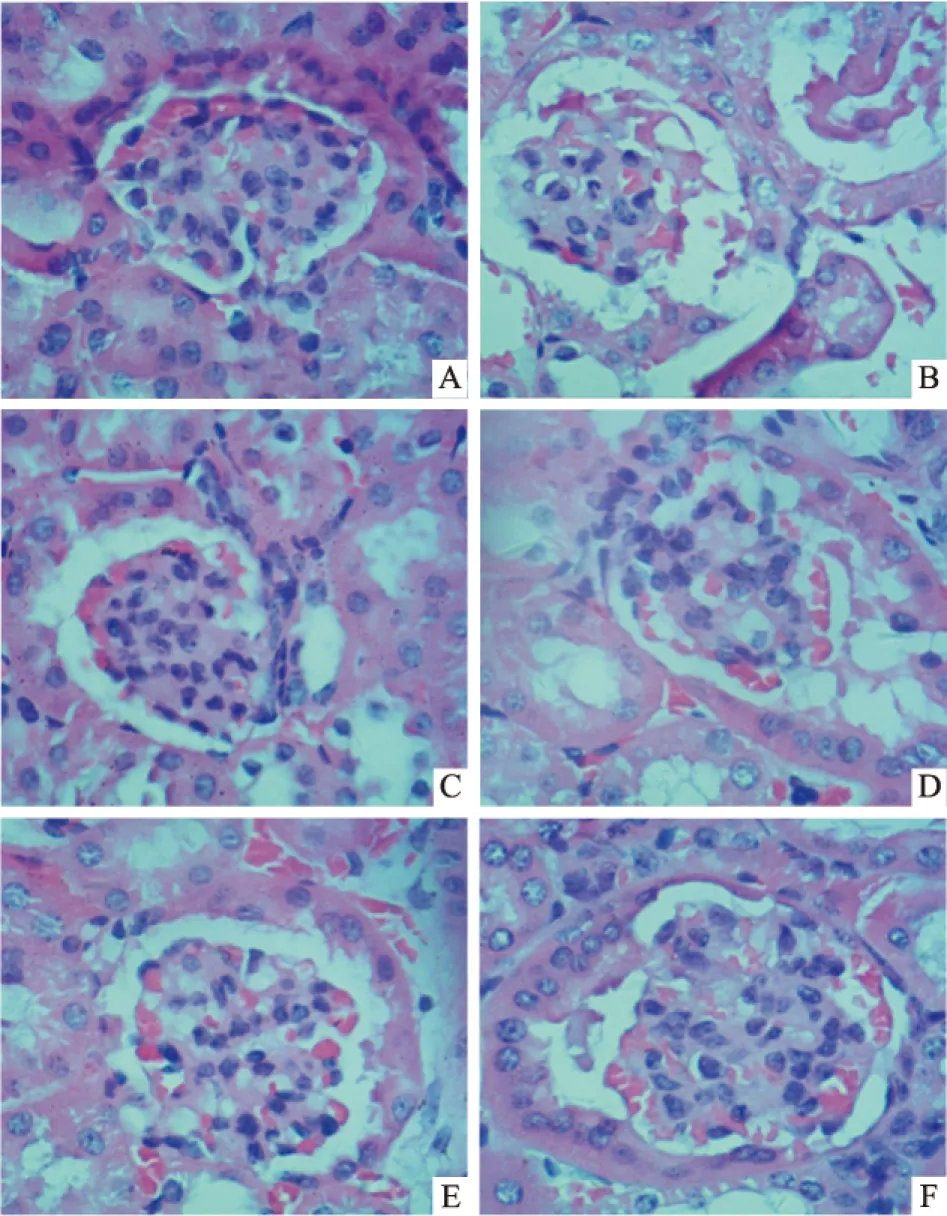
Fig 2 Histological observations of kidney tissues (HE staining×400)
A: Normal control group; B: Model control group; C: Valsartan control group; D: Low dose of EACR group; E: Moderate dose of EACR group; F: High dose of EACR group
3 讨论
糖尿病肾病(DN)为糖尿病患者常见的慢性并发症,患者出现严重的代谢紊乱,发展到末期肾病会严重影响其生存质量。DN发病机制与晚期糖基化终产物(AGEs)累积、炎症反应和氧化应激作用等途径有关[8]。
在正常的生理状态下,一定浓度的ROS是维持细胞正常生命活动所必需的物质,参与正常的细胞增殖、凋亡以及Ca2+储存等生理过程的调节。但是机体在病理状态下,机体的ROS浓度升高,可造成机体中蛋白质、DNA和脂质过氧化损伤[9]。在高糖状态下,细胞内NADH /NAD+比率增加,由NADH或FADH2通过呼吸链电子传递体传递的电子漏出增多,ROS产生增加[10]。同时高血糖还可导致抗氧化酶活性表达下降,清除氧自由基能力下降,进一步导致机体内ROS的增多及积聚,导致恶性循环,进而引起细胞的氧化应激损伤。
研究表明[11],高糖所致线粒体内ROS增多可引起线粒体内膜脂质和蛋白损伤,诱导内膜流动性和通透性改变,通透性转换孔(mPTP)开启,破坏线粒体膜电位并使线粒体内渗透压改变,使线粒体发生肿胀,ATP 合成下降[12];促使线粒体基质内促凋亡因子CytoC、DIABLO和AIF等外流,在胞质内激活caspase依赖和非依赖性凋亡途径[13],最终导致足细胞凋亡、系膜细胞外基质堆积及肾小球基底膜增厚[14]。
临床上DN主要的治疗方案是通过控制血糖的升高,调节血脂代谢以及替代治疗,要根据病程、病期及患者的自身特点制定个体优化方案。中药在防止DN的方针中主要以延缓DN的发生发展和改善其肾脏功能为出发点[15]。我们近期研究发现,杨桃根总提取物(EACR)不仅能降低糖尿病小鼠血清中总胆固醇(TC)、甘油三酯(TG)和FFAs的含量,还可调节凋亡相关蛋白的表达,从而改善糖尿病小鼠的代谢功能和抑制胰腺组织凋亡。故现深入研究,EACR对糖尿病小鼠STZ所致的肾损伤是否有保护作用。
本实验研究结果发现,EACR能明显降低糖尿病小鼠血清中Cr、BUN和尿液中尿蛋白的水平,升高肾脏组织中抗氧化酶SOD、GSH-Px的活性,以及降低组织中ROS、MDA含量,下调肾组织中Cyto-C、AIF、caspase-3的蛋白表达,并改善肾脏组织的病理学变化。提示杨桃根总提取物其作用机制可能为降低ROS的含量及提高抗氧化因子的活性,下调促凋亡因子Cyto-C、AIF、caspase-3的蛋白表达,缓解高糖所致的氧化应激对肾脏组织所造成的损伤,从而起到肾脏的保护作用。
(致谢:本文实验在广西医科大学药学院中心实验室完成,黄仁彬教授设计并指导实验研究,在范氏泰和,韦晓洁和覃妮的协助下完成实验。)
[1] 万 静,刘丽梅. 氧化应激—抗氧化系统与糖尿病肾病[J]. 国际内分泌代谢杂志,2006,4(26):18-20.
[1] Wan J, Liu L M. Oxidative stress-antioxidative system and diabetic nephropathy[J].IntJEndocrinolMetab, 2006, 4(26): 18-20.
[2] 李晓博,牟忠卿,陈 丽,等.糖尿病大鼠肾脏组织氧化应激及其在糖尿病肾病发病中的意义[J].中国病理生理杂志,2006, 22(4): 806-9.
[2] Li X B, Mu Z Q, Chen L, et al. Study on the role of oxidative stress in the kidneys of diabetic rats[J].ChinJPathophysiol, 2006, 22(4): 806-9.
[3] Carolino R O, Beleboni R O, Pizzo A B, et al. Convulsant activity and neurochemical alterations induced by a fraction obtained from fruit Averrhoa carambola (Oxalidaceae: Geraniales)[J].NeurochemInt, 2005, 46(7): 523-31.
[4] Cazarolli L H, Kappel V D, Pereira D F, et al. Anti-hyperglycemic action of apigenin-6-C-β-fucopyranoside from Averrhoa carambola[J].Fitoterapia, 2012, 83(7):1176-83.
[5] 黄桂红,贺 敏,林 兴,黄仁彬. 杨桃根醇提物对糖尿病模型小鼠的降血糖作用[J]. 中国医院药学杂志,2009, 29(15): 1256-8.
[5] Huang G H, He M, Lin X, Huang R B. Hypoglycemic effect of alcoholic extracts of Averrhoa carambola in STZ-induced diabetic mice[J].ChinHospPharmJ, 2009, 29(15): 1256-8.
[6] 罗旭艳,黄建春,杨 欣,等. 杨桃根多糖体外抗氧化作用的研究[J]. 中国实验方剂学杂志,2011, 17(4): 111-4.
[6] Luo X Y, Huang J C, Yang X, et al. Antioxidative effect of Yangtaogen polysaccharideinvitro[J].ChinJExpTraditMedFormul, 2011, 17(4): 111-4.
[7] Xu X H, Liang T, Wen Q W, et al. Protective effects of total extracts of Averrhoa carambola L. (Oxalidaceae) roots on Sreptozotocin-induced diabetic mice[J].CellPhysiolBiochem, 2014, 33(5): 1272-82.
[8] 熊凤霄, 杨志英, 王少贵,等. 胆汁酸膜受体TGR5对高糖培养的大鼠肾小球系膜细胞FN、TGF-β1的调控作用[J]. 中国药理学通报, 2016, 32(1):33-7.
[8] Xiong F X, Yang Z Y, Wang S G, et al. Regulatory effects of the bile acid membrane receptor TGR5 on FN and TGF-β1 in rat glomerular mesangial cells cultured under high glucose condition[J].ChinPharmacolBull, 2016, 32(1): 33-7.
[9] 毛志敏, 黄燕如, 万毅刚,等. 糖尿病肾病肾组织氧化应激的调控机制及中药的干预作用[J]. 中国中药杂志, 2014, 39(19):3707-12.
[9] Mao Z M, Huang Y R, Wan Y G, et al. Regulative mechanisms of oxidative stress in kidney in diabetic nephropathy and interventional effects of Chinese herbal medicine[J].ChinaJChinMatMed, 2014, 39(19):3707-12.
[10]王 臻, 陆利民. 糖代谢紊乱致肾小球内皮细胞损伤机制进展[J]. 基础医学与临床, 2012, 32(11):1360-3.
[10]Wang Z, Lu L M. Progresses in high glucose-induce glomerular endothelial cells injury in diabetic nephropathy[J].BasicClinMed, 2012, 32(11):1360-3.
[11]林海燕, 叶山东. 氧化应激与糖尿病肾病关系的研究进展[J]. 医学综述, 2013, 19(21):3949-52.
[11]Lin H Y, Ye S D. Research progress in correlation between oxidative stress and diabetic nephropathy[J].MedRecapitulate, 2013, 19(21):3949-52.
[12]Danial N N, Korsmeyer S J. Cell death: critical control points[J].Cell, 2004, 116(2):205-19.
[13]Zalk R, Israelson A, Garty E S, et al. Oligomeric states of the voltage-dependent anion channel and cytochrome c release from mitochondria [J].BiochemJ, 2005, 386(Pt 1):73-83.
[14]郭福团,许雄伟,潘建峰,等. 桑枝多糖对糖尿病肾病小鼠肾皮质氧化应激作用的影响[J]. 中国药理学通报,2016, 32(8): 1148-52.
[14]Guo F T, Xu X W, Pan J F, et al. Protective effects of NDP on LPS induced neuron injuries in rat mixed cultures[J].ChinPharmacolBull, 2016, 32(8): 1148-52.
[15]包海鹏,于 梅,郝迎秋. 糖尿病肾病的研究进展[J]. 黑龙江中医药,2015, 1:84-5.
[15]Bao H P, Yu M, Hao Y Q. Research progress of diabetic nephropathy[J].HeilongjiangJTraditChinMed, 2015, 1: 84-5.
Study of the extract of averrhoacarambola L. root on renal function in diabetic mice and its anti-oxidative action
XU Xiao-hui, Hoa Thi Thai Phama, WEI Xiao-jie, QIN Ni, HUANG Ren-bin
(PharmaceuticalCollege,GuangxiMedicalUniversity,Nanning530021,China)
Aim To investigate the effect of the extract ofAverrhoacarambolaL. root (EACR) on renal function in diabetic mice and its anti-oxidative action. Methods Diabetic mice were established by tail vein injection with 120 mg·kg-1streptozotocin (STZ) and were divided into 5 groups: model control group, valsartan control group, and low-, middle-, high-dose of EACR groups (300, 600, 1 200 mg·kg-1). And 10 normal mice consisted of normal control group. The fasting blood glucose (FBG) of mice was detected before and after administration of drugs. After last administration, the blood and urine samples were collected for creatinine (Cr), urea nitrogen (BUN), urine and 24 h urinary protein determination. The activities of superoxide dismutase (SOD), glutathione peroxidase (GSH-Px) and malonaldehyde (MDA) content were determined using kits. HE staining was conducted to observe the pathological changes of kidney tissues. ELISA method was utilized to detect the contents of catalase (CAT) and reactive oxygen species (ROS). The expressions of Cyto-C, AIF and caspase-3 proteins in kidney tissues were analyzed by Western blot. Results Compared with model group, the serum biochemical indexes and 24 h urinary protein of valsartan and moderate-, high-dose of EACR groups were decreased with statistical significance (P<0.05). After the treatment, the MDA content was decreased by EACR treatment, and SOD, GSH-Px and CAT activities were enhanced. Meanwhile the expressions of ROS,Cyto-C, AIF and caspase-3 were down-regulated. The pathological changes of kidney tissues were ameliorated by EACR through HE results. Conclusions The extract ofAverrhoacarambolaL. root can decrease the serum levels of Cr and BUN, reduce the MDA and ROS contents in kidney tissue and enhance the activities of SOD, GSH-Px and CAT, down-regulate the expressions of Cyto-C, AIF and caspase-3 proteins in kidney tissues, elevate the anti-oxidative effect of kidney. Therefore, the renal function of diabetic mice is meliorated.
extract ofAverrhoacarambolaL. root; diabetes; renal injury; oxidative stress; ROS; apoptogenic factor
时间:2016-12-27 16:13
http://www.cnki.net/kcms/detail/34.1086.R.20161227.1613.034.html
2016-06-30,
2016-10-20
广西研究生教育创新计划资助项目(No YCBZ2015035);国家自然科学基金资助项目(No 81360129, 81460205);南宁市青秀区科学研究与技术开发计划(No 2013S12)
徐小惠(1991-),女,博士生,研究方向:糖尿病药理学,E-mail:1056112307@qq.com; 黄仁彬(1955-),男,博士,教授,博士生导师,研究方向:糖尿病药理学,通讯作者,E-mail:huangrenbin518@163.com
10.3969/j.issn.1001-1978.2017.01.017
A
1001-1978(2017)01-1705-05
R-332;R284.1;R322.61;R587.1;R692
