浅议图像法确定二氧化碳与氢氧化钠溶液反应后的溶质
2017-01-26朱锡贵
朱锡贵
(重庆市云阳县江口中学校)
浅议图像法确定二氧化碳与氢氧化钠溶液反应后的溶质
朱锡贵
(重庆市云阳县江口中学校)
一定体积的CO2通入到一定浓度的NaOH溶液时,CO2的加入量不同,溶液中溶质则不同。向溶液中逐滴滴入盐酸,通过产生的气体体积与加入盐酸的体积的图像来判断溶液溶质的成分。
图像;二氧化碳;氢氧化钠溶液;溶质
一定体积的CO2通入到一定浓度的NaOH溶液时,若通入CO2少量时,反应后溶液中的溶质为NaOH和Na2CO3;随着CO2的通入,CO2不断将NaOH溶液中的溶质转化为Na2CO3,当CO2与NaOH恰好完全反应时,反应后溶液中的溶质只有Na2CO3;CO2继续通入,则CO2与Na2CO3反应生成NaHCO3,若过量的CO2不多,没有将Na2CO3完全转化为NaHCO3时,则溶液的溶质为Na2CO3和NaHCO3;若CO2继续通入,CO2将恰好Na2CO3完全转化为NaHCO3时,则溶液的溶质为NaHCO3。因此,一定体积的CO2通入到一定浓度的NaOH溶液反应后,溶液中的溶质有四种可能:(1)NaHCO3;(2)只有Na2CO3;(3)NaOH和Na2CO3;(4)Na2CO3和NaHCO3;。
为了确定反应后溶液中溶质的具体情况,可以通过向反应后的溶液中逐滴滴入盐酸,然后对以加入盐酸的体积为横坐标、产生气体的体积或者物质的量为纵坐标的图像来确定。
一、溶质为NaHCO3
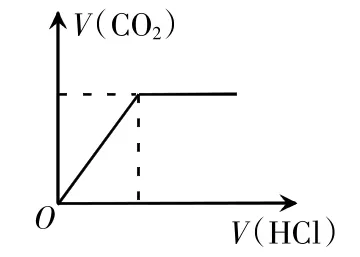
若反应后溶液的溶质为NaHCO3时,向反应后的溶液中滴入盐酸,则HCl与NaHCO3发生离子反应:HC+H+=H2O+CO2↑,立即就会出现气泡。即从坐标原点开始就会产生气体,随盐酸的加入,气体的量逐渐增多。当NaHCO3完全反应完时,气体的体积不再发生变化。如下图所示:图像特点:从O点开始立即产生CO2气体。
二、溶质只有Na2CO3
若反应后溶液的溶质只有Na2CO3时,向反应后的溶液中滴入盐酸,则HCl与Na2CO3发生离子反应:C+H+=HC,因此,开始滴入盐酸时,不会产生气泡,一段时间内气体的量都为0,随着盐酸的加入,不断将溶液中的C离子转化为HC。当将C离子完全转化为HC时,再加入盐酸,则盐酸与HC反应:HCO由此可知溶质只有Na2CO3时,不产生气体时消耗的HCl的量与生成气体消耗的HCl的量刚好相等。(如下图所示)

反应后溶液的溶质只有Na2CO3时,向反应后的溶液中滴入盐酸的图像特点:Oa段不产生气体时消耗的HCl的量、ab段生成气体消耗的HC的体积相等。
三、溶质为NaOH和Na2CO3

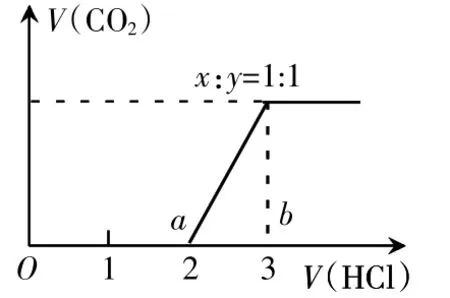
该类图像特点:Oa段不生成气体阶段消耗HCl的量大于ab生成段消耗HCl的量。
四、溶质为Na2CO3和NaHCO3
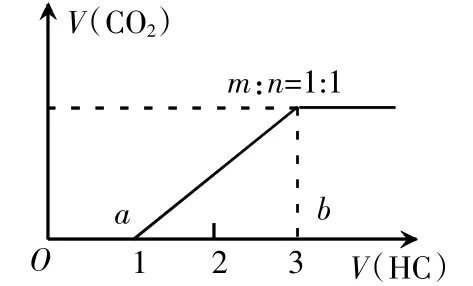
若反应后溶液的溶质为Na2CO3和NaHCO3时,向反应后的溶液中逐滴滴入盐酸,则HCl首先与Na2CO3发生反应:①C+H+因此,开始滴入盐酸,溶液中也不会产生气泡。当HCl把溶液中的Na2CO3恰好完全转化为NaHCO3时,再滴入HCl时,HCl与溶液中的NaHCO3发生反应:此时溶液中有气泡产生。
因此,向溶质为Na2CO3和NaHCO3的溶液中逐滴滴入盐酸时,不产生气体阶段消耗HCl的物质的量小于产生气体阶段消耗的HCl的物质的量。根据以上信息得出向溶质为Na2CO3和NaHCO3的溶液中逐滴滴入盐酸时的图像如下:
CO2通入到NaOH溶液后形成的溶液,向其中逐滴滴入盐酸时:滴入立即就有气泡产生,则溶质为NaHCO3;滴入开始无气泡。①不产生气体时消耗的HCl的量与生成气体消耗的HCl的量刚好相等,则溶质只有Na2CO3;②不生成气体阶段总共消耗HCl的物质的量大于生成气体阶段总共消耗HCl的物质的量,则溶质为NaOH和Na2CO3;③不生成气体阶段总共消耗HCl的物质的量小于生成气体阶段总共消耗HCl的物质的量,溶质为Na2CO3和NaHCO3。
[1]宋心琦,王晶,李文鼎,等.化学必修一[M].人民教育出版社,2007.
[2]梅若兰,李静贞,王近勇,等.无机化学[M].高等教育出版社,1992.
●编辑 鲁翠红
