Li/FeS2电池高电压现象及其原因剖析
2017-01-20刘俐伶袁中直刘亚柳
刘俐伶,袁中直,刘亚柳
(华南师范大学化学与环境学院,广东广州510006)
Li/FeS2电池高电压现象及其原因剖析
刘俐伶,袁中直,刘亚柳
(华南师范大学化学与环境学院,广东广州510006)
锂/二硫化亚铁电池开路电压(OCV)和放电初期电压高于IEC标准规定的1.83 V,将其放电50%容量以内,其OCV仍回升到标准值以上。室温储存之后的电池放电至1.80 V所得容量比新制备的电池放电至1.80 V所得容量要高。化学组成及XRD分析表明,物质纯度和配方对高电压现象有一定的影响,但是第一个2 e反应的固态溶液扩散机理,可能是维持50%放电容量以内一直具有高电压现象的重要原因。
锂/二硫化亚铁电池;高电压;固态溶液;原因
常温使用的锂/二硫化亚铁 (Li/FeS2)原电池,在《IEC 60086-1:2011 Primary batteries-Part 1:General》标准中规定其标称电压为1.5 V,开路电压(OCV)最高不得超过1.83 V,当电压过高时会对电器造成破坏。实际制作的电池,常常在放电初期出现较高放电电压的现象,近年来,虽然通过正极活性物质FeS2的提纯、电解液配方的优化、高电压抑制剂的添加以及在生产工艺上采取预放电等措施,使得电池带有负载时的前期放电电压偏高现象得到一定程度的解决,但是OCV偏高的现象仍然存在,需要对高电压现象及其原因进行更深入地研究。
1 实验
1.1 仪器与试剂
采用激光粒度仪Easysizer 20测试黄铁矿型FeS2(云浮华纳新科)的粒径分布。用KYKY-EM3200型场发射扫描电子显微镜表征材料的形貌特征。用德国Bruker D8 X射线衍射仪对FeS2进行晶体结构分析,在管电压40 kV,管电流40 mA下使用Cu-Kα线扫描,扫描范围2 θ为10°~90°。电池在电池测试系统 (深圳新威)上进行放电性能测试。用数字万用表(Fluke179)测试OCV。
1.2 电池制作
以NMP(汇鑫化工,99.9%)为溶剂,将质量分数为89% FeS2,3%Super p(瑞士,TIMCAL),3.5%的石墨 (贝特瑞,CG-K15)和4.5%聚偏氟乙烯(PVDF)(ARKEMA,HSV900)构成混合浆料涂在铝箔(深圳振鑫,20 μm)上制成电池正极片,与纯金属锂箔(顿威,0.18 mm)负极片和PP隔膜(中科,25 μm)卷绕制成FR14505型电池,电池设计容量为3 000 mAh。将制好的电池在室温下静置16 h后进行电性能测试。电解液组成为:(1)1 mol/L LiI(国泰华荣)溶解于DME/DOL(体积比为3∶7) (国泰华荣)形成的溶液;(2)1 mol/L LiCF3SO3(国泰华荣)溶解于DME/DOL(体积比为3∶7)(国泰华荣)形成的溶液。
在三电极模拟电池中通氩气(99.99%)除氧。完整的三电极模拟电池,包括工作电极(WE),对电极(CE)和参比电极(RE)。用作模拟电池的铂微电极经二次蒸馏水、乙醇超声波清洗,再放置在45℃烘箱中12 h,使用之前在干燥室冷却到室温。将FeS2粉末材料置于光滑的玻璃镜面上作为研磨剂,对上述电极端面进行研磨,使粉末紧密压入Pt电极的凹槽中,制备成相应的FeS2研究电极。对电极和参比电极都是纯金属锂。电解液同上。
2 结果与讨论
2.1 Li/FeS2电池高电压的表现形式
Li/FeS2电池放电初期的高电压,通常都使用预放电的方法来解决,即用一定的电流放出部分电量,从而使得电活性物质中高电压部分的物质减少,以达到降低用户使用电压的目的。但是电池经过放电之后,电池的开路电压仍然会回升到1.83 V以上。
取新制备的FR14505电池[开路电压在(2.2±0.05)V,内阻在(170±10)mΩ]使用不同的电流放电至1.80 V所释放出的电量在0.45~0.70 mAh之间分布,并不呈现随放电电流大小而增加或减少的规律(图1)。

图1 新制备FR14505电池在不同电流下放电至1.80 V的放电曲线
放电的电池,一旦切断负载,其开路电压仍然会上升,甚至放出更多的电量之后的电池,其开路电压仍然会回升。将FR14505电池以50 mA恒流放电,使之释放出不同比例的电量,然后观察OCV的回升情况。为了加速OCV的回升,将电池在60℃下进行加速储存观察,得到图2所示的OCV回升曲线。图2中所示的百分数为电池的放电深度,从图中可以看出,将电池释放50%甚至60%的电量后,其OCV仍然可以恢复到1.83 V以上。这说明OCV偏高可能不是电池活性物质中的高电位杂质造成的。

图2 不同放电深度的FR14505电池开路电压回升曲线(60℃)
将FR14505电池用1 500 mA放电3 min后,在45℃下存放48 h使其电压恢复,再用1 500 mA放电1 min(合计放电100 mAh,约占电池标称容量的3%),再在45℃下存放24 h,然后在室温搁置8个月,电池OCV在(1.98±0.02)V,内阻分布在(115±15)mΩ。将这些电池再使用不同的电流放电至1.80 V,得到放电曲线如图3所示。与图1所示的新制备的电池的放电曲线相比较,发现释放了3%电量的电池,经过长时间储存之后,在同样电流下放电至1.80 V所释放的电量,比新电池同样条件下放电容量更大。为了更好地比较新电池和室温8个月后电池放电至1.80 V的容量差别,将这2种电池在不同电流下放电容量绘制在同一个坐标图上,如图4,从图中可以看出室温搁置8个月电池的容量明显高于新制备的电池。这种奇特的现象表明,电池在储存过程中,具有高活性的物质的量在不断增加。这种高活性的物质不应该来自于电解液,可能来自于正极活性物质固态颗粒的深层,在电解液浸润和晶格迁移变化过程中,高活性物质逐渐向固液界面扩散,产生高的电压。
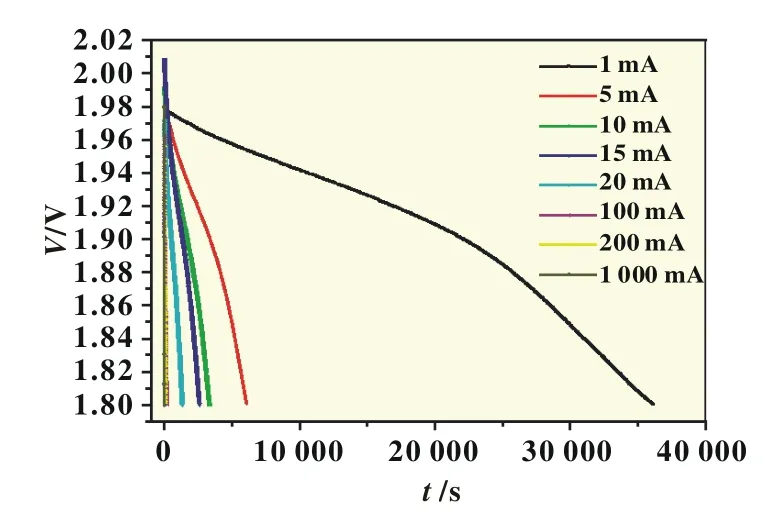
图3 室温搁置8个月FR14505电池在不同电流下放电至1.80 V的放电曲线

图4 新制备和室温搁置8个月的FR14505电池放电至1.8 V时间~电流关系
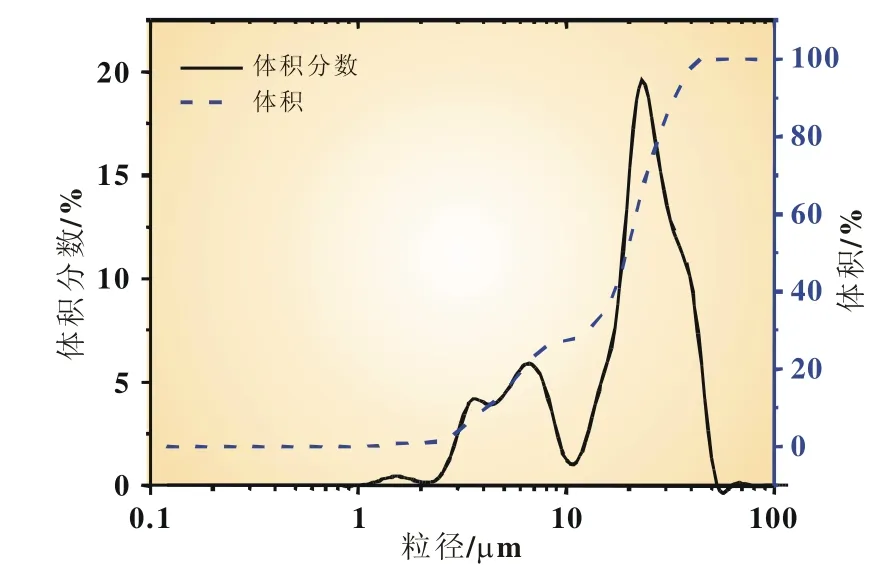
图5 黄铁矿FeS2粉末的粒径分布图
2.2 电池组成成分和杂质对电压的影响
作为正极活性物质的FeS2来源于天然黄铁矿的提纯,采用激光粒度仪Easysizer 20测试其粒径分布,最大粒径位于50.88 μm,其体积分数10%,50%和90%对应的粒径分别为4.13、19.48、33.29 μm(图5),说明颗粒粒径分布范围较宽。在扫描电镜下观察颗粒形貌发现其表面粗糙,有明显的棱角,呈不规则的几何形状(图6)。测试FeS2的XRD图谱如图7(a),与标准图谱[图7(b)和(c)]比较,可以看出电池所使用的正极活性物质FeS2为黄铁矿型(Pyrite),几乎没有其他晶型的杂质衍射峰,即使FeS2中存在杂质也应该是微量的。
此外,在正极组分和电解液组分中,也可能存在高电压的物质,包括正极混合物中石墨吸附的氧气、电解液中可能溶解的氧气,Li/O2电压高达2.91 V[1],如果有水分杂质,也可以参与化学反应和电化学反应。电解液组分中,溶剂为有机溶剂,电解质的选择较多,文献报道的主要有LiClO4、LiAsF6、LiI、LiCF3SO3、LiTFSI等等,其中LiClO4等属于强氧化性电解质,而LiI不稳定,在光照下易产生单质碘I2,当电解液中含有I2的时候可能构成Li/I2电池,其开路电压为2.795 V[1]。在DOL/DME(体积比7∶3)溶剂中,分别添加1 mol/L LiI或1 mol/L LiCF3SO3作为电解质,前者作为电解液构成的Li/FeS2电池OCV为2.85 V,后者OCV为2.83 V,这与Li/O2电池电压相近。向这2种模拟电池的电解液中持续通入干燥的氩气4 h以上,记录开路电压~时间(OCV~t)关系,观察到OCV都略有下降,稳定在2.62 V,这说明电解液中溶解的氧气对高电压会产生一定的作用。同样,文献[2]表明,通过高温处理,除掉正极导电剂石墨等材料中吸附的氧气,可以一定程度地降低OCV,这说明要获得OCV低于1.83 V的Li/FeS2电池,使用高纯度的材料是必需的。
但是现在问题是,即使电池中混杂有氧气、单质碘等杂质,其含量应该很少,这些氧化性物质在“预放电”操作中就会被还原掉,不会导致放电深度达50%时还会造成OCV回升过高。

图6 黄铁矿FeS2粉末放大500×(a)和200×(b)的SEM图

图7 正极活性物质FeS2的X射线衍射图谱
2.3 导致高电压的原因分析
通常认为Li/FeS2电池的反应式为4 Li+FeS2→2 Li2S+ Fe,正是基于这个4 e反应,黄铁矿型FeS2才具有高达893 mAh/g的理论比容量。根据原电池的电动势与反应自由能变化之间的关系式:

从反应机理上分析,Li/FeS2电池的电化学反应机理非常复杂,在不同温度和不同电流下放电的机理都是不同的,至今并没有完全形成定论,一次性得失4个电子的电化学反应也是罕见的,一般不可能。文献[4-6]报道的各种反应机理中,在小电流或高温下放电曲线可以看到2个明显的电压平台,因此认为其反应机理是下述(3)和(4)的组合:

但在室温下的反应机理目前仍然没有完全确认的结论。图2显示放电深度50%是一个分界线,这对于4 e反应来说,正好为放电2 e的容量,所以第一步2 e的反应产物应该是具有高电压的物质,只要这个物质存在,OCV就会回升到标准值以上。这个物质可能是Li2FeS2或其他的物质,这些物质也只是第一步2 e反应最终的产物而已。
比较图1与图3,新制备的电池放电至1.80 V所得到的容量,比经过预放电再室温搁置8个月电池放电至1.80 V所得的容量要小得多。这可能与第一步2 e反应具体的机理有关,意味着FeS2晶体内部高电压物质在不断地转化出来,直到转化结束形成第一个2 e反应稳定的中间产物。FeS2中元素之间以共价键结合,在这种情况下,FeS2中的元素硫可能形成许多种不同的中间化合物,或者是类似-S-Fe-S-结构的固溶体,包括符合化学计量式或不符合化学计量式的固态溶液,即和等[5],Li+离子和电子在固态溶液中迁移,放电过程中,电化学反应逐渐向晶体深层进行,但是当放电停止后,晶体内部高氧化态在固溶体中又扩散到固液界面表层,使得OCV回升到标准值以上,直到第一步2 e反应完全结束后,OCV才不再复原。但详细的演变和扩散过程还需要更深入地研究。
3 结论
尽管高电压杂质对Li/FeS2电池高电压有一定影响,但是电池在第一个2 e反应期间,由于FeS2形成复杂的固溶体,颗粒内部和表层的不同氧化态离子可以转化或迁移,使得OCV都有可能上升到标准值之上。
[1]托马斯B.雷迪.电池手册[M].4版.汪继强,刘兴江,译.北京:化学工业出版社,2013:809,877.
[2]大崎隆久.1.5伏锂电池放电初期高电压的研究[J].吴大鹏,译.电池,1985,4:31-32.
[3]伊赫桑·巴伦.纯物质热化学数据手册[M].北京:科学出版社,2003:720.
[4]IWAKURA C,ISOBE N,TAMURA H.Initial open circuit voltages and discharge reaction mechanisms in non-aqueous electrolyte Li/ FeS2cells[J].Electrochimica Acta,1983,28:277-283.
[5]SHAO-HORN Y,OSMIALOWSKI Y S,HORN Q C.Reinvestigation of lithium reaction mechanisms in FeS2pyrite at ambient temperature[J].Journal of the Electrochemical Society,2002,149:A1547-1555.
[6]FONG R,DAHN J R,JONES C H W.Electrochemistry of pyritebased cathodes for ambient temperature lithium batteries[J].Journal of the Electrochemical Society,1989,136(11):3206-3210.
Investigation on high voltage of Li/FeS2battery

The open circuit voltage(OCV)and the initial discharge voltage of Lithium/iron disulfide battery were both higher than the IEC standard 1.83 V.The OCV would still recover above the standard value when the discharge capacity was less than 50%.When discharged to 1.8 V,the capacity of batteries stored at room temperature was higher than that of freshly prepared ones.Chemical composition and XRD analysis show that purity of material and formulas has some influence on the high-voltage phenomenon.However,solid solution diffusion mechanism at the first 2 e reaction stage might be an important reason for the batteries always with high voltage phenomenon when the discharge capacity was less than 50%.
Li/FeS2battery;high voltage;solid solution;reason
TM 911
A
1002-087 X(2016)03-0547-03
2015-08-19
刘俐伶(1986—),女,湖南省人,硕士生,主要研究方向为化学电源。
袁中直
