乌龙茶水提取物对人大肠癌LOVO细胞增殖及凋亡的影响
2017-01-20王丽丽蔡淑娴薛志慧刘仲华2
王丽丽,蔡淑娴,薛志慧,刘仲华2,
(1.福建省农业科学院茶叶研究所,福建福安355015;2.湖南农业大学园艺园林学院,湖南长沙410128;3.国家植物功能成分利用工程技术研究中心,湖南长沙410128;4.福建农林大学安溪茶学院,福建福州350002)
乌龙茶水提取物对人大肠癌LOVO细胞增殖及凋亡的影响
王丽丽1,2,3,蔡淑娴3,薛志慧4,刘仲华2,3
(1.福建省农业科学院茶叶研究所,福建福安355015;2.湖南农业大学园艺园林学院,湖南长沙410128;3.国家植物功能成分利用工程技术研究中心,湖南长沙410128;4.福建农林大学安溪茶学院,福建福州350002)
以赛珍珠5800铁观音为材料,测定乌龙茶中水浸出物、茶多酚、游离氨基酸、可溶性糖、黄酮类物质、没食子酸、8种儿茶素和3种生物碱的含量;并将0、0.2、0.4、0.6、0.8和1.0 mg·mL-1乌龙茶水提取物作用于体外培养的人大肠癌LOVO细胞中,分别处理24和48 h后,采用四甲基偶氮唑蓝(MTT)法测定细胞增殖抑制率,并在倒置显微镜下观察细胞形态的变化;以0.6和0.8 mg·mL-1乌龙茶水提取物处理LOVO细胞48 h,采用流式细胞仪检测细胞凋亡率,扫描电镜下观察细胞凋亡情况.结果表明,乌龙茶中各化学成分的含量均较高,水浸出物含量达40.8%以上,茶多酚含量14.2%,游离氨基酸含量1.8%,可溶性糖含量6.9%,黄酮类物质含量0.7%,儿茶素总量12.2%,咖啡碱含量1.7%,这些成分为其品质保证和功效发挥奠定了一定的物质基础.MTT法试验结果表明:0.2 mg·mL-1乌龙茶水提取物对LOVO细胞生长无抑制作用;处理24和48 h后,0.4~1.0 mg·mL-1乌龙茶水提取物对LOVO细胞生长的抑制率分别达13.9%~79.6%和16.4%~89.2%.0.6和0.8 mg·mL-1乌龙茶水提取物处理下LOVO细胞凋亡率分别为60.4%和62.3%,且低含量下细胞凋亡主要呈早期凋亡形式.扫描电镜观察显示,0.6和0.8 mg·mL-1乌龙茶水提取物处理48 h后LOVO细胞出现明显的凋亡现象,细胞体积缩小,细胞间隙增大,表面微绒毛断裂、减少甚至消失,细胞膜表面出现塌陷,产生类似空洞的结构等.因此,乌龙茶水提取物能有效抑制人大肠癌LOVO细胞增殖,并可诱导其凋亡的发生.
乌龙茶;大肠癌细胞;增殖;凋亡
茶叶种类很多,按加工工艺可分为绿茶、白茶、黄茶、乌龙茶、红茶和黑茶六大类.乌龙茶主产于福建安溪和武夷山两地,其中以安溪铁观音为代表的闽南乌龙茶最为出名,因其具有花香馥郁、滋味醇厚回甘的品质特点,赢得消费者的广泛喜爱.
茶叶中含有茶多酚、儿茶素、咖啡碱和茶氨酸等多种活性成分,它们均被证实与人类健康有密切关系,因而成为备受人们喜爱的保健饮料之一.茶叶的防癌抗癌效应已经得到体外试验、动物试验和部分流行病学研究的支持[1].表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)以及以EGCG为主要成分的绿茶儿茶素的抑癌效应在许多癌症中得到证实;此外,茶叶中的咖啡碱及红茶多酚也具有癌症预防作用[2-3].绿茶水提取物对体外培养的大肠癌LOVO细胞有抑制和杀灭作用,并证实诱导LOVO细胞凋亡是其杀灭肿瘤细胞的重要机制之一[4].EGCG可通过抑制Akt信号通路诱导大肠癌细胞凋亡[5].凋亡是在基因调控下的“主动自杀”,又称程序性细胞死亡.正常细胞的增殖分化和凋亡存在一种平衡,而肿瘤细胞则无限增殖,分化受阻,凋亡被抑制[6].细胞凋亡机制的研究有利于揭示恶性疾病如肿瘤、艾滋病的发病机制,也能为许多疾病的治疗开辟新的思路[7].本试验以赛珍珠5800铁观音水提取物为研究对象,将其直接作用于人大肠癌LOVO细胞,通过四甲基偶氮唑蓝[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]法、流式细胞仪测定和扫描电镜观察等手段,检测分析乌龙茶对LOVO细胞增殖及凋亡的影响,从而为进一步研究乌龙茶及其成分诱导细胞凋亡的机理、阐明乌龙茶的抗癌机理及开发茶叶中的有效抗癌成分等提供参考.
1 材料与方法
1.1 材料
人大肠癌LOVO细胞由中国科学院武汉病毒研究所赠送.乌龙茶选用赛珍珠5800铁观音,由福建八马茶业有限公司提供.
杜氏改良高糖培养基、磷酸盐缓冲液、胎牛血清和胰蛋白酶均购自美国Gibco公司;MTT购自美国Amresco公司;Annexin-V-FITC/PI双标记细胞凋亡试剂盒购自南京凯基生物科技发展有限公司.
主要仪器设备有各种细胞培养耗材(丹麦NUNC公司)、NU-4750E二氧化碳培养箱(美国Nuaire公司)、DMIL-LED倒置显微镜(德国Leica公司)、Scientific Varioskan Flash光谱扫描全功能酶标仪(美国Thermo公司)、JSM-6380LV扫描电镜(日本电子株式会社)、Express 0.22 μm孔径PES膜针头式过滤器(美国Millipore公司)等.
1.2 乌龙茶化学成分的测定
茶叶干物质、水浸出物、茶多酚和游离氨基酸的含量参照文献[8]的方法测定.可溶性糖和黄酮类物质的含量分别采用蒽酮比色法和三氯化铝比色法[9]测定.没食子酸、8种儿茶素和3种生物碱的含量采用HPLC法[10]测定.其中,8种儿茶素分别为表儿茶素(epicatechin,EC)、儿茶素(catechin,C)、表没食子儿茶素(epigallocatechin,EGC)、没食子儿茶素(gallocatechin,GC)、表儿茶素没食子酸酯(epicatechin gallate,ECG)、儿茶素没食子酸酯(catechin gallate,CG)、EGCG和没食子儿茶素没食子酸酯(gallocatechin gallate,GCG);3种生物碱分别为可可碱、茶叶碱和咖啡碱.
1.3 乌龙茶水提取物的制备
取赛珍珠5800铁观音干茶适量,在料液比1∶25、浸提温度100℃、浸提时间15 min的条件下提取,再经过滤、浓缩、冷冻干燥等步骤,制得乌龙茶水提取物.精密称取适量乌龙茶水提取物,加超纯水溶解配制成含量为7.5 mg·mL-1的乌龙茶水提取物,经PES膜针头式过滤器过滤后,分装至2 mL灭菌离心管中,置-20℃保存备用.
1.4 LOVO细胞的培养
LOVO细胞培养于含10%胎牛血清的杜氏改良高糖培养基中,置培养箱(37℃、100%湿度、5%CO2)培养.细胞贴壁生长,隔日用磷酸盐缓冲液洗涤细胞并换液,3~5 d传代一次.
1.5 LOVO细胞形态及增殖的检测
收集指数生长期细胞(即细胞汇合度达80%左右),用杜氏改良高糖培养基调整细胞密度为(1~2)× 105·mL-1,按100 μL·孔-1接种于96孔培养板中.常规培养24 h后,吸弃原培养基.设置正常对照组(CK)和加茶处理组,即CK组孔内添加新鲜培养基,加茶处理组孔内分别添加含0.2、0.4、0.6、0.8和1.0 mg·mL-1乌龙茶水提取物的新鲜培养基,每孔均添加200 μL;另设调零孔,不含LOVO细胞,仅添加培养基.每个剂量组均设5个复孔,每次种板2块.分别干预24和48 h后,在倒置显微镜下观察每组活细胞的形态,采用MTT法在酶标仪(490 nm波长)下测定各孔的光密度(D),计算细胞抑制率.细胞抑制率/%=[1-(加茶处理组的D-调零孔的D)/(正常对照组的D-调零孔的D)]×100.
1.6 LOVO细胞凋亡的检测
1.6.1 流式细胞仪检测 收集生长对数期细胞,调整细胞密度为(1~2)×105·mL-1,接种于6孔板中,每孔添加2.5 mL细胞悬液,培养24 h后吸弃原培养基并作如下处理.(1)CK组:仅添加新鲜培养基;(2)加茶处理组:分别添加0.6和0.8 mg·mL-1乌龙茶水提取物的新鲜培养基.每组设一个复孔,作用48 h待胰蛋白酶消化后收集细胞沉淀,按Annexin-V-FITC/PI双标记细胞凋亡试剂盒说明书完成每项操作步骤,采用流式细胞仪检测.
1.6.2 扫描电镜观察 LOVO细胞处理方法与“1.6.1”中的方法相同.作用48 h待胰蛋白酶消化后,于4℃、1 500 r·min-1离心5 min,弃上清,用磷酸盐缓冲液洗涤3次,收集细胞团,缓慢加入1 mL 0.25%中性戊二醛固定,切忌吹散细胞团,于4℃保存过夜,用扫描电镜观察并拍照.
1.7 数据分析
计量数据以平均值±标准差表示,采用SPSS 21.0软件进行统计分析,组间两两比较采用LSD法.
2 结果与分析
2.1 乌龙茶的化学成分
赛珍珠5800铁观音系传统浓香型铁观音,采用王氏古法果木(荔枝木)焙火而成.其品质特点为:外形肥壮、圆结、匀整,色泽乌润有光泽;干茶炒米香、茶汤果甜香,香气优锐;汤色浅金黄清澈;滋味鲜醇浓爽,音韵极显;叶底肥厚软亮红边显.化学成分检测结果(表1)显示,茶叶中各化学物质的含量均较高,其中,水浸出物含量达 40.9%,茶多酚含量14.2%,游离氨基酸含量1.8%,可溶性糖含量6.9%,咖啡碱含量1.7%,儿茶素总量12.2%.据报道,水浸出物是茶叶品质的综合性指标,其含量的多少能反映茶汤的厚薄和浓淡,与茶叶质量呈正相关[11].茶多酚含量的高低在一定程度上决定了茶汤的浓度和厚度[12],其中的酯型儿茶素对茶汤的收敛性和苦涩味产生正面影响.可溶性糖使茶汤呈现甜度和粘稠度,并对苦涩味有一定的掩盖和协调作用[13].氨基酸具有鲜爽味[14],有利于形成茶叶滋味鲜醇、回味爽口、香气鲜香的品质特征.这些化学成分是茶叶优良品质形成的重要物质基础,同时为其健康功效的发挥提供了物质来源.
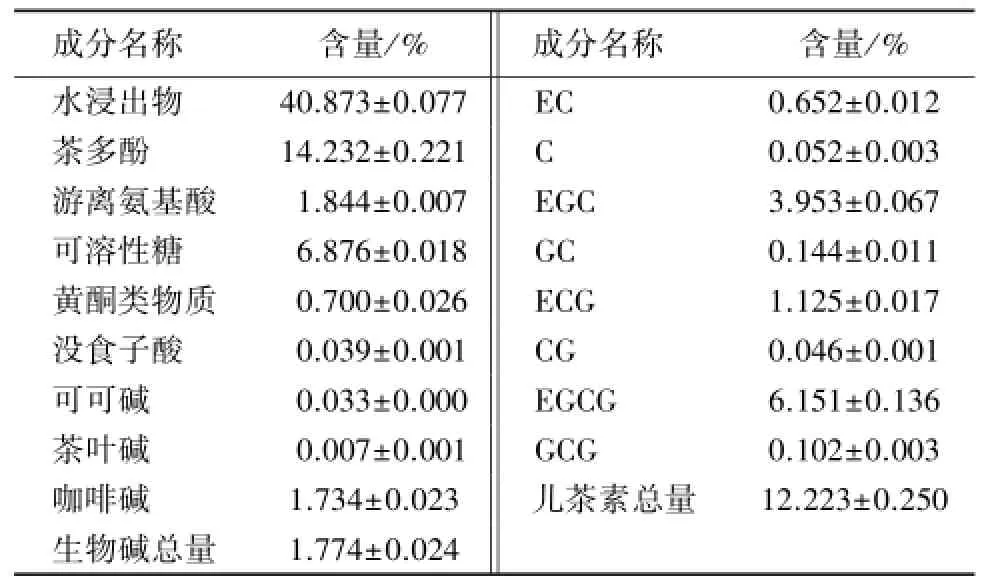
表1 赛珍珠5800铁观音中的主要化学成分Table 1 Major chemical components in Oolong tea
2.2 乌龙茶水提取物对LOVO细胞形态及增殖的影响
倒置显微镜下观察CK组的LOVO细胞生长旺盛,形态呈梭形或多边形,胞体大,胞质均匀透明,细胞之间连接紧密,成层贴于瓶底,随着培养时间的延长形态无明显变化;1.0 mg·mL-1加茶处理组的LOVO细胞变小、变圆,数目明显减少,核浓缩,体积皱缩,细胞间失去连接,部分脱落漂浮于培养瓶中(图1). MTT法试验结果表明,分别处理24和48 h后,除0.2 mg·mL-1乌龙茶水提取物对LOVO细胞增殖稍有促进外,0.4、0.6、0.8和1.0 mg·mL-1乌龙茶水提取物均表现出明显的抑制作用,且与CK的差异显著.在乌龙茶水提取物含量一致的情况下,48 h干预比24 h能更有效抑制LOVO细胞增殖;当干预时间一致时,随着乌龙茶水提取物含量的提高,其对LOVO细胞生长的抑制作用愈加明显,且抑制率与含量呈正相关(表2).由此表明,含量为0.4~1.0 mg·mL-1时,乌龙茶水提取物呈时间和剂量依赖方式抑制LOVO细胞的生长.
2.3 乌龙茶水提取物对LOVO细胞凋亡的影响
2.3.1 流式细胞仪检测结果 采用流式细胞仪分析乌龙茶水提取物诱导LOVO细胞的凋亡情况,结果(图2)显示,CK组的活细胞高达74.2%(左下象),而乌龙茶水提取物干预后细胞凋亡率明显增加.0.6 mg·mL-1乌龙茶水提取物作用48 h时,早期凋亡细胞达到39.9%(右下象),中晚期凋亡及坏死细胞为20.5%(右上象);0.8 mg·mL-1乌龙茶水提取物作用48 h时,早期凋亡细胞下降为18.5%,中晚期凋亡及坏死细胞高到43.8%.表明0.6和0.8 mg·mL-1乌龙茶水提取物均能诱导LOVO细胞凋亡,且含量高时早期凋亡细胞数量降低,中晚期凋亡及坏死细胞相应增加,推测可能是一部分早期凋亡细胞已转变为晚期或坏死细胞.
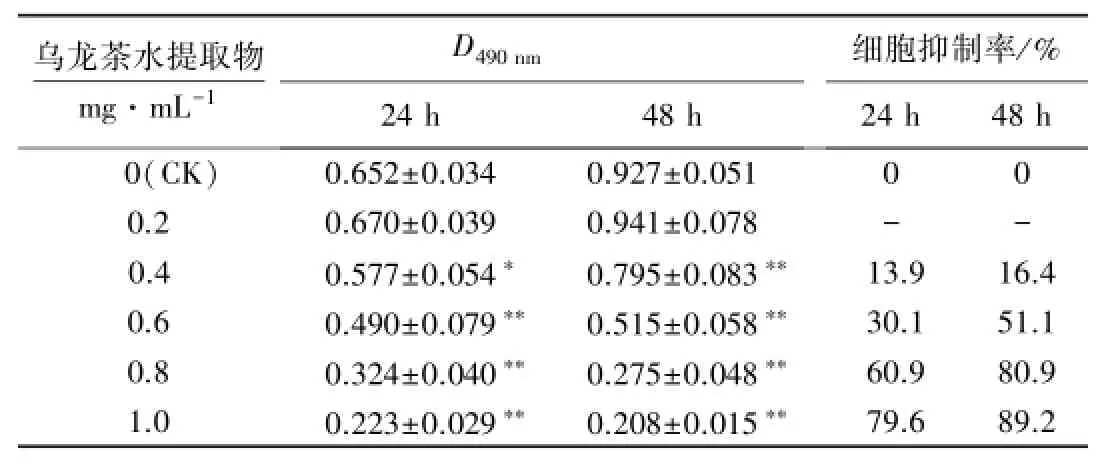
表2 乌龙茶水提取物对LOVO细胞增殖的影响1)Table 2 Effect of Oolong tea aqueous extract on the proliferation of LOVO cells
2.3.2 扫描电镜观察结果 扫描电镜观察结果(图3)显示:CK组LOVO细胞表面有丰富的微绒毛,细胞大小基本一致,细胞间隙适中;0.6和0.8 mg·mL-1乌龙茶水提取物组的LOVO细胞体积缩小,细胞间隙增大,表面微绒毛断裂、减少甚至消失,细胞膜表面出现塌陷,产生类似空洞的结构,少数细胞内容物外泄,部分细胞死亡.这一结果可直观地表明乌龙茶水提取物对LOVO细胞凋亡有一定的诱导作用.
3 结论与讨论
本试验测定了赛珍珠5800铁观音中水浸出物、茶多酚和游离氨基酸等主要化学成分的含量,结果显示,各化学成分的含量均较高,这些成分为其品质保证和功效发挥奠定一定的物质基础.MTT法试验结果显示,乌龙茶水提取物对人大肠癌LOVO细胞增殖具有明显的抑制作用,其细胞生长抑制随着乌龙茶水提取物含量的升高和作用时间的延长而增强,具有量—效、时—效的关系.流式细胞仪检测结果表明:0.6 mg ·mL-1乌龙茶水提取物组LOVO细胞的早期凋亡率为39.9%;0.8 mg·mL-1乌龙茶水提取物组的早期凋亡率下降为18.5%,而中晚期凋亡及坏死细胞高达43.8%.扫描电镜下可观察到典型的细胞凋亡形态.表明乌龙茶水提取物可诱导LOVO细胞凋亡.
细胞凋亡与肿瘤的发生发展有关,诱导肿瘤细胞凋亡可以抑制肿瘤的生长[7].诱导肿瘤细胞凋亡的作用机制主要有以下几个方面:(1)阻滞肿瘤细胞的增殖周期;(2)阻断凋亡信号传递通路;(3)影响癌基因及抑癌基因的表达等[15].本试验中,茶多酚含量高达14.2%,且儿茶素占到茶多酚含量的80%以上.目前关于茶叶活性成分的抗癌作用及机制研究主要集中在儿茶素上.谭晓华等[16]比较了4种主要儿茶素EGCG、EGC、ECG和EC对LOVO细胞的作用,发现EGCG和EGC对LOVO细胞生长抑制和诱导凋亡的活性最强,且呈时间和剂量的依赖性;它们对LOVO细胞生长周期影响的差异在于:EGCG、EGC和ECG可引起LOVO细胞生长阻滞在G1期,而EC则使LOVO细胞生长阻滞发生在S期.EGCG还可诱导结肠癌(HT-29)、前列腺癌(PC3和LnCAP)等细胞株G1期的阻滞[17-18],这可能与活化p38丝裂原活化蛋白激酶,下调细胞周期蛋白D1的表达有关[19].EGCG诱导PC3和LnCAP细胞株中p53高水平表达,并伴随下游分子p21和Bax在转录水平上表达量的增加[18].当EGCG作用于结肠癌HT-29细胞株后,可调节腺苷酸活化蛋白激酶的活性,造成环氧合酶-2基因表达受阻[17],而环氧合酶-2基因表达下调的结果同样在LOVO细胞凋亡中被检测到[20-21].Caspase家族的激活在细胞凋亡的过程中起着关键作用,被认为是引起凋亡的直接效应物.其中,Caspase-3是该家族的重要成员,是细胞凋亡过程中的关键酶.EGCG呈浓度依赖性地增加LOVO细胞Caspase-3的相对活性,提示其作用机制可能与增加细胞Caspase-3的活性有关[21]. Lee et al[22]研究表明,绿茶EGCG通过下调人慢性淋巴球性白血病B细胞中淋巴瘤因子2的表达量,裂解聚腺苷二磷酸-核糖聚合酶,以及抑制血管内皮生长因子受体的磷酸化水平等一系列途径,促进慢性淋巴球性白血病B细胞的凋亡.淋巴瘤因子2与Bax的比率决定着细胞的命运,其比率增高,细胞不易发生凋亡,而比率降低则导致凋亡.引起细胞中淋巴瘤因子2基因表达下降,而Bax基因表达增加是EGCG诱导LOVO细胞凋亡的可能机制之一[18,23].
此外,茶多糖、茶色素和咖啡碱同样具有诱导细胞凋亡的活性[1,4,24].植物多糖因其广谱抗肿瘤能力、低毒且副作用小已经成为理想的免疫调节剂和抗肿瘤新药.茶多糖是茶叶中具有生物活性的复合多糖的简称,在乌龙茶中的含量高于绿茶和红茶[25],本试验测得赛珍珠5800铁观音干茶样中的可溶性糖含量高达6.9%.茶多糖抗癌研究相对较少,已有研究表明,茶多糖呈剂量依赖性地显著抑制大肠癌细胞株HCT-15细胞增殖,但对Caco-2细胞增殖抑制效果不明显[25].而其他植物多糖,如五味子多糖抑制细胞增殖及诱导凋亡方面的报道较多[26-28].不同浓度的五味子多糖对卵巢癌SKOV3细胞的抑制率明显升高,且细胞中淋巴瘤因子2蛋白的表达明显减少,Bax和Caspase-3蛋白的表达明显增加,推测作用机制与细胞凋亡的线粒体途径有关[28].因此,茶多糖作为一种天然植物多糖,其抗肿瘤活性也值得深入研究.
上述诸多研究表明,绿茶EGCG在体内外均能抑制多种肿瘤细胞的增殖生长,但其作用机制不是十分明确,可能与其诱导细胞凋亡有关.总体来看,EGCG通过激活Caspase和淋巴瘤因子2家族,上调p53的表达,下调环氧合酶-2的表达,阻滞细胞增殖周期,抑制血管内皮生长因子受体的活性等多种机制诱导肿瘤细胞凋亡.本试验结果表明,乌龙茶水提取物能抑制LOVO细胞增殖,并诱导其凋亡,与HIBASAMI et al[29]的研究结果相符.然而关于乌龙茶水提取物及其活性物质,如含量较高的茶多糖(除儿茶素外)等诱导细胞凋亡的详细作用机制仍有待进一步研究,如可从上述机制来探讨细胞凋亡可能的途径及其作用靶点,这对阐明乌龙茶抗癌机理,开发其有效抗癌成分,无疑有重要的理论和实际意义.
[1]宛晓春,夏涛,张正竹,等.茶树次生代谢[M].北京:科学出版社,2015:163.
[2]刘华,曹第勇,杨尚君,等.表没食子儿茶素没食子酸酯对IL-1β诱导MIN6细胞凋亡的保护作用[J].重庆医学,2015,44 (23):3 183-3 186.
[3]YANG C S,WANG H,LI G X,et al.Cancer prevention by tea:evidence from laboratory studies[J].Pharmacological Research,2011,64(2):113-122.
[4]谭晓华,张亚历,周殿元,等.绿茶水提取物诱导体外培养的大肠癌LOVO细胞的凋亡[J].癌症,1998,17(3):171-174.
[5]计春燕,谭诗云.表没食子儿茶素没食子酸酯通过抑制Akt信号通路诱导大肠癌细胞凋亡[J].实用老年医学,2015,29 (7):583-586,589.
[6]孔建强,赵琦.细胞凋亡机制的研究进展[J].生物技术通报,2002(3):15-18.
[7]欧阳高亮,李祺福.细胞凋亡与肿瘤的发生发展和治疗[J].国外医学(肿瘤学分册),2000,27(5):266-269.
[8]中国标准出版社第一编辑室.茶叶标准汇编[M].4版.北京:中国标准出版社,2011:496-503,533-542.
[9]黄意欢.茶学实验技术[M].北京:中国农业出版社,1995:124,135-136.
[10]王丽丽,杨军国,陈键,等.微孔过滤对茶叶儿茶素类和生物碱HPLC检测的影响[J].茶叶科学技术,2014(3):29-33.
[11]姬志林,韦嶶.西双版纳普洱茶水浸出物的含量测定[J].中国保健营养,2012(7):236-237.
[12]宛晓春.茶叶生物化学[M].3版.北京:中国农业出版社,2005:9-15,52-57.
[13]刘晓莎,董继扬,孟维君,等.铁观音茶水浸出物组成模式及溶出规律的核磁共振波谱分析[J].茶叶学报,2015,56(4): 198-205.
[14]马林龙,金孝芳,曹丹,等.湖北引种黄金茶1号主要生化特性及绿茶适制性分析[J].茶叶学报,2016,57(1):34-41.
[15]闫华超,李林蔚.抗肿瘤药物诱导肿瘤细胞凋亡机制的研究进展[J].聊城大学学报(自然科学版),2009,22(3):42-46.
[16]谭晓华,周殿元,张亚历,等.儿茶素对LOVO细胞生长周期的影响和诱导凋亡的作用[J].2000,34(6):333-335.
[17]HWANG J T,HA J,PARK I J,et al.Apoptotic effect of EGCG in HT-29 colon cancer cells via AMPK signal pathway[J]. Cancer Letters,2007,247(1):115-121.
[18]HASTAK K,GARWAL M K,MUKHTAR H,et al.Ablation of either p21 or Bax prevents p53-dependent apoptosis induced by green tea polyphenol epigallocatechin-3-gallate[J].The FASEB Journal,2005,19(5):789-791.
[19]蒋莉莎,罗朝阳,曹慧秋,等.表没食子儿茶素没食子酸酯对人结肠癌HT-29细胞G1期的阻滞作用[J].现代生物医学进展,2010,10(18):3 438-3 442.
[20]MÉRIC J B,ROTTRY S,OLAUSSEN K,et al.Cyclooxygenase-2 as a target for anticancer drug development[J].Critical Reviews in Oncology/Hematology,2006,59(1):51-64.
[21]吴方红,周学军,文静.EGCG对大肠癌细胞系LoVo细胞增殖的影响及其机制[J].辽宁中医药大学学报,2015,17(1): 33-36.
[22]LEE Y K,BONE N D,STREGE A K,et al.VEGF receptor phosphorylation status and apoptosis is modulated by a green tea component,epigallocatechin gallate(EGCG),in B-cell chronic lymphocytic leukemia[J].Blood,2004,104(3):788-794.
[23]谭晓华,周殿元,张亚历,等.表没食子儿茶素没食子酸酯诱导大肠癌LOVO细胞凋亡和凋亡相关基因表达的改变[J].中华医学杂志,1999,79(4):308-310.
[24]WANG Y F,SHAO S H,WU P,et al.Fermentation process enhanced production and bioactivities of oolong tea polysaccharides[J].Food Research International,2012,46(1):158-166.
[25]NIE S P,XIE M Y.A review on the isolation and structure of tea polysaccharides and their bioactivities[J].Food Hydrocolloids,2011,25(2):144-149.
[26]唐泽波,温娜,张宇,等.五味子多糖诱导裸鼠胶质瘤细胞凋亡过程中Caspase-3的表达[J].中国老年学杂志,2014,34 (21):6 126-6 127.
[27]黄晓东,路倩,范红艳,等.五味子多糖对人结肠癌HT29细胞增殖的抑制作用及其机制[J].中国老年学杂志,2015,35 (22):6 337-6 338.
[28]孙雨薇,闫冬梅.五味子多糖对SMMC-7721肝癌细胞凋亡的影响[J].生物技术世界,2016(3):200.
[29]HIBASAMI H,JIN Z X,HASEGAWA M,et al.Oolong tea polyphenol extract induces apoptosis in human stomach cancer cells[J].Anticancer Research,2000,20(6):4 403-4 406.
(责任编辑:施晓棠)
Effects of Oolong tea aqueous extract on proliferation and apoptosis of human colon cancer LOVO cells in vitro
WANG Lili1,2,3,CAI Shuxian3,XUE Zhihui4,LIU Zhonghua2,3
(1.Tea Research Institute,Fujian Academy of Agricultural Science,Fu′an,Fujian 355015,China;2.College of Horticulture and Landscape,Hunan Agricultural University,Changsha,Hunan 410128,China;3.National Research Center of Engineering and Technology for Utilization of Botanical Functional Ingredients,Changsha,Hunan 410128,China;4.College of Anxi Tea,Fujian Agriculture and Forestry University,Fuzhou,Fujian 350002,China)
To investigate active constituents of Oolong tea in inhibiting the proliferation of LOVO cells and inducing apoptosis,Sai zhenzhu 5800 Tieguanyin,a type of Oolong tea,was detected in terms of water extract tea polyphenols,free amino acids,water soluble sugar,flavones,gallic acid,8 catechins and 3 alkaloids.Then the Oolong tea aqueous extract was added to human colon cancer LOVO cells,which were cultured in vitro in concentrations of 0,0.2,0.4,0.6,0.8,1.0 mg·mL-1for 24 h and 48 h,respectively. Cell morphology was observed under inverted microscope,and 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT)assay was used to detect cellular proliferation inhibition rate of LOVO cells.Lastly,apoptosis of LOVO cells after Oolong tea treatment(in 0.6 and 0.8 mg·mL-1)was analysed via flow cytometer,with apoptotic cell morphology observed under scanning electron microscope.The results showed that chemical components levels were generally high in Sai zhenzhu 5800 Tieguanyin,with water extract amounting to 40.8%.As well,tea polyphenols,free amino acids,water soluble sugar,flavones,total catechins andcaffeine was 14.2%,1.8%,6.9%,0.7%,12.2%and 1.7%,respectively,providing sound material base for its high quality and health efficacy.MTT test indicated that 0.2 mg·mL-1tea extract was not able to inhibit LOVO cell proliferation,while inhibitory rates of tea extract in concentration of 0.4-1.0 mg·mL-1after 24 h and 48 h ranged between 13.9%-79.6%and 16.4%-89.2%,respectively.After treatment in 0.6 and 0.8 mg·mL-1tea extract,apotosis rates were 60.4%and 62.3%,and early apoptosis was the main form at lower concentration.After 48 h,more contractive cells and intercellular space were observed under scanning electron microscope,together with ruptured,reduced or even disappeared microvilli on the surface.Moreover,subsidence of cell membrane surface and hollow structure occurred in LOVO cells after treated by Oolong tea.Thus Oolong tea is likely to inhibit proliferation of LOVO cells and induce cell apoptosis,effectively.
Oolong tea;colon cancer cell;proliferation;apoptosis
S571.1
:A
:1671-5470(2016)06-0638-06
10.13323/j.cnki.j.fafu(nat.sci.).2016.06.005
2016-03-15
:2016-06-27
国家自然科学基金资助项目(31471590、31471706);国家茶叶产业技术体系项目(CARS-23-C);教育部长江学者和创新团队发展计划项目(IRT0963);福建省省属公益类科研院所专项(2015R1012-3).
王丽丽(1985-),女,研究实习员,硕士.研究方向:茶叶生物化学及天然产物的分离纯化.Email:875720551@qq.com.通讯作者刘仲华(1965-),男,教授,博士.研究方向:茶叶功能成分化学研究.Email:larkin-liu@163.com.
