免疫荧光法检测B群链球菌方法的建立及性能评价*
2017-01-19樊尚荣蒋济阳刘小平黄荣唐盛龚海涛
樊尚荣 蒋济阳 刘小平△ 黄荣 唐盛 龚海涛
(1.北京大学深圳医院妇产科,深圳 518036;2.北京大学深圳医院检验科,深圳 518036;3.深圳市迈科龙生物技术有限公司,深圳 518055)
免疫荧光法检测B群链球菌方法的建立及性能评价*
樊尚荣1蒋济阳2刘小平2△黄荣2唐盛3龚海涛3
(1.北京大学深圳医院妇产科,深圳 518036;2.北京大学深圳医院检验科,深圳 518036;3.深圳市迈科龙生物技术有限公司,深圳 518055)
目的:建立免疫荧光法B群链球菌检测方法并评价其性能,确定免疫荧光法B群链球菌检测试剂的最佳反应条件;了解免疫荧光法B群链球菌检测方法的局限及改进措施。方法:双盲法。采集103例产检孕妇阴道分泌物标本,分离培养、鉴定,免疫荧光法对分离的疑似B群链球菌菌落免疫荧光法检测;248例孕妇阴道拭子直接涂片免疫荧光检测进行双盲法平行检测,以分离培养、鉴定结果为标准,统计免疫荧光法B群链球菌检测试剂与分离培养鉴定法检测结果的总符合率及阴、阳性符合率,计算一致性系数;设计干扰试验,研究与其他细菌抗原交叉反应的可能。结果:试验结果统计分析显示,103例免疫荧光法B群链球菌检测菌落涂片与分离培养鉴定法检测结果的总符合率为94.17%,阴性符合率为92.41%,阳性符合率为100%,Kappa值为0.85。对248例临床孕妇阴道分泌物涂片检测,免疫荧光法B群链球菌检测试剂与分离培养鉴定法检测结果的总符合率为95.16%,阴性符合率为96.48%,阳性符合率为80.95%,Kappa值为0.71。结论:免疫荧光法B群链球菌检测试剂检测分离菌落涂片、与分离培养鉴定法的检测结果无显著性差异,阴道分泌物直接涂片的结果与分离培养鉴定法的检测结果一致。免疫荧光B群链球菌检测方法具有快速、简便、准确的特性,可用于产前孕妇阴道分泌物分离的疑似B群链球菌菌落直接鉴定。
B群链球菌;免疫荧光技术免疫荧光分析;干扰试验
B群链球菌(Group B strcptococcus,GBS)即无乳链球菌(Streptococcus agalactiae),以其细胞壁多糖类C物质属于Lancefield抗原结构分类中的B群而得名。B群链球菌正常寄居于阴道和直肠,属于条件致病菌。在20世纪70年代,B群链球菌被证实为围产期母婴感染的主要致病菌之一,在围产医学中占有重要地位,母婴传播是新生儿GBS感染的主要途径,发生在分娩过程中,新生儿暴露于GBS存在的产道,可能吞进和吸入细菌,导致新生儿感染[1-5]。早发型GBS感染(生产后7天以内)主要引起肺炎和败血症,是新生儿死亡的主要原因之一。而晚发型GBS感染(生产后7天-3个月)主要引起脑膜炎(占新生儿脑膜炎的31%),严重者致神经系统后遗症及听力丧失等不可逆损害[6]。目前常用的GBS临床实验室诊断方法为GBS分离培养鉴定法,美国CDC、美国妇产科协会以及美国儿科协会推荐用选择性培养基对孕产妇和新生儿进行GBS感染筛查,因其操作过程相对繁琐、耗时长,医疗机构未能普遍开展。为寻求能够满足孕妇GBS快速、准确的检测方法,研发了免疫荧光法(Immunofluorescence assay,IFA)B群链球菌检测试剂并评价其性能。报道如下:
1 材料与方法
1.1 免疫荧光法B群链球菌检测试剂及质控体系的建立
1.1.1 材料
B群链球菌单克隆抗体,异硫氰酸荧光素标记。分装成0.5 mL一支。储存温度2-8℃。有效期6个月。Zeiss AXIOSKOP-PLUS荧光显微镜。阳性质控片:自制。阴性质控片:上皮细胞(Epithelial cells):用美国ATCC CCL-2标准上皮细胞、大肠埃希菌 ATCC29213、ATCC35218、金黄色葡萄球菌ATCC25923传代菌株。
1.1.2 免疫荧光法B群链球菌检测试剂最佳反应条件
运用单一变量法,分别评价B群链球菌涂片介质类型、试剂用量、反应时间、孵育温度、孵育湿度、冲洗用水对试验结果的影响。质控涂片检测采用已确定的最佳反应条件。试验用菌株为混合B群链球菌菌株。
1.1.2.1 涂片介质的选择
试验菌株为自制阳性质控菌株,介质类型包括生理盐水、营养肉汤、乙醇或丙酮。分别用生理盐水、营养肉汤作为涂片介质蘸取菌落滚动制片各10张,自然干燥,加入B群链球菌免疫荧光试剂。
涂片介质pH值:用1M乙酸稀释溶液、生理盐水、1 M碳酸氢钠溶液用于涂片介质调整试验pH,在pH值<7.0 、pH值等于7.0和 pH值>7.0时制备GBS混合菌株涂片各10片,自然干燥,加入B群链球菌免疫荧光试剂。
试剂用量:制备1麦氏单位GBS混合菌株涂片30片,自然干燥分别5 μL、10 μL、20 μLB群链球菌免疫荧光试剂。
反应时间:制备1麦氏单位GBS混合菌株涂片30片,自然干燥加入10 μLB群链球菌免疫荧光试剂分别作用15 min、30 min和45 min,观察结果。
孵育温度和湿度:制备1麦氏单位GBS混合菌株涂片各10片,加入B群链球菌免疫荧光试剂后分别放置在26-30℃、37℃、干燥37℃、保湿暗盒,30 min后冲洗、晾干、观察结果。
冲洗用水:制备1麦氏单位GBS混合菌株涂片各10片,加10 μLB群链球菌免疫荧光试剂后分别放置在保湿暗盒37℃,30 min后分别用自来水、去离子水和PBS+吐温冲洗,观察结果。
1.2 免疫荧光法B群链球菌检测试剂性能评价
1.2.1 菌落涂片免疫荧光B群链球菌检测与分离、鉴定等效性验证
1.2.1.1 主要仪器
细菌鉴定及药敏分析仪MicroScan walkAway40及96孔鉴定/药敏板,Zeiss AXIOSKOP-PLUS荧光显微镜。
1.2.1.2 主要试剂
哥伦比亚血琼脂平板(型号:LS0109)、麦康凯平板,广州市迪景微生物科技有限公司生产;乳胶凝集试剂(LA)-B生物梅里埃公司生产,有效期内、自制的B群链球菌荧光标记抗体。
1.2.1.3 标本处置
在2013年6月至9月期间共对北京大学深圳医院103例产前检查孕妇阴道分泌物标本,标本在患者签知情同意书后采集并采用无菌容器保存。编号后送至微生物室分离培养。
将标本接种于平板上,在37℃恒温箱内培养24-48 h,观察结果。GBS菌落在血琼脂平板上呈灰白、透光、湿润、光滑、凸起,选取可疑菌落涂片革兰染色镜检,显微镜下可见革兰染色阳性链球菌,触酶实验阴性、链球菌乳胶凝集试验阳性者进一步生化鉴定。挑取血平板上疑似B群链球菌的菌落涂片,干燥后加5 μL B群链球菌免疫荧光试剂,置密闭、湿润暗盒中,置于37℃温箱孵育30 min,用去离子水缓缓冲洗载玻片30 sec,晾干,用荧光显微镜阅片,在油镜下发现一个以上苹果绿色荧光、典型空心圆球颗粒状B群链球菌则为阳性,未发现可定义为阳性的典型特异染色时即为阴性。
1.2.1.4 检测下限的确定
免疫荧光法B群链球菌检测的灵敏度即确定试剂检出B群链球菌的最低浓度(检出阳性的菌液最低浓度下限)。
用GBS菌株配制0.5麦氏浓度菌悬液(1.5×108cfu·mL-1),倍比稀释至1:256,形成8个浓度的菌悬液,1.5×108、7.5×107、3.75×107、1.88×107、9.38×106、4.69×106、2.34×106、1.17×106、5.86×105。制备涂片、干燥后进行B群链球菌免疫荧光染色,显微镜观察并记录结果。每一稀释浓度的菌悬液制备3张涂片。
1.2.2 阴道分泌物涂片荧光B群链球菌检测与分离、鉴定的等效性评价
取248例产前检查孕妇阴道拭子,每例2支,1支接种血平板、麦康凯平板37℃孵育24-48 h,分离、鉴定。载玻片标记标本信息,在阴道拭子直接或滴加0.1 mL生理盐水后滚动涂片,自然干燥,免疫荧光法检测阴道分泌物B群链球菌,记录结果。
1.3 干扰试验
用免疫荧光法B群链球菌检测试剂对有明确鉴定结果的A群链球菌、肺炎链球菌、肠球菌、淋病奈瑟菌等18种临床分离菌株及标准菌株菌落涂片检测,涂片介质为生理盐水。
1.4 数据处理
采用SPSS 13.0统计分析软件比对检测结果进行统计学分析,计算免疫荧光法B群链球菌检测试剂与分离培养法检测结果的总符合率和阴、阳符合率,并计算一致性系数Kappa(K)值。规定若K值>0.8,则表明两种检测方法有一致性,在临床应用中有等效性;0.75>Kappa≥0.4两者一致性一般,Kappa<0.4两者一致性较差[7]。
2 结果
2.1 免疫荧光法B群链球菌检测试剂质控体系的建立
阳性质控结果:显微镜下清晰、易辨,B群链球菌单个或成链状排列,荧光集中在菌体膜上,其他部位荧光强度弱镜下可显示中空现象。
上皮细胞阴性质控片 采用与细菌不同生物类型的上皮细胞制成,镜下阴性、效果良好,大肠埃希菌标准菌株ATCC29213、ATCC35218、金黄色葡萄球菌ATCC25923制备的阴性质控片,镜下检测阴性效果良好。
2.2 免疫荧光法B群链球菌检测试剂最佳反应条件的确立
用GBS混合菌株制成的内控品进行检测,运用单一变量法,研究改变一项反应条件对检测结果的影响,确定该方法的最佳反应条件。试验结果如下表1,“-”代表检测结果阴性,“±”代表检测结果弱阳性,“+”代表检测结果为阳性,“++”代表检测结果强阳性。

表1 免疫荧光法B群链球菌检测试剂最佳反应条件试验结果
由上述实验结果可以确定免疫荧光法B群链球菌检测试剂的最佳反应条件为:生理盐水作为涂片介质、 pH值7.0,试剂量10 μL,孵育时间30 min,孵育温度37℃,孵育环境湿润,PBS+吐温洗剂、去离子水均可作为冲洗用水。当菌量少时选用营养肉汤作为涂片介质效果更好,当缺乏去离子水时选用自来水作为冲洗用水也能达到同等效果。简要流程如图1,整个反应过程避光。
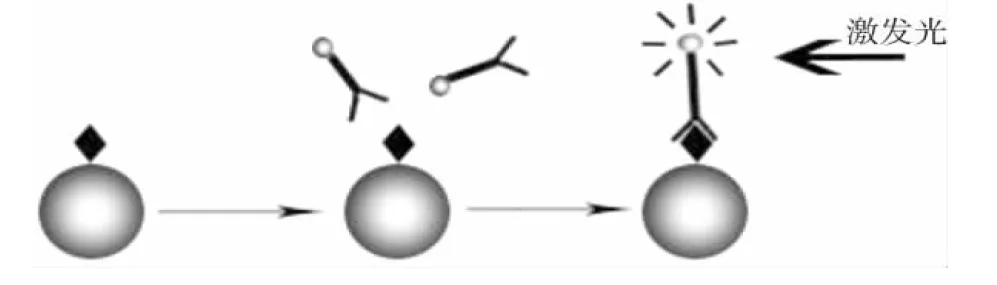
涂片固定→5 μL荧光抗体,37℃温箱孵育30 min→洗涤、晾干、镜检图1 免疫荧光检测原理及流程图
2.2 免疫荧光法B群链球菌检测试剂性能评价
2.2.1 103例样本免疫荧光法检测与分离培养法结果比较
以分离培养作为金标准,免疫荧光检测疑似B群链球菌结果与之对比,103例样本检测结果见表2。

表2 免疫荧光法检测与分离培养法结果对比
统计分析显示,103例临床标本分离的疑似菌落免疫荧光法B群链球菌检测与鉴定结果的总符合率为95.16%,阴性符合率为96.48%,阳性符合率为80.95%,Kappa值为0.85,大于0.8。
2.2.2 248例样本免疫荧光法与分离培养法检测结果比较
采用分离培养鉴定法与免疫荧光法B群链球菌检测法对248例临床孕妇阴道拭子进行双盲法平行检测,检测结果见表3。
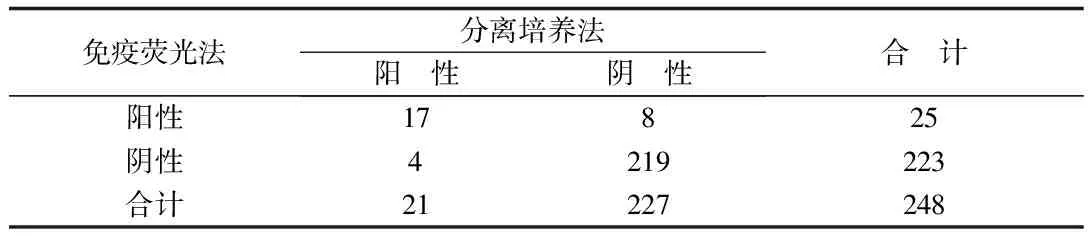
表3 免疫荧光法与分离培养法检测结果
248例孕妇阴道拭子直接涂片,免疫荧光法B群链球菌检测与分离、培养、鉴定结果的总符合率为95.16%,阴性符合率为96.48%,阳性符合率为80.95%,Kappa值为0.7126,接近0.8。两种检测方法的检测结果一致。
2.2.3 免疫荧光法B群链球菌检测的灵敏度
用阳性菌株配制0.5麦氏浓度(相当于1.5×108cfu·mL-1)菌悬液,倍比稀释至1:256,用灭菌拭子蘸取少量菌悬液涂片干燥后进行免疫荧光染色,显微镜镜检(100 X10)并记录结果,见表4。

表4 免疫荧光法B群链球菌检测试剂的灵敏度
阴性对照 用大肠埃希菌ATCC35218标准株配制0.5麦氏浓度单位细菌菌液,倍比稀释,配制成不同浓度的菌液,用灭菌拭子蘸取涂片、晾干后免疫荧光染色,结果均为阴性。
本研究检出阳性菌液最低可检测下限为5.86×105cfu·mL-1,免疫荧光法敏感度较高,能够检出较低浓度菌液中的B群链球菌。阳性质控片和阴性质控片上的菌量均高于5.86×105cfu·mL-1,质控结果可信,检出最低下限的研究为后续开展的临床检测提供了支持。
2.3 干扰试验
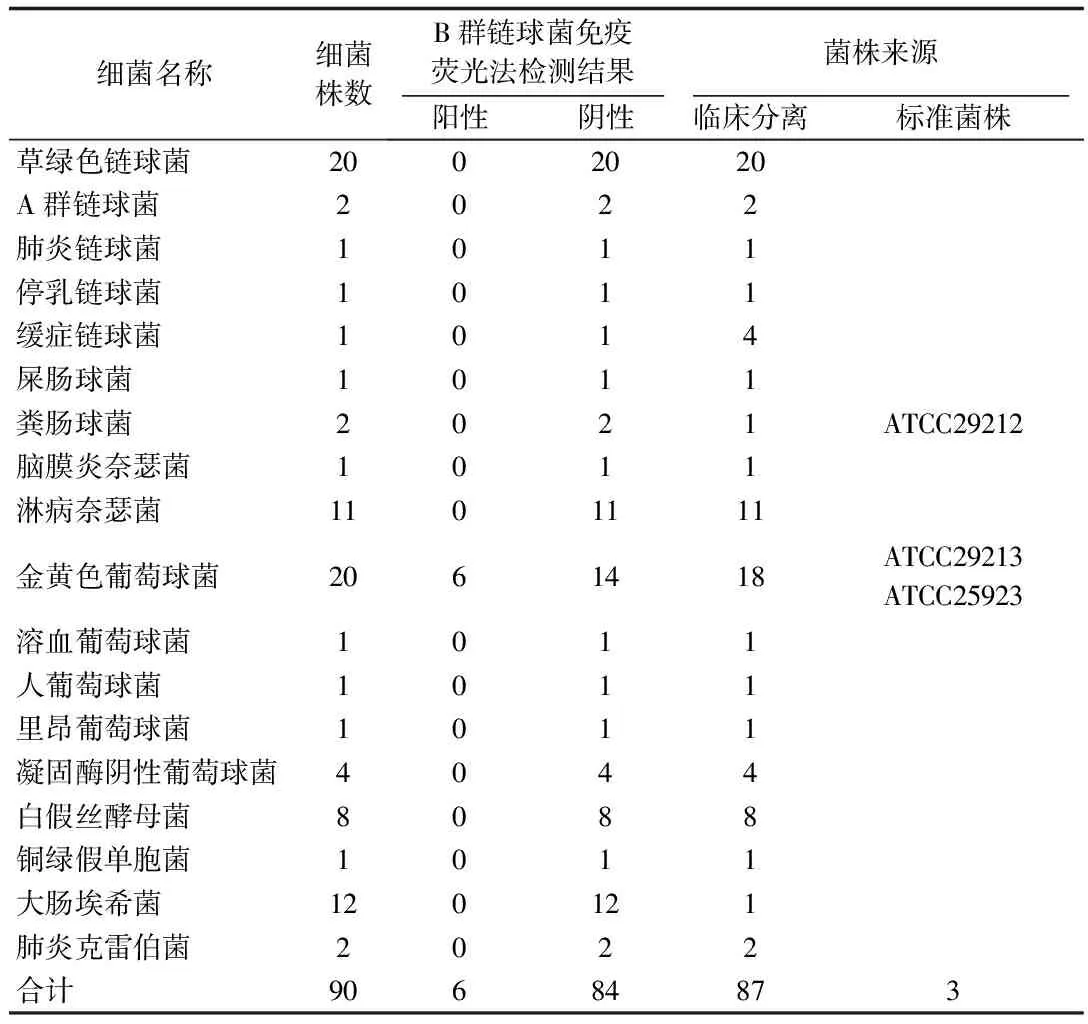
表5 干扰试验检测结果
注:细菌总株数90株,检测阳性6株,检测阴性84株。
由上述干扰试验检测结果可以看出,免疫荧光法B群链球菌检测试剂中的荧光标记抗体与6株临床分离的金黄色葡萄球菌抗原相结合,有可能存在交叉抗原。
3 讨论
3.1 B群链球菌目前常用检验方法
目前临床实验室常用的GBS检测方法为分离培养、鉴定,美国CDC、美国妇产科协会以及美国儿科协会已推荐用选择性培养基对孕产妇和新生儿进行GBS感染筛查。除此之外,还有涂片革兰染色显微镜检查、GBS分子生物学诊断、VITEK MSTM和布鲁克全自动飞行时间质谱(MALDI-TOF mass spectrometry)鉴定菌种等[8-9]。
GBS显微镜检查:常用的方法是通过对脑脊液或血培养标本浓缩涂片、革兰染色、显微镜检查,B群链球菌为革兰阳性双球菌,链状排列。其诊断准确率主要取决于标本质量、显微镜分辨率及检验人员的技术水平。
GBS的分离培养和鉴定:对GBS的诊断主要是通过对孕产妇直肠或阴道拭子、新生儿的血液或脑脊液进行培养来实现的,但发现普通培养在检测孕妇GBS定植方面的假阴性率。应用选择性培养基可以抑制其他微生物的生长,因此美国CDC、美国妇产科协会以及美国儿科协会推荐用选择性培养基对孕产妇和新生儿GBS感染进行筛查。分离培养、鉴定是检测GBS的金标准。选择性培养得出阴性结果要72 h,阳性结果至少也要48 h才能得出。GBS菌落在羊血平板上呈灰白、透光、湿润、光滑、凸起。可疑菌落进行生化鉴定:GBS触酶实验阴性, CAMP试验阳性,马尿酸试验阳性。基质辅助激光解吸电离飞行时间质谱检测系统也有着与PCR类似的局限性,通常两者都是批量测定,难以满足孕妇GBS门诊筛查个体化快速、准确检测的要求。目前大陆地区使用的仪器和试剂来自法国梅里埃bioMériux、美国BD及西门子公司的产品。
3.2 疑似B群链球菌菌落初筛的方法
在临床微生物室也普遍应用血清学检测方法,如B链球菌乳胶凝集实验,作为鉴定前初筛或补充、快速验证实验。
本研究建立的方法可用以直接检测疑似菌落和孕妇阴道分泌物涂片,与分离培养鉴定等效,可以部分替代进口试剂用于GBS鉴定。
3.3 荧光素标记GBS抗体检测GBS的方法和意义
荧光素标记GBS抗体直接检测疑似的菌落是否是GBS,或检测阴道分泌物样本中是否存在GBS。在碱性条件下,FITC的异硫氰基(-N=C=S)与抗体上的赖氨酸的ε氨基结合,形成FITC-抗体耦合物,即荧光标记抗体。异硫氰酸荧光素(Flourescein isothiocyanate,FITC)标记抗B群链球菌抗体可与B群链球菌发生特异性结合,所形成的荧光素结合物在荧光显微镜495纳米波段激发光照射下发出亮绿色荧光。由于在反应中只有抗原、抗体两种因子参与,判读简单;特异性强,与其他抗原交叉染色较少,一种标记抗体只能鉴定含有相应抗原的细菌;操作简便、省时[10]。
通过对免疫荧光法检测B群链球菌的临床检测效果评价,确定了该试剂的最佳反应条件并建立起质控体系。免疫荧光试剂检测与分离培养法检测的总符合率为94.17%,阳性符合率为100%,阴性符合率为92.41%,Kappa值为0.85,免疫荧光法鉴定GBS与金标准结果一致;对阴道分泌物标本进行双盲法平行检测,总符合率95.16%,阴性符合率为96.48%,阳性符合率为80.95%,Kappa值为0.71,接近0.8。两种检测方法的检测结果一致。在临床应用中暂不具备等效性,尚待改进。
3.4 局限及改进
干扰试验结果显示,免疫荧光法B群链球菌检测试剂与部分临床分离金黄色葡萄球菌菌株存在交叉抗原。B群链球菌免疫荧光法检测试剂与金黄色葡萄球菌表面抗原交叉的问题将进一步研究并降低金黄色葡萄球菌对试剂的反应性。
通过建立免疫荧光法检测B群链球菌的方法及性能评价,对产检孕妇GBS筛查,为国产试剂在免疫荧光法检测B群链球菌领域的应用提供了支持,部分满足了孕妇GBS筛查个体化检测的要求,临床医生对产前孕妇B群链球菌筛查多了一项选择。
1 马延敏,吴连方. B族链球菌对母婴健康的影响及诊断和防治[J]. 中华围产医学杂志, 1998, 2(1): 121-156.
2 Anthony BF, Okada DM, Hobel CJ. Epidemiology of group B streptococcus: longitudinal observations during pregnancy[J]. J Infect Dis, 1978, 137(5): 524-530.
3 Baker CJ, Goroff DK, Alpert S,et al. Vaginal colonization with group B streptococcus: a study in college women[J]. J Infect Dis, 1977, 135(3): 392-397.
4 马延敏,吴连方,黄醒华. 孕妇B族溶血性链球菌带菌与母婴预后的关系[J]. 中华围产医学杂志, 2002, 5(4): 266-268.
5 申阿东. B族链球菌生物学与围生期感染[J]. 国外医学: 儿科学分册, 1994, 21(1): 15-18.
6 Berardi A, Rossi C, Lugli L, et al. Group B Streptococcus late-onset disease: 2003-2010[J]. Pediatrics, 2013, 131(2): 361-368.
7 华琳,阎岩,张建. 关于对诊断一致性Kappa系统的探讨[J]. 数理医药学杂志, 2005, 5(19): 518-520.
8 邓江红,杨永弘. B族链球菌的分子生物学诊断和基因分型研究进展[J]. 中华儿科杂志, 2005, 43(11): 832-835.
9 Zoysa AD, Edwards K, Gharbia S, et al. Non-culture detection of Streptococcus agalactiae (Lancefield group B Streptococcus) in clinical samples by real-time PCR[J]. Med Microbiol, 2012, 61(8): 1086-1090.
10Ryan ME, Barrett FF. Rapid detection of group B streptococcal colonization by a direct immunofluorescent antibody technique[J]. J Pediatr, 1982, 101(6): 993-995.
Establishment and performance evaluation of groupBStrcptococcuswith immunofluorescence detection*
Fan Shang-rong1, Jiang Ji-yang2, Liu Xiao-ping2△, Huang Rong2, Tang Sheng3, Gong Hai-tao3
(1.Department of Gynaecology and Obstetrics, Peking University Shenzhen Hospital, Shenzhen 518036;2.Department of Clinical Laboratory, Peking University Shenzhen Hospital, Shenzhen, 518035;3.Shenzhen Microprofit Biological Technology Co., Ltd, Shenzhen 518055)
Objective:To establish and evaluate performance of immunofluorescence detection of group B Streptococcus (GBS), to grope best reaction conditions and to understand the application value and limitations of immunofluorescence detection. Methods: One hundred and three pregnant women′s vaginal samples from the Peking University Shenzhen Hospital were identified by MicroScan walkAway 40. Furthermore, suspected colony was detected by GBS immunofluorescence. Two hundreds and forty-eight pregnant women′s vaginal swabs were identified and another vaginal swab smear was detected with GBS immunofluorescence. Above two parts of clinical trials were all used double-blind parallel controlled. The results of identification were as standard. Overall coincidence rate, negative coincidence rate, positive coincidence rate and the Kappa value of the two methods were calculated. And interference test were designed to research the cross reaction possibilities with other bacterial antigens in vaginal specimens. Results: According to the statistical analysis of the 103 vaginal samples suspected colony immunofluorescence detection compared with identification, the overall coincidence rate was 94.17%, the negative coincidence rate was 92.41%, and the positive coincidence rate was 100% and the Kappa value was 0.85. Two hundreds and forty-eight pregnant woman′s vaginal swabs smear immunofluorescence Group B strcptococcus detection compared with identification, which overall coincidence rate was 95.16%, the negative coincidence rate was 96.48%, the positive coincidence rate was 80.95% and the Kappa value was 0.71. The cross reaction possibilities can be eliminated by blocking the antibody combining to the bacterial antigen-binding site. Conclusion: There was no significant difference between suspected colony immunofluorescence detection and identification, the results of vaginal swabs smear by immunofluorescence GBS detection and isolated and identification tend to be consistent. The experimental process of GBS immunofluorescence detection is simple, the result reports are fast and accurate. That can be used for direct identification of suspected GBS colony from the vaginal secretion of pregnant women.
Group B streptococcus; Immunofluorescence; Identification; Cross reaction
深圳市科技创新委员会基金课题(编号:100314037)
樊尚荣,男,主任医师/教授,主要从事妇产科临床工作,Email:fanshangrong@21cn.com。
△通讯作者:刘小平,女,主任技师,主要从事临床检验工作,Email:xpliu0101@sohu.com。
2016-10-13)
