黄孢原毛平革菌对Cr(Ⅵ)吸附条件研究*
2017-01-19郑锐东陈志超黄基满罗集丰钟小寅朱思敏黄思彤
郑锐东,陈志超,黄基满,罗集丰,钟小寅,朱思敏,黄思彤
(揭阳职业技术学院,广东 揭阳 522000)
黄孢原毛平革菌对Cr(Ⅵ)吸附条件研究*
郑锐东,陈志超,黄基满,罗集丰,钟小寅,朱思敏,黄思彤
(揭阳职业技术学院,广东 揭阳 522000)
为研究黄孢原毛平革菌在去除废水中Cr(Ⅵ)方面的应用潜力,在单因素实验基础上,采用正交设计法尝试对该菌吸附Cr(Ⅵ)条件进行优化。结果表明,黄孢原毛平革菌吸附Cr(Ⅵ)的最佳条件为:吸附pH:5.0、吸附时间:72 h、初始Cr(Ⅵ)浓度:30 mg/L、接种量:1.8 g,在此条件下吸附率达59.2%,说明黄孢原毛平革菌在工业废水处理方面具有一定的应用价值。
六价铬离子;生物吸附;黄孢原毛平革菌;正交设计;原子吸收
电镀是一项普遍的现代加工工艺,起到打磨、防腐、抛光、装饰等作用。经电镀处理后产生大量的重金属废水,若未经处理直接排放,会污染水环境,危害人类生命健康。Cr(Ⅵ)是电镀废水的主要污染物,浓度可达几十甚至上百(mg/mL)[1]。如何去除Cr(Ⅵ)是现代工业水处理的一个重要问题。目前,处理Cr(Ⅵ)的方法有化学法、物理法和微生物法,其中微生物法因其易操作、高效率、可回收、成本低、无二次污染,已成为现代工业水处理的主要方向。
黄孢原毛平革菌(P.Chrysosprium)为丝状白腐真菌,菌株表面含有丰富的胞外多糖,主要为微生物分泌物、细胞水解产物和破损细胞膜组成,对重金属具有较强的吸附能力[2-4]。同时,黄孢原毛平革菌产生的木质素过氧化酶(LiP)、锰过氧化物酶(MnP)和漆酶(Lac)能与重金属离子发生氧化还原、表面络合及离子交替换等作用,能有效去除重金属离子。王亮[5]对白腐真菌及其胞外多糖的研究发现,去除胞外多糖的白腐真菌对重金属吸附力明显降低。有研究表明,菌株长时间接触重金属,会引起细胞壁通透性变化[6],且重金属浓度会对黄孢原毛平革菌产生毒性及生物积累[7];冯宏[8]证明菌种接入量过大时会出现竞争吸附,从而导致吸附率下降。实验主要探讨单因素对黄孢原毛平革菌吸附Cr(Ⅵ)的效果,包括pH、Cr(Ⅵ)初始浓度、吸附时间,再通过正交设计试验对吸附条件进行研究,实现对黄孢原毛平革菌吸附Cr(Ⅵ)条件的优化。
1 材料与仪器设备
1.1 菌种
黄孢原毛平革菌(CICC 40299),购自中国工业微生物菌种保藏管理中心。
1.2 培养基
马铃薯琼脂培养基(PDA培养基);
液体培养基(g/L):FeSO4:0.005;NaHCO3:0.05;CaCl2:0.1;KCl:0.1;NaCl:0.2;MgSO4·7H2O:0.25;KH2PO4:0.5;蛋白胨:10.0;葡萄糖:20.0;pH:自然。
1.3 主要仪器设备修改
THZ-C-1台式恒温摇床,上海玺袁科学仪器有限公司;GTR16-2高速台式冷冻离心机,北京时代北利离心机有限公司;4510F原子吸收吸收分光光度计,上海仪电科学仪器股份有限公司;LRH-100-M霉菌培养箱,韶关市泰宏医疗器械有限公司;BXM-30R立式高压蒸汽灭菌器,上海博迅实业有限公司;Master-Q实验室超纯水系统,上海和泰仪器有限公司;SW-CT-2FCD超净工作台,苏州尚田洁净技术有限公司;DZX-6020B电热恒温真空干燥箱,上海粤明科学仪器有限公司。
2 方 法
2.1 菌丝球的一般培养
挑取培养15 d的菌丝体加入到250 mL液体培养基中,于30 ℃、转速为210 rpm条件下培养4 d,过滤收集均衡的菌丝球,取出部分于烘箱(60 ℃,1 h)烘至恒重,测其干湿比,称其重量。其余的用无菌生理用盐水浸泡,存放于冰箱内备用。
2.2 Cr(Ⅵ)吸附液的配制
分别精密量取1 mg/mL Cr(Ⅵ)标准液至干燥锥形瓶中,加去离子水至150 mL,配制浓度为10,20,30,40,50,60 mg/L的Cr(Ⅵ)吸附溶液,灭菌待用。为消除玻璃仪器对吸附实验干扰,所有玻璃器皿初洗后均用稀硝酸浸泡12 h,再用去离子水洗净,烘干。
2.3 Cr(Ⅵ)单因素吸附试验
在250 mL锥形瓶中加入各种浓度的Cr(Ⅵ)溶液(10,20,30,40,50,60 mg/L)和0.3 g菌丝球,按不同的pH要求(pH=3.0、3.5、4.0、4.5、5.0)在210 rpm转速下分别吸附24、48、72 h,取吸附液于4 ℃下, 8000 rpm离心20 min,过滤后测定滤液中残留的Cr(Ⅵ)浓度,并计算吸附率。
2.4 正交试验
在单因素试验基础上,选取吸附液pH、吸附时间、吸附液Cr(Ⅵ)初始浓度及接种量为考察因素,每个因素取3个水平,采用L9(34)正交表进行正交试验,测定Cr(Ⅵ)浓度,计算吸附率。
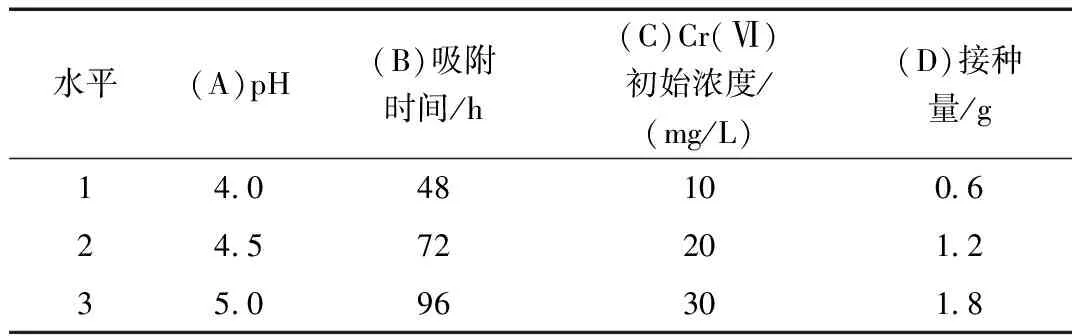
表1 因素水平表
2.5 Cr(Ⅵ)含量的测定
采用原子吸收光谱法测定Cr(Ⅵ)含量,测量条件参数分别为:波长358 nm,乙炔流量1.55 mL·min-1,狭缝0.2 nm,灯电流5.0 mA,燃烧器高度6 mm。
3 结果与分析
3.1 Cr(Ⅵ)标准曲线的绘制

图1 Cr(Ⅵ)标准曲线
3.2 P.Chrysosprium对Cr(Ⅵ)吸附的单因素试验
3.2.1 不同初始Cr(Ⅵ)浓度对吸附效果的影响

图2 不同初始Cr(Ⅵ)浓度对吸附效果的影响
如图2所示,吸附72 h后,以初始Cr(Ⅵ)浓度为 10 mg/L的吸附液中所测吸附率最高,为47.98%,其余浓度下P.Chrysosprium对Cr(Ⅵ)的吸附率均低于40%,表明低Cr(Ⅵ)浓度有利于促进P.Chrysosprium对Cr(Ⅵ)吸附,反之则有一定的抑制吸附作用。
3.2.2 不同吸附时间对Cr(Ⅵ)吸附效果的影响

图3 不同时间对Cr(Ⅵ)吸附效果的影响
从图3可知,P.Chrysosprium对Cr(Ⅵ)的吸附效果与吸附时间长短有关。在72 h吸附率最高,接近50%;而到96 h后,吸附率呈下降趋势,这可能是菌株长时间接触重金属而受到一定的抑制作用,同时也与菌株容纳重金属表面积变小有关。
3.2.3 不同pH对Cr(Ⅵ)吸附效果的影响

图4 不同pH对Cr(Ⅵ)吸附效果的影响
据图4可得,吸附液pH=3.0、3.5、4.0、4.5时,吸附率呈现逐渐上升趋势,当pH超过4.5时,吸附率开始下降,这可能跟pH变化引起P.Chrysosprium表面电荷变化有关。
3.3 正交试验结果与分析

表2 正交实验结果
根据表2中P.Chrysosprium对Cr(Ⅵ)的正交试验吸附结果,采用SPSS软件对数据进行分析,结果如表3所示。

表3 吸附率方差分析表
根据表2得出AK3>AK1>AK2,可判断A3为A因素最优水平,同理B2、C3、D3分别为对应因素的最优水平,即A3B2C3D3(pH=5.0、吸附时间:72 h、Cr(Ⅵ)初始浓度:30 mg/L、接种量:1.8 g)为此实验最优水平的组合。由R值可见主次顺序为RB>RA>RD>RC,即吸附时间影响吸附效果最大,其次是pH、接种量,而Cr(Ⅵ)初始浓度影响最小。表3中F值与显著性表明A、B、D因素对P.Chrysosprium吸附Cr(Ⅵ)影响显著。
3.4 验证试验
根据上述最优水平组合,即pH 5.0、吸附时间为72 h、Cr(Ⅵ)初始浓度为30 mg/L、接种量为1.8 g,其他条件不变,对P.Chrysosprium吸附Cr(Ⅵ)效果进行验证试验,得出吸附率为59.2%,证明正交试验最优条件可行。
4 结 论
利用P.Chrysosprium吸附Cr(Ⅵ),不考虑其他重金属离子的影响,从pH、吸附时间、Cr(Ⅵ)初始浓度、接种量等方面对P.Chrysosprium吸附Cr(Ⅵ)的影响进行单因素实验研究和正交实验优化,确定该菌吸附Cr(Ⅵ)的最优条件为:pH=5.0,吸附时间:72 h,Cr(Ⅵ)初始浓度:30 mg/L,接种量:1.8 g,吸附率可达59.2%,可见其在工业废水处理特别是电镀废水处理方面具有一定的应用价值。
[1] 李峰,吴欲,胡如南.我国电镀废水处理回用的现状及探讨[J].电镀与精饰,2011(10):17-20.
[2] Chrysi, Bruce L, Rittmann EA. Unified theory for extracellular polymeric substances soluble microbial products, and active and inert biomass[J].Water Research,2002,36:2711-2720.
[3] Hu Z Q, Jin J, Abruna H D, et al. Spatial distributions of copperin microbial biofilms by scanning electrochemical microscopy[J].Environmental Science and Technology,2007,41:936-941.
[4] Comte S, Guibaud G, Baudu M. Biosorption propertiesof extracellular polymeric substances (EPS) towards Cd, Cu and Pb for different pHvalues[J].Journal of Hazardous Materials,2008,151:185-193.
[5] 王亮,陈桂秋,曾光明,等.白腐真菌胞外聚合物及其对菌体吸附Pb2+的影响[J].环境科学,2011,32(3):773-778.
[6] 李永祺,丁美丽.海洋污染生物学[M].北京:海洋出版社,1991:376-378.
[7] 赵美花,张朝升,曾光明,等.重金属对黄孢原毛平革菌的毒性及其生物积累[J].中国有色金属学报:英文版,2016(5):1410-1418.
[8] 冯宏,李永涛,张干.强抗镉真菌月状旋孢腔菌对重金属的吸附作用[J].应用与环境生物学报,2013,9(4):694-698.
[9] 徐淑霞,张世敏,王慧琴,等.黄孢原毛平革菌210对稀土离子的吸附作用研究[J].中国稀土学报,2010,28(2):225-231.
[10]王建龙,陈灿.生物吸附法去除重金属离子的研究进展[J].环境科学学报,2010,30(4):682-683.
[11]曲娟娟,彭泓杨,顾海东,等.一种真菌吸附剂对废水中Pb2+的吸附[J].东北农业大学学报,2014,45(7):31-37.
Adsorption of Cr(Ⅵ) by P.Chrysosprium*
ZHENGRui-dong,CHENZhi-chao,HUANGJi-man,LUOJi-feng,ZHONGXiao-yin,ZHUSi-min,HUANGSi-tong
(Jieyang Polytechnic, Guangdong Jieyang 522000, China)
In order to explore the potential of P.Chrysospriumin industrial wastewater treatment, on the basis of single factor experiment, the orthogonal design method was used to optimize the adsorption conditions of Cr(Ⅵ) by P.Chrysosprium. The results showed that the optimum adsorption conditions were as follows: adsorption pH was 5.0, adsorption time was 3 d, the initial Cr(Ⅵ) concentration was 30 mg/L, inoculation amount was 1.8 g. Under these conditions, the adsorption rate reached 59.2%. It can be expected that P.Chrysospriumhad practical applications in the fields of industrial wastewater treatment.
Cr(Ⅵ); biosorption; P.Chrysosprium; orthogonal design;AAS
2016年度广东大学生科技创新培育(“攀登计划”)培育项目(pdjh2016b0777)(团粤联发[2016]25号)。
郑锐东(1982-),男,高级实验师,主要从事微生物工程相关教学与研究。
Q939 97
A
1001-9677(2016)024-0042-03
