SNP标记技术及其在水产动物遗传学中的应用
2017-01-19卞光明胡则辉柴学军王跃斌胡成硕
卞光明,胡则辉,柴学军,王跃斌,胡成硕
(浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,浙江舟山 316021)
·综述·
SNP标记技术及其在水产动物遗传学中的应用
卞光明,胡则辉,柴学军,王跃斌,胡成硕
(浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,浙江舟山 316021)
单核苷酸多态性是最新型分子标记技术,位点丰富、自动化强,可以有效地应用于水产动物遗传学研究。本文结合近年研究成果,综述了SNP特点及其在水产动物研究中的常用分型方法与应用,分析了分型方法的优劣,并对其应用前景予以展望。
SNP;水产动物;分型方法;应用
单核苷酸多态性(Single nucleotide polymorphism,SNP)指的是某种生物不同个体DNA序列中单个核苷酸点突变产生的多态性,包括置换、颠换、插入或缺失引起的多态现象[1]。SNP是由美国学者Lander于1996年提出的继RFLP、SSR的第三代新型分子标记技术[2],1998~2002年每年都召开“SNPs与复杂基因组”国际会议以探讨SNPs在复杂基因组中应用,随着PCR、分型检测、DNA芯片等技术的不断发展,SNP趋于高通量、自动化。近年来,分子标记技术逐渐成为研究水产动物遗传学的重要手段,SNP作为第三代遗传标记,位点数量多、密度广、遗传多样性高以及自动化程度强,能够显示其他分子标记技术难以检测到的遗传信息多态性,故而,SNP标记技术对于水产动物遗传学研究具有重要意义。
1 SNP特点
SNP具有以下特点:①SNP可以通过对单个核苷酸的差异检测来区分个体之间遗传物质的差异,由于CG序列中的胞嘧啶(C)极易自发脱氨转化成胸腺嘧啶(T),故而SNP等位基因多为(C)转换为(T),只有通过专门的技术才可区分其间细微的差异[3]。②第一代的RFLP、第二代STR的遗传特点是长度差异,而SNP的遗传特点是单个碱基的置换,在种群中呈二态性,在双等位基因共显性标记提供的遗传信息量小于SSR[4],但是SNP在基因组中位点丰富、遗传标记密度高、远多于SSR,能够为任何待研究基因提供合适标记,可弥补多态信息含量P(PIC)低于多等位基因SSR的缺陷[5-6]。③SNP的点突变率通常10-9,遗传稳定性远大于SSR等重复序列标记[7]。④SNP在基因组中分布具有代表性,非同义编码区SNP与蛋白质的功能有关,从cDNA序列获得的多态SNP标记一定程度上可与控制性状的基因连锁。除此之外,基因调控区的SNP则会影响着基因表达量,对于疾病发生机制的研究具有重要意义[8-9]。⑤SNP基因分型不需要检测片段长度,可直接通过“全或无”分析,制成芯片开展自动化分析,一般可同时实现104~105个分型检测[10],SNP与其他分子标记技术比较见表1。

表1 几种常见分子标记技术特点比较Tab.1 Comparison of characters of common molecular markers
2 SNP常用检测分型方法
SNP基因分型方式多样,检测方法研究进展报道较多[1,11-13,16],但应用在水产动物遗传学研究上的分型方法不多,常见的有直接测序法、PCR-SSCP、HRM以及自动化强度较高的侵入检测法、焦磷酸测序法和GoldenGate。
2.1 传统分型方法
2.1.1 直接测序法
直接测序法是依托DNA测序手段来获得碱基序列,并通过比较筛选出有效SNP位点的分型方法,一般可分为有PCR产物测序和克隆测序。邢贺飞[14]通过直接测序法对半滑舌鳎Cynoglossus semilaeviNarump基因进行抗病SNP筛选,并筛选到15个SNP位点,其中有1个SNP位点在存活与死亡差异呈现显著性,且等位基因(G)和基因型(GG)与抗鳗弧菌病呈现显著相关性,是半滑舌鳎抗病研究的一个良好的遗传标记位点。直接测序法需要设置重复实验才能将杂合子筛选出,且位点有限,成本较高,但不需要通过多个位点分型来构建遗传图谱,可以有效分析水产动物遗传信息的多样性与性状关联,是最为常用的分型方法。
2.1.2 聚合酶链式反应-单链构象多态性分析法(PCR-SSCP)
聚合酶链式反应-单链构象多态性指的是小于300 bp的DNA微小序列中单个碱基的变化所产生的构象,通过对PCR反应生成的双链DNA片段进行低浓度变性解链处理,形成单链结构,再对单链结构进行电泳分析[15]。李玉梅等[16]对PCR-SSCP技术的原理与研究进展进行详述;马瑞芹[17]运用PCR-SSCP技术对牙鲆Paralichthys olivaceus的CYP17-I编码区的SNPs进行了检测,分析了两个SNP位点中CT基因型与CC基因型个体血浆中的睾酮(T)水平差异以及CC基因型与TT基因型性腺指数(GSI)的显著性,并构建四种二倍型。PCR-SSCP成本经济,操作便捷,灵敏度高,ZHANG等[18]将非对称PCR-SSCP与传统的PCR-SSCP进行比较,发现前者清晰稳定、更适用于基因突变检测,是PCR-SSCP技术发展重点。
2.1.3 高分辨率熔解曲线法(HRM)
高分辨率熔解曲线法是基于不同核酸物理性质的差异,将荧光染料加入PCR反应体系,当含荧光染料的DNA解旋后,便可收集荧光信息形成熔解曲线[19]。当DNA序列中某个碱基发生变化,熔解曲线便会发生相应的改变,便可通过软件对遗传信息进行分析。逄锦菲[20]通过HRM技术对96尾中国对虾Fenneropenaeus chinensis进行检测发现了93个显示多态性的SNPs,并对其群体抗性进行基因分型,发现抗性群体与敏感群体分布差异显著。HRM技术通量高、操作简便、灵敏度和特异性强,可以准确快捷地筛选SNP位点。SEEB等[21]运用HRM技术在大麻哈鱼Oncorhynchus keta 202个样本中检测出SNPs,其中有37个SNP位点满足哈-温平衡期望。目前大多HRM技术被商业化占用,缺少新技术革新的灵活性,LI等[22]介绍了基于数字图像处理公共程序的高分辨率熔解曲线分析软件,可以有效地获取滤波一阶微分曲线、鉴定熔解区域、荧光性与正常曲线间差集等。CELINE等[23]运用HRM技术对21个SNP位点基因分型,实现快速、有效地识别样品种类,并在新一代测序中追踪样品,满足现代分子遗传学试验中完整干态、湿态实验室研究的需求。
2.2 高自动化分型方法
2.2.1 侵入检测法
侵入检测法的原理是等位基因特异性初始探针的一个5’端的摆动序列不与目的DNA互补结合[24]。侵入探针的3’端可以通过SNP位点的碱基特异性形成重叠区,再用核酸内切酶I识别切断,释放目标特异性产物,然后通过裂解酶裂解5’端摆动序列形成折叠结构,进而从淬灭荧光基团中释放报告荧光基团,发射荧光,以此来追踪报告SNPs。侵入检测法可通过微量样本检测SNP突变情况,易于自动化操作,侵入检测原理见图1。

图1 侵入检测原理图Fig.1 Principle of intrusion detection
2.2.2 焦磷酸测序法
焦磷酸测序技术[25]是依托PCR扩增模板单链与引物杂交,在多种酶作用下实现对模板遗传信息的分析。模板与dNTP互补配对,并通过DNA聚合酶延伸,释放焦磷酸基团,焦磷酸基团在三磷腺苷硫酸化酶的酶促作用下与5’-磷酸化硫酸腺苷生成ATP,然后荧光素酶使得ATP与荧光素发生作用,可根据dNTP种类和荧光强弱来跟踪记录模板序列。王文基[26]使用焦磷酸测序技术对半滑舌鳎Cynoglossus semilaevis组织测序,得到75万个序列。曾地刚等[27]运用焦磷酸测序法对凡纳滨对虾Litopenaeus vannamei的CTLS序列编号为C681G的SNP位点分析,发现C/C、C/G和G/G基因型以及基因型频率符合哈-温平衡,且在群体中该SNP位点与体重不显著。CRISTIAN等[28]运用454焦磷酸测序法对蛤蜊Mesodesma donacium进行分析,发现2 594个与613共有序列相关的SNP位点,平均每260 bp就有一个SNP位点,A/G、A/T以及C/T多态性较为丰富,通过热休克蛋白-70及翻译延长因子1-a注解基因验证了12个SNP位点轨迹。焦磷酸测序法精确度高、重复性好、无需荧光标记、电泳等,可配合高通量测序仪器准确、直接测定序列,特别适用于短至中等长度序列。
2.2.3 微珠芯片技术(GoldenGate)
微珠芯片技术是通过寡核苷酸对SNP位点进行识别,经过延伸、连接作用,形成等位基因特异性模板芯片,再运用微珠阵列阅读程序对芯片上荧光信号进行扫描分析,自动对基因型聚类分析[29]。目前较为先进的iSelect Infinium Custom Genotyping检测系统可以同时测定千万个基因型,已广泛应用于医学[30-34]、作物基因组学[35-39],这为水产动物基因组学研究提供参考。LAPEGUE等[40]通过电脑模拟及GoldenGate基因分型对太平洋牡蛎Crassostrea gigas和欧洲平牡蛎Ostrea edulis SNP位点进行研究,利用Illumina公司GoldenGate阵列技术为两种牡蛎设计两套384个SNP标记,发现每种牡蛎基因型SNP位点多态性比率约60%,并通过仿真模拟,发现至少有150个标记需要完成精确的亲本分配,可有效地研究野生群体与人工选择群体间的连通性及牡蛎的选择性育种。常见的高通量分型技术还有基因芯片[41]、TaqMan技术[42]、MALDI-TOF[43]等,因价格昂贵等因素,尚未发现在水产动物遗传学中应用。
3 SNP标记在遗传学中的应用
3.1 基因定位与遗传连锁图谱构建
构建遗传图谱可以显示所知基因或遗传标记的相对位置,对水产动物QTL进行精准定位,有利于基因克隆研究的开展。张建勇[44]设计800组SNP引物,筛选出200组构建中国对虾Fenneropenaeus chinensis亲本遗传连锁图谱,包含16个连锁群、180个标记,总长度899.3cM,覆盖率分别为51.94%和53.77%,依据图谱检验中国对虾体重、体长性状连锁显著性,发现了C2 904-168、C1 2871-235两个与体重相关的SNP位点。张振[45]利用SSR、SNP分子标记技术成功对皱纹盘鲍Haliotis discus hannai2个家系作图构建遗传连锁图谱,覆盖了18个连锁群,连锁群中分子标记均数约为18.0,平均间隔2.65 cM,图谱总长度810.32cM,覆盖率88.8%。HSIN等[46]运用“ssalar01”高密度SNP矩阵对60组核心家系622条大西洋鲑鱼Salmo salar进行基因分型并构建高密度遗传连锁图谱,图谱包含超过96 K的SNP位点和29组鲑鱼连锁群体,每组SNP位点与染色体长度(r=0.95)呈显著正相关。尽管遗传与物理图谱标记规则大体一致,但仍存在差异区域,覆盖率增加了6.5%,雄性重组率低于雌性,在端粒区有明显峰值。LI等[47]通过250 K SNP阵列构建斑点叉尾鮰Ietalurus Punetaus高密度、高分辨率遗传图谱,包含了54 342个SNP位点,总长度2505.4 cM,雌性与雄性重组率为1.7:1,覆盖率为90%。AO等[48]运用限制酶位点DNA测序(RAD-seq)技术发现31 191个SNP位点均匀分布在大黄鱼Larimichthys crocea基因组上,其中有10 150个SNP位点分属于24个共识连锁群体,遗传图谱总长度5451.3 cM,位点间距0.54 cM,并利用大黄鱼遗传图谱对棘鱼Gasterosteus aculeatus和青鳉Oryzias latipes基因组同线性分析,发现大黄鱼同棘鱼的亲缘关系近于青鳉。同时,在大黄鱼24个染色体上标记出1 274个免疫力相关基因和195个缺氧相关基因。目前,有很大一部分水产生物的第一代、第二代遗传图谱因标记密度较低而难以进行精细QTL分析,通过SNP技术可以有效地解决相关水产动物遗传连锁图谱上标记位点数量不足等现状,对水产动物遗传学研究具有重要的意义。
3.2 基因连锁不平衡、关联分析
基因连锁是基于两等位基因在同一染色体上存在几率大于随机分布同时存在的几率,检测分析水产生物基因组中的序列与性状位点关系,便于新基因定位与克隆[49]。关联分析一般是在连锁不平衡基础上,通过SNP标记将目的基因与目的性状相互关联。邱樱[50]基于7个EST-SNP位点对马氏珠母贝Pinctada martensii两个野生群体以及引进群体进行遗传分析,发现每个位点均包含两个等位基因,并将其中3个位点在子三代中扩增,发现基因型比符合孟德尔遗传规律,可以作为马氏珠母贝群体遗传学分析位点。曹婷婷[51]通过线性模型对草鱼Ctenopharyngodon idellus的2个SNP位点和质量、体长等生长性状进行关联分析,发现个别位点不同基因型个体的质量均值差异显著,AA基因型各项指标均值显著高于CC型,草鱼的CPA1基因可作为草鱼分子辅助育种的候选基因。ZHANG等[52]利用SNP标记分析团头鲂Megalobrama amblycephala低氧功能基因fih-1,发现团头鲂氨基酸序列显示同其他脊椎动物同源性很高,结构和功能区域高度保守,其不同组织和发展阶段的mRNA水平曲线表明团头鲂fih-1基因在肝脏和肌肉中表达程度很高,其次是腮、肠、脾脏。团头鲂fih-1 mRNA在早期胚胎发育过程中表达程度较高,然后会下降至较低水平,在孵化后又会保持在相对高水平的状态。GUTIERREZ等[53]通过4.5K SNP阵列对480个大西洋鲑鱼Salmo salar进行全基因组关联研究,发现早熟幼鲑Ssa10、Ssa02、Ssa13、Ssa25、Ssa12位点标记和晚熟幼鲑Ssa28、Ssa01、Ssa21位点处标记关联显著,Ssa13位点处生长关联性水平较低,与基因标记相关的候选位点可以反映性成熟发育历程的直属关系,在大西洋鲑鱼育种应用中的生长相关标记检测需要运用高密度SNP克服较低水平的连锁不平衡。FU等[54]分析了罗非鱼Oreochromis sppcDNA肥大细胞蛋白酶8(MCP8)及其基因组结构,发现MCP-8基因在脾脏中表达高,在肝脏、血液、大脑、鳃、肠、皮肤中次之,在肾脏、肌肉和眼表达水平较低,且在MCP-8基因序列中发现5个SNPs,其中有三个位点对无乳链球菌抗性显著。水产动物抗性性状基因定位及关联分析是水产动物分子育种研究的重要内容,其主要限制因素是缺少足够的标记,而SNP分布密度广、几乎遍布整个基因组,在全基因组关联分析研究中优于其他分子标记技术,且一个染色体区域一般仅有几个常见的SNP单体型,但其代表大部分的多态性,仅需少数SNP标签即可实现基因组选择、遗传以及育种过程中对目的基因的跟踪[55]。
3.3 遗传多样性分析
SNP可通过对不同群体比较,获得不同地理群体遗传结构,进而有效地分析该物种的遗传多样性,为水产动物分子辅助育种提供参考。金玉琳[56]通过HRM分析55个SNP位点在六个长牡蛎Crassostreagigas家系中的遗传模式,发现其中的48个位点表现过多态性,没有无效等位基因,呈遗传分离现象,且家系SNP多态性的鉴定成功率与亲本数量呈负相关。于凌云等[57]基于草鱼Cteaophoyngodon idellus0 EST数据库中21个SNPs分析长江、珠江水系6个地理群体遗传结构,发现监利群体PIC、Ne、He最高,沅江群体最低,并对遗传距离聚类分析,确立了长江与珠江部分群体的遗传结构和亲缘关系。江丽华[58]运用SNP技术对舟山、漳浦、澄迈以及宁德四个地理种群的大黄鱼Pseudosciaena crocea进行遗传背景分析,获得57组良好分型位点以及10个基因型,其中AT、GC为稀有突变型,可以在大黄鱼遗传多样性以及种群结构分析中利用。URTZI等[59]对取自26个地理位置共1 331个长鳍金枪鱼Thunnus alalunga进行SNP位点基因分型,发现过度捕捞影响着长鳍金枪鱼种群结构和遗传多样性。对地中海、大西洋、印度洋和太平洋的群体进行基因水平上同质群体界定,发现北大西洋长鳍金枪鱼有效种群大小没有出现历史性下降,其种群遗传多样性与进化潜力没有受到过度捕捞显著影响。JOBRAN等[60]对加拿大小奴湖的白鲑鱼Coregonus clupeaformis群体进行研究,发现了51个编码基因区SNP位点,且当地白鲑鱼系单一遗传繁殖群体,并通过基因扫描技术发现一个与生长差异相关的二磷酸核苷激酶A编码区SNP位点。KHRUSTALEVA等[61]对堪察加-白令区域的红大麻哈鱼Oncorhynchus nerka群体的45个SNP位点的可变性进行研究,发现岛屿与大陆的红大麻哈鱼群体存在相当大的差异,当地环境压力很大程度上决定着红大麻哈鱼单核苷酸碱基替换频率,部分区域群体出现较高的遗传分化。对于水产动物来说,表型性状数量有限,难以满足多样性研究需求,故而需要从分子水平上分析物种遗传多样性。处于非编码区的SNP在进化上属于中性,没有选择压力,其保守程度低于编码区的SNP位点,在群体中的丰度是遗传漂变结果[62],有利于对种群遗传多样性进行综合评估。
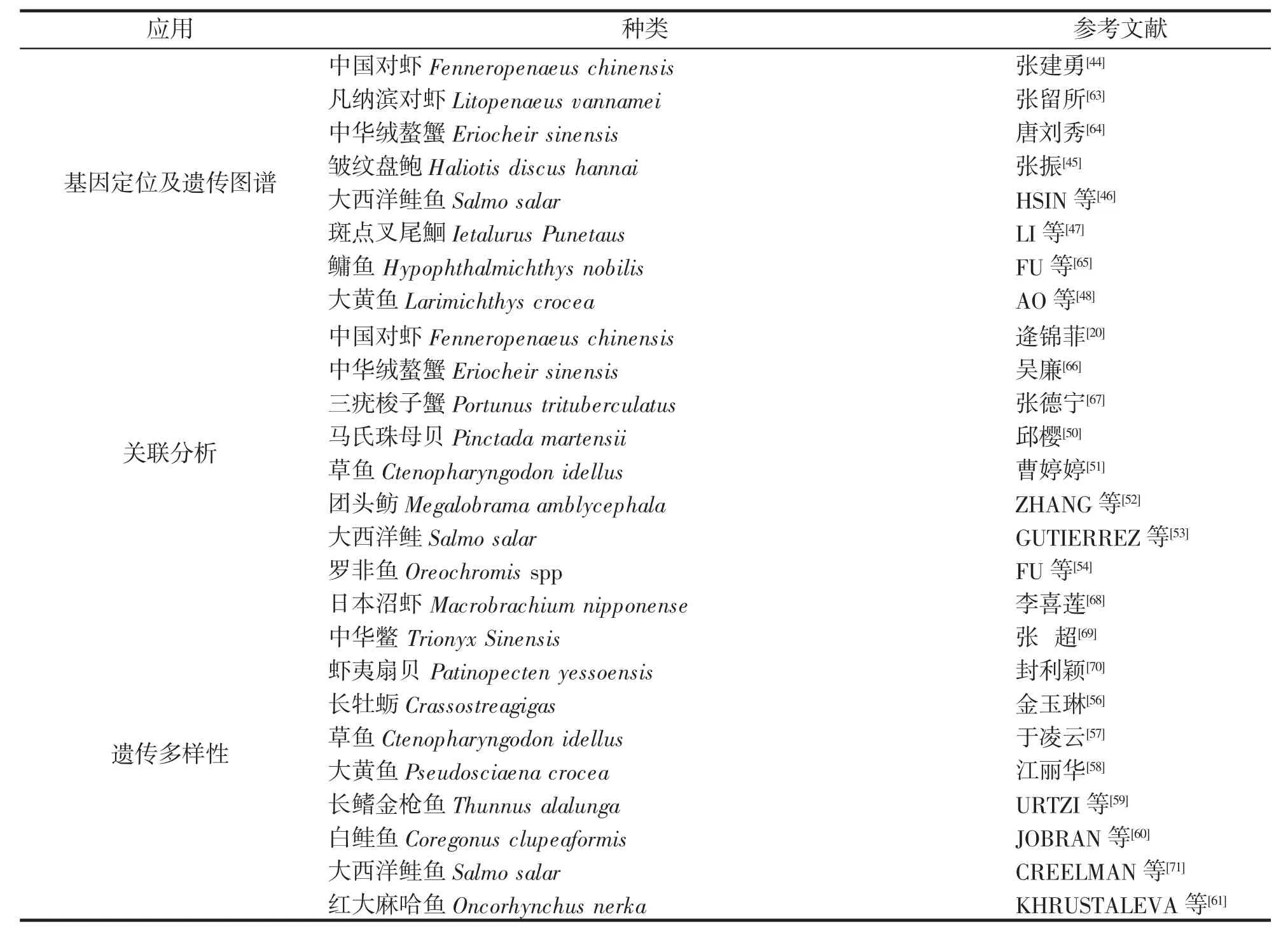
表2 SNP在水产动物遗传学中应用Tab.2 Applications of SNP in aquatic animal genetics
4 展望
SNP的发现方法、分型手段多种多样,水产动物一般无需全基因组测序,主要还是通过EST、目标特异性PCR、简化RSS以及BAC末端序列数据挖掘技术获取,分型方式可由成本、自动化程度、标记数量、样品量以及可靠性等而定,具体选择哪种研究方法取决于研究目标与研究条件,水产动物样品量一般相对较小,目前多采用HRM、焦磷酸测序等分型手段。
针对目前的研究状况,SNP研究重点应侧重于以下几个方面:①国内SNP技术研究多集中于应用方面,在SNP技术的检测、分型方法、成本以及技术革新等方面的研究力度还有待于加强。②目前,DNA微阵列与芯片技术的应用大大提高了SNP检测分型的精确度,但仍没有研发出同时符合高通量、高精度、低成本的理想检测方法,开发高效的分析系统、构建基因分型技术平台将是SNP技术的研究重点。③与第一、二代分子技术在水产动物基因组学研究以及SNP在医疗、作物等方面的应用相比较,SNP在水产动物上的研究与应用水平并不高,但随着获得越来越多的水产动物序列信息,绘制包含大量SNP标记的遗传图谱,通过QTL基因组扫描等技术对水产动物进行功能相关分析,将能够更好地集中于水产动物经济性状以及生物学发面的研究,高效地推动水产动物遗传育种发展。
[1]杨昭庆,洪坤学.单核苷酸多态性的研究进展[J].国外医学遗传学分册,2000,23(1):4-8.
[2]LANDER E S.The new genomics:global views of biology[J].Science,1996,274(5287):536-539.
[3](美)刘占江.Aquaculture Genome Technologies[M].鲍宝龙,译.北京:化学工业出版社,2011:33-34.
[4]MIDDLETON F A,PATO M T,GENTILE K L,et al.Genomewide linkage analysis of bipolar disorder by use of a high-density single-nucleotide-polymorphism(SNP)genotyping assay:a comparison with microsatellite marker assays and finding of significant linkage to chromosome 6q22[J].Am J Hum Genet,2004,74(5):886-897.
[5]JOHN S,SHEPHARD N,LIU G,et al.Whole-genome scan,in a complex disease,using 11245 single-nucleotide polymorphisms:comparison with microsatellites[J].Am J Hum Genet,2004,75(1):54-64.
[6]LIN H F,JU O S H,CHENG R.Comparison of the power between microsatellite and single-nucleotide polymorphism markers for linkage and linkage disequilibrium mapping of an electrophysiological phenotype[J].BMC Genet,2005,6(Suppl 1):S7.
[7]MA Q,YU Y,MENG Y,et al.Genome-wide linkage analysis for alcohol dependence:a comparison between single-nucleotide polymorphism and microsatellite marker assays[J].BMC Genet,2005,6(Suppl 1):S8.
[8]KIM H,HUTTER C M,MONKS S A,et al.Comparison of single-nucleotide polymorphisms and microsatellites in detecting quantitative trait loci for alcoholism:the Collaborative Study on the Genetics of Alcoholism[J].BMC Genet,2005,6(Suppl 1):S5.
[9]WILCOX M A,PUGH E W,ZHANG H,et al.Comparison of single-nucleotide polymorphisms and microsatellite markers for linkage analysis in the COGA and simulated data sets for Genetic Analysis Workshop 14:Presentation Groups 1,2,and 3[J]. Genet Epidemiol,2005,29(Suppl 1):S7-S28.
[10]BENILTON C,RAFAEL A I,ROBERT B S,et al.Processing and analyzing affumetrix SNP chip with bioconductor[J].Statistics in Biosciences,2009,1(2):160-180.
[11]许家磊,王 宇,后 猛,等.SNP检测方法的研究进展[J].分子植物育种,2015,13(2):475-482.
[12]DE WIT P.SNP Discovery through Next-Generation Sequencing and Its Applications[J].Methods Mol Biol,2016,1452:81-95.
[13]唐一通,肖 娜,李智山,等.单核苷酸多态性检测方法研究进展[J].现代生物医学发展,2013,13(27):5 393-5 396.
[14]邢贺飞.半滑舌鳎抗病相关SNP标记的筛选及两种免疫相关基因的克隆与初步分析[D].青岛:中国海洋大学,2015.
[15]GONEN D,VEENSTRA-VANDERWEELE J,YANG Z,et al.High throughput fluorescent CE-SSCP SNP genotyping[J].Mol Psychiatry,1999,4(4):339-343.
[16]李玉梅,姚纪元,吴 静,等.PCR-SSCP技术的研究及应用发展[J].生物技术通报,2007(6):71-74.
[17]马瑞芹.牙鲆三种细胞色素P450酶基因SNP与大致内分泌相关性分析[D].青岛:中国海洋大学,2012.
[18]ZHANG X H,XU S Z,GAO X,et al.The application of asymmetric PCR-SSCP in gene mutation detecting[J].Frontiers of A-griculture in China,2008,2(3):361-364.
[19]WITTWER C T,REED G H,GUNDRY C N,et al.High-resolution genotyping by amplicon melting analysis using LCGreen[J].Clin Chem,2003,49(6 Pt 1):853-860.
[20]逄锦菲.中国对虾(Fenneropenaeus chinensis)“黄海2号”人工感染WSSV的荧光定量分析[D].上海:上海海洋大学,2013.
[21]SEEB J E,PASCAL C E,GRAU E D,et al.Transcriptome sequencing and high-resolution melt analysis advance single nucleotide polymorphism discovery in duplicated salmonid[J].MolEcolRes,2011,11(2):335-348.
[22]LI H Z,LAN R T,PENG N C,et al.High resolution melting curve analysis with MATLAB-based program[J].Measurement, 2016,90:178-186.
[23]CELINE H,R.FRANK K,GEERT V.Multiplexed high resolution melting assay for versatile sample tracking in a diagnostic and research setting[J].J Mol Diagn,2016,18(1):32-38.
[24]HSU T M,LAW S M,DUAN S,et al.Genotyping single-nucleotide polymorphisms by the invader assay with dual-color fluorescence polarization detection[J].Clin Chem,2001,47(8):1 373-1 377.
[25]HE C,CHEN L,SIMMONS M,et al.Putative SNP discovery in interspecific hybrids of catfish by comparative EST analysis[J]. Anim Genet,2003,34(6):445-448.
[26]王文基.半滑舌鳎和牙鲆的转录组测序及初步分析[D].青岛:中国海洋大学,2014.
[27]曾地刚,陈秀荔,谢达祥,等.基于高通量测序的凡纳滨对虾的转录组分析[J].基因组学与应用生物学,2013,32(3):308-313.
[28]CRISTIAN G,VALENTINA V,GUSTAVO N,et al.SNP discovery and gene annotation in the surf clam Mesodesma donacium [J].Aquaculture Research,2015,46(5):1 175-1 187.
[29]FAN J B,OLIPHANT A,SHEN R,et al.Highly parallel SNP genotyping[J].Cold Spring Harb Symp Quant Biol,2003,68: 69-78.
[30]SUSAN E S,ANNA W,SAMUEL ANTWI,et al.SNPs in vitamin D-related genes are associated with prostate cancer aggressiveness in the North Carolina-Louisiana Prostate Cancer Project(PCaP)[J].Cancer Research,2016,76(14):806.
[31]EOM S Y,YIM D H,LEE C H,et al.Interactions between paraoxonase 1 genetic polymorphisms and smoking and their effects on oxidative stress and lung cancer risk in a Korean population[J].PLoS One,2015,10(3):e0119100.
[32]SHIMOSAKO N,KERR J R.Use of single-nucleotide polymorphisms(SNPs)to distinguish gene expression subtypes of chronic fatigue syndrome/myalgic encephalomyelitis(CFS/ME)[J].J Clin Pathol,2014,67(12):1 078-1 083.
[33]ARUN N,ICELA P,GANDHI P,et al.Association of TRPM3 Polymorphism(rs10780946)and Aspirin-Exacerbated Respiratory Disease(AERD)[J].Lung,2016,194(2):273-279.
[34]GUJARIA-VERMA N,RAMSAY L,SHARPE AG,et al.Gene-based SNP discovery in tepary bean(Phaseolus acutifolius)and common bean(P.vulgaris)for diversity analysis and comparative mapping[J].BMC Genomics,2016,17:239.
[35]LEE J S,YOO M H,JUNG J K,et al.Detection of novel QTLs for foxglove aphid resistance in soybean[J].Theor Appl Genet, 2015,128(8):1 481-1 488.
[36]TEA K,A INKERI L,HANNA P,et al.Preeclampsia does not share common risk alleles in 9p21 with coronary artery disease and type 2 diabetes[J].Annals of Medicine,2016:1-7.
[37]YAN J B,YANG X H,TRUSHAR S,et al.High-throughput SNP genotyping with the GoldenGate assay in maize[J].Molecular Breeding,2010,25(3):441-451.
[38]YU R B,YAN W,LIANG M Z,et al.Exploring the genetic characteristics of 93-11 and Nipponbare recombination inbred lines based on the GoldenGate SNP assay[J].Science China Life Sciences,2016,59(7):700-708.
[39]KHAN M A,HAN Y P,ZHAO Y F,et al.A high-throughput apple SNP genotyping platform using the GoldenGateTMassay[J]. Gene-COMBIS,2012,494(2):196-201.
[40]LAPEGUE S,HARRANG E,HEURTEBISE S,et al.Development of SNP-genotyping arrays in two shellfish species[J].Mol Ecol Resour,2014,14(4):820-830.
[41]HACIA J G,FAN J B,RYDER O,et al.Determination of ancestral alleles for human single-nucleotide polymorphisms using high-density oligonucleotide arrays[J].Nat Genet,1999,22(2):164-167.
[42]LI B,KADURA I,FU D J,et al.Genotyping with TaqMAMA[J].Genomics,2004,83(2):311-320.
[43]STORM N,DARNHOFER-PATEL B,VAN DEN BOOM D,et al.MALDI-TOF mass spectrometry-based SNP genotyping[J]. Methods Mol Biol,2003,212:241-262.
[44]张建勇.中国对虾(Fenneropenaeus chinensis)基因组SNP标记的开发与应用[D].青岛:中国海洋大学,2011.
[45]张 振.基于微卫星和SNP标记的皱纹盘鲍遗传连锁图谱及其应用[D].北京:中国科学院研究生院(海洋研究所),2010.
[46]HSIN Y T,DIEGO R,NATALIE R L,et al.Construction and Annotation of a High Density SNP Linkage Map of the Atlantic Salmon(Salmo salar)Genome[J].G3-Genes Genomes Genetics,2016,6(7):2 173-2 179.
[47]LI Y,LIU S,QIN Z,et al.Construction of a high-density,high-resolution genetic map and its integration with BAC-based physical map in channel catfish[J].DNA Research,2015,22(1):39-52.
[48]AO J,LI J,YOU X,et al.Construction of the High-Density Genetic Linkage Map and Chromosome Map of Large Yellow Croaker(Larimichthys crocea)[J].Int J Mol Sci,2015,16(11):26 237-26 248.
[49]PRITCHARD J K,PRZEORSKI M.Linkage disequilibrium in humans:models and data[J].The American Journal of Human Genetics,2001,69(1):1-14.
[50]邱 樱.马氏珠母贝EST-SSR和SNP标记开发及其与生长及珍珠层性状的关联分析[D].海口:海南大学,2013.
[51]曹婷婷.草鱼生长相关SNPs的筛选和群体的遗传结构分析[D].上海:上海海洋大学,2012.
[52]ZHANG B,CHEN N,HUANG C,et al.Molecular response and association analysis of Megalobrama amblycephala fih-1 with hypoxia[J].Mol Genet Genomics,2016,291(4):1 615-1 624.
[53]GUTIERREZ A P,YANEZ J M,FUKUI S,et al.Genome-wide association study(GWAS)for growth rate and age at sexual maturation in Atlantic salmon(Salmo salar)[J].PLoS One,2015,10(3):e0119730.
[54]FU G H,WAN Z Y,XIA J H,et al.The MCP-8 gene and its possible association with resistance to Streptococcus agalactiae in tilapia[J].Fish Shellfish Immunol,2014,40(1):331-336.
[55]COWLING W A,BALAZS E.Prospects and challenges for genome-wide association and genomic selection in oilseed Brassica species[J].Genome,2010,53(11):1 024-1 028.
[56]金玉琳.长牡蛎SNP标记开发及其在家系分析和物种鉴定中的应用[D].青岛:中国海洋大学,2014.
[57]于凌云,白俊杰,曹婷婷,等.六个不同地域草鱼群体遗传多样性和遗传距离的EST-SNP标记分析 [A].中国水产学会学术年会论文摘要集[C].2013.
[58]江丽华.我国主要石首鱼科鱼类分子系统发育及大黄鱼群体遗传结构的DNA标记研究[D].厦门:厦门大学,2014.
[59]URTZI L,MIKEL I,HARITZ A,et al.New Nuclear SNP Markers Unravel the Genetic Structure and Effective Population Size of Albacore Tuna(Thunnus alalunga)[J].PLoS One,2015,10(6):e0128247.
[60]JOBRAN C,SEBASTIEN R,LOUIS B,et al.Genetic structure and within-generation genome scan analysis of fisheries-induced evolution in a Lake Whitefish(Coregonus clupeaformis)population[J].Conservation Genetics,2016,17(2):473-483.
[61]KHRUSTALEVA A M,KLOVACH N V,VEDISCHEVA E V,et al.Genetic Differentiation of Sockeye Salmon Oncorhynchus nerka from Kamchatka River Basin and the Lake-River Systems of the West Coast of the Bering Sea as Inferred from Data on Single Nucleotide Polymorphism[J].Genetika,2015,51(10):1 141-1 153.
[62]EDWARDS D,FORSTER J W,CHANGNE D,et al.What are SNPs[A]//ORAGUZIE N C,RIKKERINK E H A,GARDINER S E,et al.Association mapping in plants[M].NewYork:Springer,2007:41-52.
[63]张留所.凡纳滨对虾分子标记筛选、连锁图谱构建和QTL定位[D].北京:中国科学院研究生院(海洋研究所),2006.
[64]唐刘秀.中华绒螯蟹育种群体遗传特征分析及性早熟相关SNP标记筛选[D].南京:南京师范大学,2014.
[65]FU B,LIU H,YU X,et al.A high-density genetic map and growth related QTL mapping in bighead carp(Hypophthalmichthys nobilis)[J].Sci Rep,2016,6:28 679.
[66]吴 廉.中华绒螯蟹配套系育种群体的遗传与性别效应分析[D].上海:上海海洋大学,2015.
[67]张德宁,吕建建,刘 萍,等.三疣梭子蟹生长相关SNP位点的鉴定[J].中国水产科学,2015,22(3):393-401.
[68]李喜莲,杨元杰,李 飞,等.日本沼虾EST-SNP的筛选及多态性检测[J].东北农业大学学报,2016,47(2):67-73.
[69]张 超,张海琪,许晓军,等.中华鳖(Pelodiscus sinensis)不同品系线粒体SNP的分型与鉴定[J].海洋与湖沼,2014,45(2): 376-381.
[70]封利颖.虾夷扇贝IGFBP5、IGF2BP2基因克隆、表达分析及与生长相关的SNP位点筛查[D].青岛:中国海洋大学,2013.
[71]CREELMAN E K,HAUSER L,SIMMONS R K,et al.Temporal and Geographic Genetic Divergence:Characterizing Sockeye Salmon Populations in the Chignik Watershed,Alaska,Using Single-Nucleotide Polymorphisms[J].Transactions of the American Fisheries Society,2011,140(3):749-762.
Single Nucleotide Polymorphism and Its Application in Aquatic Animal Genetics
BIAN Guang-ming,HU Ze-hui,CHAI Xue-jun,et al
(Institute of Marine and Fisheries of Zhejiang Ocean University,Marine Fishery Institute of Zhejiang Province,Zhoushan 316021,China)
Single nucleotide polymorphism(SNP),as the latest generation molecular marker,has many characters with widely spread and automated detection.It could be used in the aquatic animal genetics.This paper summarized the characteristics,application of main detection methods of SNP,the advantage and disadvantage of genotyping inrecent researchesfor aquatic animals.latestly,the prospect of SNP molecular marker was also predicted.
SNP;aquatic animals;genotyping;application
S 917
A
1008-830X(2016)04-0346-08
2016-05-10
浙江省科技厅合作与转化项目(2013F50003);浙江省科技厅公益技术研究农业项目(2014C32069);舟山市公益类科技项目(2014C31062);舟山市公益项目(2015C31013)
卞光明(1992-),男,江苏连云港人,硕士研究生,研究方向:种质与种苗工程.E-mail:mingbg@163.com
柴学军(1972-),男,浙江舟山人,教授级高级工程师,研究方向:鱼类繁育与海洋生物技术.E-mail:chaixj6530@sohu.com
