Fe3O4/TiO2复合物的制备
2017-01-18常凯凯周红刚杨鹏杰汤燕娜
常凯凯,周红刚,李 桃,杨鹏杰,汤燕娜*
(1.绍兴文理学院化学化工学院,浙江绍兴 312000;2.绍兴铜都铜材有限公司,浙江绍兴 312000)
Fe3O4/TiO2复合物的制备
常凯凯1,周红刚2,李 桃1,杨鹏杰1,汤燕娜1*
(1.绍兴文理学院化学化工学院,浙江绍兴 312000;2.绍兴铜都铜材有限公司,浙江绍兴 312000)
[目的]以钛铁矿为原料,制备包覆性Fe3O4/TiO2磁性光催化剂。[方法]研究不同温度、反应时间、钛铁矿颗粒大小、是否冷凝回流等条件下钛铁矿的溶解情况以及TiO2、Fe3O4/TiO2的产率和催化效果,并采用X射线粉末衍射仪(XRD)、红外光谱(FT-IR)、扫描电镜(SEM)、透射电镜(TEM)等对催化剂产物进行表征,且验证催化剂的磁性能。[结果]该方法可以制备出磁性良好、包覆效果好、较纯净的Fe3O4/TiO2包覆性光催化材料。[结论] 制备出的Fe3O4/TiO2复合物保持了Fe3O4的磁性,是一种性能优良的包覆性光催化材料。
钛铁矿;TiO2;Fe3O4/TiO2
近年来,随着人们物质生活水平的提高,新兴产业的不断发展,有机类产品不断增多。浙江省轻工业发达,特别是印染企业的发展,染料种类不断增多。如何处理有机类印染废水成为省内乃至国家研究的重要课题之一。传统的生物池法耗时长、成本高,寻找一种新型无污染材料成为研究的重要方面。
TiO2是一种安全、稳定、无污染的新型环保材料,由于其优良的物理化学性质,在工业和生活中均有较好的应用。光能够激发二氧化钛半导体中的电子,将电子从价带激发到导带生成光生电子,而价带中产生对应的光生空穴,电子和空穴分别扩散到半导体表面[1],在表面与不同反应对象进行反应。但TiO2表面光生电子与空穴的复合机会较大[2-4],TiO2有很强的亲水性,且超细TiO2容易团聚。在光催化反应结束后无法有效回收,因此寻找一种合适的载体,降低TiO2的孔径分布,能够有效回收利用,具有重要意义。目前常用的载体有SiO2[5]、分子筛、有机玻璃、碳纳米材料等,但均需要外加设备才能有效除去光催化剂[6]。Fe3O4又称磁性氧化铁,因其具有较强的磁性以及较强的吸附效果,而被广泛应用于生物、制药、污水处理等方面。利用比重较大的Fe3O4做TiO2的磁核,不仅可利用其磁性实现多次利用,而且降低了TiO2的亲水性,防止其团聚。笔者以钛铁矿为原料,制备包覆性Fe3O4/TiO2磁性光催化剂。
1 材料与方法
1.1 试验原理 钛铁矿中主要含有TiO2、Al2O3、FeTiO3等成分,TiO2是一个非常稳定的氧化物,不溶于水、弱无机酸和有机酸,化学性质非常稳定,但在高温条件下,浓硫酸可以与TiO2缓慢反应[7]:
TiO2+H2SO4=TiOSO4+H2O
(1)
TiO2+2H2SO4=Ti(SO4)2+H2O
(2)
Al2O3+3H2SO4=Al2(SO4)3+3H2O
(3)
FeTiO3+2H2SO4=FeSO4+TiOSO4+2H2O
(4)
硫酸钛水解后也可以产生硫酸氧钛:
Ti(SO4)2+H2O=TiOSO4+ H2SO4
(5)
硫酸氧钛进行水解生成偏钛酸:
TiOSO4+2H2O=TiO(OH)2+H2SO4
(6)
偏钛酸分解生成二氧化钛:
TiO(OH)2= TiO2+H2O
(7)
1.2 试剂与仪器 98%浓硫酸(AR)、28%氨水(AR)、过氧化氢(AR)、还原铁粉(AR)等。
DF-101Z集热式加热磁力搅拌器;日本JEM-1011电子投射显微镜(TEM);英国牛津(OXFORD)X-act扫描电子显微镜带能谱(SEM),日本电子(JEOL),JSM-6360LV;Empyrean X-射线衍射仪(XRD),荷兰帕纳科;Empyrean比表面积和孔隙度分析仪(BET),美国Micromeritics公司;杭州卓驰QSXL-1216气氛保护箱式炉等。
1.3 试验方法 取10 g钛铁矿粉末和15 mL浓硫酸(27.6 g),加入到圆底烧瓶中混合均匀。控制适宜的温度油浴加热,反应一定时间,停止反应冷却至室温后,加入一定量的浸取液进行水解,过滤;将残渣烘干、称量;在过滤液中加入适量的还原剂铁粉,待溶液变为紫红色,快速过滤;滤液以适宜的速度通入N2约15 min,封闭条件下低温冷藏析出硫酸亚铁,过滤称量。在250 mL烧杯中加入2.5 mL氨水,加热至90 ℃,调节pH至11左右后,在1 000 r/min下加入1/5的钛液,液体由紫红变成白色浊液,加热搅拌10 min,加水稀释到400 mL,再加入25 mL钛液,调pH至2~3,反应一段时间后加入7.2 mL氨水,待溶液由偏蓝色变为白色乳浊液,停止加热,静置冷却。
倒出上清液,将固体产物在3 000 r/min下离心15 min,倒出上清液,用50 ℃温水洗涤3次,离心分离。80 ℃烘箱烘干,在600 ℃的马弗炉中灼烧2 h,称量。
调节上清液pH,待完全沉淀后,滴加少量H2O2至颜色变为红棕色,静置,抽滤。洗涤滤渣数次,烘干。用扫描电子显微镜带能谱(SEM)测定固体中Fe含量。固体加入过量稀硫酸中,用氨水调节pH至中性,持续通入N2,钛液中析出的硫酸亚铁以Fe2+∶Fe3+=1.0∶1.8加入溶液中,调节pH为10~11。同时加入0.5 g柠檬酸表面活性剂,在1 000 r/min下继续搅拌1 h,磁性分离。用冷水洗涤数次,至pH中性,磁性分离,80 ℃真空烘干。
将上述磁性物质中倒入10 mL无水乙醇,超声分离10 min,制备为磁流体。用热水稀释至40 mL,并持续加热磁流体,待温度上升至90 ℃后,滴加上述钛液的1/5,过程中不断用氨水调节pH,使pH保持在4~5,持续煮沸10~15 min。待液体颜色变为咖啡色后,停止加热。静置冷却,磁性分离。将固体洗涤3~4次,保留上清液。将固体烘干后,放入高温马弗炉下灼烧2 h,干燥保存,制得包覆性Fe3O4/TiO2复合物材料。
2 结果与分析
2.1 不同条件对钛铁矿酸解的影响 在颗粒度为80目,采用超声分离,温度200 ℃反应12 h,且不设置冷凝回流的条件下,残渣质量最少,TiO2产率最高。这是由于颗粒度越小,超声分散越均匀,与浓硫酸的接触面积越大,在同样反应条件下,反应程度越高。在回流条件下,虽然能够防止酸雾挥发,保持反应物的浓度,但冷凝回流条件下,被酸雾带走的水分也回到反应体系,在较高的温度下,TiO2+遇水易水解,变为偏钛酸沉淀,以固体的形式停留在残渣中,降低了TiO2的产率。且由于水的挥发,硫酸的浓度降低不明显。
浸取液是影响钛液质量的关键因素。由于反应物中硫酸剩余量多,如果用水做浸取液,温度会瞬间升高至Ti4+水解为偏钛酸的温度,降低产量,影响钛液质量。该试验选择10%的稀硫酸做浸取液,使温度升高程度降低。试验发现,用稀硫酸做浸取液,浸取物中灰白色的物质变少。
2.1.2 不同条件对TiO2+水解的影响。由于钛铁矿浸取液中加入少量的还原铁粉,除使Fe3+还原为Fe2+外,还使Ti4+还原为紫红色的Ti3+,所以在水解过程中要有充足的氧气使Ti3+氧化。研究发现,钛液水解时将全部钛液加入沸水中,由于沸水中无过多的氧气,无法使Ti3+及时氧化为Ti4+,导致无法水解为H3TiO4。若使用窄口容器作为反应容器,钛液无法与空气大面积接触,也无法使钛液水解。故应使用敞口容器进行水解。用50 ℃左右的水清洗,将产品表面的杂质铁离子清洗完全,提高产品纯度[8]。
TiO2+水解时需要预先将1/5体积的钛液慢慢加入沸水,制备出晶核。研究表明,水解时间是影响水解的重要因素。选取一份质量较高的紫红色钛液在不同条件下水解,结果见图1。由图1可知,随着水解时间的增加,水解质量增加。当时间达3 h时水解几乎达到饱和。

图1 水解时间对TiO2质量的影响Fig. 1 Effect of Hydrolytic time on the quality of TiO2
2.1.3 不同条件对Fe3O4/TiO2复合物制备的影响。研究表明,pH低于4,Fe3O4易被酸解,水解溶液瞬间变为黄色;pH大于6,原钛液中的Fe3+、Fe2+易变为絮状沉淀,且吸附水中的Ti3+以及Fe3O4溶液瞬间澄清。故用钛铁矿制备包覆性Fe3O4/TiO2时应控制pH在4~5。
制备Fe3O4需加入一定的表面活性剂,且需要超声分离,除防止Fe3O4团聚外,在制备Fe3O4/TiO2复合物时也可以使钛氧离子吸附在Fe3O4表面。制备Fe3O4时pH为11左右,加入柠檬酸后发生中和反应,柠檬酸根离子被吸附在Fe3O4表面。氧钛离子带正电,易被柠檬酸根吸附[9](图2)。在90 ℃高温下氧钛离子水解,高温煅烧,得到包覆性的Fe3O4/TiO2结构。

图2 合成Fe3O4/TiO2的示意Fig.2 Illustrates of Fe3O4/TiO2 synthesis
2.2 Fe3O4、TiO2及Fe3O4/TiO2复合物的表征

图3 Fe3O4、TiO2及Fe3O4/TiO2复合物的XRD表征结果Fig.3 XRD characterization results of Fe3O4,TiO2 and Fe3O4/TiO2 composites
2.2.1 XRD图。XRD衍射峰的强度、形状和峰的位置反映了晶体的结晶度,不同样品的XRD分析见图3。由图3可知,TiO2的XRD和锐钛矿的XRD非常类似,属于锐钛矿。
在Fe3O4的XRD图中,无明显的衍射尖峰,表明Fe3O4属于非晶态结构。对于Fe3O4/TiO2复合物的XRD图,主要衍射峰的位置也与锐钛矿一致,表明在复合物中,TiO2主要以锐钛矿存在[10]。
2.2.2 比表面积与孔径分布。Fe3O4、TiO2及Fe3O4/TiO2复合物的N2吸附-脱附等温线以及相对应的孔径分布见图4。根据相关的理论和公式计算,Fe3O4、TiO2及Fe3O4/TiO2复合物的平均孔径为24.852、34.053、38.040 nm;Fe3O4、TiO2及Fe3O4/TiO2复合物的主要孔体积是介孔。Fe3O4、TiO2及Fe3O4/TiO2复合物的比表面积分别是93.58、70.76、116.12 m2/g。

图4 Fe3O4、TiO2及Fe3O4/TiO2复合物的比表面积(A)和Fe3O4、TiO2及Fe3O4/TiO2复合物的孔径分布(B)Fig.4 Specific surface area of Fe3O4,TiO2 and Fe3O4/TiO2 composites(A),pore size distribution of Fe3O4,TiO2 and Fe3O4/TiO2 composites(B)
2.2.3 Fe3O4与Fe3O4/TiO2的磁性。Fe3O4与Fe3O4/TiO2复合物的磁化曲线见图5。由图5可知,Fe3O4与Fe3O4/TiO2复合物的比饱和磁化强度分别为σs=36.23 emu/g(矫顽力为±18.92 kOe)及σs=31.46 emu/g(矫顽力为±15.88 kOe)。说明Fe3O4与Fe3O4/TiO2复合物有很好的磁性。Fe3O4与Fe3O4/TiO2复合物可以很容易地通过磁分离方法进行分离回收,这对Fe3O4与Fe3O4/TiO2复合物去除大面积环境污染物有很好的利用效果[11]。
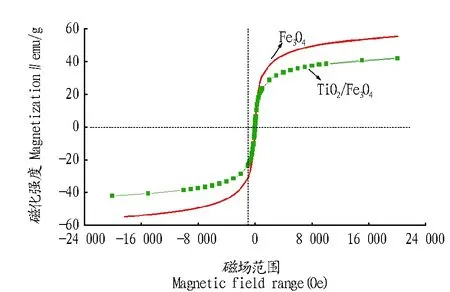
图5 Fe3O4与Fe3O4/TiO2的磁化曲线Fig.5 Magnetization curve of Fe3O4 and Fe3O4/TiO2

图6 Fe3O4及Fe3O4/TiO2的红外光谱Fig.6 Infrared spectrum of Fe3O4 and Fe3O4/TiO2
2.2.4 Fe3O4与Fe3O4/TiO2红外比较。Fe3O4与Fe3O4/TiO2复合物的FTIR见图6。由图6可知,在3 500 cm-1处出现宽峰,表明表面—OH基的存在。1 600和2 300 cm-1处的吸收峰分别对应于残留的H2O和材料表面吸附CO2的伸缩振动。另外,570 cm-1处是Fe—O的特征峰,在890 cm-1的吸收峰属于Ti—O之间的伸缩振动,在495 cm-1的吸收峰属于Ti—O—Ti之间的变形振动。表明Fe3O4与TiO2很好地复合在一起[12]。2.2.5 固体物质的透射电镜照片。由图7可知,Fe3O4作为有效的磁核,TiO2有效地包覆在Fe3O4表面。中间核为Fe3O4,包覆物为TiO2。图中有些颜色较深,原因可能是超声时间短,Fe3O4未能有效分离,有团聚现象。但绝大多数复合物包覆效果良好,形成了有效的Fe3O4/TiO2包覆性复合物。
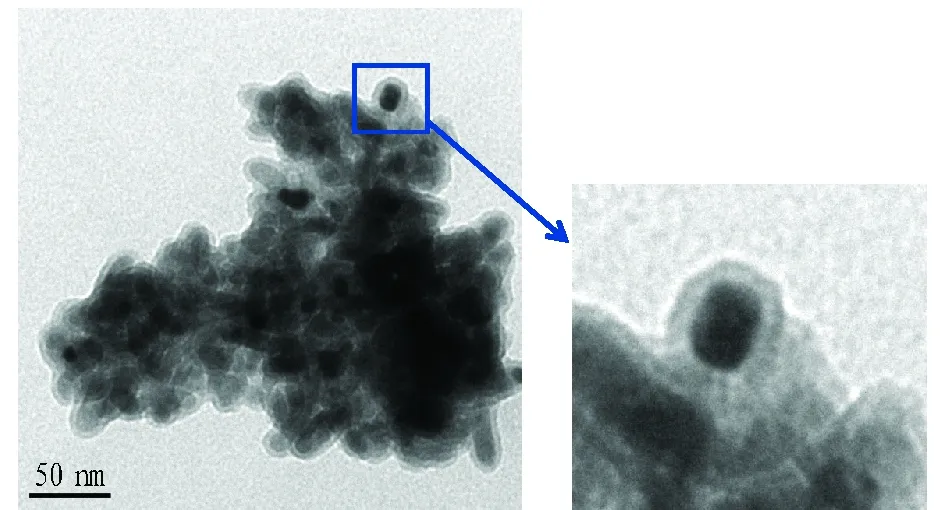
图7 Fe3O4/TiO2的透射电子显微镜照片Fig.7 Transmission electron microscopy(TEM)photos of Fe3O4/TiO2

由图9可知,400 ℃灼烧后虽然有包覆结构,但由于温度极低,TiO2的结晶水无法脱除,TiO2仍以偏钛酸的形式存在,且由于偏钛酸的黏性,纳米颗粒间无法正常分离。由图9B可知,颗粒之间已经明显分离,且有较明显的包覆结构但仍有团聚现象。
3 小结
该研究结果表明,利用钛铁矿可以制备出较纯净的锐钛型TiO2,并利用Fe3O4做磁芯,制备出的Fe3O4/TiO2复合物可以明显降低TiO2的空穴,从理论上降低了Fe3O4/TiO2中光生电子与空穴结合的可能性,提高了其光催化效果。Fe3O4/TiO2复合物保持了Fe3O4原有的磁性,提供了新型回收型材料的可能性。

图8 TiO2的投射电子显微镜照片(A)和合成TiO2的EDS能谱(B)Fig.8 The TiO2 projection electron microscope photos(A)and EDS spectrum of compound TiO2(B)
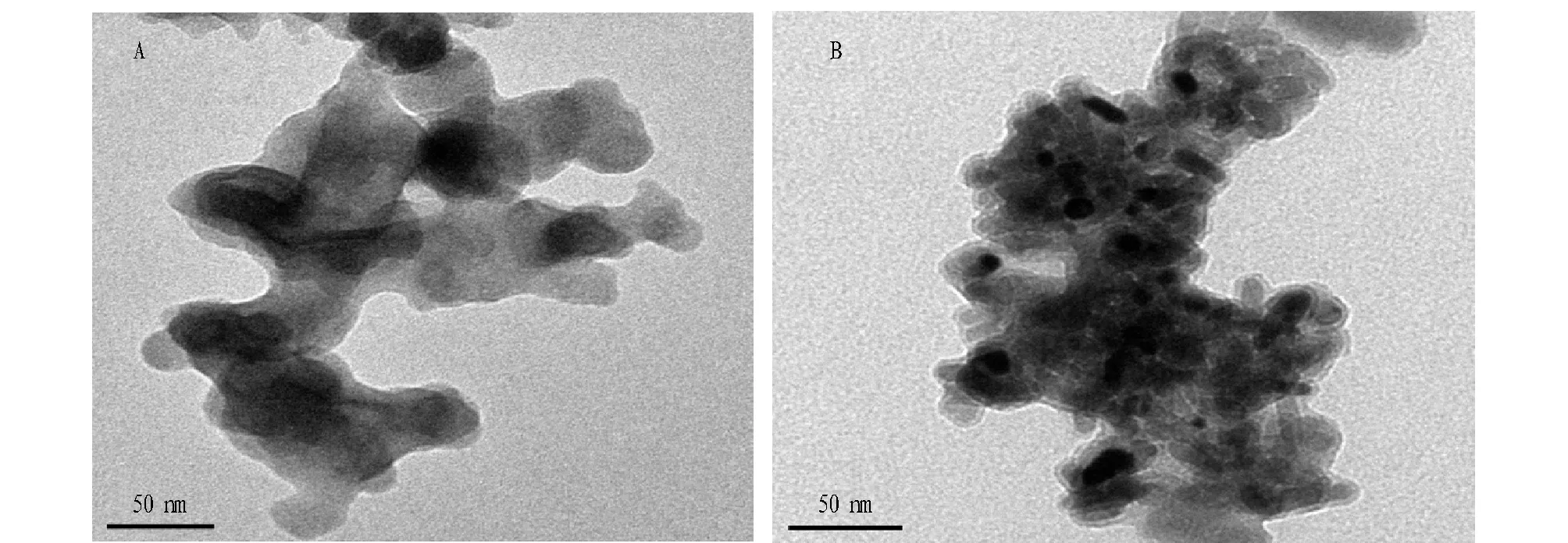
图9 400 ℃灼烧投射电镜图片(A)和600 ℃灼烧投射电镜图片(B)Fig.9 400 ℃ burning projection electron microscope images(A)and 600 ℃ burning projection electron microscope images(B)
[1] 赵伟,陈美,沈毅.金属离子掺杂对TiO2光催化性能的影响研究[J].化学试剂.2009,31(6):431-434.
[2] 沈文浩,刘天龙,李翠翠,等.TiO2胶体光催化降解罗丹明B染料[J].环境工程学报,2012,6(6):1863-1870.
[3] LI Z D,WANG H L,WEI X N,et al.Preparation and photocatalytic performance of magnetic Fe3O4@TiO2coree-shell microspheres supported by silica aerogels from industrial fly ash[J].Journal of alloys & compounds,2015,659:240-247.
[4] 高春华,黄新友.纳米TiO2光催化在医学上的应用[J].新材料产业,2003(7):68-71.
[5] CHI Y,YUAN Q,LI Y,et al.Magnetically separable Fe3O4@SiO2@TiO2-Ag microspheres with well-designed nanostructure and enhanced photocatalytic activity[J].Journal of hazardous materials,2013,262(22):404-411.
[6] 赵冉,马宏瑞,吕向菲,等.包覆性TiO2/Fe3O4光催化剂的合成及光催化性研究[J].化学研究与应用,2013,25(11):1554-1558.
[7] 郭靖.低温还原钛铁矿及分离钛铁技术的研究[D].淄博:山东理工大学,2013:1-51.
[8] 向斌.硫酸氧钛的水解动力学研究[D].重庆:重庆大学,2011:1-56.
[9]XINTJ,MAML,ZHANGHP,etal.AfacileapproachforthesynthesisofmagneticseparableFe3O4@TiO2,core-shellnanocompositesashighlyrecyclablephotocatalysts[J].Appliedsurfacescience, 2014,288:51-59.
[10]LIUPB,HUANGY,YANGYW,etal.Sandwichstructuresofgraphene@Fe3O4@PANIdecoratedwithTiO2nanosheetsforenhancedelectromagneticwaveabsorptionproperties[J].Journalofalloys&compounds,2016,662:63-68.
[11]TANLC,ZHANGXF,LIUQ,etal.SynthesisofFe3O4@TiO2core-shellmagneticcompositesforhighlyefficientsorptionofuranium(VI)[J].ColloidsandsurfacesA:Physicochemicalandengineeringaspects,2015,469:279-286.
[12]YUANQ,LIN,GENGWC,etal.PreparationofmagneticallyrecoverableFe3O4@SiO2@meso-TiO2nanocompositeswithenhancedphotocatalyticability[J].Materialsresearchbulletin,2012,47(9):2396-2402.
[13] 张淑敏,李巧玲,安长胜,等.三维花状纳米TiO2的制备及光催化性能研究[J].化学试剂,2014,36(3):243-247.
[14] 高万寿,黄贤丹,赵月红,等.双模板作用下3DOMZnO/ZrO2-TiO2(P123)的制备及表征[J].化学试剂,2013,35(8):741-745.
Preparation of Fe3O4/TiO2Composites
CHANG Kai-kai1, ZHOU Hong-gang2, LI Tao1, TANG Yan-na1*et al
(1. School of Chemical Engineering, Shaoxing University, Shaoxing, Zhejiang 312000;2. Shaoxing Tong Du Copper Co., Ltd., Shaoxing, Zhejiang 312000)
[Objective] With ilmenite as raw materials, preparation of coated magnetic Fe3O4/TiO2light catalyst was studied. [Method] The dissolution of ilmenite TiO2, the yield of Fe3O4/TiO2and catalytic effect were studied in different temperature, reaction time, titanium iron ore particle size and the condenser conditions. Using the X-ray powder diffraction (XRD), infrared spectrum (FT-IR), scanning electron microscope (SEM) and transmission electron microscopy (TEM), material product was characterized and magnetic perpormance of catalyst was verified.[Result]The study showed that the method could prepare Fe3O4/TiO2coating photocatalytic materials which had good magnetism and good coating effect.[Conclusion] Fe3O4/TiO2composites maintained the Fe3O4magnetic,and was a kind of high performance coating photocatalytic materials.Key words Ilmenite; TiO2; Fe3O4/TiO2
常凯凯(1994- ),男,山西平遥人,本科生,专业:化学。*通讯作者,本科生,专业:化学。
2016-09-14
S 181;TB 331
A
0517-6611(2016)36-0118-04
