木村病的影像学诊断
2017-01-17南方医科大学附属南海医院放射科广东佛山528200
1.南方医科大学附属南海医院放射科 (广东 佛山 528200)
2.广东省佛山市第一人民医院(广东 佛山 528000)
梁德志1 覃业志2 莫森林1
木村病的影像学诊断
1.南方医科大学附属南海医院放射科 (广东 佛山 528200)
2.广东省佛山市第一人民医院(广东 佛山 528000)
梁德志1覃业志2莫森林1
目的探讨木村病的CT、MRI表现。方法对13例经手术切除并病理证实的木村病的影像征象进行回顾性分析。结果患者临床体征均为一侧或两侧颌面部、上肢、腋窝、腹股沟无痛性肿块,及局部淋巴结肿大,并伴随外周血嗜酸性粒细胞明显升高。5例病灶分别位于腮腺、下颌区、颈部、腹股沟区及腋窝,表现为边界清晰的结节状影,增强扫描明显均匀强化;8例病灶分别位于腮腺、泪腺、耳周、下颌区、上肢,表现为边界模糊的斑块状影,增强扫描大多强化不均匀。结论木村病的CT、MRI表现有其特征性,结合病史及实验室检查,有助于木村病与其他病变的鉴别。
木村病;体层摄影术,X线计算机;磁共振成像
木村病(Kimura's disease,KD)又名嗜酸性粒细胞增生性淋巴肉芽肿(eosinophi l ic lymphanaticgranuloma,ELG)是一种少见而病因不明的免疫系统介导的慢性肉芽肿性病变。1937年我国的金显宅先生首先对该病进行了描述,称为“嗜伊红细胞增生性淋巴肉芽肿”。1948年日本的木村哲二系统地分析了本病的病理学特征,国际上开始以木村(Kimura)命名本病。木村病主要临床表现为不明原因出现的皮下软组织肿胀或肿瘤样结节,并缓慢进行性增大,伴淋巴结肿大,多发于头颈部。本病因发病率低而容易误诊。本文收集经病理证实的木村病13例,对其CT及MRI资料进行分析,以期加强对本病的认识并减少误诊。
1 材料和方法
1.1 临床资料收集2006年4月~2016年4月经手术病理证实的13 例KD患者临床资料,全部均为男性,年龄14~74岁,中位年龄40岁,病程0.5~8年,中位时间5年;临床表现大多相似,均表现为皮下可触及的缓慢增大的无痛性结节或肿块,位于一侧或双侧腮腺、下颌部、眼眶、上下肢等部位,全部病例均可触及相关引流区域淋巴结肿大。除3例伴局部皮肤瘙痒,1例伴局部皮肤色素沉着,余无特殊临床症状。13例患者实验室检查均见外周血嗜酸性粒细胞计数明显高于正常水平,最高达2.86×109/L,嗜酸性粒细胞比例最高达60%。11例患者接受了CT检查,4例患者接受了MRI检查(其中2例同时进行了CT和MRI检查)。
1.2 检查方法
1.2.1 CT平扫及增强检查使用GE LightSpeed 64排螺旋CT扫描机:对9例患者均行头颈部扫描,1例行胸部扫描,1例为行全腹部扫描时意外发现。扫描参数:管电压120kV,管电流250mA,层厚5mm,层距5mm,重建层厚1.25mm,间隔0.625mm。增强对比剂采用非离子型造影剂(370mgI/ml 碘帕醇),经健侧肘静脉穿刺,高压注射器注入,剂量为2.0ml/kg,注射速度3ml/s。
1.2.2 MR平扫及增强检查使用GE Signa Inf inity EchospeedPl us 1.5T超导型磁共振扫描仪:对4例患者行头颈部扫描,其中1例同时行左上臂扫描。扫描参数:FSE序列轴位及冠状位T2WI(TR 3500ms,TE 104ms),常规使用化学位移饱和法脂肪抑制;SE序列轴位TlWI(TR 500ms,TE 8.6ms);增强对比剂采用钆喷替酸葡甲胺注射液(Gd-DTPA),经健侧肘静脉穿刺,高压注射器注入,剂量为0.1mmo l/kg,注射对比剂后进行轴位、矢状位及冠状位T1WI 扫描。视野200mm×200mm,矩阵512×512,层厚5mm,层距5mm。
1.3 影像结果分析对病变的定位、大小、数目、边界、形态、密度或信号强度、强化方式、病灶周围情况进行分析。
1.3.1 病灶边界标准:清晰(超过2/3病灶边界与周围组织分界清楚)、部分清晰(1/3-2/3病灶边界与周围软组织分界清楚)、模糊(少于1/3病灶边界与周围软组织分界清楚)[1]。
1.3.2 强化程度标准:以病灶邻近骨骼肌为参考,增强扫描密度或信号强度高于骨骼肌为显著强化,与骨骼肌相仿的为中度强化,低于骨骼肌的为轻度强化[1]。
2 结 果
2.1 影像表现13例中5例病灶位于一侧腮腺,2例位于一侧耳周,1例位于双侧泪腺,1例位于一侧下颌部及上臂皮下软组织,4例表现为一侧多发结节(分别位于颈部胸锁乳突肌下、下颌部、腹股沟区、腋窝)。病灶范围从5mm~60mm不等。依据病灶形态学表现及强化方式大致可以分为两型:I型(5/13):表现为边界清晰、形态较规则的单发或多发结节状或团块状影,无融合倾向,密度或信号均匀,周围脂肪间隙清晰;增强扫描病灶呈均匀性显著强化。病灶主体分别位于腮腺、下颌区、颈部、腹股沟区及腋窝(图1-2)。II型(8/13):表现为边界部分清晰或模糊、形态不规则的斑块状影,密度或信号大多不均匀,周围脂肪间隙浑浊;增强扫描病灶呈不均匀中度或显著强化,内见范围大小不一的条索状、网格状、斑片状中低强化区。病灶位于腮腺、泪腺、耳廓及外耳道周围、下颌区、上肢,邻近皮肤、咬肌、下颌下腺等与病灶分界欠清;泪腺病变者,表现为双侧泪腺弥漫性对称性肿胀,与眼环分界清晰,与皮肤分界不清(图3-6)。
CT平扫病灶等于或稍低于邻近骨骼肌密度;MRI平扫T1WI病灶信号强度与肌肉相仿,T2WI信号强度高于肌肉。全部病例均合并有病灶相关引流区域淋巴结肿大,包括颈I~IV区、腋窝、腹股沟,病灶未见明显坏死、囊变、钙化及出血(图7-9)。
2.2 病理表现(各部位病灶主体及淋巴结)淋巴组织增生,淋巴滤泡中心血管增生、有玻璃样变,大量嗜酸性粒细胞浸润,嗜酸性脓肿灶形成;部分病变间质纤维化,内见分枝状小血管增生;涎腺及泪腺病变者可见腺体萎缩;淋巴结病变者,淋巴结结构保留,滤泡生发中心扩大,生发中心及副皮质区见嗜酸性粒细胞灶性片状分布。
3 讨 论
木村病又名嗜酸性粒细胞增生性淋巴肉芽肿,以往命名混杂,包括皮下嗜酸性淋巴肉芽肿、嗜酸性淋巴滤泡增生、皮肤嗜酸性滤泡过度增殖等,是一种少见的病因不明的慢性炎性肉芽肿病变。以往认为内分泌功能紊乱、自身免疫性疾病、过敏、感染均可能与本病相关[2]。病变大体标本表现为病灶与正常组织分界不清,不同部位病灶的组织学表现大致相仿,包括(1)大量嗜酸性粒细胞细胞浸润,形成嗜酸性脓肿;(2)淋巴组织及纤维组织增生,淋巴滤泡形成,生发中心活跃增生;(3)病灶及淋巴组织内小血管增生扩张;(4)病变累及的腺体破坏、腺泡萎缩;(5)淋巴结正常结构保存[3]。
KD好发于亚洲人群,特别是中国和日本,男性发病比例较高,男女比例约4~7:1[4],任何年龄均可发病,但发病高峰年龄段为20~40岁[5],本研究病例全部为男性,提示实际男女发病比可能要高于文献报道的比例。本病主要发生在头、颈部,表现为腮腺、耳周、下颌下区、眼眶或邻近皮下软组织等区域可触及的无痛性结节或软组织肿块,同时伴有相关引流区域淋巴结病变,有时淋巴结肿大为仅有的表现,其他的发病部位还包括口腔、腋窝、腹股沟、四肢、躯干等,发生于呼吸系统者罕见;除了偶然出现局部皮肤瘙痒或色素沉着外,鲜有其他症状及体征。KD发展缓慢,往往需要数年时间,据报导从影像学检查发现小结节到触及肿块的时间达1~10年[6]。本病患者外周血嗜酸性粒细胞计数及IgE水平明显增高,约12%的病例合并有肾病综合征,少部分伴有支气管哮喘[7];本组13例木村病实验室检查嗜酸性粒细胞计数均明显增高,一例合并有肾病综合征,与文献报道相符。
KD罕见故影像学分析较少,相关文献以个案报道较多,大部分文献认为本病影像学上缺乏特异性。本文根据对收集的13例KD 的MR、CT表现及相关文献报道,总结出一些影像学特征:(1)本病以头颈部发病率高,特别是腮腺区,其次为耳周、下颌区等,多较表浅,可单侧或双侧发病,单一或多发病灶,多发病灶可数年内先后出现于不同部位。(2) Gopinathan等[8]通过对头颈部KD的分析,认为从形态学上可以把KD分成两种明确的亚型:边界相对清晰的结节样病变(I型)和边界模糊的斑块样病变(II型),本文也作相似分类,II型病变者无明确形态,因筋膜阻隔可呈塑形性浸润生长。通过观察发现I型病变大多见于腮腺区及淋巴结密集区(下颌下、颈部、腋窝、腹股沟等),II型病变可发生于任何常见发病部位[1,5,9],本研究所有I型病灶经病理证实均存在正常淋巴结结构,也有文献报道KD可引起腮腺内淋巴结肿大[10];因此有理由认为I型为KD的淋巴结内病变,称为结节型,II型为KD在淋巴结外组织的弥漫浸润性生长,称为弥漫型,而实际上本文所收集病例病灶主体邻近区域肿大淋巴结均呈I型表现,故I、II型可共存,称为混合型。(3)病灶均为实性,未见明显囊变、坏死、钙化、出血。(4)多数病例合并有病灶主体相关引流区域的成串多发淋巴结肿大,边界清楚,密度或信号均匀,无粘连、融合倾向[11],部分病例可仅表现为淋巴结肿大。(5)增强扫描结节型呈显著且均匀强化;弥漫型者呈中度或显著强化,强化多数不均匀,内见条索状、网格状、斑片状低强化区,Takahashi等[12]认为纤维及血管增生导致不同的强化类型,同时他们报道病变内纤维组织成分的增加导致MRI T2WI信号的下降。
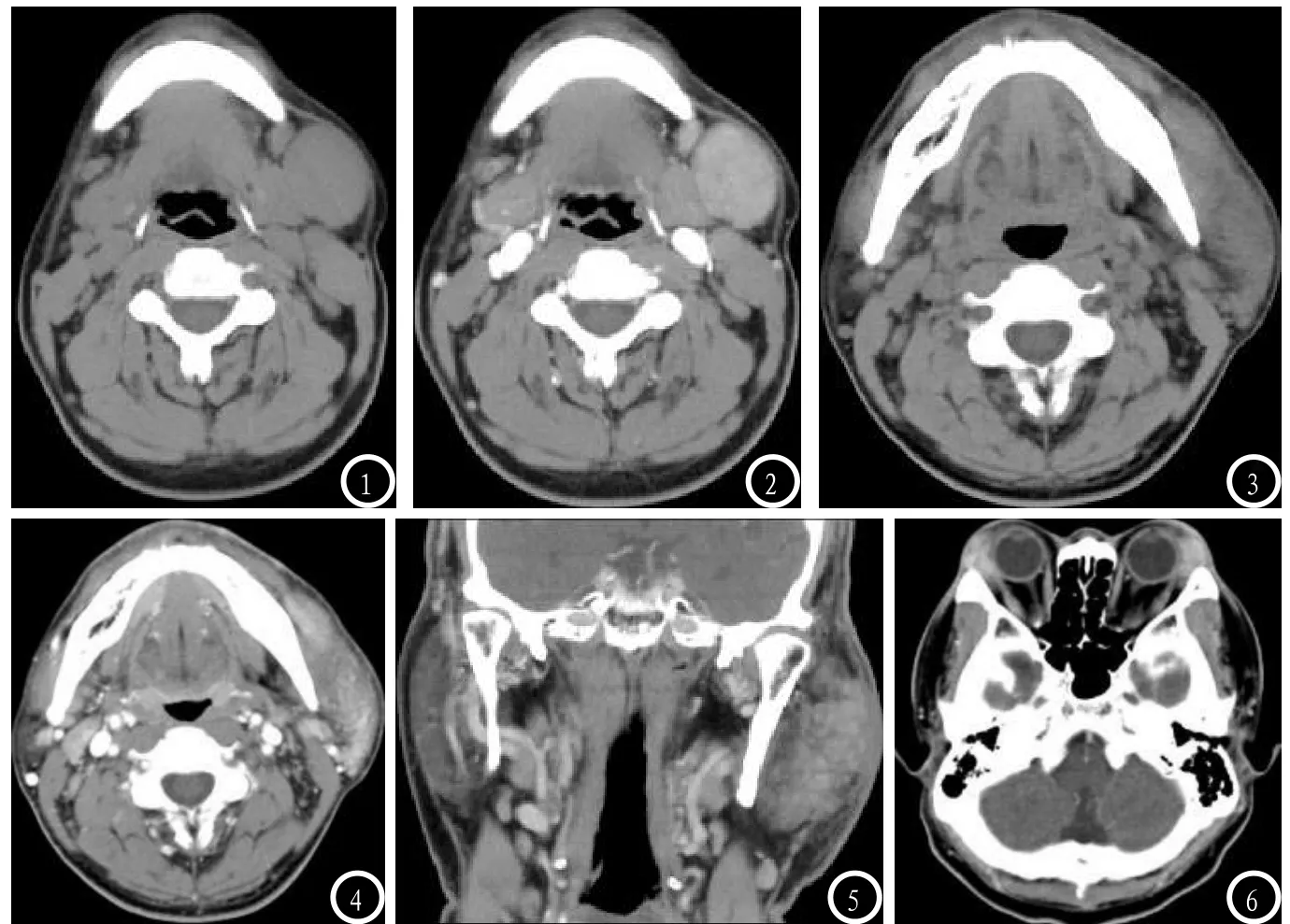

图1-2 男性,32岁,左下颌触及无痛性肿块 图1 左下颌见一卵圆形软组织肿块影,边界清晰,密度均匀,周围脂肪间隙清晰,邻近组织被推压,病灶右前缘见一相似密度结节;图2 增强扫描病灶均匀明显强化;手术切除,病理证实为淋巴结木村病。图3-4 男性,43岁,左下颌及腮腺无痛性肿大 图3 左下颌及腮腺区皮下见一斑块状软组织样密度影,密度不均,边缘模糊,形态不规则,周围脂肪间隙模糊,邻近骨质未见明显破坏;图4 增强扫描病灶明显不均匀强化;手术切除,病理证实为木村病。 图5 男性,63岁,左腮腺木村病,增强扫描见左腮腺病灶不均匀强化,内见条索状、网状低强化区,周围脂肪间隙浑浊,邻近皮肤稍增厚。 图6 男性,36岁,双侧泪腺木村病,双侧泪腺对称性肿胀,边界模糊,密度不均,与眼环分界尚清,周围脂肪间隙模糊。图7-8 男性,15岁,木村病,T1WI及T2WI压脂图,左上臂外侧皮下见一梭型软组织影,T1WI与肌肉信号相仿,T2WI信号强度高于肌肉,周围脂肪间隙模糊,沿筋膜间隙塑形性生长,同侧腋窝见多发肿大淋巴结(箭头),信号均匀,信号强度与皮下病灶相仿。图9 男性,40岁,可见左侧腮腺内及腮腺外多发结节,边界清晰,密度均匀;手术切除,病理证实均为淋巴结木村病。
本病罕见且表现多样,易误诊为结核性淋巴结炎、淋巴瘤、猫抓病、转移瘤、腮腺急慢性炎症、腮腺恶性肿瘤和软组织肉瘤等。(1)结核性淋巴结炎表现为淋巴结肿大,并见中央液化坏死区和周边环形强化,易融合成团,多伴肺结核病史,易于鉴别。(2)淋巴瘤多见于中老年人,肿大淋巴结有融合倾向,内可见血管漂浮征,增强扫描呈轻中度均匀强化,且外周血嗜酸性粒细胞水平不高,可资鉴别。(3)猫抓病患者常有猫接触史,表现为多发淋巴结肿大与KD相似,但淋巴结中央易液化、坏死及周围炎性渗出,病史大多较短(数周至数月),有助于本病与KD的鉴别[13]。(4)淋巴结转移瘤发病年龄大,有原发肿瘤病史,淋巴结大小、密度或信号不均,增强扫描呈不均匀强化。(5)腮腺内病变者需与腮腺急慢性炎症鉴别,均可表现为腮腺肿胀,腮腺内斑片状模糊影,但腮腺炎多有压痛,且外周血嗜酸性粒细胞水平不高。(6)与腮腺恶性肿瘤性病变及其他软组织肉瘤鉴别,此类病变生长迅速,呈浸润性生长,表现为软组织样肿块向周围蔓延,可突破筋膜生长,侵犯邻近的神经、血管、骨骼等,较大者可合并坏死、囊变、出血,增强扫描强化不均匀,并可有远处转移瘤,而KD一般无坏死、囊变、出血,无明显侵犯破坏征象,可资鉴别。
本病由于发病率低及认识上的不足,术前误诊率高。青壮年男性发现头颈部皮下或涎腺内可触及无痛性肿块,伴淋巴结肿大,病史较长,且反复多部位发作,结合外周血嗜酸性粒细胞及IgE水平明显增高,应怀疑KD的可能。本病为良性病变,通过手术切除、放射治疗及激素治疗可以达到较好疗效,预后良好,但停药后容易复发,且有个案报道KD并发淋巴瘤[14-15],提示KD存在恶性转化的可能,因此建议随访复查。
[1]Choi JA,Lee GK,Kong KY, et al. Imaging findings of Kimura's disease in the sof t tissue of the upper ext remity[J].AJR Am J Roentgenol,2005,184(1):193-199.
[2]Kimura T, Pawankar R, Aoki M, et al. Mast cells and Tce lls in Kimu ra's di sease express inc reased level s of inter leukin-4, inter leukin-5, eotaxin and rantes[J].Cl in Exp Al lergy,2002,32(12):1787-1793.
[3]肖璇,王聪,徐祎.Kimu r a病的病理学分析[J].口腔生物医学,2012,3(4):197-200.
[4]Chen H, Thompson LD, Agui lera NS, et al. Kimura disease: a c l ini copat ho logic study of 21 cases[J].Am J Surg Pathol,2004,28(4):505-513.
[5]Hor ikoshi T, Motoor i K, Ueda T, et al. Head and neck MRI of Kimu ra di sease[J].Br J Radiol,2011,84(1005):800-804.
[6]Takeishi M, Makino Y, Nishioka H. Kimura disease: diagnost ic imaging f indings and surgical trea tmen t[J].J Cr ani of ac Surg,2007,18(5):1062-1067.
[7]Maleki D, Sayyah A, Rahimi-Rad MH. Kimura's disease with eosinophilic pannicul it is--treated with cyc lospor ine: a case repor t[J].Al lergy Asthma Cl in Immunol,2010,6(1):5.
[8]Gopinathan A, Tan TY. Kimura's disease: imaging pat terns on computed tomography[J].Cl in Radiol,2009,64:994-999.
[9]刘珊珊,朱斌.木村病3例报道并文献回顾[J].罕少疾病杂志.2015.22(3):56~58.
[10]Boc ca t o P, Manna rà GM, Rinal do A, et al. Kimura's disease of the int raparot id l ymph nodes: f i ne need l e aspiration biopsy f indings[J]. ORL J Otorhinolaryngol Relat Spec,1999,61(4):227-231.
[11]熊润青,包燕妮,王金喜.左颌下淋巴结嗜酸性淋巴肉芽肿1例[J].中国医学影像技术,2008,24(3):357.
[12]Takahashi S, Ueda J, Furukawa T, et al. Kimura disease: CT and MR f indings[J].AJNR Am J Neuroradiol,1996.17:382-385.
[13]陆方,詹松华,杨烁慧.猫抓病的影像学进展[J].中国医学计算机成像杂志,2015,21(5):497-500.
[14]陈辉树,陈华,张乃鑫,等.木村病38年伴发皮肤T细胞淋巴瘤一例[J].中华血液学杂志,2007,28(4):271-272.
[1 5]陈旭艳,蔡继福,潘海晖,等.Kimu r a病演变为非霍奇金淋巴瘤一例[J].中华血液学杂志,2005,26(10):615.
(本文编辑: 唐润辉)
Imaging Diagnosis of Kimura's Disease
LIANG De-zhi, QIN Ye-zhi, MO Sen-lin. Department of Radiology, Nanhai Hospital Affiliated to Southern Medical University, Foshan 528200, Guangdong Province, China
ObjectiveTo study the CT and MR I findings of Kimura's disease (KD) in order to improve diagnosis of it.MethodsThe imaging finding of 13 patients With histologically confirmed KD were analyzed retrospectively.Results13 patients had common clinical features With painless mass and local lymphadenectasis, lesions occured in maxillofacial region, upper limb, axilla, inguina respectively. All patients accompanying peripheral blood eosinophilia were also observed. Five patients showed soft tissue nodules With welldefined margins and homogeneous enhancement in parotid gland, submandibular region, neck region, axilla, inguina respectively. Eight patients showed soft tissue swelling With ill-defined margins and heterogeneous enhancement in parotid gland, lacrimal gland, periauricular region, submandibular region, upper limb respectively.ConclusionThe CT and MRI findings of KD have some characteristic features. Combining With the clinical manifestations and laboratory exam inations, the diagnosis could be made.
Kimura's Disease; CT; MR I
R816.1
A
10.3969/j.i s s n.1672-5131.2016.12.044
梁德志
2016-10-24
