玉米基因组DNA不同提取方法及提取部位的比较研究
2017-01-13楚海娇
楚海娇
(吉林农业科技学院生物工程学院,吉林 吉林 132101)
玉米基因组DNA不同提取方法及提取部位的比较研究
楚海娇
(吉林农业科技学院生物工程学院,吉林 吉林 132101)
分别探讨CTAB法和SDS法对玉米不同部位基因组DNA的提取效果。综合比较了2种方法提取的DNA浓度、纯度及完整性,结果表明SDS 法是比较适合玉米基因组DNA提取的方法;同时比较了以玉米叶片、幼根和成熟胚为材料提取的DNA质量,发现以新鲜叶片为材料提取的DNA浓度和纯度较高,更适合用于玉米基因组DNA的提取。
玉米;基因组DNA;CTAB法;SDS法
基因组DNA是生物体所有遗传信息的总和。植物总DNA的提取是研究植物DNA的结构和功能,开展外源DNA转化和转导的前提。玉米是重要的粮食和饲料作物[1]。目前,国内外已开展了大量的玉米分子生物学研究和基因组学研究。研究玉米基因的结构与功能,发现具有目标性状的基因资源,探明基因位点与效应,可解决一些育种问题;同时通过转基因育种的使用,可实现物种之间跨越[2]。
进行玉米生物技术研究的基础是大量高质量、高纯度的玉米基因组DNA的提取[3],提取的DNA浓度和质量对后续试验结果有较大的影响,因此合适的DNA提取方法非常重要。目前用于制备基因组DNA的方法很多,用于植物基因组提取的方法有CTAB法、SDS法及尿素法等[4]。对于玉米来讲,不同部位的材料、不同提取方法,DNA的得率不同。适宜的DNA提取方法不仅能够获得产量高、纯度高、完整性好的DNA,同时也应具备操作程序简便、快速、成本低的特点。
1 材料与方法
1.1 试验材料
玉米材料为“吉科3536”,由吉林农业科技学院植物科学学院提供。玉米种植采用盆栽法,待玉米长至2叶期时取不同部位,用于DNA的提取纯化。
1.2 主要试剂和药品
CTAB提取液、SDS提取液、饱和酚、氯仿、异戊醇、5M KAc、无水乙醇、TE缓冲液、5xTBE电泳缓冲液、6x凝胶上样缓冲液、DNA Marker、核酸染料。
1.3 试验方法
1.3.1 CTAB法
0.3g玉米材料液氮中研磨→加入CTAB提取液800uL→65℃水浴中提取→有机溶剂抽提2次→无水乙醇沉淀DNA→70%乙醇洗涤沉淀→RE缓冲液溶解DNA。
1.3.2 SDS法
0.3g玉米材料液氮中研磨→加入SDS提取液800uL→65℃水浴中提取→有机溶剂抽提2次→无水乙醇和5mol/L KAc沉淀DNA→70%乙醇洗涤沉淀2次→RE缓冲液溶解DNA。
1.3.3 基因组DNA浓度和纯度的测定
采用紫外分光光度法进行定量分析。取1uLDNA样品滴加于超微量紫外可见分光光度计Bionano上,测定玉米基因组DNA在260nm和280nm紫外光波长下的吸光度值。由吸光度值计算核酸分子浓度的公式如下:
dsDNA浓度(ug/mL)=OD260×50ug/mL×稀释倍数
基因组DNA纯度根据OD260/OD280的比值来衡量。纯净的DNA样品OD260/280在1.8~2.0之间,比值小于1.8,说明蛋白质或酚未除净;比值大于2.0,说明有RNA污染。
1.3.4 1%琼脂糖凝胶电泳进行基因组DNA完整性的检测
2 结果与讨论
2.1 不同方法提取玉米基因组DNA的结果分析
2.1.1 DNA浓度和纯度检测
使用紫外分光光度计分别对CTAB法和SDS法提取的玉米基因组DNA样品进行浓度和纯度测定,检测结果如表1所示。
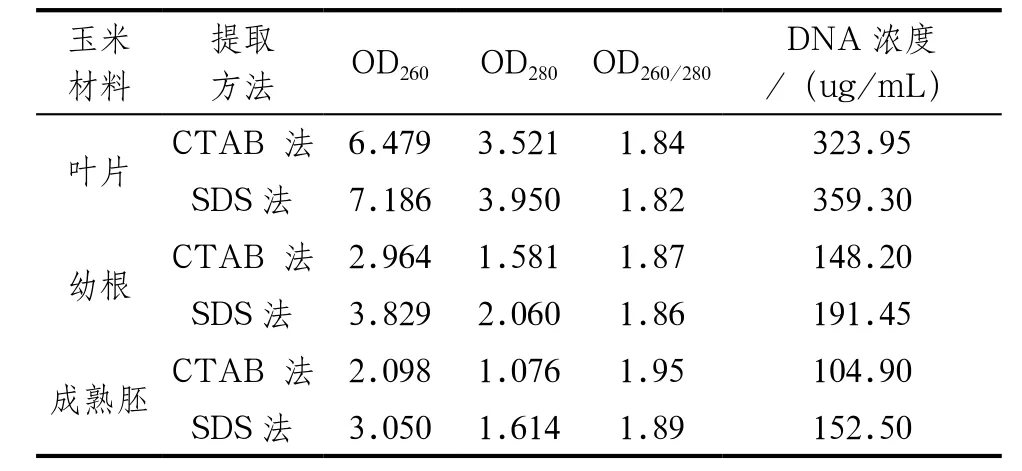
表1 不同方法提取玉米DNA的浓度和纯度比较
由表1可知,CTAB法与SDS法相比,玉米不同部位提取的基因组DNA在纯度上均无较大差别,并且DNA的OD260/280都在最佳范围1.8~2.0之间,说明2种方法所提取的DNA样品纯度较高,基本上无RNA、蛋白质和多糖等杂质存在。

图1 CTAB法和SDS法提取DNA的浓度比较
由表1可知,CTAB法提取的玉米成熟胚、叶片及幼根的DNA浓度分别为:104.90ug/mL 、323.95ug/mL、148.20ug/mL;SDS法提取玉米叶片、幼根及成熟胚的DNA浓度分别为:152.50ug/mL、359.30ug/mL、191.45ug/mL。由图1可直观看出,对于相同玉米材料,采用SDS法提取的基因组DNA浓度均比CTAB法提取的浓度高,因此,SDS法更适宜用作玉米基因组DNA的提取方法。
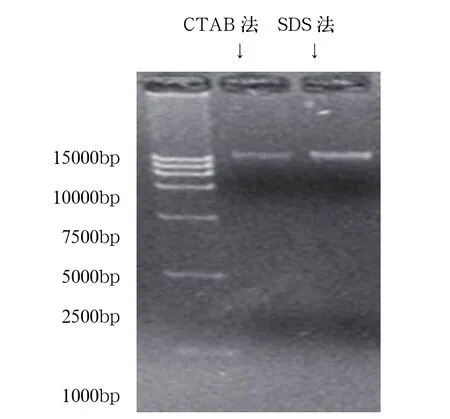
图2 不同方法提取的玉米基因组DNA电泳图谱
2.1.2 琼脂糖凝胶电泳检测
从图2可以看出,采用CTAB法和SDS法提取玉米叶片基因组DNA的电泳条带都比较清晰,说明均获得了一定量的DNA。SDS法提取的玉米叶片DNA条带明亮且无拖尾痕迹,说明DNA含量较高;CTAB法提取的玉米叶片DNA条带虽无明显拖尾,但条带较弱,说明DNA含量较低。由此得出SDS法是提取玉米基因组DNA较好的方法。
2.2 不同部位提取玉米基因组DNA的结果分析
2.2.1 DNA纯度和浓度检测
使用紫外分光光度计分别对SDS法提取的玉米成熟胚、叶片及幼根基因组DNA样品进行浓度和纯度测定,检测结果如表2所示。
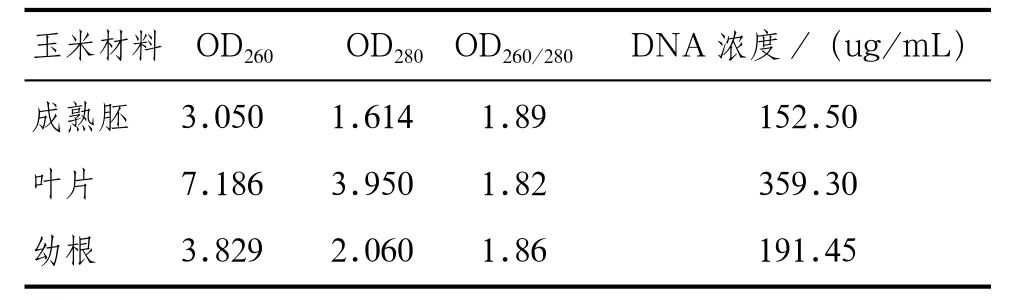
表2 SDS法提取的玉米不同部位DNA的纯度和浓度
由表2可知,玉米不同提取部位所提取的DNA含量存在一定差异。SDS法提取的玉米叶片DNA浓度为359.30ug/mL,达到分子生物学的要求高于200ug/mL。而从玉米幼根和成熟胚中所提DNA的浓度分别为191.45ug/mL 和152.50ug/mL,DNA含量相对较些,这主要是因为玉米成熟胚和幼根中的蛋白质、碳水化合物、淀粉等含量比新鲜叶片中高,而在DNA提取过程中,这些物质均被作为杂质除去,因此会影响到DNA的提取[6]。同时玉米不同部位基因组DNA的OD260/280均在最佳范围1.8~2.0之间,说明所提取的DNA样品纯度较高,基本上无RNA、蛋白质和多糖等杂质存在。从而说明玉米叶片较适宜作为提取玉米基因组DNA的材料。
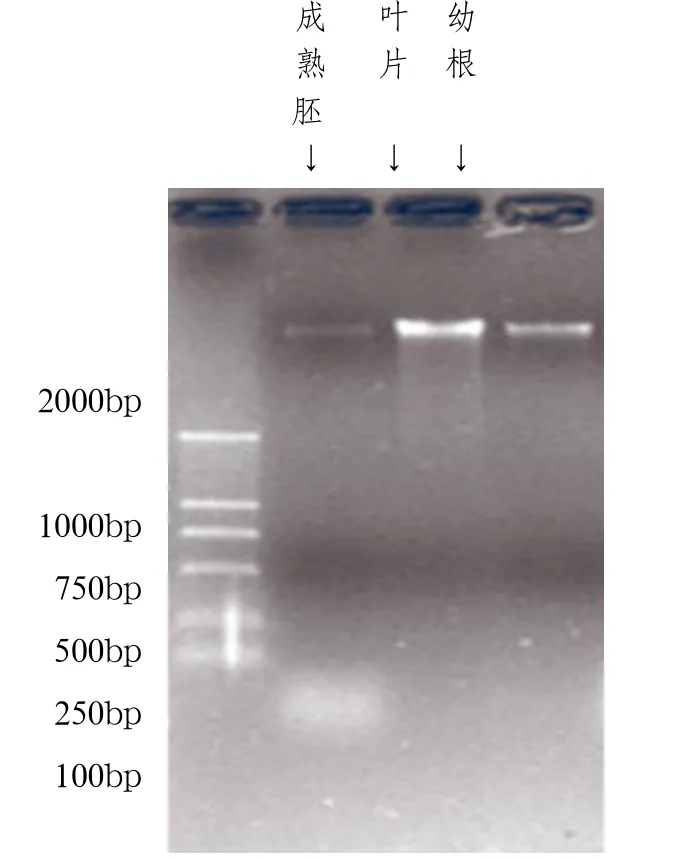
图3 不同部位基因组DNA电泳图谱
2.2.2 脂糖凝胶电泳检测
由图3可知,以玉米叶片为材料,提取的DNA条带清晰明亮,无拖尾痕迹,从成熟胚和幼根中提取的DNA均无拖尾痕迹,但条带较弱,并且成熟胚中最弱,这可能是由于成熟胚中富含多糖类等储藏性成分,大大增加了提取DNA的难度,同时由于成熟胚经液氮处理后比较坚硬,研磨时可能造成了DNA的降解。由此可见,新鲜叶片更适合作为玉米基因组DNA提取和分子生物学研究的材料。
3 结论
提取高质量的DNA样品是进行分子生物学研究的的关键步骤。本试验为了得到优良的玉米基因组DNA提取方法及适宜的玉米材料,分别采用CTAB法和SDS法对玉米叶片、幼根及成熟胚3个不同部位的基因组DNA进行提取,通过检测发现,SDS法提取玉米叶片基因组DNA可获得高纯度、高浓度的DNA。此认为SDS法是提取玉米基因组DNA较好的方法,新鲜叶片更适合作为玉米基因组DNA提取的材料。在试验中应将玉米DNA的不同提取方法与所用材料结合起来考虑。
为了获得高质量高纯度DNA,在选取材料时应尽量选取新鲜的实验材料,因为新鲜材料次生代谢产物少、DNA含量高[7];在加入液氮研磨时,速度要快,研磨要充分并始终保持材料的超低温状态,避免DNA的降解和酚类氧化;在转移上清液时应避免将中间层吸起,以减少杂质的吸入量;在DNA提取过程中,所有操作均需动作轻柔,避免剧烈振荡使大分子DNA断裂。本试验采用2种方法提取DNA时,均采用Tris饱和酚/氯仿/异戊醇和氯仿/异戊醇2次抽提,得到的DNA纯度较高。由此表明,此方法更能有效的去除蛋白质。
[1]魏琦超,畅丽萍,周岩,等.一种简便实用的玉米干种子基因组DNA提取方法[J].广东农业科学,2009(6):165-167.
[2]贾继增.分子标记种质资源鉴定和分子标记育种[J].中国农业科学,1999,29(4): 1-10.
[3]陈庆山,刘春燕,吕东,等.大豆DNA提取原理的探讨[J].东北农业大学学报,2004, 35(2):151-153.
[4]周春阳,谢立波,李景富,等.辣椒叶片基因组DNA提取方法的研究[J].辣椒杂志,2011(3):35-37.
[5]刘哲,刘庆平,孙霞,等.几种基因组DNA提取方法的比较研究[J].技术论坛,2011:68-72.
[6]陈丽丽,张鹏,黄新,等.玉米基因组DNA提取及浓度测定方法评价[J].生物技术通报,2011(12):71-74.
[7]易庆平,罗正荣,张青林.植物总基因组DNA提取纯化方法综述[J].安徽农业科学,2007,35(25):7789-7791.
S513
A
10.11974/nyyjs.20161232006
