免疫性血小板减少症病证结合动物模型研究
2017-01-13郎海燕褚雨霆马薇张雅月陈信义
郎海燕,褚雨霆,马薇 ,张雅月 ,陈信义*
(1.北京中医药大学东方医院,北京 100078;2.北京中医药大学东直门医院,北京 100700)
模 型 研 讨
免疫性血小板减少症病证结合动物模型研究
郎海燕1,褚雨霆2,马薇2,张雅月2,陈信义2*
(1.北京中医药大学东方医院,北京 100078;2.北京中医药大学东直门医院,北京 100700)
目的:探讨非附加条件建立免疫性血小板减少症(immune thrombocytopenic purpura, ITP)病证结合动物模型的可行性。方法:对3批ITP模型小鼠相关数据进行了综合分析,并按照病证结合模型辨识标准,评估注射APS的被动性免疫造模法复制的小鼠模型是否能够模拟人类ITP发病过程与临床特征。结果:注射APS复制的ITP模型小鼠特征如下:1)模型小鼠外周血小板计数下降、凝血时间延长,与正常组比较,有统计学意义(P<0.01)。2)骨髓产板巨核细胞减少,与正常组比较,有统计学意义(P<0.05、0.01、0.001)。3)模型小鼠注射APS部位或其他部位有自发性出血。4)造模1周后模型小鼠即有活动减少,行动迟缓,不思饮食,进食(水)量明显减少,大便溏稀,皮肤瘀斑、瘀点,皮肤或注射部位自发性出血,并随造模时间延长,上述表征日趋加重。结论:在非附加任何条件下,注射APS的被动免疫造模法复制的ITP动物模型符合病证结合模型特征,从而为开展中药药理学实验提供了理想的研究工具。
免疫性血小板减少症;脾(气虚)不统血证;病证结合动物模型
目前,病证结合是中医临床重要的诊疗模式,其特点是既注重对疾病的诊断与治疗,又重视对中医证候的辨证施治[1]。在中医研究领域,在研究一组中药能否用于治疗疾病,或要探讨临床疗效很好的一组作用机理时,需要建立相应的动物模型予以证实。但由于在动物实验中不能充分运用中医四诊理论(缺少问诊、切诊与舌诊),复制的动物模型多为疾病模型,而缺乏中医证候表征[2]。为解决这一难题,通常在慢性疾病基础上,研究者需要施加其他干预方法建立一个病加证或证加病的动物模型。这种模型与疾病发生、进展之间有一些差距。就此,我们提出了“既然能够复制疾病模型,就可以通过模型小鼠的某些外在表征观察,找到与人类疾病相似的中医证候特征”[3]。基于这一假设,我们对3批非附加任何干预条件复制的ITP小鼠模型的相关数据进行了综合分析,并按照拟定的ITP病证结合模型辨识标准,评估注射APS的被动性免疫造模法复制的ITP小鼠模型是否能模拟人类ITP发病过程与临床特征。
1 病证结合模型辨识标准
1.1 疾病模型辨识标准
具备以下4条可判定符合疾病模型标准:1)外周血血小板计数下降;2)注射或其他部位出血或自发性皮肤瘀斑;3)凝血时间延长;4)骨髓产板巨核细胞减少。
1.2 证候模型辨识标准
基于人类ITP发病特点,结合实验小鼠行为学特征和部分定量检测指标,将用于人体的“气不摄血证”外在表现转换为类似实验动物的“脾不统血证”行为学表征,转换指标包括:1)注射或其他部位出血或自发性皮肤瘀斑为病与证共性特征;2)活动减少类似于神疲乏力;3)行动迟缓类似于肢体倦怠;4)不思饮食、进食与饮水量减少、大便溏稀类似于脾虚或脾气虚;5)体质量下降类似于脾虚,不主肌肉。
1.3 病证结合模型辨识标准
依据疾病与证候模型辨识指标,具备疾病模型辨识标准4条中的3条以上(第1必备),结合证候模型辨识标准5条中任意3条,即可判定为病证结合模型。
2 实验方法
2.1 抗小鼠血小板血清制备
抗小鼠血小板血清制备步骤:1)取BALB/c小鼠,乙醚麻醉后,从小鼠心脏取全血,以EDTA-Na2抗凝,分离血小板并洗涤,用生理盐水稀释。2)取已分离的血小板分别与等量完全福氏佐剂和不完全福氏佐剂混合成油包水状作抗原,以含完全福氏佐剂抗原于0周注射豚鼠足掌、背及皮下,至少四点;以含不完全福氏佐剂抗原分别于l、2、4周按上述相同部位与点数注射。第5周从豚鼠心脏取不抗凝全血,560 g×10 min离心后取上清,即得豚鼠抗小鼠血小板血清(GP-APS),并贮存于-20℃冰箱待用。3)参照ELISA法加以改进,用国产冻干酶联A蛋白纯品代替碱性磷酸酶-蛋白A酶标抗体检测抗血清效价。4)将APS从-20℃中取出,置56℃水浴30 min,用等量BALB/c小鼠红细胞吸附至少两次,用生理盐水稀释成1∶4浓度APS备用。
2.2 实验动物分组
每批实验动物均采用SPF级健康BALB/c小鼠,体质量为18~22 g,8周龄,雌雄各半。每批实验前从24只小鼠尾静脉取血,用全自动血细胞计数仪检测小鼠外周血小板计数后,随机分2组,每组12只。正常组常规饲养;模型组于1、3、5、7、9、11、13天,按照100 μl/20 g剂量向小鼠腹腔内注入1∶4稀释的APS造模,并在动态观察各项指标变化,于第15天处死小鼠,取骨髓涂片检测相关指标。
2.3 观察指标
主要观察指标如下:1)疾病模型指标:血小板计数、出血情况、凝血时间、骨髓巨核细胞分类。2)证候模型指标:动态观察模型小鼠行为学与体质量变化。
2.4 统计学处理
3 结果
3.1 疾病模型指标变化
3.1.1 血小板计数
实验结束后,从尾静脉取血80 μl,加入带有EDTA-Na2固体抗凝剂试管,使血液与抗凝剂充分混合后,用全自动血细胞计数仪检测血小板计数。3批实验结果见表1。从表1可以看出,造模成功后,模型小鼠外周血血小板数值明显下降,与同批实验正常组比较,有统计学意义(P<0.01)。

组别第1批(n)第2批(n)第3批(n)正常组967.00±301.30(12)542.80±116.13(10)552.00±114.00(9)对照组618.1±192.10*(11)313.60±77.69*(10)314.00±78.00*(10)
注:与正常组比较,*P<0.01。
3.1.2 出血情况比较
在实验过程中,经连续、动态观察发现,注射APS后第3天皮下可见密集的鲜红出血点,皮下瘀斑融合成片,持续时间大约3~4天。于造模1周后出血逐渐减轻,出血颜色也由鲜红逐渐转为暗红,类似人类ITP慢性出血表现。3批实验模型小鼠出血情况分别见图1~3。

图1 第1批实验:模型小鼠腹部、四肢出血

图2 第2批实验:模型小鼠耳缘出血

图3 第3批实验:模型小鼠足趾出血肿胀
3.1.3 凝血时间比较
实验结束时取一小滴眼球血于表面皿中,用注射器针头尖端不断挑拨,记录到出现血丝为止的时间(秒)。3批实验凝血时间检测结果见表2。从表2可以看出,实验结束后,模型小鼠凝血时间延长,与同批实验正常组比较,有统计学意义(P<0.01)。
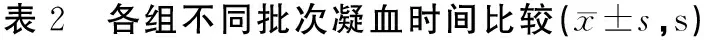

组别第1批(n)第2批(n)第3批(n)正常组62.66±6.71(12)61.60±2.88(10)61.60±2.88(10)对照组90.81±8.70*(11)81.90±4.12*(10)81.90±4.12*(10)
注:与正常组比较,*P<0.01。
3.1.4 骨髓巨核细胞分类变化
实验结束后处死动物,剥离小鼠,取胸骨骨髓,用25 μl小牛血清混匀,迅速涂片,风干后做瑞氏染色,用显微镜(10×100) 顺序计数100个巨核细胞并分类(原始巨、幼稚巨、颗粒巨、产板巨、裸巨)。3批实验结果见表3。从表3结果可以看出,与同批实验正常组比,1)模型小鼠骨髓产板巨核细胞明显减少(P<0.01);2)第2、第3批实验模型小鼠骨髓裸核细胞均有下降(P<0.01)。


实验批次组别(n)原、幼稚巨裸核巨颗粒巨产板巨第1批正常组(12)6.25±1.4827.41±5.0558.16±5.028.16±2.25模型组(11)4.18±1.33△30.63±4.5060.00±3.665.18±1.83*第2批正常组(10)28.90±5.226.30±2.4556.80±5.778.10±1.85模型组(10)32.20±5.903.70±1.42△58.9±5.495.20±1.48▲第3批正常组(10)28.90±5.226.30±2.4556.80±5.778.10±1.85模型组(10)32.20±5.903.70±1.42△58.90±5.495.20±1.48△
注:与正常组比较,*P<0.05,△P<0.01,▲P<0.001。
3.2 证候模型观察
3.2.1 小鼠行为学变化
正常组小鼠在饲养过程中始终反应灵活,毛色光润,喜活动,主动觅食,大便呈条状。模型小鼠于注射APS后1周表现活动减少,行动迟缓,不思饮食,进食(水)量明显减少,大便溏稀,皮肤瘀斑、瘀点,皮肤或注射部位自发性出血,并随造模时间延长,上述表征日趋加重。
3.2.2 体质量比较
3批实验模型小鼠体质量检测结果见表4。从表4可以看出,第1、2、3批实验造模后1周两组小鼠体质量变化不大,造模后2周,模型小鼠体质量明显减轻,与正常组、造模前比较,有统计学意义(P<0.05)。


实验批次分组(n)造模前造模后1周造模后2周第1批正常组(12)18.63±2.3318.95±1.1421.17±1.81模型组(11)20.21±1.5117.69±1.5217.18±1.94*第2批正常组(10)20.10±0.7421.30±0.8221.80±0.79模型组(10)20.00±0.8219.50±0.6718.70±0.95*第3批正常组(20)24.3±2.5223.35±2.1621.00±1.38对照组(20)23.93±2.6622.07±1.6420.65±1.35*
注:与正常组、造模前比较,*P<0.05。
3.3 病证结合模型判定
基于以上实验结果,依据拟定的ITP病证结合模型辨识标准判定,ITP模型小鼠除有明显的注射部位和皮肤自发性出血、外周血小板数值下降、凝血时间延长、骨髓产板巨核细胞减少疾病模型特征外,还具有模型小鼠活动减少、行动迟缓、不思饮食、大便溏稀、毛失光泽、皮肤瘀斑(出血)、体质量减轻等外在证候表征。
4 讨论
按照疾病急缓程度,将免疫性血小板减少症(Immune thrombocytopenic purpura,ITP)分为急性ITP(Acute immune thrombocytopenic purpura,AITP)与慢性ITP(Chronic immune thrombocytopenic purpura,CITP)两种类型[4]。基于中医理论,结合临床表现,AITP多见于儿童,因其发病急、血小板严重降低、出血量大等,属中医“血热妄行”证候;CITP特征表现为起病缓慢、病程漫长、血小板减少伴有慢性出血,属中医“气不摄血”证候[5-6]。通过长期临床实践,中医药在治疗CITP方面具有明显的治疗优势,主要表现在中药能够改善患者临床症状,缓解出血倾向,提升外周血小板计数[7-8]。但中医药治疗ITP的临床实际中,我们要证实按照中医理论拟定的一组中药应用于临床是否有效,或说明一组临床有效的中药治疗ITP作用机制时,需要建立能够模拟人类ITP发病过程与临床特征,且稳定性好、可重复的动物模型。但从目前已经发表的文献分析,仅有ITP疾病模型,缺乏既符合疾病特点,又符合证候表现的病证结合模型[9-10]。有基于此,我们拟定了ITP病证结合模型辨识标准,并试图通过以被动性免疫造模法复制的3批ITP动物模型相关数据进行分析与总结,判定是否与人类ITP发病特点及其证候具有一致性,从而为临床应用中医的健脾益气摄血法则治疗ITP提供参考。
对3批实验结果分析显示:注射APS复制的ITP模型小鼠具有下列特征:1)模型小鼠外周血小板计数下降、凝血时间延长,与正常组比较,有统计学意义(P<0.01)。2)骨髓产板巨核细胞减少,与正常组比较,具有统计学意义(P<0.05、0.01、0.001)。3)模型小鼠注射APS部位或其他部位均有自发性出血。4)造模1周后模型小鼠即有活动减少,行动迟缓,不思饮食,进食(水)量明显减少,大便溏稀,皮肤瘀斑、瘀点,皮肤或注射部位自发性出血,并随造模时间延长,上述表征日趋加重。按照预先拟定的ITP病证结合模型辨识标准判定,注射APS的被动免疫造模法复制的ITP模型小鼠具有与人类ITP发病相似的疾病与证候特征。
以注射APS的被动性免疫造模法复制ITP动物模型具有技术成熟度高、操作简便、重复性好、干扰因素少、成本相对较低等优势[11-12]。但非附加条件建立ITP病证结合动物模型研究至今还在探索之中。我们既往也尝试过不施加任何人为干预方法,建立免疫性血小板减少性紫癜“气虚血瘀”病证结合动物模型,但因血瘀指标选择难度较大,血瘀证据相对不足,其准确度还在进一步评估[13]。在本文中除拟定了ITP小鼠疾病模型辨识指标外,还拟定了ITP模型小鼠证候辨识标准与转换指标,并按照病证结合模型辨识标准对各项数据进行归纳与分析证明,注射APS的被动免疫造模法复制的ITP模型小鼠检测的客观指标不但与人类ITP发病特点一致,其外在表征(中医证候)也与人类ITP有高度的相关性。证明了“非附加条件可以复制与人类ITP发病相似的病证结合动物模型”。同时,通过分析在实验过程中连续、动态观察结果发现,注射APS后第3天模型小鼠皮下和注射部位可见密集的鲜红色出血点,皮下瘀斑融合成片,持续大约3~4天后,出血颜色逐渐转为淡红或暗红。在这一暂短的变化过程中,模型小鼠依然存在着明显活动减少、行动迟缓、不思饮食、食(饮水)量减少、体质量下降等表征,我们无法用“血热妄行证候”来合理解释,有待通过实验进一步观察和总结。
对于上述结果与结论也存在一些需要商榷与改进的问题:1)目前尚无公认的ITP病证结合动物模型辨识标准,我们拟定的证候诊断条件是否确切,有待进一步改进与完善。2)APS属外源性抗体,并非来源于研究对象自身。当停止注射APS后,模型小鼠外周血小板低水平维持时间较短,是否为预防用药的最佳动物模型[14],需待进一步证实。3)虽然本文检测的各项指标均有阳性结果,如外周血小板数值下降、骨髓产板巨核细胞减少、不同程度出血以及具有与人类ITP发病相似的临床证候表现。但其他造模方法是否也具有上述特征需要提供更多的实验证据[15-16]。4)作为最有说服力的抗血小板抗体、血小板膜糖蛋白(Ⅱa与Ⅲb)在该模型中是否有表达以及该指标检测意义,待通过研究予以证实。因此,在今后的研究中,将用较大的动物(豚鼠或家兔)复制ITP动物模型,以保证有足够的血液标本用于指标检测。
[1] 柴程芝,寇俊萍,朱丹妮,等.关于病证结合动物模型研究现状的思考[J].中国中药杂志,2009,34(20):2673-2675.
[2] 林志健,张冰,刘小青,等.中医证候动物模型评价研究[J].中国中医药杂志,2013,28(8):2217-2221.
[3] 富琦,陈信义.建立病证结合动物模型的新思路[J].中国中医药信息杂志,2003,10(9):79-80.
[4] 秦平,侯明.2012版成人原发免疫性血小板减少症诊治的中国专家共识解读[J].临床血液学杂志,2013,26(2):151-155.
[5] 常冬梅.特发性血小板减少性紫癜中医证候分布规律探讨[D].郑州:河南中医学院,2012:24-26.
[6] 王伟涛,吴深涛,刘宝山.免疫性血小板减少症的中医病因病机浅析[J].中医药学报,2016,44(4):8-9.
[7] 郎海燕.益气养血活血方治疗激素无效特发性血小板减少性紫癜初步临床探索[D].北京:北京中医药大学,2012:42-50.
[8] 赵伟,秦克力,郝晶.止血、消瘀、宁血、补虚法对CITP患者调节性T细胞影响的研究[J].中医药信息,2016,33(4):78-81.
[9] 张爱军,侯明.免疫性血小板减少性紫癜动物模型的研究进展[J].中国实验血液学杂志,2006,14(3):623-626.
[10] 旺建伟,叶虹玉,胥风华,等.中医动物模型建立的研究进展及思路[J].中医药信息,2014,31(4):80-84.
[11] 富琦.芪龙调血方治疗免疫性血小板减少性紫癜疗效与机制研究[D].北京:北京中医药大学,2004:19-27.
[12] 吴晓勇.探讨益髓颗粒对免疫性血小板减少性紫癜动物模型的免疫网络调控机制[D].北京:北京中医药大学,2010:58-59.
[13] 吴晓勇,李冬云,陈信义,等.益髓颗粒对免疫性血小板减少性紫癜模型小鼠细胞相关因子表达影响[J].中华中医药杂志,2010,25(6):849-852.
[14] 张爱军,侯明.免疫性血小板性紫癜动物模型的研究进展[J].中国实验血液学杂志,2006,14(3):623-626.
[15] 王颖.1400例血小板减少症患者病因分析[D].长春:吉林大学,2012:35-40.
[16] 李锦霞,杨炳华.血小板特异性抗体及其检测在诊断特发性血小板减少性紫癜中的研究进展[[J].血栓与止血学,2010,16(3):139-141.
Disease-syndrome Combined Animal Models for Immune Thrombocytopenic Purpura
LANG Hai-yan1, CHU Yu-ting2, MA Wei2, ZHANG Ya-yue2, CHEN Xin-yi2*
(1.DongfangHospital,BeijingUniversityofChineseMedicine,Beijing100078,China;2.DongzhimenHospital,BeijingUniversityofChineseMedicine,Beijing100700,China
To explore the feasibility of establishing the disease-syndrome combined animal models for immune thrombocytopenic purpura (ITP) without additional conditions. Methods: Three batches of data related to the ITP model mice obtained by replication at different time were overall analyzed, and whether the APS-injected model mice replicated through the passive immune modeling method could simulate the pathogenesis and clinical characteristics of human ITP was evaluated according to the differentiation criteria for disease-syndrome combined models. Results: The APS-injected replicated ITP model mice possessed the following characteristics: ①Compared with the normal group, the platelet count was significantly decreased, and coagulation time was significantly increased in the model group (P<0.01). ②Compared with the normal group, the medullary thrombocytogenous megakaryocytes were significantly decreased (P<0.05, 0.01, 0.001). ③The APS injected sites and other parts of model mice had spontaneous hemorrhage. ④Behavioral changing signs were observed after 1 week of modeling,with low activity, delayed activity, poor appetite, skin petechia/hemorrhage and spontaneous hemorrhage of injected sites and other parts, and became more and more severe. Conclusion: According to the syndrome differentiation criteria for disease-syndrome combined models of ITP, the APS-injected animal models of ITP replicated through the passive immune modeling method without additional conditions possess the characteristics of disease-syndrome combined models. It provides an ideal tool for the development of pharmacology experiment in traditional Chinese medicine.
Immune thrombocytopenic purpura; Syndrome of spleen failing to manage blood due to the spleen Qi deficiency; Disease-syndrome combined animal models
国家重点基础研究发展计划(973计划)(No.2013CB531705)
郎海燕(1979-),女,博士,讲师,副主任医师,主要研究方向:中医药治疗血小板疾病应用研究。
陈信义*(1954-),男,教授,主任医师,博士研究生导师,主要研究方向:中西医结合防治恶性肿瘤及血液系统疾病。
2016-04-28
R285.5
A
1002-2406(2017)01-0039-05
修回日期:2016-05-10
