CO2-N2-TBAB-H2O体系水合物生成实验和模型研究
2017-01-10赵光华
赵光华
(长城钻探工程技术研究院,辽宁 盘锦 124000)
CO2-N2-TBAB-H2O体系水合物生成实验和模型研究
赵光华
(长城钻探工程技术研究院,辽宁 盘锦 124000)
四丁基溴化铵(TBAB)可以作为热力学促进剂用于从烟道气中分离CO2。研究CO2-N2-TBAB-H2O体系水合物生成条件的热力学模型,为水合分离CO2提供热力学相平衡数据,具有一定实际意义。将Chen-Guo水合物热力学模型用于计算CO2+N2在TBAB溶液中的水合物生成压力,将计算结果与实验值、文献值进行比较,误差分别为15.96%、5.45%,并对误差进行分析。
水合物; TBAB; 烟道气; 生成实验; Chen-Guo模型
每年全球因化石燃料而排放的CO2达200亿t左右,随着世界各国对地球温室效应问题的关注,CO2减排引起了世界各国的重视[1]。排放入大气中的CO2,其中3/4是由化石燃料燃烧造成的,烟道气是CO2长期集中的排放源。但CO2又是一种重要的工业原料,它广泛用于食品和化工等各个领域,如用于生产食品、尿素、甲醇等。从燃气锅炉的烟道气中回收的CO2用于生产尿素的原料,一方面可以提高经济效益,另一方面又可以降低温室气体排放量。水合物法分离烟道气中的CO2是一种新方法。
气体水合物,是一种雪花状冰结构,由CH4、CO2等客体分子进入主体水分子笼子形成的笼型结构化合物。根据客体分子的尺寸大小,气体水合物通常包括Ⅰ型、Ⅱ型和H型三种结构[2]。半笼型结构水合物通常是由四正丁基卤离子铵盐(溴离子,TBAB; 氯离子,TBAC; 氟离子,TBAF)存在下形成的。在TBAB半笼型水合物结构中,Br-和水分子连接成笼,(n-C4H9)4N+占据十四面体和十五面体大笼,小分子气体占据剩余的十二面体小笼[3]。由于部分笼型结构因捕获(n-C4H9)4N+被占据,因此称为半笼型水合物。半笼型水合物在天然气储存和运输、工业废气、二氧化碳分离方面有巨大的潜力和应用。
TBAB作为热力学促进剂,能够有效地降低混合气体的水合物生成压力,其中包括CO2+N2。许多研究者通过实验研究了CO2-N2-TBAB-H2O体系水合物生成的热力学平衡条件。N. H. Duc等[4]使用摩尔分数0.29% 的TBAB溶液来研究不同气体(CO2摩尔分数:15.5%、19.2%、 21.5%、 23.4%)组成的CO2-N2-TBAB- H2O体系的气相-液相-水合物相的三相平衡条件,温度范围282~295 K,压力范围0.5~4.4 MPa。鲁涛等[5]研究了278.05~287.85 K,TBAB质量分数5%、15.3%、34.8%、40.7%、45.7%下,CO2(摩尔分数16.6%)+N2(摩尔分数83.4%)+TBAB的水合物生成压力。李士凤[6]研究了摩尔分数分别为0.293%和0.617% TBAB水溶液中,CO2(摩尔分数15.3%)+N2(摩尔分数84.7%)生成水合物的相平衡条件,证明TBAB的存在能够显著降低CO2+N2的水合物生成压力,TBAB浓度越大,更易生成水合物。J.Deschamps等[7]使用扫描量热法测定了CO2(摩尔分数24.9%)+N2(摩尔分数75.1%)在质量分数4%的TBAB水溶液中的水合物生成条件。P.Meysel等[8]研究了TBAB浓度对半笼型水合物初始生成条件的影响,并对二元气体混合物CO2+N2(CO2摩尔分数分别为20%、50%、75%)在TBAB水溶液(TBAB质量分数为5%、10%、20%)的三相(气相-水合物相-液相)平衡时,水合物离解压力进行测定。V. Belandria等[9]采用等容压力搜索法测定了CO2+N2(CO2摩尔分数分别为15.1%、 39.9%、74.9%)在TBAB水溶液中的水合物生成条件。
目前,半笼型水合物相平衡模型引起了越来越多人的关注。A. Joshi等[10]将Chen-Guo模型[11]应用于CH4、CO2、N2在TBAB水溶液中的半笼型水合物生成压力计算。证明该模型可以应用于半笼型水合物的相平衡计算,并且建立了一个能够在一系列压力范围内表达对温度促进效果的关联式。A. H. Mohammadi等[12]使用传统Van de Waals-Platteeuw理论模型预测CH4、CO2、N2在TBAB水溶液中的半笼型水合物相平衡条件。J. Verrrett等[13]采用共存理论模型成功地预测了281~294 K范围内的TBAB-H2O-CO2和TBAB-H2O-CH4的热力学水合物生成条件。Z. X. Liao等[14]研究了278.1~286.2 K内,合成气混合物在TBAB水溶液中的水合生成条件,将两步水合生成机理的Chen-Guo模型用于热力学计算,计算结果与实验值较为一致。
本研究以燃气锅炉排放的烟道气为研究对象。首先,测定CO2(摩尔分数9.06%)+N2(摩尔分数90.94%)在摩尔分数0.293% TBAB水溶液中的水合物生成压力。然后将Chen-Guo模型应用于气体混合物在TBAB水溶液中的水合物生成压力计算。再将计算结果分别与实验值、文献值进行比较,并进行分析。
1 实验部分
实验所用CO2+N2混合气体由北京市北温气体制造厂提供,去离子水为实验室自制。TBAB为分析纯,由国药集团化学试剂有限公司提供。本次实验装置如文献[15]所述,实验方法为恒温压力搜索法,该实验方法在文献[16-17]中已详细阐述。本次实验测定了278.32~286.28 K内,CO2(摩尔分数9.06%)+N2(摩尔分数90.94%)在摩尔分数0.293% TBAB水溶液中的水合物生成压力。
2 模型计算
2.1 热力学模型推导
Chen-Guo两步水合生成机理[11],主要包括一个准化学反应过程形成基础水合物结构以及气体小分子在基础水合物连接孔的填充。在本次研究过程中,两步水合生成机理应用于CO2-N2-TBAB-H2O体系。先对TBAB水合物结构作以下物理假设:
(1) 假设TBAB半笼型水合物的十四面体大笼和十五面体大笼是尺寸相同的大笼,大笼为络合孔,每个络合孔只能占据一个客体大分子。
(2) 假设TBAB不发生解离,笼子只是由主体水分子通过氢键连接形成。
(3) TBAB和气体组分CO2、N2均是客体组分,均参与形成基础水合物。TBAB占据水合物结构的大笼,即络合孔。气体分子进入小笼,即连接孔,每个连接孔只能占据一个气体分子。
(4) TBAB为大分子,根据多元气体水合物生成条件预测原则[2],只能生成水合物结构Ⅱ型。因此,假设客体组分(TBAB、CO2、N2)在水中生成Ⅱ型水合物。
根据液相-水合物相-气相三相平衡条件,可以得到:
(1)
其中,f指逸度,下标W表示H2O,L表示液相,H表示水合物相。
基于Chen-Guo模型,在平衡条件时,气相和水合物相中气体逸度存在如下关系式:
(2)
基于热力学模型的物理假设,小分子气体N2、CO2以及TBAB均参与生成水合物,所以公式(2)可由以下公式表示:
(3)
(4)
(5)
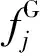
根据Chen-Guo两步水合生成机理,具体生成过程如下:
第1步:H2O和客体组分(CO2、N2、TBAB)通过准化学反应生成化学计量型基础水合物,该准化学反应过程用化学反应式表示如下:
(6)
其中,S代表TBAB和气体组分,λ2表示在基础水合物中,单位水分子包含的客体S分子数。H. Oyama等[19]研究得到TBAB半笼型水合物结构单元,分为A型和B型结构。A型结构,包含26个水分子,B型结构,包含38个水分子。每个结构单元包括4个大笼和3个小笼。根据模型假设,TBAB占据4个大笼,即4个络合孔。因此,对于结构A型,λ2=4/26,对于结构B型,λ2=4/38。在第1步准化学反应过程中,连接孔(十二面体小笼)会自动生成。
第2步:小尺寸气体分子(N2、CO2等)能够吸附进入空的连接孔,形成水合物稳态。气体分子部分占据连接孔能够降低基础水合物的化学势,导致基础水合物的非化学计量性质。
基于上述两步生成机理,描述半笼型水合物生成的最终模型表示如下:
(7)
(8)
(9)
其中,α=λ1/λ2。λ2是基础水合物中单位水分子包含的连接孔个数,A型结构,λ1=3/26[14],B型结构,λ1=3/38[14]。
(10)
(11)
(12)
(13)
式(8)中,Cj为气体分子在连接孔中的Langmuir吸附常数,可以用Antoine公式表示:
(14)
式(14)中,N2、CO2的X、Y、Z值如表1所示[11]。

表1 计算Langmuir常数C的Antoine参数
Chen-Guo模型中Ⅱ型水合物需考虑气体小分子与大分子之间的相互作用[2],引进二元交互作用参数AjM,其中AjM=AMj,Ajj=AMM=0。AjM可以表示为TBAB浓度的函数[14]:

(15)

(16)
H. Oyama等[19]研究得到TBAB水合物晶体(A型、B型)的相图,可以发现18%是临界质量分数。在低于18%时,B型晶体有更高的熔点;高于18%时,A型晶体有更高的熔点。因此,可以规定TBAB质量分数低于18%时,生成B型水合物晶体,质量分数高于18%时,生成A型水合物晶体。
式(12)中,β是水合物结构参数。对于B型TBAB半笼水合物,β=3.5×10-5K/Pa[14],对于A型TBAB半笼水合物,β=2.8×10-5K/Pa[14]。
式(11)中,气体分子的A′、B′、C′参照Chen- Guo模型Ⅱ型水合物的相关参数,TBAB的A′、B′、C′由Z.X.Liao等[20]给出,见表2。

表2 公式(11)计算的Antoine参数
式(4)中,液相中TBAB的逸度可以由下式计算:
(17)
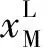
(18)
TBAB的饱和蒸汽压可由B. E. Poling等[22]给出的关联式计算:
(19)
TBAB水溶液中水的活度采用S. Lindenbaum等[23]以及G.E.Amado等[24]给出的关联式进行计算:
(20)
确定TBAB溶液的密度可以相应地求出TBAB的摩尔体积,可以采用O. Sohnel等[25]给出的关联式求算ρM的单位为g/cm3:
ρM=ρw+B1(100wM)+B2(100wM)2+
(21)

(22)
式(22)中,T为温度,K;qi、ri、si为临界参数,其值参照V. Belandria等[26]给出的值,列于表3中。

表3 相关参数
2.2 计算过程
1) 输入温度T,TBAB质量分数,给生成压力赋初值P0;
2) 采用PT状态方程[18]计算混合气体在气相中的逸度;
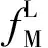
4) 采用公式(14)计算Langmuir常数C,采用公式(8)计算气体组分在连接孔的占有率θj;
6) 采用公式(7)计算各个组分所形成的基础水合物在混合基础水合物中所占的比例xi;
2.3 计算结果与讨论
将上述计算过程用于计算CO2(摩尔分数9.06 %)+N2(摩尔分数90.94%)在摩尔分数0.293%TBAB水溶液中水合物生成压力计算,将实验结果与计算值对比见图1。

图1 CO2+N2在TBAB溶液中水合物生成压力的实验值和计算值对比
平均相对误差(AARD)可以用于实验值与模型计算值的误差计算,见公式(23):
(23)
式中,N表示实验点数。由式(23)计算得到本次模型计算的AARD为15.96%,说明该模型可以在一定程度上预测CO2+N2在TBAB溶液中的水合物生成压力计算。278.32、284.28 K下,实验值分别为0.94、6.00 MPa,而计算值为0.69、7.32 MPa,相
对误差分别为26.6%和22.0%。由于模型中的二元交互作用参数是由纯气体在TBAB溶液中的水合物生成压力拟合出的,但对于二元气体混合物体系,参数的通用性降低,造成个别模型计算值与实验值存在较大误差。将该模型用于文献中相关CO2+N2在不同摩尔分数TBAB溶液中的水合物生成压力计算,计算值与文献值对比如图2、图3所示。

图2 文献[8-9]中不同组分CO2+N2在TBAB的水合物生成压力与模型计算值对比
Fig.2 The comparison of different components of CO2+N2hydrate formation pressure in TBAB solution between literature value[8-9] and model calculational value
Fig.3 The comparison of different components of CO2+N2hydrate formation pressure in TBAB solution between literature value[6,8] and model calculational value
通过计算,摩尔分数0.293%的 TBAB溶液中,水合物生成压力的文献值与模型计算值的AARD为5.45%。摩尔分数0.617%的 TBAB溶液中,水合物生成压力的文献值与模型计算值的AARD为14.41%。该模型可以在一定程度上预测CO2+N2
在TBAB溶液中的水合物生成压力。
对此次模型产生的误差进行分析,分析结果如下:
(1) 研究者发现,对于TBAB+H2O体系,有至少5种不同的水合物结构,对应水合分子数分别为:24、26、32、36、38[27]。对于本次实验采用的水合分子数是大多数模型计算采用的参数,但未经严格证实,导致模型计算存在偏差。
(2) 在水的活度计算过程中,未考虑到CO2在水中的溶解度。由于CO2在水中存在一定溶解度,在标准状况下为0.076 7 mol/kg(H2O)[28],会影响水的活度计算,导致计算结果存在误差。
(3) 在摩尔分数0.293% TBAB溶液中,文献值与模型计算值误差较小,而实验值与模型计算值误差较大。本次实验的实验方法采用恒温压力搜索法[16-17],文献[8-9]采用恒容压力搜索法。对于恒温压力搜索法,需要观察水合物颗粒的生成和化解现象,而恒容压力搜索法通过电脑记录的体系压力曲线得到水合物生成压力,后者更为准确,造成模型计算值与文献值的AARD为5.45%,而计算值与实验值的AARD为15.96%。
(4) 本文的模型参数是由纯物质的水合物生成条件拟合出的,但是对于CO2-N2-TBAB-H2O体系,相关参数的通用性降低,个别模型计算值与实验值的相对误差甚至达到20%以上,造成较大误差。
3 结论
本文首先采用恒温压力搜索法测定278.32~286.28 K内,CO2(摩尔分数9.06%)+N2(摩尔分数90.94%)在摩尔分数0.293% TBAB溶液中的水合物生成压力。采用Chen-Guo模型计算CO2+N2在TBAB溶液中的水合物生成压力,该模型在TBAB水合物结构基础上做出物理假设,将计算值与实验值、文献值比较,平均相对误差分别为15.96%、5.45%。说明改进的Chen-Guo模型可以用于CO2+N2在TBAB溶液中半笼型水合物生成压力的相平衡计算,但是模型参数和计算精度仍有待于改进。
[1] 叶宁,毕亚军. 烟道气回收CO2的工业应用[J]. 化学工程师,2005, 121(10):59-61. Ye Ning,Bi Yajun. Application of the technology of carbon dioxide recovery from flue gas [J]. Chemical Engineer,2005,121(10):59-61.
[2] 陈光进,孙长宇,马庆兰. 气体水合物科学与技术[M].北京: 化学工业出版社, 2007.
[3] Shimada W,Shiro M,Kondo H,et al.Tetra-n-butyl-ammonium bromide-water(1/38)[J]. Acta Crystallographica Section C:Structural Chemistry,2005,61(2):65-66.
[4] Duc N H,Chauvy F,Herri J M. CO2capture by hydrate crystallization-A potential solution for gas emission of steelmaking industry[J]. Energy Conversion & Manage,2007,48(4):1313-1322.
[5] 鲁涛,张郁,李小森,等. CO2-N2-TBAB和CO2-N2-THF体系的水合物平衡生成条件[J]. 过程工程学报,2009,9(3):541-544. Lu Tao,Zhang Yu,Li Xiaosen,et al. Equilibrium conditions of hydrate formation in the systems of CO2-N2-TBAB and CO2-N2-THF[J]. The Chinese Journal of Process Engineering,2009,9(3):541-544.
[6] 李士凤. 基于水合物技术的模拟电厂烟气中二氧化碳捕获研究[D]. 大连:大连理工大学,2010.
[7] Deschamps J,Dalmazzone D. Dissociation enthalpies and phase equilibrium for TBAB semi-clathrate hydrates of N2,CO2, N2+CO2and CH4+CO2[J]. Journal of Thermal and Calorimetry,2009,98(1):113-118.
[8] Meysel P,Oellrich L,Bishnoi P R,et al. Experimental investigation of incipient equilibrium conditions for the formation of semi-clathrate hydrate from quaternary mixtures of (CO2+N2+TBAB+H2O)[J]. Journal of Chemical Thermodynamics,2011,43(10):1475-1479.
[9] Belandria V,Mohammadi A H,Eslamimanesh A,et al. Phase equilibrium measurements for semi-clathrate hydrates of the(CO2+ N2+tetra-n-butylammonium bromide aqueous solution systems:Part 2[J]. Fluid Phase Equilibria,2012,322-323(22):105-112.
[10] Joshi A,Mekala P,Sangwai J S. Modeling phase equilibria of semi-clathrate hydrates of CH4,CO2and N2in aqueous solution of tetra-n-butyl ammonium bromide[J]. Natural Gas Chemistry,2012,21(4):459-465.
[11] Chen G J,Guo T M. A new approach to gas hydrate modeling[J].Chemical Engineering Journal,1998,71(2):145-151.
[12] Mohammadi A H,Afzal W,Richon D. Experimental data and predictions of dissociation conditions for ethane and propane simple hydrates in the presence of distilled water and methane,ethane,propane,and carbon dioxide simple hydrates in the presence of ethanol aqueous solutions[J]. Journal of Chemical & Engineering Data,2008,53(1):73-76.
[13] Verrett J,Renault-Crispo J S,Servio P. Phase equilibria,solubility and modeling study of CO2/CH4+tetra-n-butyl ammonium bromide aqueous semi-clathrate systems[J]. Fluid Phase Equilibria,2015(388):160-168.
[14] Liao Z X,Guo X Q,Li Q,et al. Experimental and modeling study on the phase equilibria for hydrates of gas mixtures in TBAB solution[J]. Chemical Engineering Science,2015(137):656-664.
[15] 刘爱贤,赵光华,阿不都热和木,等. 水合物法分离烟道气中CO2的实验和模拟研究[J]. 石油化工高等学校学报,2013,26(6):1-5. Liu Aixian,Zhao Guanghua,Abudurehemu,et al. Experimental and modelling studies on separation carbon dioxide from flue gas via forming hydrate[J]. Journal of Petrochemical Universities,2013,26(6):1-5.
[16] 张世喜,陈光进,杨兰英,等.含氢气体水合物生成条件的测定和计算[J]. 化工学报,2003,54(1):24-27. Zhang Shixi,Chen Guangjin,Yang Lanying,et al. Measurement and calculation of hydrate formation conditions for gas mixtures containing hydrogen [J]. Journal of Chemical Industry and Engineering (China):2003,54(1):24-27.
[17] 王秀林,黄强,陈立涛,等. 天然气水合物生成条件的测定和计算[J]. 化工学报,2006,57(10):2416-2419. Wang Xiulin,Huang Qiang,Chen Litao,et al. Measurement and calculation of hydrate formation conditions for natural gases[J]. Journal of Chemical Industry and Engineering(China):2006,57(10):2416-2419.
[18] Patel N C,Teja A S.A new cubic equation of state for fluids and fluid mixtures[J]. Chemical Engineering Science,1982,37(3):463-473.
[19] Oyama H,Shimada W,Ebinuma T,et al. Phase diagram latent heat and specific heat of TBAB semi-clathrate hydrate crystals [J]. Fluid Phase Equilibria,2005,234(1-2):131-135.
[20] Liao Z X,Guo X Q,Zhao Y Y,et al. Experimental and modeling study on phase equilibria of semi-clathrate hydrates of tetra-n-butyl ammonium bromide+CH4,N2,or gas mixtures[J]. Industrial & Engineering Chemisry Research,2013,52(51):18440-18446.
[21] Eslamimanesh A,Mohammadi A H,Richon D. Thermodynamic modeling of phase equilibria of semi-clathrate hydrates of CO2,CH4or N2+ tetra-n-butyl ammonium bromide aqueous solution [J].Chemical Engineering Science,2012(81):319-328.
[22] Poling B E,Prausnitz J M,O'Connell J P. The properties of gases and liquids[M]. New York: Mc Graw-Hill,2004.
[23] Lindenbaum S,Boyd G E. Osmotic and activity coefficients for the symmetrical tetra alkyl ammonium halides in aqueous solutionat 25 ℃[J]. Journal of Physical Chemistry,1964,68(4):911-917.
[24] Amado G E,Blanco L H. Isopiestic determination of theosmotic and activity coefficients of dilute aqueous solutions of symmetrical and unsymmetrical quaternary ammonium bromides with a new isopiestic cell at 298.15 K [J].Fluid Phase Equilibrium,2005,233(2):230-233.
[25] Sohnel O,Novotny P. Densities of aqueous solutions of inorganic substances[M]. Amsterdam:Elsevier Science Publish,1985.
[26] Belandria V,Mohammadi A H,Richon D. Volumetric properties of the (tetrahydrofuran + water)and(tetra-n-butyl ammonium bromide + water)systems:Experimental measurements and correlations[J]. Journal of Chemical Thermodynamics,2009,41(12):1382-1386.
[27] Li D L,Du J W,Fan S S,et al. Clathrate dissociation conditions for methane + tetra-n-butyl ammonium bromide (TBAB) + water[J]. Chemical & Engineering Data,2007,52(5):1916-1918.
[28] Kamata Y,Oyama H,Shimada W,et al. Gas separation method using tetra-n-butyl ammonium bromide semi-clathrate hydrate[J]. Japanese Journal of Applied Physics, 2004,43(1):362-365.
(编辑 闫玉玲)
The Formation Experiment and Modeling Study of CO2-N2-TBAB-H2O Hydrate System
Zhao Guanghua
(EngineeringandTechnologyResearchInstituteofGWDC,PanjinLiaoning124000,China)
Tetra-n-butyl ammonium bromide (TBAB) is used as thermodynamic promoter in separation CO2from flue gas. Thermodynamic model is investigated for hydrate formation condition of CO2-N2-TBAB-H2O system, which can provide thermodynamic phase equilibrium data for hydrate separation of CO2and has certain significance. In this work, the Chen-Guo thermodynamic hydrate model is used to calculate hydrate formation pressure of CO2+N2in TBAB solution. The calculation result is compared with experimental value and literature value. The deviation is 15.96% and 5.45% and the deviation is analyzed.
Hydrate; TBAB; Flue gas; Formation experiment; Chen-Guo model
1006-396X(2016)06-0011-07
投稿网址:http://journal.lnpu.edu.cn
2016-05-16
2016-11-07
国家科技部973项目(2012CB215005)。
赵光华(1986-),男,硕士,工程师,从事水合物法分离气体水合物与气体采油技术等研究;E-mail:zhaoguanghua-1986@163.com。
TE65
A
10.3969/j.issn.1006-396X.2016.06.003
