热活化胶状黄铁矿去除酸性溶液中的Cd(Ⅱ)
2017-01-10朱宇珂刘海波陈天虎
朱宇珂,李 平,刘海波,杨 燕,陈天虎
合肥工业大学资源与环境工程学院,纳米矿物与环境材料实验室,合肥230009
热活化胶状黄铁矿去除酸性溶液中的Cd(Ⅱ)
朱宇珂,李 平,刘海波,杨 燕,陈天虎*
合肥工业大学资源与环境工程学院,纳米矿物与环境材料实验室,合肥230009
利用XRD和SEM测试方法表征了热活化胶状黄铁矿结构和微观形貌,考察了溶液pH、溶解氧和热活化温度对热活化胶状黄铁矿去除水中Cd(Ⅱ)的影响,并探讨了除Cd(Ⅱ)反应动力学和作用机理。胶状黄铁矿在N2氛围下650℃热活化5min可完全分解生成多孔结构化单斜磁黄铁矿(PMPyr)。在pH 2~6的无氧水溶液中PMPyr除Cd(Ⅱ)效率均达到88%以上,除Cd(Ⅱ)效率受pH影响较小;PMPyr表面氧化会抑制其与Cd(Ⅱ)的反应。PMPyr除Cd(Ⅱ)动力学可用准二级动力学模型拟合(R2>0.9992),结合溶液pH变化趋势、Fe(Ⅱ)和SO42-浓度变化推测,PMPyr除Cd(Ⅱ)机理主要是Fe1-xS和CdS溶度积差异推动了PMPyr与Cd(Ⅱ)交换反应,表面络合属于次要作用。
胶状黄铁矿;热活化;重金属;镉离子;沉淀反应
1 引言
黄铁矿(FeS2)是自然界中数量最多、分布最广的硫化物矿物,作为环保材料一直以来受到高度关注(Yangetal.,2014a)。胶状黄铁矿是沉积作用形成的纳米粒级黄铁矿,在铜陵硫铁矿中有较大的储量。胶状黄铁矿具有纳米特性,表现出比普通黄铁矿更高的化学活性(谢巧勤等,2014;Yang etal.,2016)。研究表明,黄铁矿在惰性气氛下高温热活化可获得化学活性较高的磁黄铁矿(朱晓等,2014;Bhargava etal.,2009),磁黄铁矿本身还具有磁性特征,在环境保护领域具有重要的应用前景(Jeong etal.,2007)。高温热活化胶状黄铁矿可生成纳米级磁黄铁矿,较普通磁黄铁矿更有应用价值(Chen etal.,2013a)。
磁黄铁矿(Fe1-xS)(x=0~0.223,含硫量可达39%~40%)在去除废水中重金属领域已进行了很多研究,国内外对磁黄铁矿除Hg(Ⅱ)、Pb(Ⅱ)、Cd(Ⅱ)、Cu(Ⅱ)等研究均有不少成果(Bone etal., 2014;Yang et al.,2014b;Chen et al.,2013b,2014)。Cd(Ⅱ)作为一种酸性废水中常见的有毒重金属离子,其处理要求日益提高(Erdem etal.,2006)。但目前大多数吸附Cd(Ⅱ)的材料都是在溶液近中性条件下有较好的去除效果(Xuetal.,2013;Ciesielczyk etal.,2015;Valeetal.,2015),酸性条件下对Cd(Ⅱ)的吸附量偏低(Zeng etal.,2015)。本文着重研究热活化胶状黄铁矿生成PMPyr在各影响因素下对Cd(Ⅱ)去除效果和机理,为从酸性废水中除Cd(Ⅱ)新型廉价功能材料的制备提供新的思路。

图1 不同温度热活化胶状黄铁矿XRD图谱(a)和PMPyr SEM图像(b)Fig.1 XRD patternsof colloidalpyrite thermally activated atdifferent temperatures(a)and SEM of PMPyr(b)
2 材料与方法
2.1 热活化实验
实验所用胶状黄铁矿矿石来自安徽铜陵新桥矿山。将矿石研磨过100目筛;用10%盐酸浸泡2 h去除其中的杂质组分,再用超纯水清洗3~4次,真空干燥后密封保存。每次取样6g,平铺放入3 cm×5cm的特制密闭铁盒中,从铁盒一侧小孔以50m L·min-1通入N2,置换铁盒内空气3min,放入温度设置为500℃、550℃、600℃、650℃、700℃、750℃、800℃的马弗炉中热活化5min,然后取出冷却到室温密封保存样品。热活化后样品用XRD(丹东浩圆2700型,铜靶,电压40 kV,电流30mA,扫描速率4O/min)仪进行结构表征,用JSM-6490 LV型扫描电镜观察650℃煅烧生成的PMPyr结构特征。
2.2 除镉实验
配制1 g·L-1Cd(NO3)2溶液,加超纯水稀释到10 mg·L-1,调至不同初始pH值进行除镉实验。取0.1 g样品若干份加入若干个50 mL离心管中,向每个离心管加入Cd(NO3)2溶液至离心管刻度并加盖,放到翻转混合器中反应,按照一定的时间间隔取下二支离心管作为平行样,过0.45μm滤膜,溶液分别用皖仪WYS22000型原子吸收分光光度计检测Cd(Ⅱ)浓度、用721型分光光度计Tfe和Fe(Ⅱ)浓度、皖仪WY6100型离子色谱检测SO42-浓度。做无氧实验时,水为煮沸超纯水,溶液配置好后立即通入N2脱氧,然后定容移至离心管,加上保鲜膜隔离空气后加盖进行实验。
3 实验结果
3.1 样品表征分析
图1a为不同温度热活化胶状黄铁矿XRD图。从XRD图中可以看出,煅烧温度为500℃时胶状黄铁矿开始分解生成磁黄铁矿。600℃时胶状黄铁矿分解尚不完全,当煅烧温度达到650℃时黄铁矿衍射消失,表明在该温度下胶状黄铁矿热分解完全,新生物相的衍射峰较弱、半高宽大,表明产物为结晶度较低的单斜磁黄铁矿。由图1b可以看出,胶状黄铁矿在N2氛围下650℃热活化5min可完全分解形成由纳米-亚微米磁黄铁矿晶体组成,晶体颗粒之间具有纳米-亚微米开放空隙,属于多孔结构化材料,称为多孔结构化单斜磁黄铁矿(Porous Monoclinic Pyrrhotite,PMPyr)。700℃时产物的衍射峰变强,峰位置左偏移,表明700℃时矿物组成由单斜磁黄铁矿转变为六方磁黄铁矿,矿物的结晶度增加(李平等,2013),高于700℃煅烧产物仍显示为六方磁黄铁矿,说明高温下六方磁黄铁矿较为稳定。单斜磁黄铁矿表现出的化学活性比六方磁黄铁矿高(Janzen etal.,2000),因此本文采用PMPyr作为主要材料进行研究。
3.2 影响PMPyr除镉效率的因素
图2a为pH=6,温度为20℃条件下不同温度热活化材料在10mg·L-1Cd(NO3)2溶液中反应48 h后除Cd(Ⅱ)效率。可以看出热活化温度对吸附效果有很大影响。随着热活化温度的升高,矿物除Cd(Ⅱ)效率也在升高,除Cd(Ⅱ)效率最高的热活化温度为650℃。通过图2a中有无溶解氧存在下除Cd(Ⅱ)效率的对比可知,溶解氧对不同温度热活化产物除Cd(Ⅱ)效率有较大的影响。黄铁矿和磁黄铁矿在水溶液中易发生氧化作用生成Fe(Ⅲ)和SO42-(Chinchónetal.,2012;Heideland Tichomirowa, 2011),而PMPyr表面氧化生成的三价铁氢氧化物包覆膜会抑制其进一步与Cd(Ⅱ)的交换反应。无溶解氧条件可以较大程度降低PMPyr的氧化速率,促进PMPyr与Cd(Ⅱ)发生交换反应。无溶解氧条件下PMPyr除Cd(Ⅱ)效率达到95%。
图2b为不同的溶液pH值下初始Cd(Ⅱ)浓度为10mg·L-1在20℃反应48 h后的结果。在不同pH条件下有溶解氧存在时PMPyr除Cd(Ⅱ)效率显著降低,说明酸性条件下PMPyr除Cd(Ⅱ)受溶解氧影响较大。从图2b中还可以看出在pH=2~6范围内无氧水溶液中PMPyr除Cd(Ⅱ)效率都达到88%以上,表明受pH影响较小,随着pH增加除Cd(Ⅱ)效率稍有增加。

图2 不同温度热活化胶状黄矿除Cd(Ⅱ)效率(a)和不同pH下PMPyr除Cd(Ⅱ)效率(b)Fig.2 Removal rateofCd(Ⅱ)atdifferent thermally activated temperaturesof colloidalpyrite(a)and removal rate of Cd(Ⅱ)atdifferentpH of PMPyr(b)
3.3 除镉动力学和机理
根据图2的实验结果可知,在无溶解氧条件下PMPyr除Cd(Ⅱ)效果最佳。因此用PMPyr在无氧水溶液中进行吸附动力学实验。加入初始浓度为10mg·L-1的无溶解氧Cd(NO3)2溶液中,调节初始pH=6,反应温度为20℃,间隔0.5、1、2、6、10、20、48 h取一组平行样,得到图3a中结果。分别用准一级动力学模型和准二级动力学模型对实验结果进行拟合(Ding etal.,2014),得到图3a、3b结果,可以看出准二级动力学模型(R2>0.9992)及准一级动力学模型(R2<0.978)都比较符合实验结果,说明PMPyr除镉是一个化学吸附过程(Wangetal.,2005)。

图3 PMPyr去除Cd(Ⅱ)动力学实验(无溶解氧)Fig.3 Experimental investigation of the dynamic ofCd(Ⅱ)removalby PMPyr(no dissolved oxygen)
图3c为动力学实验过程中不同时段溶液中TFe、Fe(Ⅱ)、SO42-含量的变化图。从图3c中可以看出,反应刚开始进行时Fe(Ⅱ)与TFe浓度迅速增加,并且Fe(Ⅱ)与TFe基本一致,说明溶液中三价铁离子很少,主要是Fe(Ⅱ)。SO42-浓度很缓慢升高,始终维持在较低的浓度。反应平衡后大量Fe(Ⅱ)存在及低浓度的SO42-说明溶液中并未发生明显的氧化反应。FeS的Ksp为1.59×10-19,CdS的Ksp为7.1×10-27(Ni etal.,1998),对比图3a和3c可以看出溶液中Fe(Ⅱ)释放量与Cd(Ⅱ)的去除摩尔量相近(PMyr存在缺位Fe情况),推测Cd(Ⅱ)去除是在溶度积差的推动下PMPyr溶解于水中,S2-溶于水后与Cd(Ⅱ)反应生成CdS沉淀。随着反应时间延长,Cd(Ⅱ)浓度趋于稳定TFe缓慢上升,而Fe(Ⅱ)稍有降低。表明在反应进行到10 h之后空气中氧缓慢扩散进入离心管促使很少量的PMPyr发生氧化,而溶液中的Fe(Ⅱ)也逐渐氧化为Fe(Ⅲ)。
对PMPyr与Cd(Ⅱ)反应前及反应平衡后的固体进行SEM观察和能谱分析(图4)。SEM图像显示反应前后固体形貌在微米尺度上没有显著的变化,仍然保持多孔的颗粒状。能谱分析结果显示,反应前PMPyr中主要成分为Fe、S,而PMPyr与Cd(Ⅱ)反应后的固体探测到了很强的镉能谱峰(图4d),表明有大量含Cd(Ⅱ)化合物被固定在PMPyr表面。
图5为硫离子与Cd(Ⅱ)在不同pH条件水溶液中的存在形式(VisualMINTEQ3.0)。从图中可以看出,酸性条件下硫离子基本上以H2S的形式存在,pH>5.5开始水解生成HS-,而Cd(Ⅱ)在pH>7.5时开始发生水解生成Cd2(OH)3+,本文实验条件为酸性溶液,反应前后溶液pH值<7,Cd(Ⅱ)主要以Cd2+的形式存在。因此,pH<6时溶液中存在的大量Cd(Ⅱ)和H2S发生化学反应可生成CdS沉淀(Erdem and Ozverdi,2006;Lu et al.,2006)。W idler和Seward(2002)研究得出各种磁黄铁矿的pHpzc在pH 2~3左右。当pH>pHpzc时材料表面呈阴性,可吸附阳离子Cd(Ⅱ),结合图2b可知随着pH的不断升高,PMPyr的除Cd(Ⅱ)效率略有增加,说明材料表面与重金属的吸附作用对于去除水中Cd(Ⅱ)也有一定贡献,属于次要作用。金属沉淀反应和材料表面络合反应两者共同作用促使水中Cd(Ⅱ)浓度减少(Bostick and Fendorf,2003)。PMPyr的反应机理总结如下:

4 结论
(1)胶状黄铁矿在N2氛围下650℃热活化5分钟可完全分解为由纳米-亚微米磁黄铁矿晶体组成的多孔材料PMPyr。热活化温度、反应pH值以及溶解氧均对除Cd(Ⅱ)效果有显著影响。在初始浓度为10 mg·L-1、pH 6的无氧水溶液中PMPyr除Cd(Ⅱ)效率达到95%以上。
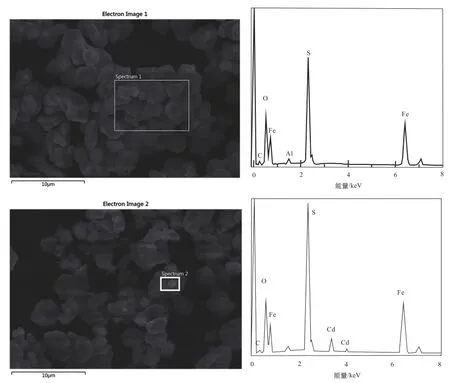
图4 PMPyr与Cd(Ⅱ)反应前后SEM图像和能谱(a、b为反应前,c、d为反应后)Fig.4 The SEM and EDSof the reaction about PMPyr and Cd(Ⅱ)(a,b.before reaction;c,d.after reaction).

图5 不同pH条件下离子分布Fig.5 Ion distribution atdifferentpH levels
(2)在弱酸性无氧溶液中PMPyr除Cd(Ⅱ)机理主要是Fe1-xS微量溶解于水中再与Cd(Ⅱ)发生反应形成CdS,是Fe1-xS与CdS溶度积差异推动的溶解-沉淀反应,PMPyr表面与Cd(Ⅱ)发生络合以及在有氧溶液中Fe1-xS氧化形成铁氢氧化物对Cd(Ⅱ)的滞留是次要的作用。
李平,陈天虎,杨燕,等.2013.氮气保护下热处理胶状黄铁矿的矿物特性演化[J].硅酸盐学报,41(11):1564-1570.
谢巧勤,陈天虎,范子良,等.2014.铜陵新桥硫铁矿床中胶状黄铁矿微尺度观察及其成因探讨[J].中国科学:地球科学,44(12): 2665-2674.
朱晓,陈天虎,颜玲,等.2014.黄铁矿-针铁矿混合无氧焙烧产物物相演变和特性[J].硅酸盐学报,42(11):1435-1440
Bhargava SK,Garg A and Subasinghe N D.2009.In situhigh-temperature phase transformation sutdieson phrite[J].Fuel,88(6):988-993.
Bone S E,Bargar JR and Sposito G.2014.Mackinawite(FeS)reduces mercury(II)under sulfidic conditions[J].Environmental Science& Technology,48(18):10681-10689.
Bostick B C and Fendorf S.2003.Arsenite sorption on troilite(FeS)and pyrite(FeS2)[J].Geochimica&Cosmochimica Acta,67:909-921.
Chen T H,Wang J Z,Wang J,et al.2013a.Phosphorus removal from aqueous solutions containing low concentration of phosphate using pyrite calcinated sorbent[J].International journal of Environmental Scienceand Technology,47(13):1-8.
Chen T H,Yang Y,Chen D,et al.2013b.The structural evolution of heat-treated colloidal pyrite under inert atmosphere and its application for the purification of Cu(II)ion from wastewater[J].Environmental Engineering&Management Journal,12(7):1411-1416.
Chen T H,Yang Y,Li P,et al.2014.Performance and characterization of calcined colloidal pyrite used for copper removal from aqueous solutions in a fixed bed column[J].International Journal of Mineral Processing,130:82-87.
Chinchón A,Aguado A and Chinchón S.2012.A comparative investigation of the degradation of pyrite and pyrrhotite under simulated laboratory conditions[J].EngineeringGeology,127:75-80.
Ciesielczyk F,Bartczak P and Jesionowski T.2015.A comprehensive study of Cd(II)ions removal utilizing highsurface-area binary Mg-Si hybrid oxide adsorbent[J].Environmental Science&Technology,12: 3613-3626.
Ding C C,Cheng W C,Sun Y B,et al.2014.Determination of chem ical affinity of graphen oxide nanosheets with radionuclides investigated by macroscopic,spectroscopic and modeling techniques[J].Dalton Transactions,43:3888-3896.
Erdem M and Ozverdi A.2006.Kinetics and thermodynamics of Cd(II) adsorption onto pyrite and synthetic iron sulphide[J].Separation and Purification Technology,51:240-246.
Heidel C and TichomirowaM.2011.The isotopic composition of sulfate from anaerobic and low oxygen pyrite oxidation experimentswith ferric iron: New insights into oxidation mechanisms[J].Chemical Geology,281 (3-4):305-316.
Janzen M P,Nicholson R V and Scharer J M,2000.Pyrrhotite reaction kinetics:Reaction rates for oxidation by oxygen,ferric iron,and for nonoxidative dissolution[J].Geochimica&Cosmochimica Acta,64(9): 1511-1522.
Jeong H Y,Kim H and Hayes K F.2007.Reductive dechlorination pathways of tetrachloroethylene and trichloroethylene and subsequent transformation of their dechlorination products bymackinawite(FeS)in the presence of metals[J].Environmental Science&Technology,41: 7736-7743.
Lu A,Zhong S,Chen J,et al.2006.Removal of Cr(VI)and Cr(III)from aqueous solutions and industrialwastewaters by natural clino-pyrrhotite [J].EnvironmentalScience&Technology,40:3064-3069.
Ni JA,Zhang JQ and Shang SM,1998.Inorganic and Analytical Chemistry [M].Chemical Industry Press,China.
Vale G,Franco C,Brunnert A M,et al.2015.Adsorption of cadmium on titanium dioxide nanoparticles in freshwater conditions:a chemodynamic study[J].Electroanalysis,27(10):2439-2447.
Wang X K,Chen C L,HuW P,etal.2005.Sorption of243Am(III)tomultiwall carbon nanotubes[J].Environmental Science&Technology,39: 2856-2860.
W idler A M and Seward TM.2002.The adsorption of gold(I)hydrosulphide complexes by iron sulphid surfaces[J].Geochimica&Cosmochimica Acta,66:383-402.
Xu X Y,Cao X D,Zhao L,et al.2013.Removal of Cu,Zn,and Cd from aqueous solutions by the dairy manure-derived biochar[J]. EnvironmentalScienceand Pollution Research,20:358-368.
Yang ZW,Kang M L,Ma B,et al.2014a.Inhibition of U(VI)reduction by synthetic and natural pyrite[J].Environmental Science&Technology, 48(18):10716-10724.
Yang Y,Chen T H,Li P,et al.2014b.Removal and recovery of Cu and Pb from single-metaland Cu-Pb-Cd-Znmulti-metal solutions bymodified pyrite:fixed bed columns[J].Industrial&Engineering Chemistry Research,53:18180-18188.
Yang Y,Chen T H,Li P,et al.2016.Immobilization of copper under an acid leach of colloidal pyrite waste rocks by a fixed-bed column[J]. EnvironmentalEarth Sciences,75:205-213.
Zeng L X,Chen Y F,Zhang Q Y,et al.2015.Adsorption ofCd(II),Cu(II)and Ni(II)ions by cross-linking chitosan/rectorite nano-hybrid composite microspheres[J].Carbohydrate Polymers,130:333-343.
Performanceof Thermally Activated ColloidalPyrite in Rem ovalof Cadm iun(Ⅱ)in Acid Solution
ZHU Yuke,LIPing,LIU Haibo,YANG Yan,CHEN Tianhu*
SchoolofResourcesand Environmental Engineering,HefeiUniversity of Technology,NanoMineralsand EnvironmentMaterials Laboratory,Hefei230009,China
The thermally activated colloidal pyritewas characterized by XRD and SEM.The effectof solution pH,dissolved oxygen,and thermal activation temperatures on the performance of thermally activated colloidal pyrite on removal of Cd(Ⅱ)from aqueous solution were systematically studied.The reactive kinetics and themechanism of the adsorption of Cd(Ⅱ)on thermally activated colloidal pyrite were also discussed.Colloidal pyrite was decomposed into Porous Monoclinic Pyrrhotite(PMPyr)after thermal activation at 650℃for 5m inutes in amuffle furnace(nitrogen atmosphere).The removalefficiency of Cd(Ⅱ)by PMPyr in the solution of no dissolved oxygen was above 88%at pH 2~6,suggesting that the removal efficiency of Cd(II)was less affected by pH.Moreover, surface oxidation of PMPyr could restrain the interaction between PMPyr and Cd(Ⅱ).The kinetic adsorption process was well described by pseudo-second-order model with high correlation coefficient(R2>0.9992).The influence of pH and change of concentration of Fe(Ⅱ)and SO42-showed that the adsorption of Cd(Ⅱ)on PMPyrwasmainly dominated by ion exchange and surface complexation.
colloidalpyrite;thermalactiation;heavymetals;Cd(Ⅱ);precipitate reaction
CHEN Tianhu,Professor;E-mail:chentianhu168@vip.sina.com
P599;618.31
A文献标识码:1006-7493(2016)04-0638-06
10.16108/j.issn1006-7493.2015258
2016-01-08;
2016-04-23
国家自然科学基金(41402029;41072035)
朱宇珂,女,1992年生,硕士,环境工程专业;E-mail:arryanna@163.com
*通讯作者:陈天虎,1962年生,教授,主要从事环境矿物、纳米矿物材料、环境工程材料方面的研究;E-mail:chentianhu168@vip.sina.com
