混合气体在水溶液中的溶解度计算模型
2017-01-10张路,孙睿
张 路,孙 睿
大陆动力学国家重点实验室,西北大学地质学系,西安710069
混合气体在水溶液中的溶解度计算模型
张 路,孙 睿*
大陆动力学国家重点实验室,西北大学地质学系,西安710069
该文将段振豪及合作者建立的单气体溶解度模型推广到混合气体系,建立了能够计算CO2-CH4-N2-C2H6-H2S混合气体在电解质水溶液中溶解度的热力学模型。本模型将DMW 92方程扩展到上述多组分混合气体系并使用其计算气体组分的逸度系数,采用Pitzer活度系数模型描述液相并沿用段振豪及合作者以前确定的纯CO2、CH4、C2H6和H2S的溶解度模型参数,而纯N2的溶解度模型参数由本研究确定。由于本模型不包含依赖混合气体溶解度实验数据确定的参数,因此对混合气体溶解度的计算是预测性的。通过与实验数据的对比,证实了本模型能够在宽广的温度、压力范围内准确预测CO2-CH4-N2-C2H6-H2S混合气体在水溶液中的溶解度(对于CO2和CH4的摩尔百分数超过90%的混合气体,本模型适用于273~523K和0~2000×105Pa的温压范围)。本模型的计算表明,相对于纯CO2气相,少量CH4、N2或H2S的加入会降低CO2的溶解度。对于CO2-H2O-NaCl型流体包裹体,少量CH4的加入会增大流体包裹体的均一压力。相关的计算程序可从通讯作者处获得。
溶解度;模型;混合气体;水溶液;CO2
1 引言
地质流体是地球内部进行物质迁移和能量传输的最活跃媒介(Fyfe etal.,1978;刘丛强,2005;卢焕章,2011)。CO2和CH4是地质流体中最主要的气体组分,而H2S、N2、C2H6也是常见的气体组分(Roedder,1984;卢焕章等,2004)。了解CO2、CH4、N2、H2S等气体在电解质水溶液中的溶解度对于热液矿床流体包裹体分析等地球化学研究有着重要的作用(刘斌和沈昆,1999;Chietal.,2003;张月沙和毛世德,2015)。
另一方面,CO2是最重要的温室气体。CO2的分离和封存是缓解全球气温升高的重要途径,将CO2注入地层卤水或枯竭的油气藏中是可行的CO2地质储存方案(Spycher etal.,2003;沈平平和廖新维,2009;王焰新等,2011)。由于从烟道气(指煤等化石燃料燃烧时所产生的对环境有污染的气态物质)中分离出的CO2气体中含有少量的N2、H2S等杂质气体,准确计算CO2-CH4-N2-H2S混合气体在电解质水溶液中的溶解度对于CO2地质储存研究是必不可少的(Bachu and Adams,2003;Xu et al., 2007;朱宁军等,2011;郑菲等,2012)。
对于CO2、CH4、N2、H2S等气体在纯水及电解质水溶液中溶解度的计算,从二十世纪八十年代起,前人提出了许多适用于较宽广的温度、压力范围(大多数单组分气体溶解度模型适用的温压范围不超过273~473 K,0~1000×105Pa)的气体溶解度模型(Liand Nghiem,1986;徐英年和胡英, 1987;徐英年等,1987;Harvey and Prausnitz,1989;左有祥和郭天民,1990,1991;Zuo and Guo,1991; Søreide and Whitson,1992;付晓泰等,1996,2000;Li etal.,1997;Wu and Prausnitz,1998;Gao et al.,1999; Spycher et al.,2003;Ji et al.,2005;Li and Firoozabadi,2009;Yan et al.,2009;Akinfiev and Diamond,2010;Sun and Dubessy,2010,2012;Ji and Zhu,2012,2013;Springer et al.,2012;Tan et al., 2013;Courtial et al.,2014;Sun et al.,2014; Venkatraman etal.,2014;Wang etal.,2014;Lietal., 2015a;侯大力等,2015)。这些模型可分为两类,即γ(活度系数)-φ(逸度系数)模型和φ-φ模型。第一类模型采用活度系数模型处理水溶液相,采用状态方程描述气相;第二类模型采用某一状态方程同时描述气相和液相的热力学性质。后者的理论基础更严格,能够计算包括溶解度在内的多种热力学性质;而前者往往专为气体溶解度的计算而设计。对于气体在水溶液中的溶解度的准确模拟,第二类模型需要较复杂的形式,而第一类模型的形式相对较简单,更易于应用。前人建立的气体溶解度模型中采用的状态方程大多是立方型状态方程(如PR方程),导致模型在超过500巴的高压条件下的精度下降。段振豪及合作者(Duan etal.,1992a;Duan and Sun,2003;Mao et al.,2005;Duan and Mao,2006;Duan etal.,2007)采用高精度的维里型状态方程描述气相,并首次采用Pitzer模型(Pitzeretal.,1984)计算气体组分在水溶液相中的活度系数,建立了适用的温度压力范围更宽广、计算精度更高的气体溶解度模型(适用于CO2、CH4、C2H6和H2S等纯气体,其中CO2和CH4溶解度模型适用于273~523 K,0~2000×105Pa的温度、压力范围,计算精度与实验数据的偏差相当)。
需要注意的是,大多数溶解度模型(包括段振豪及合作者建立的溶解度模型)只能计算单组分气体在水溶液的溶解度。近年来,一些研究者建立了能够计算混合气体溶解度的模型。例如Zirrahi等(2012)及Ziabakhsh-Ganji和Kooi(2012)采用PR方程(Peng and Robinson,1976)描述气相,采用Pitzer模型计算液相中气体组分的活度系数,分别建立了计算CO2—CH4—H2S—卤水和CO2—CH4—N2—H2S—SO2—卤水体系中气体溶解度的模型。Venkatraman等(2014)采用PR方程描述气相,采用NRTL活度系数模型(Renonand Prausnitz,1968)处理液相,建立了计算CO2—H2S混合气体在纯水中的溶解度的模型。这三个模型适用的温度上限不超过400K,压力上限不超过800×105Pa。另外Li等(2015b)基于PR方程开发了计算CO2—CH4—H2S混合气体在NaCl水溶液中的溶解度的模型。该模型对气相和液相采用不同的交互作用系数(校正不同种类的气体分子间的相互作用的状态方程参数),并采用经验方法考虑NaCl对气体溶解度的影响。总的来说,上述模型能够基本满足CO2地质储存研究的需求,但是不能满足更高的温度、压力条件下的地球化学研究的需求。
本研究旨在将段振豪及合作者建立的单组分气体溶解度模型扩展到混合气体系,使其能够准确计算CO2—CH4—N2—C2H6—H2S混合气体在电解质水溶液中的溶解度。本文第二部分阐述混合气体溶解度模型的计算原理,第三部分介绍模型的验证和应用。
2 混合气体溶解度模型原理
根据热力学原理,当气体溶于水溶液中达到溶解平衡时,每个气体组分在水溶液相中的化学势()和其在气相中的化学势()相等。和的表达式分别为:

在公式(1)和(2)中,i代表任一气体组分,T表示温度(K),P表示压力×105Pa,y表示气体组分在气相中的摩尔分数,f表示逸度,φ表示逸度系数,m表示溶质在水溶液相的质量摩尔浓度(mol/ kg),a表示活度,γ表示活度系数。μiV(0)表示气体组分在气相中的标准态化学势,即气体处于假想的压力等于1×105Pa的理想气体状态时的化学势;表示气体组分在溶液相中的标准态化学势,即假想的溶解气体浓度等于1mol/kg的理想稀溶液中的化学势。
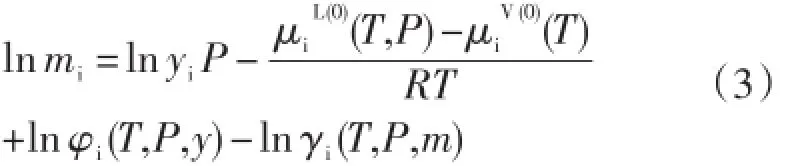
气体组分在气相中的逸度系数φi根据Duan等(1992b,1992c)建立的维里型状态方程(DMW92方程)计算。由于平衡时气相中仅含有少量的水蒸气,气体组分在含水的二元气相混合物中的逸度系数与其在温度压力相同的纯气相中的逸度系数相差很小,因此段振豪及合作者(Duan etal., 1992a;Duan and Sun,2003;Mao et al.,2005;Duan and Mao,2006;Duan et al.,2007)在构建CH4、CO2、C2H6和H2S等纯气体的溶解度模型时分别采用描述纯气体的DMW 92方程来计算相应气体的逸度系数。
需要注意的是,在计算yi时仍需考虑气相中水的存在。Duan等(1992a)假设气相中水的分压等于相同温度压力下纯水的蒸汽压(即假设气相遵守拉乌尔定律)。虽然不太准确,但由于水的分压值较小,给计算yi带来的误差一般可忽略。另外上述两个假定带来的误差可在模型的参数化过程中抵消。
气体在液相的活度系数γi采用Pitzer活度系数模型(Pitzeretal.,1984)来计算

由公式(5)可知,气体溶解度mi是与差值的函数,与μLi或μVi的具体数值无关,因此为了简化模型,Duan等(1992a)假设μVi等于零。因此,公式(5)变成

公式(6)中,所有的λ,ζ和无量纲的标准化学势μL(0)iRT通过拟合相应气体在纯水中的溶解度数据确定,而λ,ζ则通过回归相应气体在NaCl水溶液中的溶解度来确定。段振豪及合作者(Duan et al.,1992a;Duan and Sun,2003;Mao et al.,2005;Duan and Mao,2006;Duan et al.,2007)分别确定了CH4、CO2、C2H6和H2S的标准化学势及与钠离子、氯离子的二阶相互作用参数λ及三阶相互作用参数ζ。由于上述气体在除NaCliRT都是温度、压力的函数,这些参数通过回归纯气体的溶解度实验数据确定。具体来说,各种气体的μL(0)
公式(4)中,λ是离子与溶解气体的二阶相互作用参数,ζ是阳离子、阴离子及溶解气体的三阶相互作用参数,下标a代表阴离子,c代表阳离子。

将公式(4)代入公式(3)可得以外的电解质水溶液中的溶解度实验数据的缺乏,无法准确求取这些气体与Na+、Cl-以外的其它离子的相互作用参数,段振豪及合作者采用近似方法来处理。
因为溶解度模型中不包含两种或两种以上气体组分之间的相互作用参数,笔者认为,采用混合气体状态方程计算气体组分的逸度系数,即可依据公式(6)计算混合气体在水溶液中的溶解度。也就是说,在沿用Duan和Sun(2003)、Mao等(2005)、Duan和Mao(2006)和Duan等(2007)的研究工作确定的CO2、CH4、H2S等单组分气体的溶解度模型参数(包括RT、λ和ζ)的基础上,只要将DMW92方程推广到CO2-CH4-N2-C2H6-H2S体系,即可将段振豪及合作者建立的纯气体溶解度模型扩展到混合气体体系。为了使DMW 92方程能够准确计算CO2-CH4-N2-C2H6-H2S体系中组分的逸度系数,需要确定CH4、CO2、N2等纯组分的方程参数以及不同组分间的交互作用系数。Duan等(1992b,1992c)确定了纯CH4和纯CO2的状态方程参数,Mao等(2005)和Duan等(2007)分别确定了纯C2H6和纯H2S的DMW 92方程参数。本研究依据N2体系的PVT数据确定了纯N2的DMW 92方程参数(见表1),使用这些参数,扩展的DMW92方程能够准确计算纯N2在173-1273 K和0~3000×105Pa的温度、压力范围内的PVT性质,与实验数据的平均偏差仅为0.15%。另外,本研究依据CH4-C2H6、CO2-N2、CO2-H2S等二元混合气体系的气-液相平衡和PVTx数据回归了不同气体组分之间的交互作用参数(表2)。对于以CH4和CO2为主的CO2-CH4-N2-C2H6-H2S混合气体,扩展的DMW92方程适用于273~673K,0~3000×105Pa的温度、压力范围。

表1 本研究确定的纯N2的DMW 92状态方程参数Table1 DMW 92EOSparameters for pure N2determined in this study

表2 本研究确定的DMW 92方程中不同分子间的交互作用系数Table2 Binary parametersofDMW92EOS for variousmolecularpairsdetermined in thisstudy

表3 本研究确定的纯N2的溶解度模型参数Table3 SolubilitymodelparametersforN2determined in thisstudy
需要说明的是,Sun等(2001)建立的N2溶解度模型虽然原理与本模型相似,但是它采用的状态方程并非DMW 92方程,因此该模型确定的溶解度模型参数/RT、λN2-Na和ζN2-Na-Cl不能移植到本模型中。本研究采用DMW92方程计算φN2,重新回归了溶解度模型参数,这些参数随温度压力变化的函数形式如下:


表4 气体溶解度模型适用的温度、压力和盐度范围及参数来源Table4 P-T-mNaClrangesofgassolubilitymodelsand sources of parameters
3 模型验证与应用
根据吉布斯相律,包含n种气体组分的气相与水溶液处于两相平衡时的自由度为n+1,这意味着当温度、压力以及气相中各种气体的浓度比都确定时,混合气体的溶解度才能确定。因为本模型采用近似方法计算与溶液平衡的气相中的水含量yH2O,所以应用本模型时输入的是扣除水含量后的气相中各种气体的浓度yi0,在应用DMW92方程计算气体组分的逸度系数时依据的也是yi0。但如前所述,公式(6)中yi的计算式中仍需考虑水含量,即yi与yi0的换算关系为

公式(9)中的PH2O表示水的分压。如前所述,本模型假设PH2O等于相同温度压力下纯水的蒸汽压。
因为无需依赖混合气体系的溶解度数据确定溶解度模型的参数,所以本模型对于混合气体在水溶液中的溶解度的计算是预测性的。为了检验本模型的预测效果,下文将本模型的计算结果与CH4-CO2、CH4-C2H6、N2-CO2等混合气体系现有的溶解度实验数据进行了比较。
图1将本模型对CO2-CH4混合气体在纯水中的溶解度的计算结果与Dhima等(1999)和Qin等(2008)测定的实验数据进行了对比。可以看出,本模型能够准确预测CO2-CH4混合气体在水溶液中的溶解度。CO2溶解度及CH4溶解度的计算值与实验数据(温度压力范围:324~376K,0~1000×105Pa)的平均偏差分别为2.66%和8.24%。
图2将本模型对CH4-C2H6混合气体在纯水中的溶解度的计算结果与Dhima等(1998)测定的实验数据进行了对比。同样的,本模型的预测结果与实验数据吻合良好。CH4溶解度及C2H6溶解度的计算值与实验数据的平均偏差分别为4.79%和6.65%。
图3显示本模型能够准确预测CO2-N2混合气体在水溶液中的溶解度。CO2溶解度及N2溶解度的计算值与Liu等(2012)报道的实验数据的平均偏差分别为2.46%和4.94%。
由图1、2和3可以看出,混合气体系中气体组分在水溶液中的溶解度随温度压力的变化规律与纯气体在水溶液中的溶解度随温度压力的变化规律一致。在给定的温度和总压力下,气体组分在水溶液中的溶解度随其在气相中的含量的增大而增大。本模型能够准确预测混合气体系中气体组分的溶解度随温度、压力和气相组成变化的规律。当然,现有的混合气体系溶解度的实验数据数量偏少,需要更多的实验数据(特别是混合气体在电解质水溶液中的溶解度数据)来检验本模型在更宽广的温度压力范围内的可靠性。考虑到本模型采用的参数能够在宽广的温度压力范围内准确计算CO2、CH4、N2等纯气体在纯水、NaCl水溶液及卤水中的溶解度,并且本模型不包含依赖混合气体溶解度数据确定的参数,我们相信本模型能够比较可靠地预测混合气体在宽广的温度压力范围内的溶解度(对于CO2和CH4的摩尔百分数超过90%的混合气体,本模型适用于273~523 K和0~2000×105Pa的温压范围)。
如前所述,从烟道气中分离出的CO2气体常含有少量N2、H2S等杂质气体。作为示例,图4显示了当气相由纯CO2变成掺入10%摩尔百分数的CH4、N2或H2S的混合气体后,CO2溶解度的变化。本模型的计算表明,在保持CO2分压相同的前提下,少量CH4、N2或H2S的加入会降低CO2的溶解度。其中N2和CH4的降低效应大致相同,而H2S的降低效应略小。
本模型可用于计算CO2-H2O-NaCl型流体包裹体的均一压力。其计算原理是依据显微测温及激光拉曼光谱等成分分析方法确定的包裹体的均一温度(Th)、盐度和气体组分含量数据,应用本模型计算具有确定组成的溶液在给定温度Th时的饱和压力,此即流体包裹体的均一压力。表5给出一些计算示例。可以看出,在均一温度和盐度相同的条件下,包裹体中的气体由纯CO2变成含10%摩尔百分数CH4的CO2-CH4混合气体(气体总含量不变)时,均一压力将增大20%~35%。这是因为在相同的温度、压力和盐度条件下CH4在水溶液中的溶解度低于CO2。N2在水溶液中的溶解度的量值与相同温度、压力及盐度条件下的CH4相近,因此气相中少量N2对均一压力的影响与CH4相似。
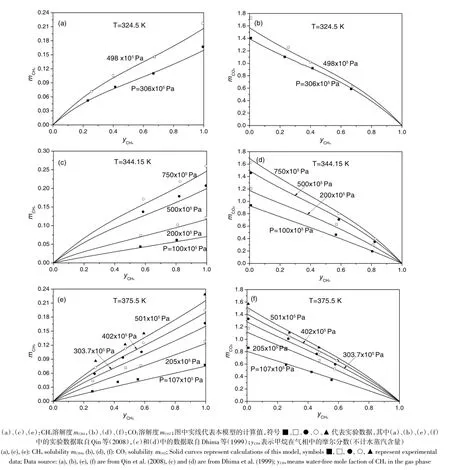
图1 CH4-CO2混气体在纯水中的溶解度计算值与实验数据的对比Fig.1 Comparison ofcalculationsof thismodel forsolubilitiesof theCH4-CO2mixture inwaterwith experimentaldata

表5 增加CH4对CO2-H2O-NaCl流体包裹体均一压力的影响Table 5 The influence of CH4added on homogenization pressuresofCO2-H2O-NaCl fluid inclusions

图2 CH4-C2H6混合气体在纯水中的溶解度Fig.2 Solubilitiesof the CH4-C2H6mixture inwater

图3 N2-CO2混合气体在纯水中的溶解度Figure3 Solubilitiesof the N2-CO2mixture inwater

图4 CH4、N2和H2S对CO2溶解度的影响Fig.4 The influence of CH4,N2and H2Son solubilitiesofCO2in water.All curves represent calculationsof thismodel.
4 结论
通过扩展DMW92方程并使用其计算CO2-CH4-N2-C2H6-H2S体系中组分的逸度系数,本研究将段振豪及合作者建立的纯气体溶解度模型推广到混合气体系。本模型沿用以前确定的纯CO2、CH4、C2H6和H2S的溶解度模型参数,而纯N2的溶解度模型参数由本研究确定。本模型不包含依赖混合气体溶解度实验数据确定的参数,因此对混合气体溶解度的计算是预测性的。通过与实验数据的对比,证实了本模型能够在宽广的温度压力范围内准确预测CO2-CH4-N2-C2H6-H2S混合气体在水溶液中的溶解度(对于CO2和CH4的摩尔百分数超过90%的混合气体,本模型适用于273~523 K和0~2000×105Pa的温压范围)。本模型的计算表明,相对于纯CO2气相,少量CH4、N2、C2H6或H2S的加入会降低CO2的溶解度。另外,对于CO2-H2O-NaCl型流体包裹体,少量CH4和N2的加入会增大流体包裹体的均一压力。当然,仍然需要更多的实验数据(尤其是混合气体在电解质水溶液中的溶解度数据)来进一步验证本模型。
(
):
付晓泰,王振平,卢双舫.1996.气体在水中的溶解机理及溶解度方程[J].中国科学,26(2):124-130.
付晓泰,王振平,卢双舫,等.2000.天然气在盐溶液中的溶解机理及溶解度方程[J].石油学报,21(3):89-94.
侯大力,罗平亚,王长权,等.2015.高温高压下CO2在水中溶解度实验及理论模型[J].吉林大学学报:地球科学版,45(2):564-572.刘斌,沈昆.1999.流体包裹体热力学[M].北京:地质出版社:290.
刘丛强.2005.地质流体作用地球化学最新进展[C]//张本仁,傅家谟.地球化学进展.北京:化学工业出版社:276-308.
卢焕章.2011.地球中的流体[M].北京:高等教育出版社:354.
卢焕章,范宏瑞,倪培,等.2004.流体包裹体[M].北京:科学出版社:487.
沈平平,廖新维.2009.二氧化碳地质埋存与提高石油采收率技术[M].北京:石油工业出版社:239.
王焰新,毛绪美,DePaolo D.2011.CO2地质储存的纳米尺度流体—岩石相互作用研究[J].地球科学,36(1):163-171.
徐英年,胡英.1987.气体溶解度的分子热力学(III)气体在1-1价电解质溶液中的Henry常数[J].化工学报,38(2):146-155.
徐英年,胡英,刘国杰.1987.气体溶解度的分子热力学(II)气体在极性溶剂中的Henry常数[J].化工学报,38(2):137-145.
张月沙,毛世德.2015.常见含水流体包裹体体系pH值的程序计算[J].高校地质学报,21(1):43-49.
郑菲,施小清,吴吉春,等.2012.苏北盆地盐城组咸水层CO2地质封存泄漏风险的全局敏感性分析[J].高校地质学报,18(2): 232-238.
朱宁军,宋永臣,张毅,等.2011.地质封存中CO2溶解度的测量与模型研究进展[J].环境科学与技术,34(3):162-166.
左有祥,郭天民.1990.天然气在水中的溶解度计算II.应用到多元系统[J].石油学报,6(3):95-100.
左有祥,郭天民.1991.气体在电解质水溶液中的溶解度计算[J].石油学报,7(1):88-95.
Akinfiev N N and Diamond LW.2010.Thermodynamic model of aqueous CO2-H2O-NaCl solutions from-22 to 100oC and form 0.1 to 100 Mpa [J].Fluid Phase Equilibria,295:104-124.
Bachu S and Adams J J.2003.Estimating CO2sequestration capacity in solution in deep saline aquifers[J].Energy Conversion and Management,44(20):3151-3175.
ChiGX,Chou IM and Lu H Z.2003.An overview on current fluid-inclusion research and applications[J].Acta Petrologica Sinica,19(2):201-212.
Courtial X,Ferrando N,de Henptinne J C,et al.2014.Electrolyte CPA equation of state for very high temperature and pressure reservoir and basin applications[J].Geochimica etCosmochimica Acta,142:1-14.
Dhima A,de Hemptinne JC and Jose J.1999.Solubility of hydrocarbonsand CO2mixtures in water under high pressure[J].Industrial& Engineering Chemistry Research,38(8):3144-3161.
Dhima A,de Hemptinne J C,and Moracchini G.1998.Solubility of light hydrocarbons and their mixtures in pure water under high pressure [J].Fluid Phase Equilibria,145:129-150.
Duan Z and Mao S.2006.A thermodynamic model for calculating methane solubility,density and gas phase composition of methane-bearing aqueous fluids from 273 to 523 K and from 1 to 2000 bar[J]. Geochimica etCosmochimica Acta,70(13):3369-3386.
Duan Z,Moller N,Greenberg J,et al.1992a.The prediction of methane solubility in naturalwaters to high ionic strength from 0 to 250 C and from 0 to 1600 bar[J].Geochimica et Cosmochimica Acta,56(4): 1451-1460.
Duan Z,Moller N and Weare J H.1992b.An equation of state for the CH4-CO2-H2O system:I.Pure systems for 0 to 1000 C and 0 to 8000 bar[J].GeochimicaetCosmochimica Acta,56(7):2605-2617.
Duan Z,Moller N and Weare J H.1992c.An equation of state for the CH4-CO2-H2O system:II.Mixture from 50 to 1000 C and 0 to 1000 bar[J].GeochimicaetCosmochimica Acta,56:2619-2631.
Duan Z and Sun R.2003.An improved model calculating CO2solubility in pure water and aqueous NaCl solutions from 273 to 533 K and from 0 to2000 bar[J].ChemicalGeology,193(3-4):257-271.
Duan Z,Sun R,Liu R,et al.2007.Accurate thermodynamic model for the calculation of H2S solubility in pure water and brines[J].Energy& Fuels,21:2056-2065.
Fyfe W S,Price N Jand Thompson A B.1978.Fluids in the Earth's Crust [M].Amsterdam:Elsevier,383.
GaoGH,Tan ZQ and Yu Y X.1999.Calculation ofhigh-pressure solubility of gas in aqueous electrolyte solution based on non-primitive mean spherical approximation and perturbation theory[J].Fluid Phase Equilibria,165(2):169-182.
Harvey A H and Prausnitz JM.1989.Thermodynamics of high-pressure aqueous systems containing gases and salts[J].AIChE Journal,3(4):635–644.
Ji X,Tan S P,Adidharma H,et al.2005.SAFT1-RPM approximation extended to phase equilibria and densities of CO2-H2O and CO2-H2O-NaCl systems[J].Industrial&Engineering Chemistry Research, 44(22):8419-8427.
Ji X and Zhu C.2012.A SAFT equation of state for the quaternary H2SCO2-H2O-NaCl system[J].Geochimica etCosmochimica Acta,91(5): 40-59.
Ji X and Zhu C.2013.Predicting possible effects of H2S impurity on CO2transportation and geological storage[J].Environmental Science& Technology,47:55-62.
Li J,Vanderbeken I,Ye S,et al.1997.Prediction of the solubility and gas-liquid equilibria for gas-water and light hydrocarbon-water systems at high temperatures and pressures with a group contribution equation of state[J].Fluid Phase Equilibria,131(1):107-118.
Li J,Zhang Z,Luo X,et al.2015a.Modelling of phase equilibria in CH4-C2H6-C3H8-n C4H10-NaCl-H2O systems[J].Applied Geochemistry, 56:23-36.
Li J,Wei L and Li X.2015b.An improved cubic model for the mutual solubilities of CO2-CH4-H2S-brine systems to high temperature, pressure and salinity[J].Applied Geochemistry,54:1-12.
LiY K and Nghiem L X.1986.Phase equilibria of oil,gas and water/brine mixtures from a cubic equation ofstateand Henry’s law[J].Canadian JournalofChemicalEngineering,64(3):486–496.
Li Z and Firoozabadi A.2009.Cubic-plus-association equation of state for water-containing mixtures:Is“cross association”necessary?[J] AIChEJournal,55(55):1803-1813.
Liu Y,Hou M,Ning H,et al.2012.Phase equilibria of CO2+N2+H2O and N2+ CO2+H2O+NaCl+KCl+CaCl2systems at different temperatures and pressures[J].Journal of Chem ical&Engineering Data,57(7): 1928-1932.
Mao S,Zhang Z,Hu J,et al.2005.An accuratemodel for calculating C2H6solubility in pure water and aqueous NaCl solutions[J].Fluid Phase Equilibria,238(1):77-86.
Peng D Y and Robinson D B.1976.A new two constant of equation[J]. Industrial&Engineering Chem istry Fundamentals,15(1):59–64.
Pitzer K S,Peiper JC and Busey R H.1984.Thermodynamic properties of aqueous sodium chloride solutions[J].Journal of Physical& Chemical Reference Data,13(1):1-102.
Qin J,Rosenbauer R Jand Duan Z.2008.Experimentalmeasurements of vapor-liquid equilibria of the H2O+CO2+CH4ternary system[J]. JournalofChemical&EngineeringData,53(6):1246-1249.
Renon H and Prausnitz JM.1968.Local compositions in thermodynamic excess functions for liquid mixtures[J].AIChE Journal,14(1): 135-144.
Roedder E.1984.Fluid inclusion[M]//Reviews in Mineralogy,12. Mineralogical Society of America:644.
Søreide I and Whitson C H.1992.Peng-Robinson predictions for hydrocarbons,CO2,N2and H2S with pure water and NaCl brine[J]. Fluid Phase Equilibria,77:217–240.
Springer R D,Wang Z,Anderko A,et al.2012.A thermodynamic model for predictingmineral reactivity in supercritical carbon dioxide:I.Phase behavior of carbon dioxide-water-chloride salt systems across the H2O-rich to the CO2-rich regions[J].Chemical Geology,322-323: 151-171.
Spycher N,Pruess K and Ennis-King J.2003.CO2-H2O mixtures in the geological sequestration of CO2.I.Assessment and calculation of mutual solubilities from 12 to 100 oC and up to 600 bar[J]. GeochimicaetCosmochimicaActa,67(16):3015-3031.
Sun R and Dubessy J.2010.Prediction of vapor-liquid equilibrium and PVTx properties of geological fluid system with SAFT-LJEOS including multi-polar contribution.Part I.Application to H2O–CO2system[J]. GeochimicaetCosmochimicaActa,74(7):1982-1998.
Sun R and Dubessy J.2012.Prediction of vapor-liquid equilibrium and PVTx properties of geological fluid system with SAFT-LJ EOS including multi-polar contribution.Part II.Application to H2O-NaCl and CO2-H2O-NaCl System[J].Geochimica et Cosmochimica Acta,88: 130-145.
Sun R,Hu W and Duan Z.2001.Prediction of nitrogen solubility in pure water and aqueous NaCl solutions up to high temperature,pressure, and ionic strength[J].Journalof Solution Chemistry,30(6):561-573.
Sun R,Lai S and Dubessy J.2014.Calculation of vapor-liquid equilibrium and PVTx properties of geological fluid system with SAFT-LJ EOS including multi-polar contribution.Part III.Extension to water-light hydrocarbons systems[J].Geochimica et Cosmochim ica Acta,125: 504-518.
Tan S P,Yao Y and Piri M.2013.Modeling the solubility of SO2+CO2mixtures in brine at elevated pressures and temperatures[J]. Industrial&Engineering Chemistry Research,52(52):10864-10872.
Venkatraman A,Lake L W and Johns R T.2014.Gibbs free energy minimization for prediction of solubility of acid gases in water[J]. Industrial&Engineering Chemistry Research,53:6157-6168.
Wang L,Shen Z,Hu L,et al.2014.Modeling and measurement of CO2solubility in salty aqueous solutions and application in the Erdos basin[J].Fluid Phase Equilibria,377:45-55.
Wu J and Prausnitz JM.1998.Phase equilibria for systems containing hydrocarbons,water and salt:An extended Peng-Robinson equation of state[J].Industrial&Engineering Chemistry Research,37(5): 1634-1643.
Xu T,Apps JA,Pruess K,etal.2007.Numericalmodeling of injection and mineral trappingofCO2with H2Sand SO2in a sandstone formation[J]. ChemicalGeology,242:319-346.
Yan W,Kontogeorgis G M and Stenby E H.2009.Application of the CPA equation of state to reservoir fluids in presence of water and polar chemicals[J].Fluid Phase Equilibria,276:75-85.
Ziabakhsh-Ganji Z and Kooi H.2012.An equation of state for thermodynamic equilibrium of gas mixtures and brines to allow simulation of the effects of impurities in subsurface CO2storage[J]. International JournalofGreenhouse Gas Control,11s:S21-S34.
Zirrahi M,Azin R,Hassanzadeh H,et al.2012.Mutual solubility of CH4, CO2,H2S,and their m ixtures in brine under subsurface disposal conditions[J].Fluid Phase Equilibria,324:80-93.
Zuo Y X and Guo TM.1991.Extension of the Patel-Teja equation of state to the prediction of the solubility of natural gas in formation water[J]. Chem ical Engineering Science,46(12):3251-3258.
An Im proved Thermodynam ic Model for Calculating Solubility of the CO2-CH4-N2-C2H6-H2SGasM ixture in W ater
ZHANG Lu,SUN Rui*
State Key Laboratoryof ContinentalDynam ics,DepartmentofGeology,NorthwestUniversity,Xi'an 710069,China
This study extends the solubility model developed by Duan and coworkers for pure CO2,CH4,C2H6,and H2S to the CO2-CH4-N2-C2H6-H2Sgasmixture.The DMW92 equation of state(EOS)was extended to the CO2-CH4-N2-C2H6-H2Sgasmixture by evaluation of interaction parameters between dissimilarmolecule pairs from experimental VLE or PVTx data of binary gasmixtures. The extended DMW 92 EOSwas used in thismodel to calculate fugacity coefficients of components in gasmixture.The Pitzermodel was used to calculate activity coefficients of gas dissolved in aqueous solutions.Solubility parameters determined by Duan and coworkers for pure CO2,CH4,C2H6and H2Swere followed and solubility parameters for pure N2were determ ined in this study.Because this model contains no parameters evaluated from solubility data of gas mixtures,it is predictive for solubility of gas mixtures. Comparison with experimental data available shows that thismodel can predict solubility of CO2-CH4-N2-C2H6-H2S gasm ixtures in aqueous solutions with high accuracy over a wide P-T range(For CO2and CH4dom inant gasm ixtures,the P-T range of thismodel is from 273 to 523 K and from 0 to 2000×105Pa).Calculations of thismodel indicate that the solubility of CO2decreases with adding small percentage of CH4,N2or H2S.The homogenization pressure of CO2-H2O-NaCl fluid inclusionswill increasewith adding CH4.The computer program based on thismodel can be obtained from theCorrespondingauthor.
SUNRui,Professor;E-mail:ruisun@nwu.edu.cn
P594
A文献标识码:1006-7493(2016)04-589-09
10.16108/j.issn1006-7493.2016009
2016-01-22;
2016-06-30
国家自然科学基金(41373058)资助
张路,1987年生,硕士研究生,地球化学专业;E-mail:603381703@qq.com
*通迅作者:孙睿,1974年生,教授,主要从事地质流体热力学性质的计算模拟与应用研究;E-mail:ruisun@nwu.edu.cn
Keywords:solubility;model;gasmixture;aqueoussolution;CO2
