转录因子SP1调控血管平滑肌细胞表型转化在主动脉夹层发病中的作用
2017-01-10袁瑞军唐杨烽刘晓红王国坤
袁瑞军 唐杨烽 刘晓红 袁 扬 王国坤 韩 林
·基础研究·
转录因子SP1调控血管平滑肌细胞表型转化在主动脉夹层发病中的作用
袁瑞军 唐杨烽 刘晓红 袁 扬 王国坤 韩 林
目的:探讨转录因子SP1在主动脉夹层组织中的表达情况及与主动脉夹层血管平滑肌细胞(VSMC)表型转化的关系。 方法:收集人主动脉夹层血管壁组织(n=10)及正常主动脉壁组织(n=4),分别采用RT-PCR和Western blot检测主动脉壁组织中SP1和收缩型VSMC表型标志物SM22α的mRNA和蛋白表达水平;体外培养正常人主动脉平滑肌细胞(HA-VSMC),以转染SP1过表达腺病毒(Ad-SP1)的HA-VSMC为Ad-SP1组,以转染仅表达荧光蛋白腺病毒(Ad-GFP)的HA-VSMC为对照组,分别采用RT-PCR和Western blot检测转染后HA-VSMC中SM22α mRNA和蛋白表达水平。 结果:与正常主动脉壁组织相比,人主动脉夹层血管壁组织中SP1 mRNA(3.81±2.84对0.91±0.67,P<0.05)和蛋白(2.09±0.32对0.90±0.09,P<0.05)表达水平均明显升高,SM22α mRNA(0.39±0.20对1.01±0.51,P<0.05)和蛋白(0.75±0.10对1.01±0.09,P<0.05)表达水平均明显下降;腺病毒转染HA-VSMC后,与对照组相比,Ad-SP1组中SM22α mRNA(0.36±0.03对0.95±0.11,P<0.05)和蛋白(0.84±0.11对1.06±0.06,P<0.05)表达水平均明显下降。 结论:转录因子SP1在主动脉夹层组织中表达水平升高,与VSMC表型转化密切相关,参与主动脉夹层的发病过程。
主动脉夹层;SP1;血管平滑肌细胞;表型转化
主动脉夹层是血液经主动脉壁内膜撕裂口进入血管壁中层,形成夹层血肿并沿主动脉壁延伸剥离的致死性血管疾病[1]。目前主动脉夹层的治疗方法主要是外科手术,但病情的复杂性及手术的高风险性严重影响了治疗效果。研究显示主动脉夹层术后早期住院死亡率高达9%~30%[2]。深入研究主动脉夹层的发病机制有助于探寻疾病早期非手术干预方法。
主动脉壁中层的血管平滑肌细胞发生由收缩型到合成型的表型转化是主动脉夹层发生发展的重要病理基础[3];而我们前期研究发现,在人主动脉夹层血管壁组织中,转录因子SP1(specificity protein 1)呈现高表达。本研究通过对SP1与VSMC表型转化之间关系的研究,探讨SP1在主动脉夹层发病中的作用机制。
1 材料与方法
1.1 主要试剂、细胞株和仪器
BCA蛋白浓度测定试剂盒,中国碧云天;mRNA逆转录试剂盒、RT-PCR试剂盒,日本Takara公司;SP1抗体、平滑肌22α(smooth muscle 22 alpha,SM22α)抗体,英国Abcam公司,羊抗兔二抗、羊抗鼠二抗,美国Earthox公司;腺病毒表达载体试剂盒,美国Stategene公司;pHBAd-MCMV-GFP过表达载体,汉恒生物科技;DNA限制性内切酶、T4DNA连接酶,美国BioLabs公司;大肠杆菌菌株DH5α、人胚肾细胞系HEK293,保存于本实验室;原代正常人主动脉血管平滑肌细胞(HA-VSMC),美国模式菌种收集中心(ATCC);LighterCycler®480Ⅱ实时荧光定量PCR扩增系统,瑞士Roche公司。
1.2 人主动脉壁组织留取
主动脉夹层血管壁组织和正常主动脉壁组织分别取自长海医院心血管外科主动脉夹层患者、主动脉瓣置换术患者和心脏移植术捐赠者。其中主动脉夹层血管壁组织标本10份,正常主动脉壁组织标本4份。标本的收集使用均经患方知情同意并签字。标本取下后即刻用预冷的生理盐水冲洗,剥离内膜及外膜,留取中层血管壁组织,液氮内冻存备用。
1.3 HA-VSMC的培养
HA-VSMC快速复温后用含20%胎牛血清(FBS)的SMEM培养基于37℃、5% CO2温箱内培养,待细胞贴壁生长良好时,更换为含2%FBS的SMDM培养基继续培养。当细胞长势良好,覆盖培养皿总面积80%以上时进行传代培养。
1.4 SP1过表达腺病毒的构建
采用pHBAd-MCMV-GFP过表达载体,MCMV启动子后为多克隆位点(MCS)区,目的基因片段插入EcoRⅠ、NotⅠ位点。于GenBank中查找SP1基因CDS区序列,设计包含有EcoRⅠ、NotⅠ酶切位点的引物,正向序列为5′-atagaattcgccacc ATGAGCGACCAAGATCACT-3′;反向序列为5′-atagcggccgcTCAGAAGCCATTGCCACTGAT-3′。提取HA-VSMC总mRNA,逆转录并扩增SP1的cDNA。对pHBAd-MCMV-GFP载体及SP1的cDNA采用EcoRⅠ、NotⅠ进行酶切,连接酶进行连接;连接产物加入感受态细胞(大肠杆菌菌株DH5α)悬液,于氨苄青霉素抗性LB固体培养基37℃培养,选取生长良好的菌落,进行PCR扩增并鉴定,提取纯化重组质粒。采用人胚肾细胞系HEK293进行重组腺病毒载体的包装及扩增,TCID50法测定感染滴度。
1.5 SP1过表达腺病毒转染HA-VSMC
将长势良好的HA-VSMC接种到12孔或6孔培养板内,贴壁生长至覆盖培养板底部面积约70%时,更换新的培养基,SP1过表达腺病毒(Ad-SP1)组培养孔内加入Ad-SP1,对照组加入仅表达荧光蛋白的腺病毒(Ad-GFP)。转染24 h后,观察细胞内荧光含量,确认病毒转染效率;弃去含病毒的培养基,换成正常培养基继续培养24 h后,收集细胞。
1.6 RT-PCR检测SP1和SM22α mRNA表达水平
TRIzol法提取主动脉夹层血管壁组织、正常主动脉壁组织和HA-VSMC的总RNA,紫外吸收法测定总RNA浓度。根据GenBank中SP1和SM22α基因序列设计PCR引物,SP1基因正向序列为5′-CTATAGCAAATGCCCCAGGT-3′,反向序列为5′-TCCACCTGCTGTGTCATCAT-3′;SM22α基因正向序列为5′-TCCAGACTGTTG ACCTCTTTG-3′,反向序列为5′-TCTTATGC TCCTGCGCTTTC-3′。将RNA逆转录为cDNA,采用20 μl反应体系进行PCR扩增,扩增条件:95℃预变性30 s,95℃变性5 s,60℃退火20 s,72℃延伸20 s,40个循环后,获得样本Ct值。采用2-ΔCt法计算目的基因的mRNA相对表达量。
1.7 Western blot检测SP1和SM22α蛋白表达水平
蛋白裂解液从主动脉夹层血管壁组织、正常主动脉壁组织和HA-VSMC中提取总蛋白,BAC法测定蛋白浓度,根据蛋白浓度调整上样量。凝胶电泳分离蛋白后,湿转法将蛋白转到PVDF膜上,5%脱脂奶粉封闭1 h,SP1抗体(1∶5 000)、SM22α抗体(1∶1 000)和GAPDH抗体(1∶5 000)4℃孵育过夜,二抗室温下孵育1 h,显色。通过Image J软件测定蛋白条带灰度值,以目的蛋白与内参蛋白GAPDH灰度值的比值作为目的蛋白相对表达量。
1.8 统计学分析
采用SPSS 22.0软件进行统计学分析,计量资料以均值±标准差表示,组间比较采用单因素方差分析,P<0.05为有统计学差异。
2 结果
2.1 人主动脉壁组织中SP1和SM22α 的mRNA、蛋白表达水平
与正常主动脉壁组织相比,主动脉夹层血管壁
组织中SP1 mRNA和蛋白表达水平均明显升高(P均<0.05),SM22α mRNA和蛋白表达水平均明显下降(P均<0.05),见图1、表1。

注:A为正常主动脉壁组织;B、C为主动脉夹层血管壁组织图1 人主动脉壁组织中SP1和SM22α蛋白表达水平
2.2 SP1过表达腺病毒对HA-VSMC的转染效率
在对HA-VSMC转染24 h后,光镜下观察可见细胞生长良好,形态正常;相同视野下观察细胞内荧光含量,>90%的细胞内出现绿色荧光信号,提示病毒的转染效率满意,见图2。
2.3 转染后的HA-VSMC中SP1和SM22α的 mRNA、蛋白表达变化
Ad-SP1组的HA-VSMC中,SP1 mRNA和蛋白表达水平均明显高于对照组(P均<0.05),SM22α mRNA和蛋白表达水平较对照组均明显降低(P均<0.05),见表2、图3。
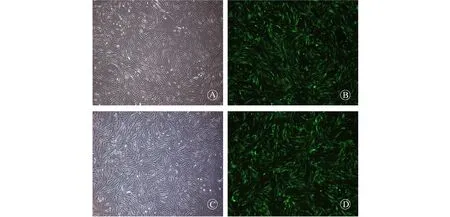
注:A为Ad-SP1组HA-VSMC的形态;B为Ad-SP1组荧光蛋白GFP的表达情况;C为对照组HA-VSMC的形态;D为对照组荧光蛋白GFP的表达情况图2 腺病毒对HA-VSMC的转染效率(×40)
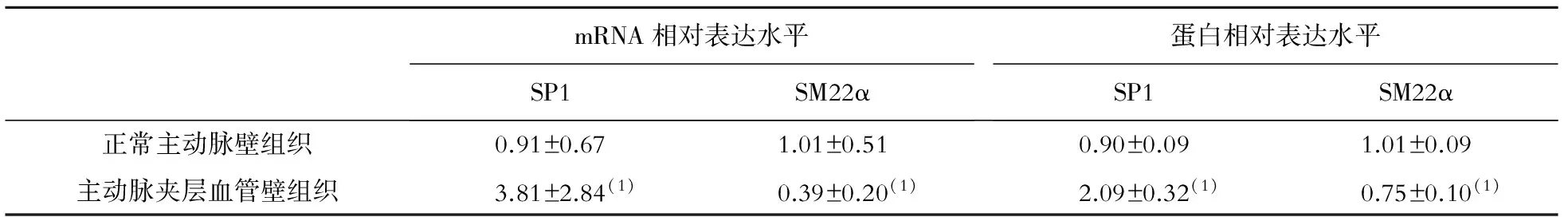
mRNA相对表达水平SP1SM22α蛋白相对表达水平SP1SM22α正常主动脉壁组织0.91±0.671.01±0.510.90±0.091.01±0.09主动脉夹层血管壁组织3.81±2.84(1)0.39±0.20(1)2.09±0.32(1)0.75±0.10(1)
注:与正常主动脉壁组织比较,(1)P<0.05
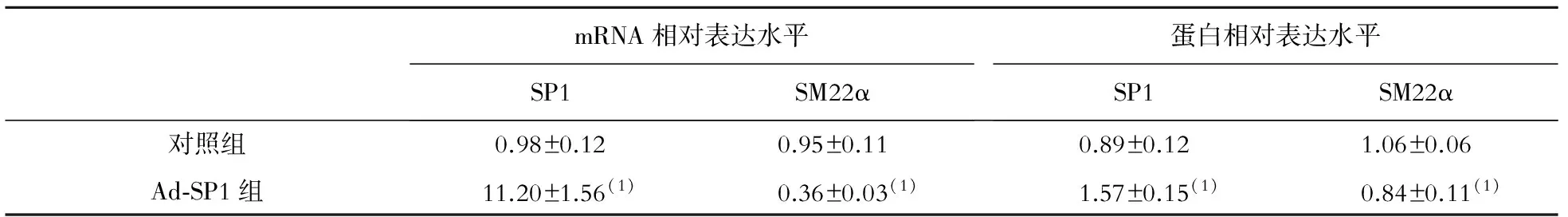
表2 转染后的HA-VSMC中 SP1和SM22α mRNA、蛋白表达水平的比较
注:与对照组比较,(1)P<0.01
3 讨论
SP1是SP1/Krüppel样转录因子家族中最有效的转录激活因子之一[4],其含有高度保守的DNA结合区,能与下游靶基因中富含GC的序列结合,调控多种基因表达。研究表明,SP1能够促进肿瘤细胞中骨桥蛋白(osteopontin, OPN)、基质金属蛋白酶(matrix metalloproteinase, MMP)2等的表达,同时促进其上皮-间质转化过程[5-7]。Murthy等[8]发现SP1能促进循环中巨噬细胞MMP9的表达。此外,SP1可通过促进VSMC增殖、迁移,参与多种心血管疾病的发生发展[9-11]。但SP1对VSMC表型转化的影响,以及SP1高表达与主动脉夹层发生发展的关系尚未见报道。
作为主动脉壁中层的主要细胞成分,VSMC一直都是主动脉夹层发病机制的研究热点。VSMC存在收缩型及合成型两种表型[12]。正常主动脉壁内VSMC以收缩型为主,其分化程度高,增殖及迁移能力低,收缩能力强;而主动脉夹层血管壁组织中的VSMC以合成型为主,其分化程度低,增殖及迁移能力增强,收缩能力弱。VSMC在由收缩型向合成型的转化过程中,胞内收缩蛋白大量降解,细胞收缩能力下降;另一方面,表型转化导致MMP2、MMP9过度表达,引起弹力蛋白降解,加重基质破坏和细胞丢失[13],使血管壁的稳定性下降。SM22α蛋白属于细胞骨架相关蛋白,在收缩型VSMC中特异性高表达[14]。本研究证实转录因子SP1在人主动脉夹层血管壁组织中高表达,而收缩型VSMC标志物SM22α表达下降,提示主动脉夹层血管壁组织中的VSMC发生了由收缩型向合成型的转化。我们进一步构建SP1过表达腺病毒,高效转染离体培养的HA-VSMC并使其过表达SP1,发现其SM22α表达减少,提示SP1高表达与HA-VMSC表型转化密切相关。
本研究表明,SP1可能通过促进VSMC表型转化参与主动脉夹层的发病过程。关于SP1调控VSMC表型转化的相关通路,以及SP1在主动脉夹层组织中高表达的原因,尚需进一步研究。
[1] Golledge J, Eagle KA. Acute aortic dissection[J]. Lancet, 2008, 372(9632): 55-66.
[2] Pagni S, Ganzel BL, Trivedi JR, et al. Early and midterm outcomes following surgery for acute type A aortic dissection[J]. J Card Surg, 2013, 28(5): 543-549.
[3] Meszaros I, Morocz J, Szlavi J, et al. Epidemiology and clinicopathology of aortic dissection[J]. Chest, 2000, 117(5): 1271-1278.
[4] Chu S. Transcriptional regulation by post-transcriptional modification--role of phosphorylation in Sp1 transcriptional activity[J]. Gene, 2012, 508(1): 1-8.
[5] Iqbal J, McRae S, Banaudha K, et al. Mechanism of hepatitis C virus (HCV)-induced osteopontin and its role in epithelial to mesenchymal transition of hepatocytes[J]. J Biol Chem, 2013, 288(52): 36994-37009.
[6] Chuang CY, Chang H, Lin P, et al. Up-regulation of osteopontin expression by aryl hydrocarbon receptor via both ligand-dependent and ligand-independent pathways in lung cancer[J]. Gene, 2012, 492(1): 262-269.
[7] Guan H, Cai J, Zhang N, et al. Sp1 is upregulated in human glioma, promotes MMP-2-mediated cell invasion and predicts poor clinical outcome[J]. Int J Cancer, 2012, 130(3): 593-601.
[8] Murthy S, Ryan AJ, Carter AB. SP-1 regulation of MMP-9 expression requires Ser586 in the PEST domain[J]. Biochem J, 2012, 445(2): 229-236.
[9] Azahri NS, Di Bartolo BA, Khachigian LM, et al. Sp1, acetylated histone-3 and p300 regulate TRAIL transcription: mechanisms of PDGF-BB-mediated VSMC proliferation and migration[J]. J Cell Biochem, 2012, 113(8): 2597-2606.
[10] Yang HM, Kim BK, Kim JY, et al. PPARgamma modulates vascular smooth muscle cell phenotype via a protein kinase G-dependent pathway and reduces neointimal hyperplasia after vascular injury[J]. Exp Mol Med, 2013, 45: e65.
[11] Shi JH, Zheng B, Chen S, et al. Retinoic acid receptor alpha mediates all-trans-retinoic acid-induced Klf4 gene expression by regulating Klf4 promoter activity in vascular smooth muscle cells[J]. J Biol Chem, 2012, 287(14): 10799-10811.
[12] Salabei JK, Hill BG. Implications of autophagy for vascular smooth muscle cell function and plasticity[J]. Free Radic Biol Med, 2013, 65: 693-703.
[13] Milewicz DM, Guo DC, Tran-Fadulu V, et al. Genetic basis of thoracic aortic aneurysms and dissections: focus on smooth muscle cell contractile dysfunction[J]. Annu Rev Genomics Hum Genet, 2008, 9: 283-302.
[14] Regan CP, Adam PJ, Madsen CS, et al. Molecular mechanisms of decreased smooth muscle differentiation marker expression after vascular injury[J]. J Clin Invest, 2000, 106(9): 1139-1147.
(收稿:2016-06-17 修回:2016-08-24)
(本文编辑:胡晓静)
The effects of transcription factor SP1 on phenotypic switching of vascular smooth muscle cells in pathogenesis of aortic dissection
YUANRuijun,TANGYangfeng,LIUXiaohong,YUANYang,WANGGuokun,HANLin.
DepartmentofCardiovascularSurgery,ChanghaiHospitalAffiliatedtotheSecondMilitaryMedicalUniversity,Shanghai200433,China
Objective:To investigate the expression level of specificity protein 1 (SP1) in the tissue from human aortic dissection (AD) and the relationship between SP1 and phenotypic switching of vascular smooth muscle cell (VSMC) in aorta. Methods:Human aortic wall tissues were collected from ten AD patients and four normal donors. The mRNA and protein expressions of SP1 and contractile VSMC marker SM22α were detected by RT-PCR and western blot. Normal human aorta smooth muscle cells (HA-VSMC) were culturedinvitro. Human SP1 overexpression adenovirus (Ad-SP1) was constructed and used to transfect HA-VSMC, using GFP expression adenovirus (Ad-GFP) as control. The expressions of SM22α in HA-VSMC after transfection were detected by RT-PCR and western blot. Results:Compared with normal aortic wall tissues, the expressions of SP1 in AD tissues were significantly upregulated in both mRNA level (3.81±2.84 vs. 0.91±0.67,P<0.05) and protein level (2.09±0.32 vs. 0.90±0.09,P<0.05), while the SM22α expressions were downregulated (mRNA 0.39±0.20 vs. 1.01±0.51,P<0.05; protein 0.75±0.10 vs. 1.01±0.09,P<0.05). Compared with control group, the expressions of SM22α in HA-VSMC culturedinvitrowere significantly downregulated after successful overexpression of SP1 by Ad-SP1 (mRNA 0.36±0.03 vs. 0.95±0.11,P<0.05; protein 0.84±0.11 vs. 1.06±0.06,P<0.05). Conclusion:In AD tissue, SP1 is upregulated and closely correlated with VSMC phenotypic switching, indicating that SP1 may participate in the pathogenesis of AD.
Aortic dissection; SP1; Vascular smooth muscle cell; Phenotypic switching
国家自然科学基金(81400344)
200433 上海,第二军医大学附属长海医院心血管外科
韩 林,Email:sh_hanlin@163.com
10.3969/j.issn.1673-6583.2016.06.013
