牛呼吸道综合症多重PCR检测方法的建立
2017-01-10周玉龙吴丹丹周金玲朴范泽
周玉龙,吴丹丹,周金玲,朴范泽
(黑龙江八一农垦大学动物科技学院,预防兽医重点实验室,大庆 163319)
牛呼吸道综合症多重PCR检测方法的建立
周玉龙,吴丹丹,周金玲,朴范泽
(黑龙江八一农垦大学动物科技学院,预防兽医重点实验室,大庆 163319)
为了建立针对BRDC常见的主要病原牛黏膜病病毒(BVDV)、牛副流感病毒3型(BPIV-3)和牛呼吸道合胞体病毒(BRSV)的一步法多重RTPCR,引入了新型的具有反转录酶和DNA聚合酶活性的rTth DNA聚合酶,通过对退火温度和引物浓度的优化,敏感性和特异性的检测,最终确定最佳退火温度为54.5℃,最佳引物浓度为0.6 uM。对BPIV-3、BRSV和BVDV的最小检测量分别为162、16和21个TCID50/0.1 mL。与牛传染性鼻气管炎病毒、冠状病毒、腺病毒,以及多杀性巴氏杆菌、肺炎链球菌、化脓隐秘杆菌、溶血性曼氏杆菌等没有交叉反应。建立起的mRT-PCR检测方法可用于鼻腔分泌物的检测,为进一步mRT-PCR试剂盒的组装奠定了基础。
牛呼吸道综合症;病毒;mRT-PCR
牛呼吸道综合症(bovine respiratory disease complex,BRDC)是多因素的,环境条件与多种病毒和细菌性病原的共同作用使牛产生严重的呼吸道疾病。应激因素像温度、饲养密度、灰尘、湿度和长途运输等[1-2],能够导致机体免疫力下降,继而感染机会性病毒或者细菌性病原。国内外研究表明牛黏膜病病毒(bovine viral diarrhea virus,BVDV)、牛副流感病毒3型(bovine parainfluenza virus-3,BPIV3)和牛呼吸道合胞体病毒(bovine respiratory syncytial virus,BRSV)是与BRDC相关的常见病原,这些病毒常常作为BRDC的原发性病原。一般认为这些病毒能导致牛免疫系统抑制和破坏呼吸道上皮,使常见的机会性的二级病原更容易感染,像溶血性曼氏杆菌、多杀性巴氏杆菌、昏睡嗜血杆菌、化脓隐秘杆菌和牛支原体等,从而导致临床上呈现BRDC[3-4]。
BRDC在世界范围内普遍存在,据报道因牛呼吸道疾病造成死亡的病例占到46%~67%。同时,因感染疾病造成的牛生长发育迟缓和产奶量下降等间接损失更是不可估计[5]。多年来在临床诊疗工作中发现,在黑龙江省BRDC有上升的趋势,尤其是发生BPIV3、BRSV和BVDV单独或混合感染时,患病牛病程可达30 d左右,临床兽医由于无法确诊,盲目长期应用抗生素类药,但是效果不显著,导致治疗成本增加,仅治疗费用最高达200元·头-1,因此急需有效的检测手段进行确诊。
传统的单重或者多重PCR方法需要经反转录和PCR两个过程操作复杂耗时,同时增加了检测过程中污染的几率,为了克服上述困难,研究引入了具有RNA反转录酶活性和DNA聚合酶活性的新型耐热性DNA多聚酶开发一种敏感性高、特异性强、使用方便快捷的一步法BVDV、BRSV和BPIV3三重反转录PCR试剂盒,增加了该方法的临床可应用性。以便能够及时确诊采取有效的防控措施,最大程度上减少经济损失,保障养牛业的顺利发展。
1 材料
1.1 菌毒株及细胞株
BRSV NMK-7株、BPIV-3 BN-1株和牛腺病毒7型(BAdV-7 Fukuroi株)由日本动物卫生研究所惠赠;牛呼吸道合胞体病毒HJ株、BPIV3 HJ株,BVDV HJ-1株GenBank登录号JX065783、牛传染性鼻气管炎病毒DQ株和牛冠状病毒DQ、化脓隐秘杆菌、牛多杀性巴氏杆菌、牛溶血性曼氏杆菌和牛肺炎链球菌等由黑龙江八一农垦大学传染病研究室分离鉴定保存[6-9]。MDBK细胞、非洲绿猴肾细胞(Vero)和HRT-18细胞购自中国科学院上海细胞库,由黑龙江八一农垦大学传染病研究室保存。
1.2 主要试剂
RNA提取试剂盒(Qiagen)、DNA提取试剂盒(TIANGEN)、一步法RT-PCR试剂盒(TOYOBO),胰大豆蛋白肉汤培养基TSB(BD)、血液营养琼脂培养基按常规方法配制。
1.3 临床样本
采集自2012年5月~2015年7月黑龙江省大庆市、哈尔滨市和齐齐哈尔市的周边地区。具有呼吸道症状的肉牛和奶牛鼻腔拭子,总计35份。
1.4 引物的设计与合成
根据GenBank上发表的BRSV和BPIV3的N基因序列,以及BVDV 5′UTR基因序列,经DNAStar软件比对分析,利用Oligo6.0在保守区设计特异性引物各2对,由上海生工生物工程技术服务有限公司合成,引物序列见表1。
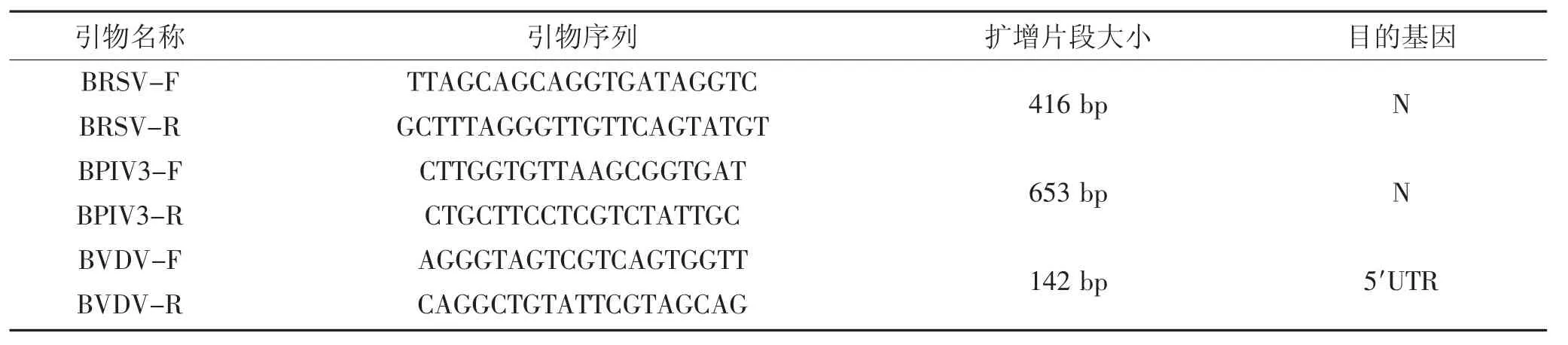
表1 引物序列Table 1 Primer sequence
2 方法
2.1 试验用病毒液制备
BRSV HJ株、BPIV3 HJ株、BVDV HJ-1、牛冠状病毒DQ和IBRV DQ株等试验用病毒株按照常规方法接种敏感细胞以后,待60%~70%的细胞出现CPE以后收集细胞,反复动融3次后分成3等份-80℃储存备用。
2.2 试验用细菌液的制备
将化脓隐秘杆菌、牛多杀性巴氏杆菌、牛溶血性曼氏杆菌和牛肺炎链球菌分别接种加入5%新生牛血清的TSB培养基,37℃摇床培养12 h,收集菌体;IBRV接种MDBK细胞,60%~70%的细胞出现CPE时收集细胞,按照TIANamp Genomic DNA Kit说明书步骤制备上述细菌和病毒的基因组,-80℃储存备用。
2.3 基因组RNA和DNA的制备
使用Rneasy plus Mini kit制备BRSV、BPIV3、BVDV和BCV等试验用病毒核酸,以及制备临床样本核酸,具体方法按照说明书操作。
使用TIANamp Genomic DNA Kit制备化脓隐秘杆菌、牛多杀性巴氏杆菌、牛溶血性曼氏杆菌、牛肺炎链球菌和IBRV等试验用细菌和病毒的核酸,具体方法按照说明书操作。
2.4 单一病毒一步法RT-PCR反应条件的优化
先对BVDV、BPIV3和BRSV三种病毒分别进行一步法RT-PCR反应条件优化,包括退火温度(54.5、56.2、57.3、58.8、60.1、61.4℃和62.8℃),引物浓度(终浓度0.1、0.2、0.4、0.6、0.8和1.0 μM),然后根据最佳的退火温度和引物浓度进行PCR反应体系组合,检测BVDV、BPIV3和BRSV的复合样本,确定最佳复合引物条件。优化时先固定其他因素,逐个分析变量,最终筛选出最佳条件。反应液组成见表2。

表2 一步法RT-PCR反应液组成Table 2 Composition of one-step RT-PCR reaction liquid
一步法RT-PCR反应条件:变性90℃30 s;反转录60℃30 min;变性94℃1 min;预变性94℃30 s、退火54.5~62.8℃30 s、延伸72℃1 min,反应进行40个循环;延伸72℃7 min。取10 uL PCR扩增产物于15 g·L-1琼脂糖凝胶中进行电泳鉴定。
2.5 敏感性实验
分别把BRSV HJ株(104.0TCID50/0.1 mL)、BPIV3 HJ株(107.1TCID50/0.1 mL)和BVDV HJ-1株(105.3TCID50/0.1 mL)的细胞培养物原液进行1∶5、1∶52、1∶53、1∶54、1∶55、1∶56和1∶57倍连续稀释,每一个稀释度进行3个重复,使用多重PCR反应扩增。另外,把BRSV HJ株、BPIV3 HJ株和BVDV HJ-1株的细胞培养物混合,起始浓度均配成1×105TCID50/0.1 mL,同样进行10倍系列稀释,检测多重PCR的敏感性。比较单病原与多病原之间是否有干扰抑制现象。
2.6 特异性实验
使用常见的牛呼吸道病原体IBRV、BCV、化脓隐秘杆菌、牛多杀性巴氏杆菌、牛溶血性曼氏杆菌和牛肺炎链球菌等基因组为模板,利用上述最优的PCR条件进行扩增,用来评价该方法的特异性。
2.7 临床样本检测
把采集的65份临床样本用本研究中的一步法三重RT-PCR方法检测,同时使用已发表的两步法单重PCR方法进行检测[10-12]。评价这两种方法的符合率,以及这三种病原在目前呼吸道病牛中的流行病学情况。
3 实验结果
3.1 最佳退火温度优化
为了确定最佳退火温度,首先将引物浓度确定为常规浓度0.4 μM,分别对BVDV、BPIV3和BRSV的退火温度进行优化,结果见图1。可见不同退火温度对BPIV3的扩增效率影响不大,对BRSV扩增效率仅在62.8℃时明显下降,对BVDV的基因扩增效率影响较大,退火温度在54.5℃和56.2℃时扩增效率相对较高,因此综合考虑选择54.5℃为最佳退火温度。
3.2 最佳引物浓度优化
把BPIV3、BRSV和BVDV的引物分别配制成浓度10 μM的混合液,使每个体系终浓度分别为0.05、0.1、0.2、0.4、0.6和0.8 μM,在最佳退火温度为54.5℃条件下进行PCR扩增,结果见图2。综合BPIV3、BRSV和BVDV的扩增效率可见0.6 μM是最佳引物浓度。
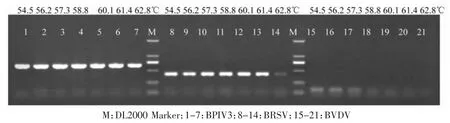
图1 一步法RT-PCR最佳退火温度优化结果Fig.1 Results of one-step RT-PCR optimum annealing temperature optimization
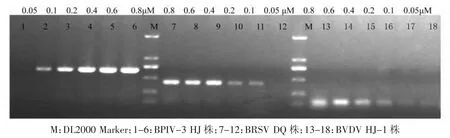
图2 一步法RT-PCR最佳引物浓度优化结果Fig.2 Results of one-step RT-PCR best primer concentration optimization
3.3 特异性实验结果
为了评价引物的特异性我们选择了牛常见呼吸道病毒IBRV、BCV和BADV,以及常见细菌多杀性巴氏杆菌、曼氏杆菌、化脓隐秘杆菌、肺炎链球菌、葡萄球菌和大肠杆菌,以及BPIV3 775株、AD、HJ株和BN-1株,BRSV NMK-7株和HJ株,BVDVHJ-1株和HJ-2株。特异性实验结果见图3。可见实验建立的方法能够有效扩增出4个株BPIV3,2株BRSV和2株BVDV,而与IBRV、BCV、BADV、多杀性巴氏杆菌、曼氏杆菌、化脓隐秘杆菌、肺炎链球菌、葡萄球菌和大肠杆菌无交叉反应。

图3 一步法RT-PCR特异性实验结果Fig.3 Results of one-step RT-PCR specific experimental
3.4 敏感性实验结果
通过对BRSV HJ株、BPIV3 HJ株和BVDV HJ-1株的细胞培养物原液进行1∶5系列稀释后进行三重RT-PCR扩增,结果见图4。结果本方法BPIV3、BRSV和BVDV的最小检测量分别为162、16和21个TCID50/0.1mL。
3.5 临床样本检测结果
采集自2012年5月~2015年7月黑龙江省大庆市、哈尔滨市和齐齐哈尔市的周边地区。具有呼吸道症状的肉牛和奶牛鼻腔拭子,总计35份,检测结果见表3。
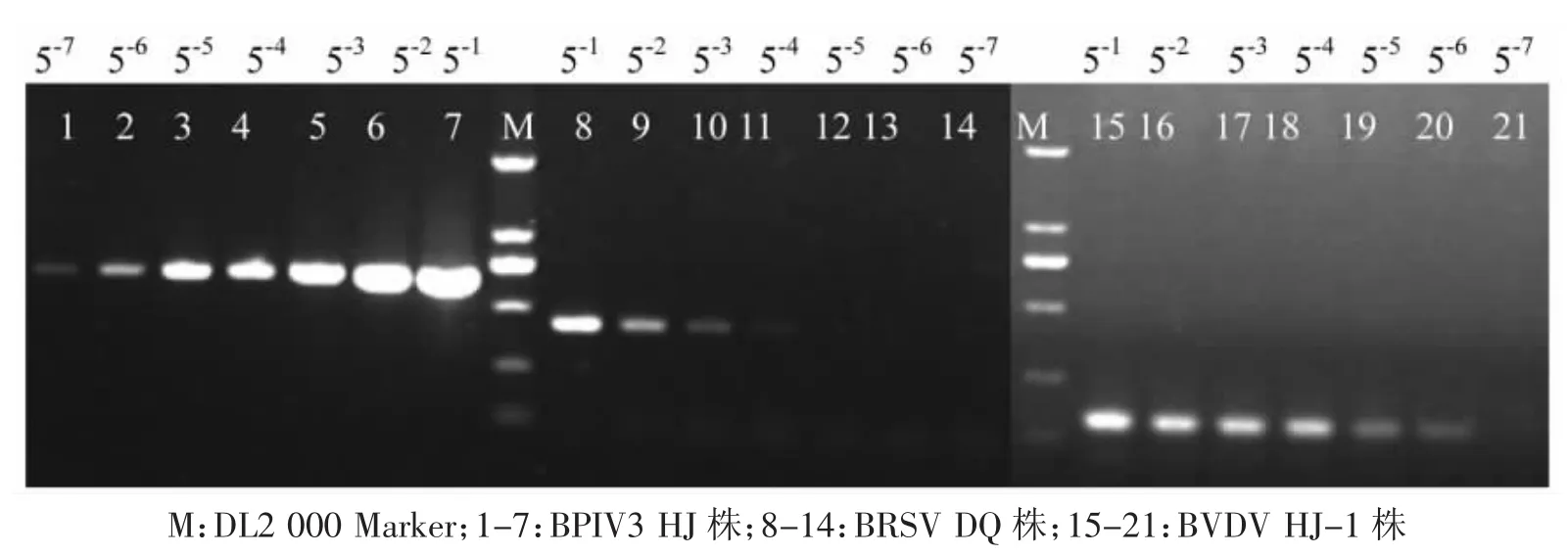
图4 一步法RT-PCR敏感性实验结果Fig.4 Results of one-step RT-PCR sensitivity experiment
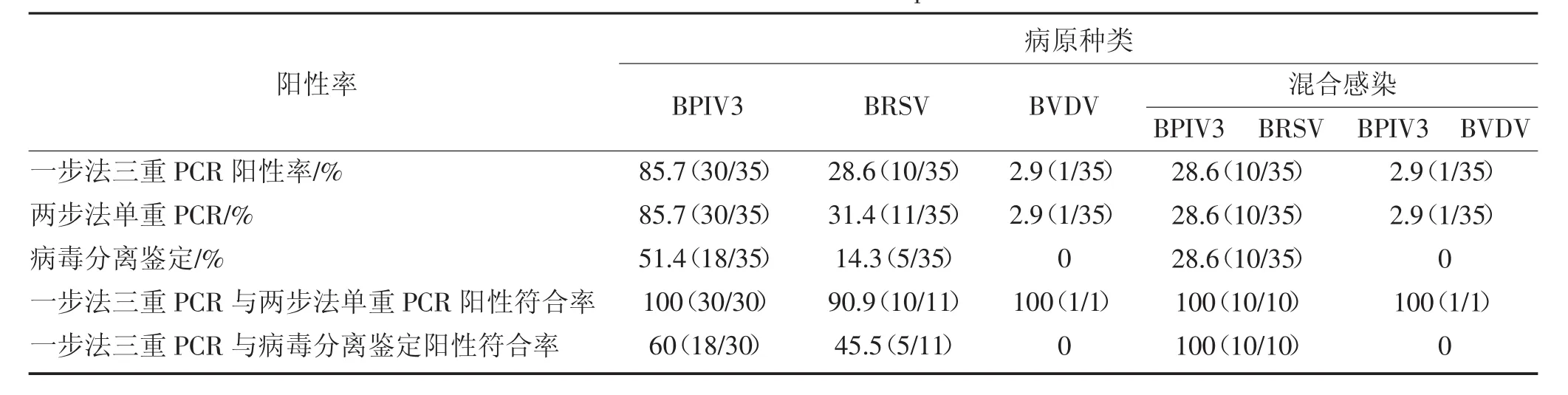
表3 临床样本检测结果Table 3 Results of clinical samples test
4 讨论
BRDC是舍饲牛最重要的疾病[1]。mRT-PCR是针对BRDC的一种快速和有效的诊断方法,可以用于检测和区分BPI3、BRSV和BVDV。可用于调查BRDC爆发的病原因素和流行病学研究。对于推荐适当的处理和管理策略,减少相关疾病的发病率和死亡率,进而对提高了生产效益具有重要意义。
mRT-PCR与传统的单重特异性RT-PCR相比,在多病原检测方面有诸多优点,包括高敏感性和特异性、低成本、所需样本更少、检测快速、若有自动化实验条件适合于高通量检测。BRDC临床样本通常发生共感染[13-14],因此,确保非优势靶病毒能被检测到很重要。
尽管实验是使用单个混合样本建立和优化的,但是为了能够保证mRT-PCR能够检测到BRDC中共同感染的病原,对含有多个靶病毒的混合物的敏感性进行了检测,结果与检测单个混合样本时的敏感性没有变化。而且通过对临床样本的检测结果也表明一步法mRT-PCR与传统的两步法RT-PCR检测敏感性差异不大见表3。同样在检测BRDC荧光定量mRT-PCR方法中检测共感染样本和检测单个病原样本的效率是一致的[15]。实验中最好使用经过滤处理配制的RNase-free水,DEPC处理过的水DEPC残留会抑制PCR反应的进行。RNA样品的添加量也不益过高2.5 μg以下,过多的添加量是反应效率下降。诊断方法的不断改进使得流行病学研究更容易,便于更好的理解这些病毒在疾病过程中的作用。另外,诊断方法的敏感性越高也便于调查健康牛对于这些病院的携带率[16]。
总之,mRT-PCR方法是一种敏感和特异的检测技术,能够检测牛的三种主要病毒性病原体,而且可以同时检测者三种病原。虽然mRT-PCR实验一般认为成本较高,但是考虑到在短时间之内能够检测到多种病原,减少了劳动时间,效率更高,能产生不同的诊断信息。另外,养殖场也会获益,由于快速诊断的结果能够指导其有针对性地处理措施,使用合适的疫苗或者快速改进管理程序等措施的实施。
[1]Snowder G D,Van Vleck LD,Cundiff LV,et al.Bovine respiratory disease in feedlot cattle:environmental,genetic,and economic factors[J].J.Anim.Sci.,2006,84,1999-2008.
[2]Dyer R M.The bovine respiratory disease complex a complex interaction of host,environmental and infectious agents.In:Infectious Disease in Food Animal Practice[M]. Trenton:Veterinary Learning Systems,1993.
[3]杨珂伟,胡亮,罗斌,等.藏绵羊KAP3.2基因的cDNA克隆、序列分析及组织表达的研究[J].西南民族大学学报,自然科学版,2014,40(6):809-813.
[4]Ellis J A.The immunology of the bovine respiratory disease complex[J].Vet.Clin.North Am.Food Anim.Pract,2001,17(3):535-550.
[5]Snowder G D,Van Vlek L Dl.Bovine respiratory disease in feedlot cattle:enviro-nmental,genetic and economic factors[J].J Anim Sci,2006,84:1999-2008.
[6]王红,朴范泽,侯喜林.牛呼吸道合胞体病毒的分离鉴定[J].畜牧兽医学报,2009,40(9):1414-1419.
[7]周玉龙,吴海涛,任亚超,等.牛副流感病毒3型的分离鉴定及感染牛抗体消长规律的研究[J].中国人兽共患病学报,2011,27(1):23-28.
[8]王延涛,李国军,周玉龙,等.牛传染性鼻气管炎病毒分离鉴定[J].中国兽医杂志,2007,43(5):30-31.
[9]关新,朴范泽,侯喜林.牛冠状病毒的分离鉴定[J].黑龙江八一农垦大学学报,2007,19(2):55-58.
[10]王红,朴范泽,侯喜林.牛呼吸道合胞体病毒RT-PCR检测方法的建立[J].动物医学进展,2008,29(11):1-4.
[11]刘鹏.牛副流感病毒3型的分离鉴定和间接ELISA方法建立及初步应用[D].大庆:黑龙江八一农垦大学,2010.
[12]Vilcˇek,J.Herring A,A.Herring J,et al.Pestiviruses isolated from pigs,cattle and sheep can be allocated into at least three genogroups using polymerase chain reaction and restriction endonuclease analysis[J].Archives of Virology,1994,136:309-323.
[13]Rosenquist B D,Dobson A W.Multiple viral infection in calves with acute bovine respiratory tract disease[J].Am. J.Vet.Dis.,1974,35:363-365.
[14]Liu L.,Lehmkuhl H D.,Kaeberle M L.Synergistic effects of bovine respiratory syncytial virus and non-cytopathic bovine viral diarrhea virus infection on selected bovine alveolar macrophage functions[J].Can.J.Vet.Res.,1999,63:41-48.
[15]Horwood PF1,Mahony TJ.Multiplex real-time RT-PCR detection of three viruses associated with the bovine respiratory disease complex[J].J Virol Methods,2011,171(2):360.
[16]Thonur L1,Maley M,Gilray J,et al.One-step multiplex real time RT-PCR for the detection of bovine respiratory syncytial virus,bovine herpesvirus 1 and bovine parainfluenza virus 3[J].BMC Vet Res,2012,28:8-37.
Establishment of Multiple PCR Detection Method of Bovine Respiratory Disease Complex
Zhou Yulong,Wu Dandan,Zhou Jinling,Piao Fanze
(Preventive Veterinary key Laboratory,College of Animal Science and Veterinary Medicine,Heilongjiang Bayi Agriculture University,Daqing 163319)
Bovine respiratory syncytial virus,bovine viral diarrhoea virus and bovine parainfluenza virus 3 were three of the major viruses associated with BRDC.In this study,one-step multiple RT-PCR(mRT-PCR)was established for detecting these three pathogens.The rTth DNA polymerase,a new type of reverse transcriptase with the activity of DNA polymerase,was used in the study. Through the optimization of annealing temperature and concentration of primers,sensitivity and specificity of detection,finally the optimum annealing temperature was 54.5℃,the best primer concentration was 0.6 uM.The BPIV-3,BRSV and BVDV were minimum detectable quantity 162,16,and 21 respectively TCID50/0.1 mL.Without crossing reaction to infectious bovine rhinotracheitis virus,coronavirus,adenovirus,andpasteurellamultocida,streptococcuspneumoniae,arcanobacteriumpyogenes,Mannheimia haemolytica,etc.For clinical validation,the established mRT-PCR could be used to the detection of nasal secretions in clinical samples from cattle.The study laid further a solid foundation for the mRT-PCR kit assembly.
bovine respiratory disease complex;virus;mRT-PCR
S855.3
A
1002-2090(2016)06-0097-05
10.3969/j.issn.1002-2090.2016.06.020
2015-07-20
黑龙江省教育厅项目(12531471)。
周玉龙(1980-),男,副教授,黑龙江八一农垦大学毕业,现主要从事家畜传染病诊断与防治方面的研究工作。
